
1
ALKANY
Węglowodory:
- nasycone = alkany
- nienasycone (alkeny, alkiny)
C
n
H
2n+2
, brak gr. funkcyjnych.
Alkany:
- nierozgałęzione;
- rozgałęzione;
- cykliczne.
Związki homologiczne, -CH
2
-
Alkany rozgałęzione są izomerami konstytucyjnymi alkanów „normalnych”.
n = 1
3
1 izomer
n = 4
2 izomery
n = 5
3 izomery
Grupy alkilowe:
metyl-, etyl-, propyl-, izopropyl-, butyl-, izobutyl-, sec-butyl-, tert-butyl-
1
-, 2
-, 3
- rzędowy atom C i H
Nazewnictwo:
1. Znajdź najdłuższy łańcuch węglowy i nazwij go (wybierz ten, który ma pierwszy
podstawnik bliżej atomu krańcowego).
2. Nazwij wszystkie grupy przyłączone do łańcucha głównego.
3. Ponumeruj atomy zaczynając od końca bliższego pierwszemu podstawnikowi:
a. gdy dwa jednakowo odległe, decyduje pierwsza litera nazwy podstawnika;
b. gdy kilka, decyduje pierwszy lokant różnicujący ;
4. Zaaranżuj alfabetycznie wszystkie podstawniki dodając di- tri- - poprzedzając
lokantem oddzielonym myślnikiem (di-… nie liczy się, chyba, że w nazwie
podstawnika)
Właściwości fizyczne:
Związki niepolarne,systematyczne zmiany właściwości (temp. wrzenia,
topnienia, gęstości) w serii homologicznej (wzrost ze zwiększaniem masy
cząsteczkowej).
Konformacje alkanów
Konformacja naprzeciwległa, naprzemianległa,
E = 3 kcal/mol (etan)
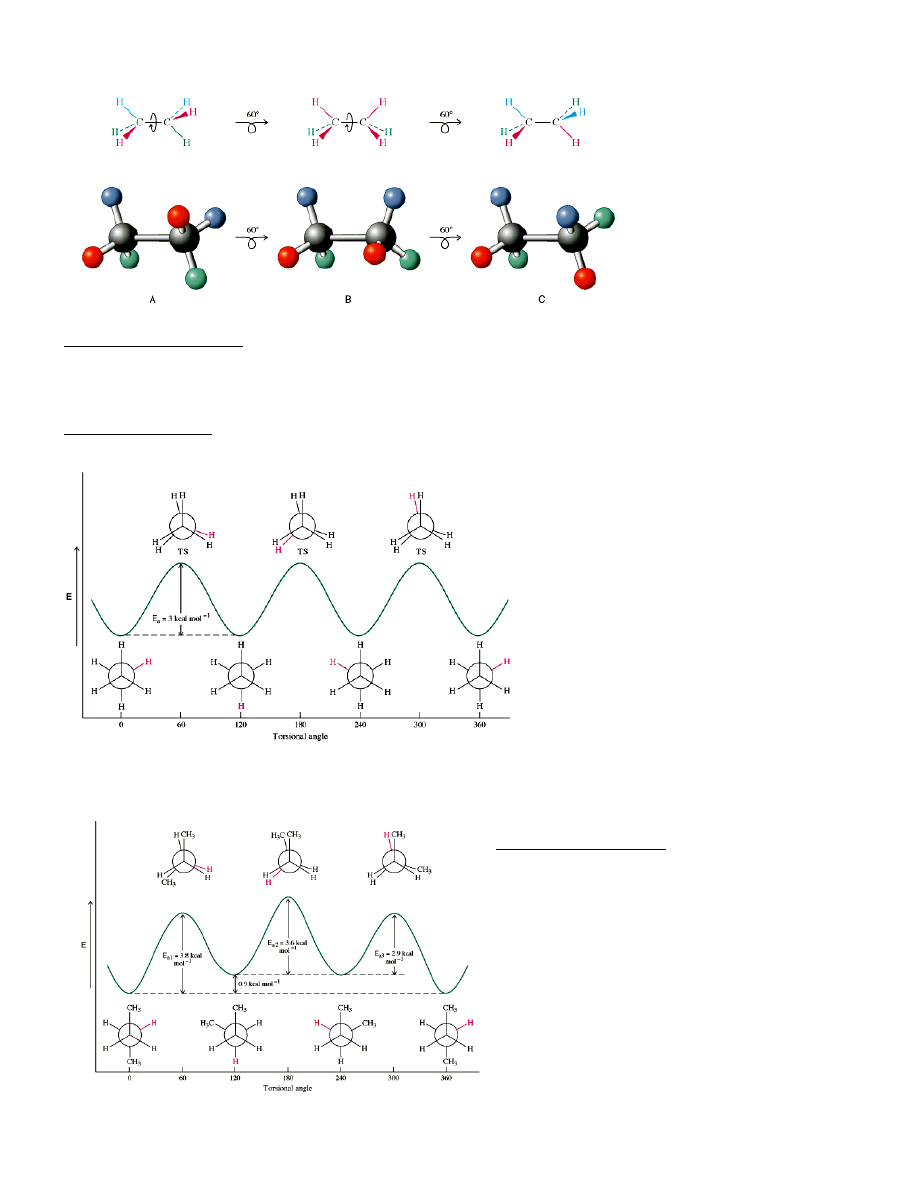
2
*
Projekcja Newmana (frontowy atom - punkt, tylny – kółko)
Energia potencjalna konformacji –różna.
Kąt torsyjny (ф), stany przejściowe dla rotacji, energia aktywacji
*
Propan, E
akt.
= 3.4 kcal/mol
Typy konformerów:
antyperiplanarny, ф = 180˚;
synperiplanarny, ф = 0˚;
synklinalny, ф = 60˚;
antyklinalny, ф = 120˚.
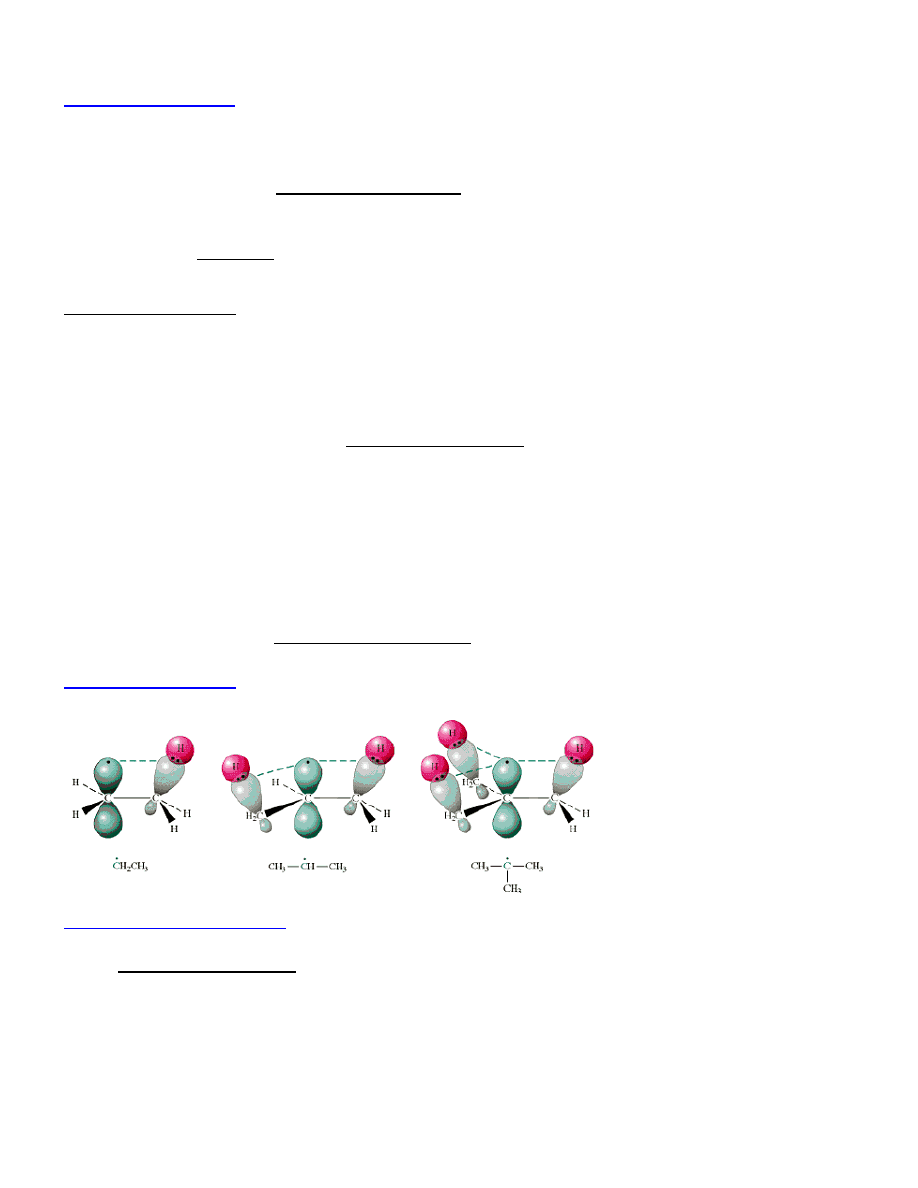
3
Reakcje alkanów
CH
3
– H → CH
3
+ H
H
= +105 kcal/mol
H
= D
Energia dysocjacji
CH
3
+ H
→ CH
3
– H
H
= -105 kcal/mol
ΣD
H (f. gazowa)
Energie dysocjacji:
dotyczą tylko r. homolitycznych;
zmiany D w szeregu R-X, X = F > Cl > Br > I;
energie dysocjacji są największe gdy wiązania tworzą się przez nakładanie
orbitali zbliżonych kształtem i energią;
są determinowane przez stabilność rodników:
CH
3
– H → CH
3
+ H
D
= + 105 kcal/mol
R– H → R
+ H
1
D
= + 98 kcal/mol
2
D
= + 94.5 kcal/mol
3
D
= + 93 kcal/mol
Podobnie rozpad C – C
Rodniki alkilowe: 3
> 2
> 1
> CH
3
Badanie spektralne
rodniki prawie płaskie (jak BH
3
)
Hiperkoniugacja
– sprzężenie między nie w pełni zapełnionym orbitalem p a wiążącą
parą el. na orbitalu σ wiązania C-H.
*
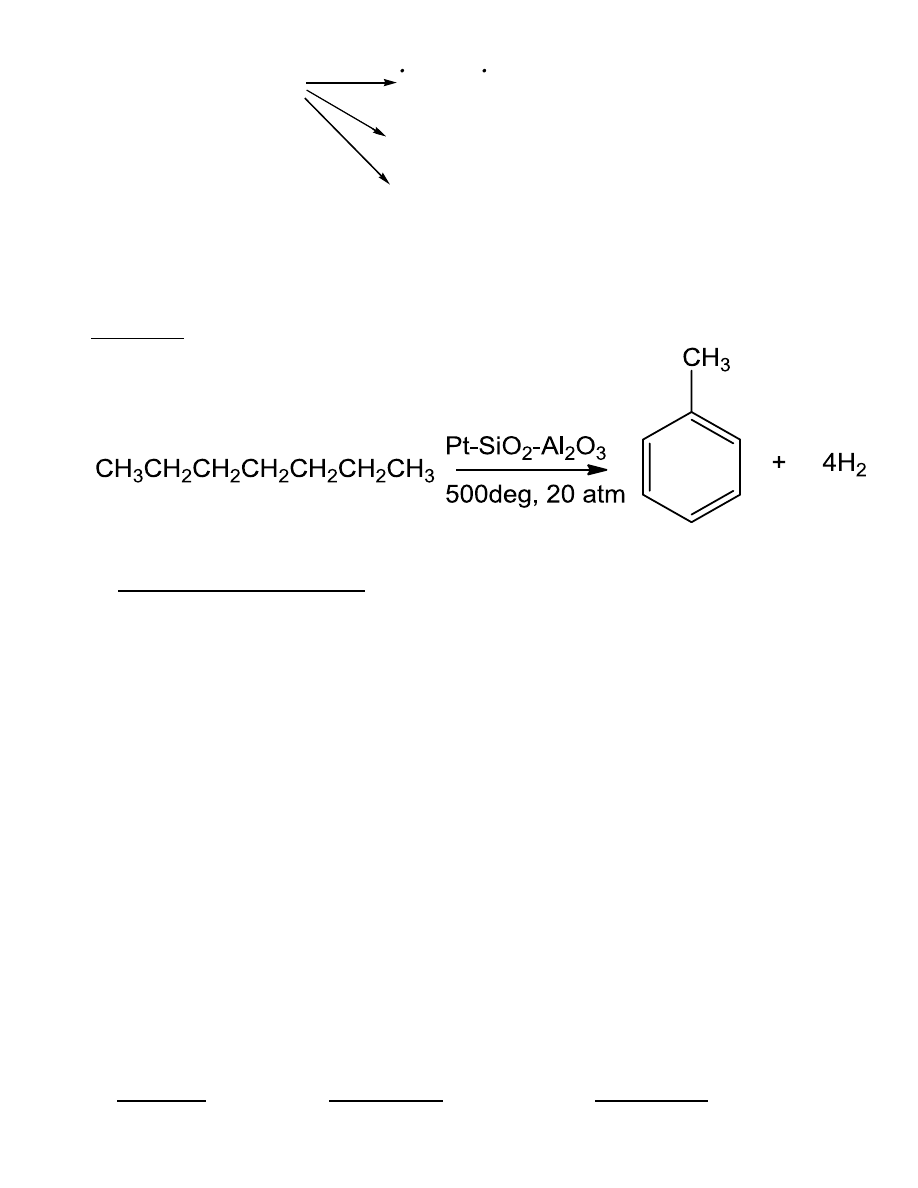
Typy reakcji alkanów:
I.
Piroliza (kraking)
4
CH
3
CH
2
CH
2
CH
2
CH
2
CH
3
rozpad
C1-C2
rozpad C2-C3
rozpad C3-C4
CH
3
+ CH
2
CH
2
CH
2
CH
2
CH
3
a/ rekombinacja:
CH
3
+
CH
2
CH
3
→ CH
3
CH
2
CH
3
b/ odrywanie H
CH
2
CH
3
+
CH
2
CH
2
CH
3
→ CH
3
-CH
3
+ CH
2
=CHCH
3
Reforming – przekształcanie alkanów w zw. aromatyczne o podobnej M
II.
Halogenowanie alkanów
CH
4
, Cl
2
> 300
C / hν
CH
3
-H + Cl-Cl → CH
3
-Cl + HCl
D
Cl – Cl
58 kcal/mol
CH
3
-Cl
85 kcal/mol
CH
3
– H
105 kcal/mol
H-Cl
103 kcal/mol
H
= Σ D(wiązań zerwanych) - Σ D(wiązań tworzonych)
H
= 105 + 58 – 85 – 103 = -25 kcal/mol
Mechanizm:
1. Etap inicjacji:
Cl – Cl → 2Cl
H
= + 58 kcal/mol
2. Etap propagacji / rozwijania:
a/ Cl
+ CH
4
→ H – Cl + CH
3
H
= 105 – 103 = + 2 kcal/mol
b/ CH
3
+ Cl – Cl → CH
3
– Cl + Cl
H
= 58 - 85 = - 27 kcal/mol
3. Etap terminacji:
Cl
+ Cl
→ Cl
2
Cl
+ CH
3
→ CH
3
- Cl
CH
3
+ CH
3
→ CH
3
- CH
3
Inicjacja
Propagacja
Terminacja

5
X
2
→ 2X
X
+ R-H→HX + R
X
+ X
→ X
2
R
+ X
2
→ R-X + X
R
+ X
→ RX
R
+ R
→ R-R
Względna reaktywność:
F
> Cl
> Br
> I
Jod nie reaguje.
X = F
Cl
Br I
H
(etapu propagacji) -103
-25
-7 +13 kcal/mol
Chlorowanie wyższych alkanów:
hν
CH
3
CH
2
CH
2
CH
3
+ Cl
2
→ CH
3
CHClCH
2
CH
3
+ CH
3
CH
2
CH
2
CH
2
Cl
A
B
spodziewany stosunek A : B = 4 : 6 = 2 : 3
eksperymentalny stosunek A : B = 7 : 3
CH
3
CHCH
3
CH
3
CCH
3
CH
3
CHCH
2
CH
3
Cl
CH
3
CH
3
Cl
+ Cl
2
+
hv
A
B
spodziewany stosunek: A : B = 1 : 9
eksperymentalny stosunek: A : B = 36 : 64 = 5,06 : 9
Względna reaktywność w reakcji chlorowania:
R
3
CH > R
2
CH
2
> RCH
3
5.0 3.5 1
Selektywność halogenowania rodnikowego:
F
2
+ (CH
3
)
3
CH → (CH
3
)
3
CF + FCH
2
CH(CH
3
)
2
+ HF
14% 86%
Br
2
+ (CH
3
)
3
CH → (CH
3
)
3
CBr + BrCH
2
CH(CH
3
)
2
+ HBr
> 99% < 1%
Fluorowanie - drogie, agresywny F
2
, r. niekontrolowane,
Chlorowanie – tani substrat, konieczność separacji produktów
Bromowanie – selektywne, laboratoryjnie – met. z wyboru (Br
2
lub N-bromo-
sukcynimid)
Jodowanie – niekorzystna termodynamika
Otrzymywanie rozpuszczalników, halotanu (CF
3
CHBrCl)
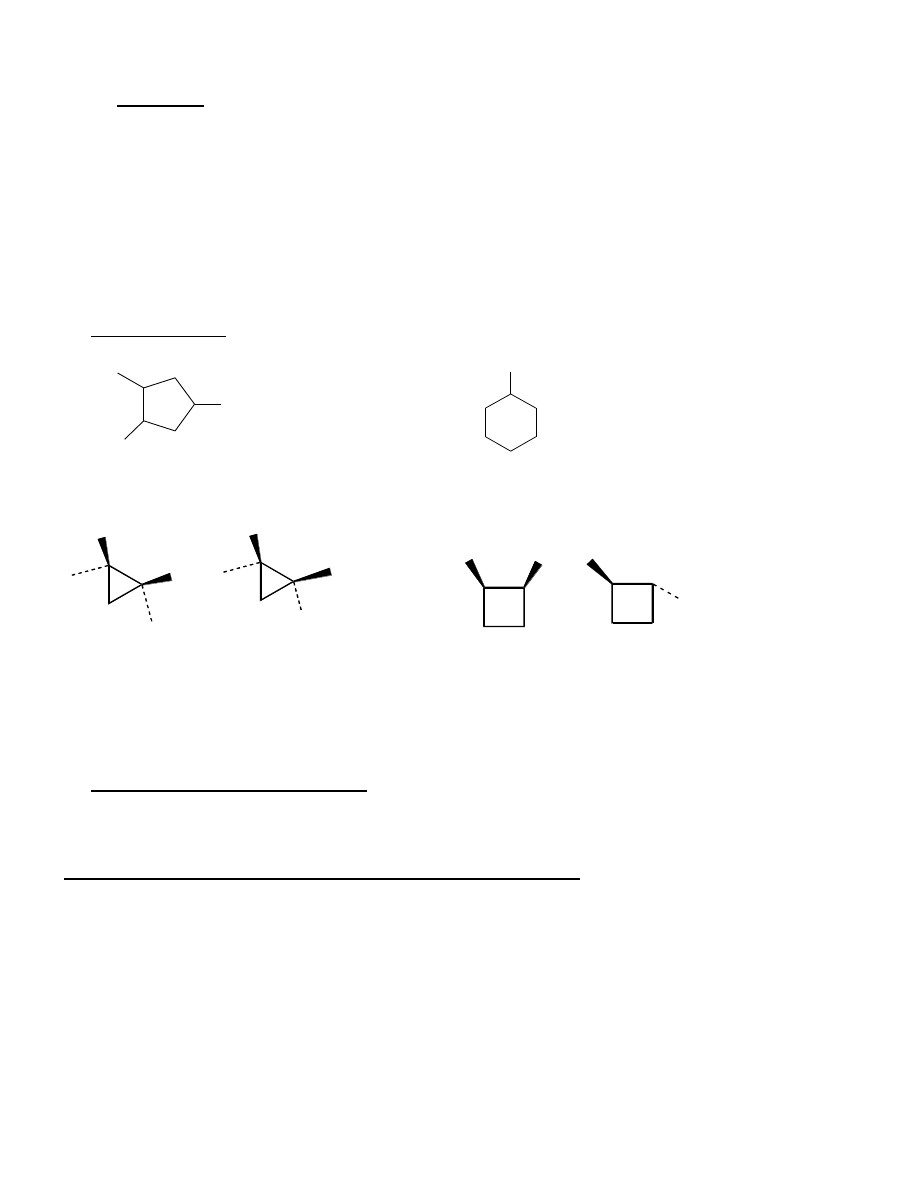
6
III. Spalanie
2C
n
H
2n +2
+ (3n+1)O
2
→ 2nCO
2
+ (2n+2)H
2
O
H
spal.
H
spal.
– miarą zawartości energii
M↑,
H
spal.
↑
H
spal.
= f (st.skupienia)
EtOH(ciecz) = – 327 kcal/mol
EtOH(gaz) = – 336 kcal/mol
Izomery konstytucyjne ≠
H
spal
ALKANY CYKLICZNE
= cykloalkany, karbocykle, C
n
H
2n
Nazewnictwo – podstawniki z ich lokantami poprzedzają cyklo- … . Mniejszy
fragment podstawnikiem większego.
Cl
CH
2
CH
2
CH
3
H
3
C
CH(CH
2
)
6
CH
3
nie
2-chloro-1-metylo-4-propylocyklopentan
cykloheksylooktan
tylko: 1-chloro-2-metylo-4-propylocyklopentan
CH
3
H
3
C
H
3
C
CH
3
Cl
Br Cl
Br
cis-
trans-
cis- trans-
1,2-dimetylocyklopropan
1-bromo-2-chlorocyklobutan
Stereoizomery – związki o identycznych połączeniach między atomami, a różnym
ułożeniu przestrzennym (nie można ich wzajemnie przekształcić bez rozerwania
wiązań).
Właściwości cykloalkanów:
Temp. wrzenia, temp. topn., gęstość – wyższa niż normalne alkany (bardziej
sztywny i symetryczny układ).
Ciepło spalania miarą naprężenia w cykloalkanach:
H
spal.
CH
3
CH
2
CH
3
- 530.6 kcal/mol
H = 156.8
CH
3
CH
2
CH
2
CH
3
- 687.4 kcal/mol
H = 157.8
CH
3
(CH
2
)
3
CH
3
- 845.2 kcal/mol
alkany:
H
spal.
(CH
2
) = 157 kcal/mol
cykloalkany:
H
exper
>
H
obl.
7
H
exper
-
H
obl.
–
naprężenie pierścienia
(N)
N (CH
2
)
N (CH
2
)
C
n
n = 3
9.2 kcal/mol
n = 4
6.6
Cykloalkany:
n = 5
1.3
1. małe pierścienie (C
3
, C
4
)
n = 6
0
2. zwykłe pierścienie (C
5
, C
6
, C
7
)
n = 7
0.9
3. średnie (C
8
– C
12
)
n = 8
1.3
4. duże (
C
13
)
Naprężenia:
- kątowe;
- torsyjne (naprzeciwległe);
- steryczne (odpychanie Van der Waalsa).
*
Cyklopropan:
naprężenia kątowe, torsyjne
słabe wiązanie C-C
(D
=65 kcal/mol)
+ H
2
Pd
CH
3
CH
2
CH
3
H
spal
= -37.6 kcal/mol
Cyklobutan
Zmniejszenie napięć
konformacja zgięta
+ H
2
Pd
CH
3
CH
2
CH
2
CH
3
Cyklopentan
Gdyby płaski – α = 108
, naprężenia torsyjne
konformacja kopertowa
konformacja półkrzesłowa
Brak nietypowych reakcji C
3
, C
4
.
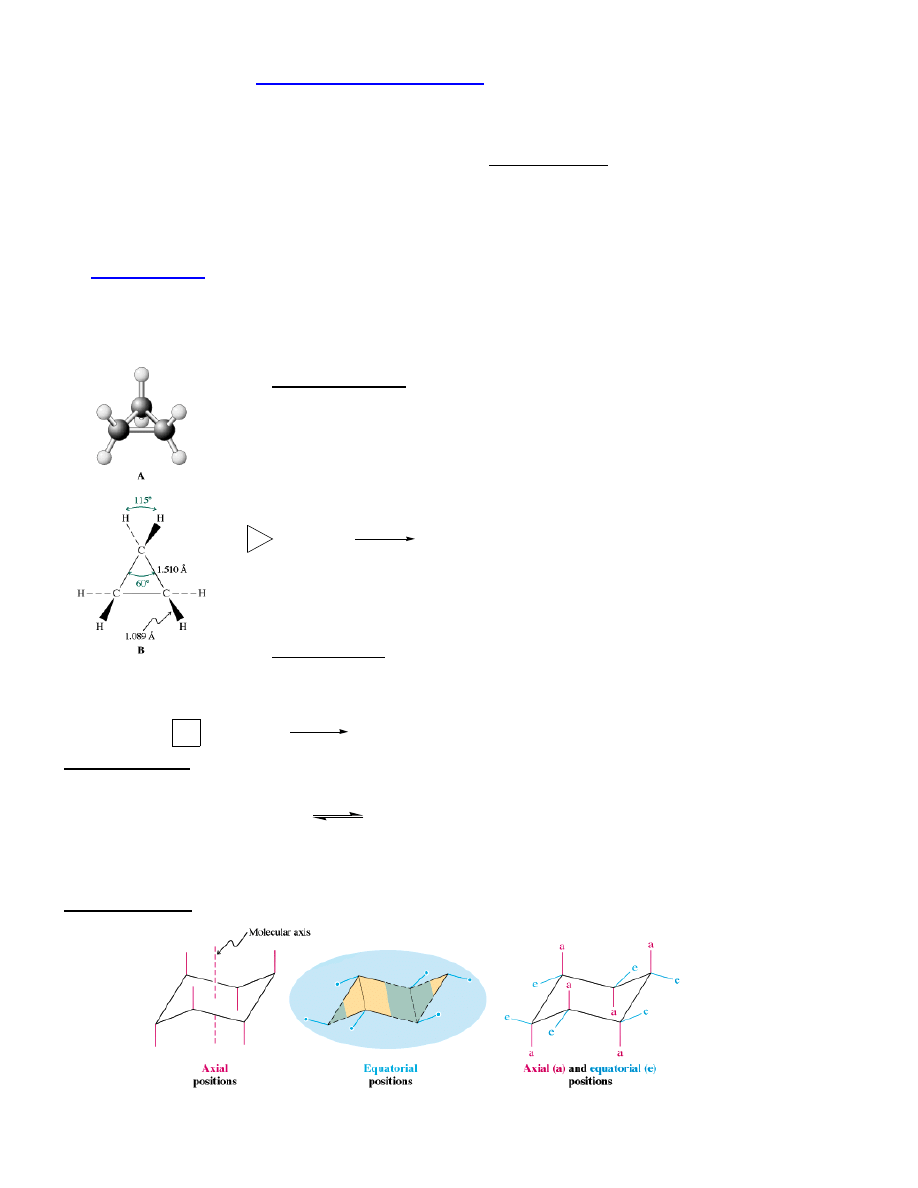
Cykloheksan
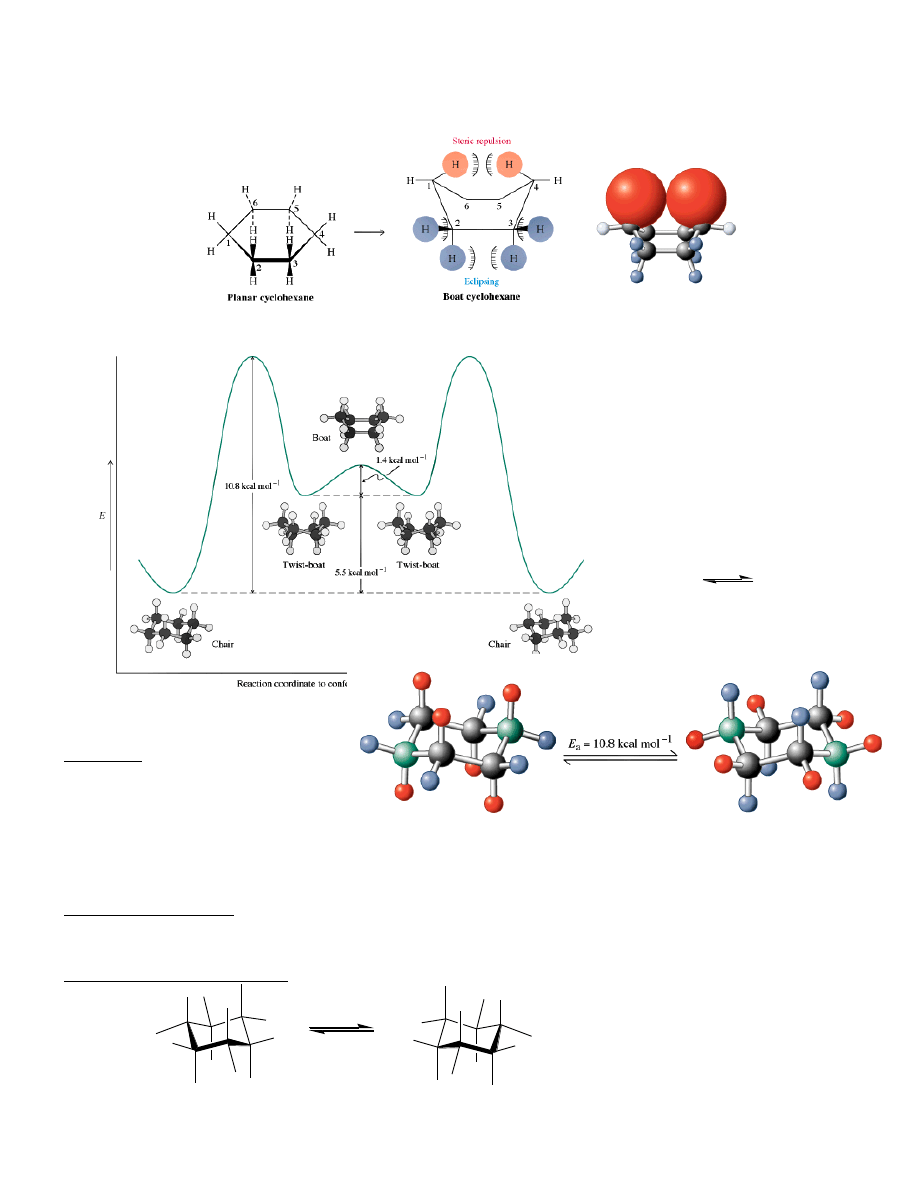
8
*
Konformacja krzesłowa – beznapięciowa
Mniej stabilne: łódkowa, skręcona
Steryczne oddziaływanie 1,4 (transanularne) + nap. torsyjne
skręcenie
*
ax
eq
*
Inwersja pierścienia –
100 000/ s
Oddziaływania 1,3-
diaksjalne
podstawniki
konkurują o pozycję ekwatorialną.
Metylocykloheksan – oddziaływania 1,3-diaksjalne
E
ax
≠ E
eq
G
ax
- G
eq
= 1.7 kcal/mol
ax : eq = 5 : 95
tert – butylocykloheksan
G(ax–eq) = ok. 5 kcal/mol
ax : eq = 1 : 10 000
CH
3
CH
3
CH
3
H
3
C
G
= 0 kcal/mol (cis)
9
H
3
C
CH
3
CH
3
CH
3
Izomery cis i trans
G
= + 3.4 kcal/mol
F
CH
3
CH
3
F
G
= - 1.45 kcal/mol
Większe cykloalkany (do C
12
) – małe naprężenia (kombinacja nap. torsyjnego I
kątowego).
Alkany policykliczne
skondensowane
mostkowe
spiro
Karbocykliczne produkty naturalne
terpeny (związki zapachowe)
steroidy
Terpeny:
- monoterpeny (C
10
); → monoterpenoidy
- seskwiterpeny (C
15
);
- diterpeny (C
20
).
mentol
kamfora
2-metylo-1,3-butadien (izopren)
Substrat terpenów, steroidów:
pirofosforan 3-izopentylu
CH
3
OH
CH
3
H
3
C
O
CH
3
H
3
C
CH
3
2HC
CCH
2
CH
2
O
CH
3
P
O
O
P
O
O
O
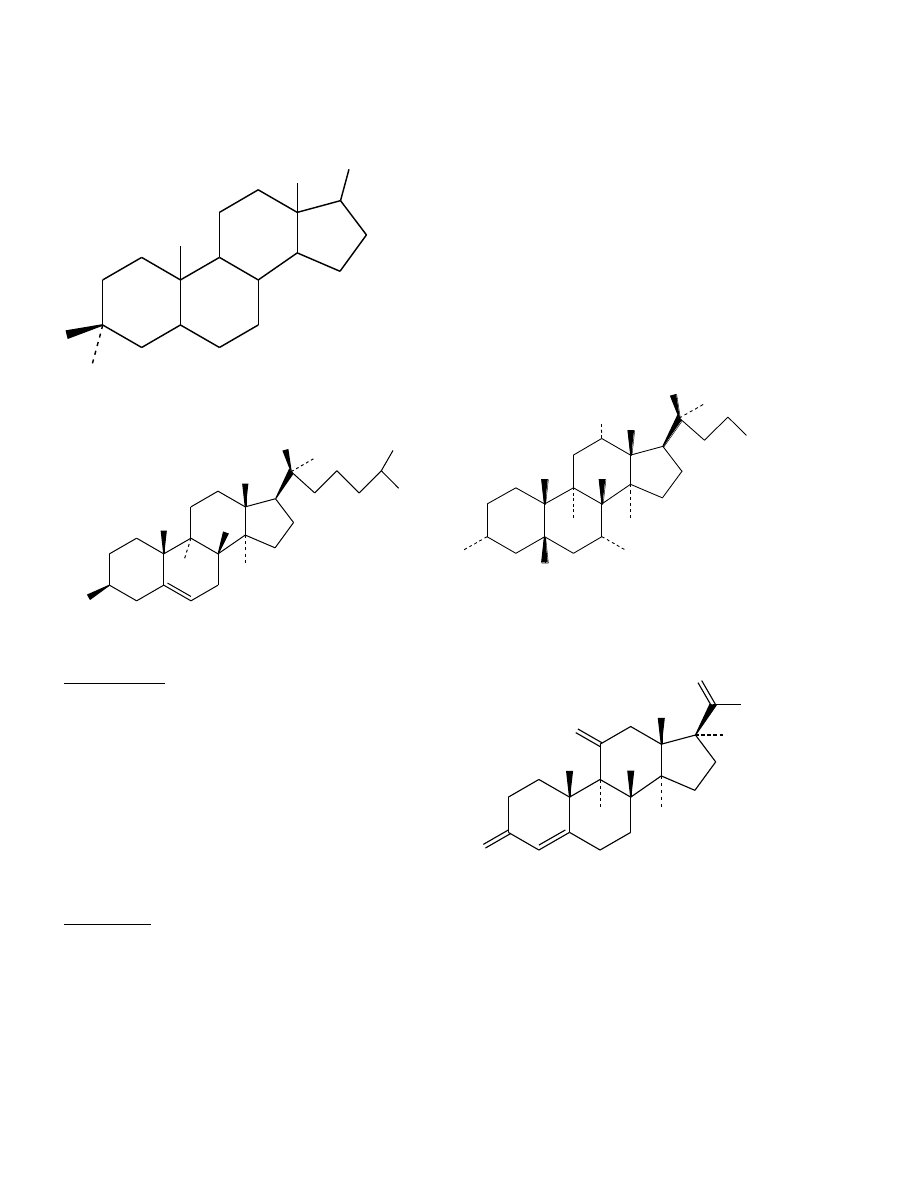
10
Steroidy: sterole, witamina D, kwasy żółciowe, kortykosteroidy, hormony płciowe,
saponiny...
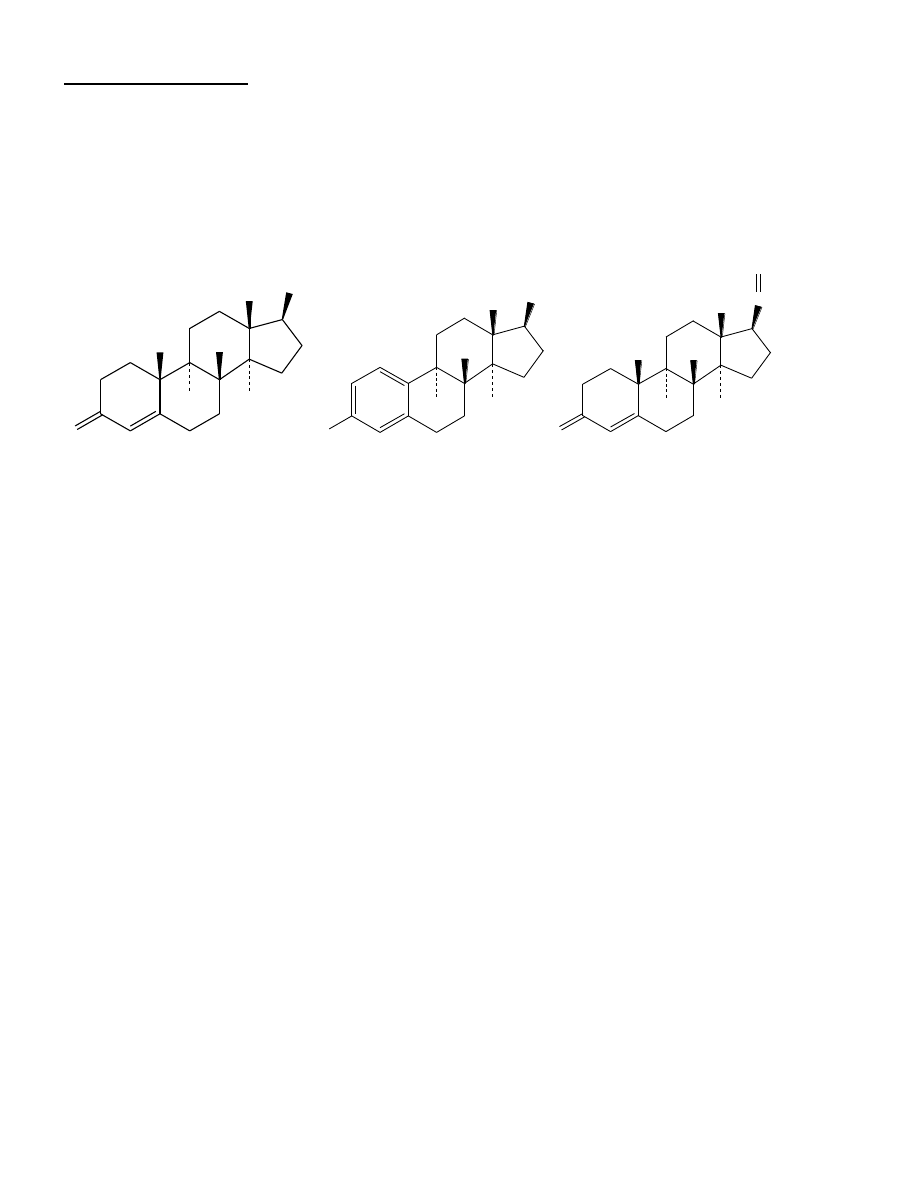
podstawiony perhydrocyklopentanofenantren
OH w C3 – sterole
R
2
– zwykle CH
3
R
3
– zróżnicowany
B i C oraz C i D – trans
A i B może być cis/trans
→
seria 5α, 5β
HO
CH
3
H
H
H
H
CH
3
COOH
CH
3
1
2
3
4
5
6
7
8
9
10
11
12
13
15
16
17
14
H
OH
HO
cholesterol (β-sterol)
kwas cholowy (kw.żółciowy)
Cholesterol – najbardziej ozpowszechniony
steroid;
człowiek – 200-300g;
prekursor hormonów i kwasów żółciowych.
kortyzon
Kortyzon – jeden z hormonów kortykosteroidowych (kora nadnercza)
odpowiedzialnych za gospodarkę wodno-elektrolitowa i metabolizm białek i cukrów:
- mineralokortykosteroidy;
- glikokortykosteroidy.
CH
3
H
H
H
CH
3
1
2
3
4
5
6
7
8
9
10
11
12
13
15
16
17
14
O
O
OH
O
CH
2
OH
1
2
3
4
5
6
7
8
9
10
11
12
13
15
16
17
14
A
B
C
D
R
1
R
2
R
3
HO
CH
3
H
H
H
H
CH
3
CH
3
CH
3
CH
3
1
2
3
4
5
6
7
8
9
10
11
12
13
15
16
17
14
11
Hormony płciowe:
androgeny: testosteron, analogi
→ anaboliki (leczenie niedorozwojów
mięśniowych, nadużywanie → rak wątroby, choroba wieńcowa, bezpłodność..)
estrogeny: estradiol …
progestageny (progestany): progesteron…
H
H
H
CH
3
1
2
3
4
5
6
7
8
9
10
11
12
13
15
16
17
14
O
CH
3
OH
H
H
H
CH
3
1
2
3
4
5
6
7
8
9
10
11
12
13
15
16
17
14
HO
OH
H
H
H
CH
3
1
2
3
4
5
6
7
8
9
10
11
12
13
15
16
17
14
O
CCH
3
CH
3
O
testosteron
estradiol
progesteron
17-β-hydroxy-4-androsten-3-on 1,3,5(10)-estratrien-3,17-β-diol 4-pregnene-
3,20-dione
Wyszukiwarka
Podobne podstrony:
cw 13 id 121763 Nieznany
36 13 id 36113 Nieznany (2)
7 13 id 44730 Nieznany (2)
piae wyklad3 12 13 id 356381 Nieznany
Alkohole 13 id 58087 Nieznany (2)
IMG 13 id 210986 Nieznany
G2 PB 02 B Rys 3 13 id 185405 Nieznany
13 id 189372 Nieznany (2)
(13)id 841 Nieznany
Lab 13 id 257441 Nieznany
Cwiczenie 13 id 125163 Nieznany
INS LAB PEWN 4 12 13 id 214856 Nieznany
B 13 id 74810 Nieznany (2)
INS LAB PEWN 1 12 13 id 214853 Nieznany
28 13 id 31840 Nieznany
7izostazja 2012 13 id 46496 Nieznany
2czas geologiczny 2012 13 id 32 Nieznany
więcej podobnych podstron