s m s • c h e m i a
M – masa molowa substancji wydzielonej na elektrodzie,
M
k n
F
⋅
=
k – równoważnik elektrochemiczny,
n – liczba elektronów biorąca udział w reakcji, w której
powstaje 1 mol substancji o masie molowej M,
F – stała Faradaya (96500 C/mol).
18. IZOMERIA – RODZAJE I PRZYKŁADY
Izomeria – zjawisko występowania dwóch lub więcej związków
o jednakowym wzorze sumarycznym, ale o różnej budowie
(strukturze) oraz odmiennych właściwościach fizyko-chemicz-
nych. Związki takie nazywamy izomerami. Istnieją dwa główne
rodzaje izomerii:
IZOMERIA
konstytucyjna (strukturalna)
stereoizomeria (przestrzenna)
izomery różnią się kolejnością i sposo-
bem powiązania atomów w cząsteczce
stereoizomery różnią się rozmieszczeniem
atomów w przestrzeni przy tej samej ko-
lejności powiązania atomów
I. szkieletowa
a) łańcuchowa
b) pierścieniowa
c) położenia wiązań wielokrotnych
II. podstawienia
III. metameria (funkcyjna)
IV. tautomeria
I. konformacyjna
II. geometryczna
III. optyczna
Poniżej podano przykłady różnych rodzajów izomerii:
a) IZOMERIA KONSTYTUCYJNA
CH
3
—CH
2
—CH
2
—CH
3
CH
3
—CH—CH
3
izomery łańcuchowe
(różnice w bu-
x
dowie szkieletu węglowego)
CH
3
CH
2
=CH—CH
2
—CH
3
izomery łańcuchowo-pierścieniowe
CH
3
izomery pierścieniowe
CH
2
=CH—CH
2
—CH
3
CH
3
—CH=CH—CH
3
izomery położenia
wiązania podwójnego
CH
3
—CH
2
—CH
2
—CH
2
—OH CH
3
—CH
2
—CH—CH
3
izomery podstawienia
x
OH
CH
3
—CH
2
—OH
CH
3
—O—CH
3
metamery (alkohol – eter)
CH
3
—CH
2
—CHO
CH
3
—CO—CH
3
metamery
(aldehyd – keton)
CH
3
—CH
2
—COOH CH
3
—COOCH
3
metamery (kwas – ester)
CH
3
—CH
2
—NO
2
CH
2
—COOH
metamery
x
(nitrozwiązek – aminokwas)
NH
2
tautomery
keto-enolowe
(istnieją w stanie równowagi)
keton
enol
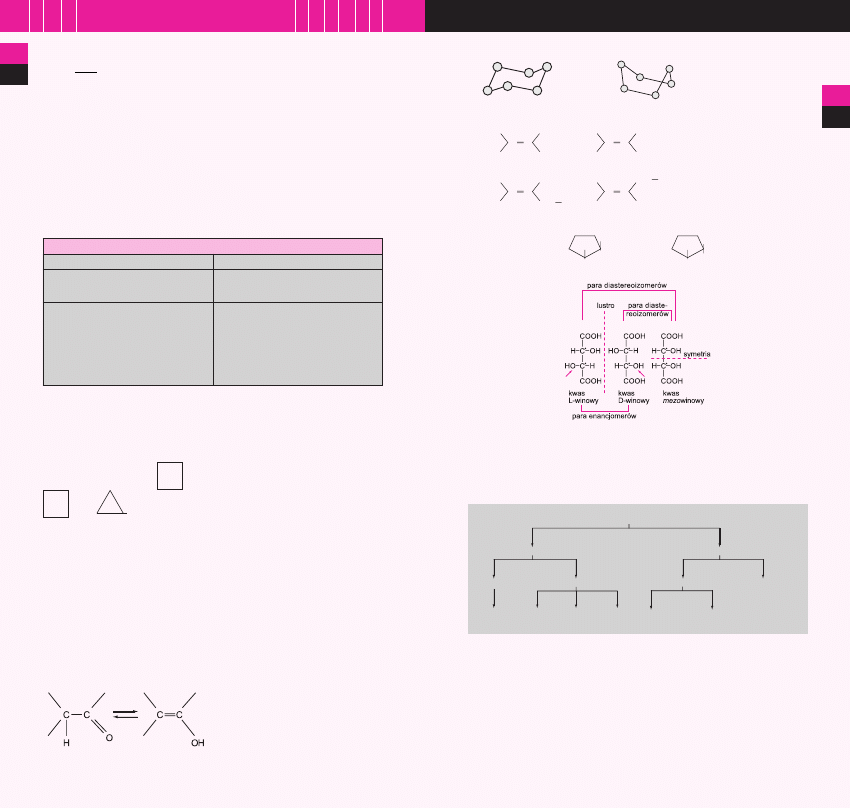
b) STEREOIZOMERIA
konformacje
cykloheksanu
konformacja krzesełkowa
konformacja łódkowa
CH
3
H
CH
3
H
C
C
CH
3
H
CH
3
H
C
C
cis-but-2-en
trans-but-2-en
CH
3
H
CH
3
CH
3
CH
2
CH
3
CH
2
C
C
CH
3
H
CH
3
C
C
E-3-metylopent-2-en
Z-3-metylopent-2-en
izomery
geometryczne
Cl
Cl
Cl
Cl
cis-1,2-dichlorocyklopentan trans-1,2-dichlorocyklopentan
19. WĘGLOWODORY,
FLUOROWCOPOCHODNE WĘGLOWODORÓW
nasycone
alkany
alkeny
alkadieny
nienasycone
WĘGLOWODORY
łańcuchowe
pierścieniowe
cykliczne
alkiny
cykloalkany
cykloalkeny
cykloalkadieny
C
n
H
2n+2
C
n
H
2n
C
n
H
2n-2
aromatyczne
C
n
H
2n-2
Węglowodory to związki, w cząsteczkach których występują
wyłącznie atomy węgla i wodoru.
WĘGLOWODORY NASYCONE (ALKANY)
Cząsteczki
alkanów
zbudowane są z atomów węgla, których
orbitale walencyjne są w stanie hybrydyzacji sp
3
. Atomy węgla
połączone są ze sobą wyłącznie wiązaniami pojedynczymi σ.
Długość wiązania pojedynczego węgiel-węgiel wynosi 154 pm,
a energia wiązania 368 kJ/mol. Cząsteczki alkanów nie są płaskie,
i z o m e r i a – r o d z a j e i p r z y k ł a d y
52
18
53
19
Wyszukiwarka
Podobne podstrony:
Rodzaje i przykłady komputerów
RYMY RODZAJE I PRZYKŁADY
PROP 2 (4 wykład) Bazy Rodzaje Przykłady
Błędy typograficzne rodzaje, przykłady
zawal rodzaje, mechanizm i przyklady
Rodzaje zadań, przykłady, odpowiedzi
ChO w Rodzaje izomerii, ~FARMACJA, I rok, chemia (ciul wie co), Semestr I
Sieć komputerowa i jej rodzaje. Internet i jego usługi jako przykład sieci globalnej., edukacja i na
Ocena skutków orodowiskowych zmian rodzaju użytkowania gruntów na przykładzie wybranych pól
rodzaje kosztów na przykładzie wybranej firmy, finanse
CZYNNIKI BIOLOGICZNE, CZYNNIKI BIOLOGICZNE - definicja, klasyfikacja do grup ryzyka, drogi przenosze
13b rodzaje izomerii
6 Izomeria konfiguracyjna heteroatomów Przykłady chiralności w przyrodzie
więcej podobnych podstron