1
http://sylwester_stepniak.users.sggw.pl
MANGANOMETRIA I
Nazwisko, imię:…………………………………………………………………….…………………………………………………………………
METODYKA POSTĘPOWANIA ANALITYCZNEGO
Substancja podstawowa - krystaliczny kwas szczawiowy (H
2
C
2
O
4
·2H
2
O).
1
2
06
,
126
2
4
2
2
mol
g
M
O
H
O
C
H
Wskaźnik PRM: roztwór KMnO
4
w środowisku kwasu H
2
SO
4
.
Równanie reakcji 1: 5 H
2
C
2
O
4
+ 2 MnO
4
–
+ 6 H
+
10 CO
2
+ 2 Mn
2+
+ 8 H
2
O
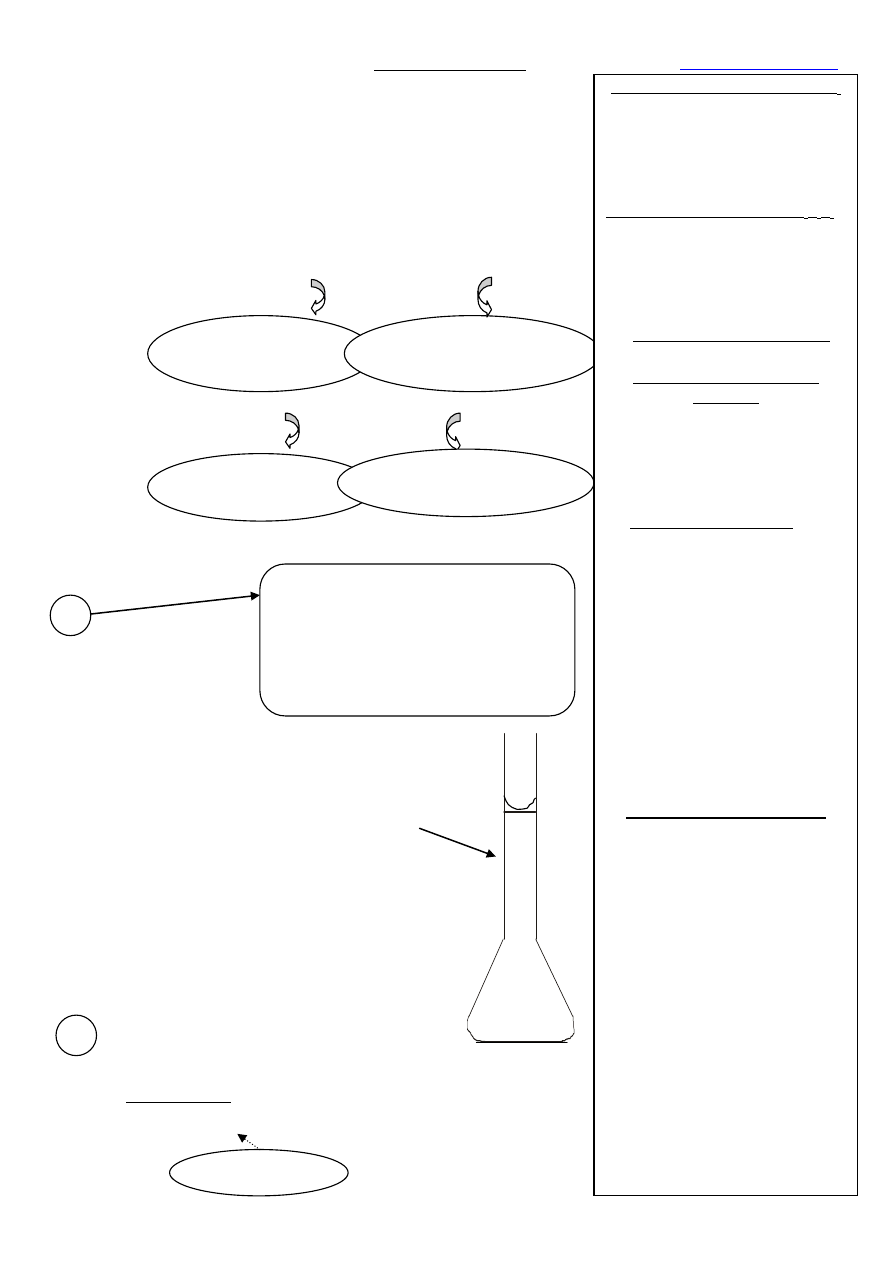
Określanie PRM:
Równanie reakcji 2: 5 Fe
2+
+ MnO
4
–
+ 8 H
+
5 Fe
3+
+ Mn
2+
+ 4 H
2
O
Określanie PRM:
Przygotowanie mianowanego roztworu H
2
C
2
O
4
o stężeniu około 0,05 mol·dm
–3
w kolbie miarowej (V
k,1
)
Masa krystalicznego kwasu szczawiowego
przeniesionego ilościowo do kolby miarowej (V
k,1
):
.....
..........
..........
..........
..........
2
4
2
2
2
O
H
O
C
H
m
........
..........
..........
..........
..........
..........
..........
..........
1
,
2
2
2
4
2
2
2
4
2
2
4
2
2
k
O
H
O
C
H
O
H
O
C
H
O
C
H
V
M
m
c
[1]
2
Obliczenie stężenia H
2
C
2
O
4
:
Roztwór bezbarwny
(nadmiar H
2
C
2
O
4
)
Bladoróżowe zabarwienie
roztworu (nadmiar MnO
4
–
)
Roztwór bezbarwny
(nadmiar Fe
2+
)
Bladoróżowe zabarwienie
roztworu (nadmiar MnO
4
–
)
PRZYGOTOWANIE ROZTWORU KMnO
4
1.
Odważyć na wadze technicznej ok.1 g
KMnO
4
w łódeczce aluminiowej.
2.
Przesypać odważony KMnO
4
do podpisanej
butelki z korkiem szklanym.
3.
Dodać 300 cm
3
wody destylowanej.
PRZYGOTOWANIE ROZTWORU H
2
C
2
O
4
W KOLBIE MIAROWEJ (V
k,1
)
1.
Wyjąć z szafki nr:………..kolbę miarową.
2.
Podpisać numerem z listy kolbę miarową.
3.
Przepłukać kolbę miarową wodą
destylowaną
Ważenie na wadze technicznej (pokaz)
- odważyć ok. 1,3 g H
2
C
2
O
4
·2H
2
O
Przygotowanie do ważenie na wadze
analitycznej:
- wyjąć korek z kolby miarowej i schować go do
kieszeni fartucha,
- włożyć lejek do kolby miarowej,
- kolba z lejkiem, naczynko wagowe z kwasem,
arkusz analityczny, długopis,
Ważenie na wadze analitycznej:
- otworzyć drzwiczki wagi analitycznej i wstawić
delikatnie naczynko na szalkę wagi, zamknąć
drzwiczki wagi,
- wcisnąć tarę,
- otworzyć drzwiczki wagi, zdjąć delikatnie
naczynko z szalki i przenieść ilościowo kwas na
lejek,
- wstawić naczynko na szalkę wagi i zamknąć
drzwiczki,
- odczytać i zapisać masę odsypanego kwasu z
dokładnością do 4 miejsca po przecinku,
- zdjąć naczynko z szalki wagi, zamknąć
drzwiczki wagi i nacisnąć tarę.
Przygotowanie mianowanego roztworu
H
2
C
2
O
4
4. Wlać do zlewki 300cm
3
wody destylowanej,
5. Dokładnie spłukać lejek w kolbie miarowej,
6. Wyjąć lejek,
7. Rozcieńczyć roztwór w kolbie miarowej
wodą destylowaną (nalewając do początku
szyjki kolby),
8.
Pobrać pipetą wodę destylowaną i
uzupełniać roztwór w kolbie miarowej
regulując wypływ wody z pipety palcem
wskazującym, trzymając kolbę tak, aby
kreska była na wysokości oczu,
9. Zamknąć dobrze kolbę korkiem i kilkanaście
razy odwrócić do góry dnem,
10. Schować kolbę do szafki nr ……………….
11. Obliczyć stężenie substancji w otrzymanym
roztworze wg wzoru [1] w arkuszu analitycznym
(do 4 miejsca po przecinku).
1
Ważenie na wadze analitycznej
substancji podstawowej
w naczyńku wagowym
(H
2
C
2
O
4
·2H
2
O)
1.
Odważyć na wadze analitycznej około 1,3 g
krystalicznego kwasu szczawiowego
z dokładnością do 0,0001g.
2.
Przenieść ilościowo odważony kwas,
przesypując go przez suchy lejek do kolby
miarowej V
k,1
.
3.
Spłukać dokładnie lejek i uzupełnić
roztwór w kolbie miarowej wodą destylowaną
do kreski.
H
2
C
2
O
4
Objętość kolby w dm
3
2
http://sylwester_stepniak.users.sggw.pl MANGANOMETRIA II
e-mail:
Nazwisko, imię:…………………………………………………………………….…………………………………………………………………
Oznaczanie stężenia KMnO
4
I.
Sączenie roztworu nadmanganianu potasu (pokaz):
II.
Oznaczenie stężenia roztworu nadmanganianu potasu metodą miareczkowania roztworu kwasu
szczawiowego o znanym stężeniu
Równanie reakcji: 5 H
2
C
2
O
4
+ 2 MnO
4
–
+ 6 H
+
10 CO
2
+ 2 Mn
2+
+ 8 H
2
O
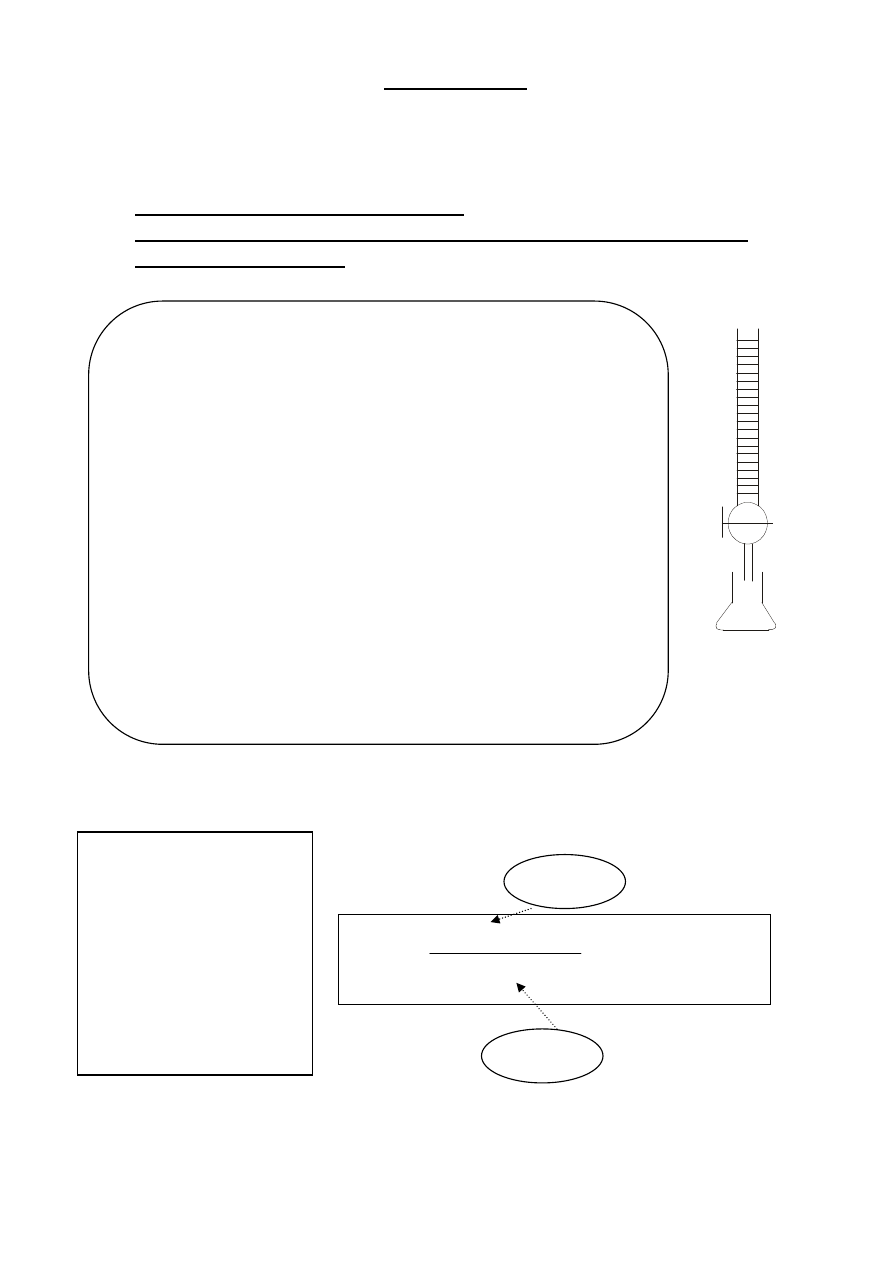
Miareczkowanie mianowanego
roztworu kwasu H
2
C
2
O
4
roztworem KMnO
4
Biureta
(roztwór
KMnO
4
)
Kolba stożkowa
(podgrzany do
60
o
C roztwór
H
2
C
2
O
4
i
10% kwas
H
2
SO
4
)
.......
..........
..........
..........
1
,
4
KMnO
V
.......
..........
..........
..........
2
,
4
KMnO
V
.......
..........
..........
..........
3
,
4
KMnO
V
.......
..........
..........
..........
,
4
śr
KMnO
V
1.
Napełnić biuretę roztworem nadmanganianu potasu używając lejka
plastikowego
2.
Przygotować biuretę do miareczkowania:
a.
Wypełnić końcówkę biurety roztworem, ustawić menisk górny roztworu
nadmanganianu potasu na kresce zerowej biurety, wyjąć lejek
b.
Położyć białą kartkę pod biuretę
3.
Pobrać pipetą roztwór kwasu szczawiowego i przenieść ilościowo do kolby
stożkowej (przed pobraniem dobrze wymieszać roztwór w kolbie miarowej)
4.
Dodać cylindrem miarowym ok. 20 cm
3
10% roztworu kwasu siarkowego (VI)
5.
Ogrzać roztwór w kolbie stożkowej do temperatury ok. 60
o
C,
po ogrzaniu postawić kolbę stożkową na białek kartce
6.
Miareczkować roztwór w kolbie stożkowej roztworem nadmanganianu potasu
do momentu aż roztwór zabarwi się na kolor lekko różowy
7.
Odczytać i zapisać objętość zużytego roztworu nadmanganianu potasu
8.
Wykonać jeszcze dwa takie miareczkowania (poczynając od punktu 2)
9.
Obliczyć średnią wartość objętości zużytego roztworu nadmanganianu potasu
i obliczyć stężenie roztworu nadmanganianu potasu (wzór 2)
........
..........
..........
5
2
4
4
2
2
4
2
2
4
KMnO
O
C
H
O
C
H
KMnO
V
c
V
c
objętość
pipety w cm
3
Odczyt z
biurety w cm
3
[2]
3
http://sylwester_stepniak.users.sggw.pl
MANGANOMETRIA III
e-mail:
Nazwisko, imię:…………………………………………………………………….…………………………………………………………………
III.
Oznaczenie stężenia żelaza w badanym roztworze (V
Fe
)
metodą miareczkowania roztworem nadmanganianu
potasu o znanym stężeniu
Równanie reakcji: 5 Fe
2+
+ MnO
4
–
+ 8 H
+
5 Fe
3+
+ Mn
2+
+ 4 H
2
O
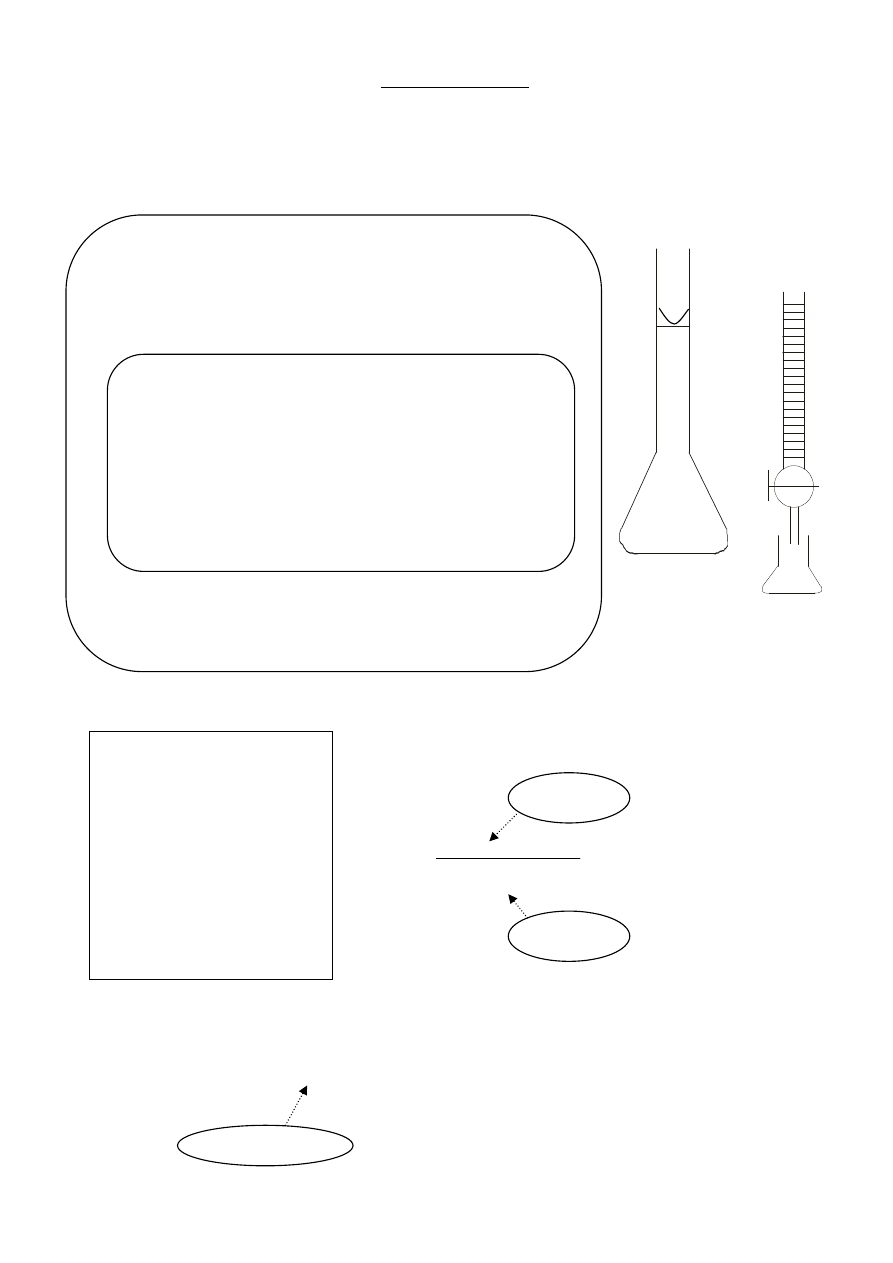
Biureta
(roztwór
KMnO
4
)
Kolba stożkowa
(roztwór Fe
2+
i
10% kwas H
2
SO
4
)
.......
..........
..........
..........
1
,
4
KMnO
V
.......
..........
..........
..........
2
,
4
KMnO
V
.......
..........
..........
..........
3
,
4
KMnO
V
.......
..........
..........
..........
,
4
śr
KMnO
V
Obliczenie
stężenia Fe
2+
w badanym roztworze
..........
..........
..........
5
2
4
4
2
,
Fe
KMnO
śr
KMnO
Fe
V
c
V
c
[3]
Objętość
pipety w cm
3
Odczyt z
biurety w cm
3
Obliczenie
masy Fe
2+
w badanym roztworze
......
..........
..........
..........
..........
..........
2
2
2
,
Fe
k
Fe
Fe
c
V
M
m
Objętość kolby w dm
3
[4]
1. Uzupełnić badany roztwór wodą destylowaną w kolbie
miarowej (V
Fe
)
do kreski i dobrze wymieszać
2. Miareczkować analogicznie jak opisano arkuszu
analitycznym Manganometria II (bez ogrzewania)
3. Obliczyć stężenie żelaza w badanym roztworze (wzór 3)
4. Obliczyć masę żelaza w badanym roztworze (wzór 4)
1. Pobrać pipetą z kolby miarowej (V
Fe
) roztwór Fe
2+
i przenieść ilościowo do kolby stożkowej.
2. Dodać cylindrem miarowym do kolby stożkowej 20 cm
3
10% kwasu siarkowego i 50 cm
3
wody destylowanej.
3. Miareczkować roztworem KMnO
4
do momentu, gdy roztwór
w kolbie stożkowej zabarwi się na kolor bladoróżowy.
4. Wykonać jeszcze dwa takie miareczkowania
(poczynając od punktu 1)
Fe
2+
Wyszukiwarka
Podobne podstrony:
blok 2 skrypt id 90327 Nieznany (2)
blok 3 skrypt id 90351 Nieznany (2)
md skrypt id 290151 Nieznany
AiSD skrypt id 53503 Nieznany (2)
Enzymologia Skrypt I id 162159 Nieznany
blok 8 skrypt id 90430 Nieznany (2)
Ekonomia skrypt id 156120 Nieznany
Eschatologia skrypt id 163497 Nieznany
mikro II skrypt id 300610 Nieznany
Prawoznawstwo skrypt id 388928 Nieznany
parazyty skrypt id 349280 Nieznany
handel zagraniczny skrypt id 19 Nieznany
ELEKTROFOREZA skrypt id 158052 Nieznany
blok 5 skrypt id 90384 Nieznany (2)
Chemia analityczna skrypt id 11 Nieznany
Logika SWPW MGR Skrypt id 27217 Nieznany
ksop skrypt id 252775 Nieznany
FORMY PRACY SKRYPT id 179816 Nieznany
więcej podobnych podstron