
Ćwiczenie 2.
OZNACZANIE TWARDOŚCI WODY
SPOSOBEM WARTHA - PFEIFERA
WSTĘP
RODZAJE TWARDOŚCI WODY
Twardość wody jest jej właściwością wynikającą z obecności rozpuszczonych w niej
związków, głównie wapnia i magnezu. Pierwotnie definiowana jako właściwość polegająca
na zużywaniu pewnych ilości mydła bez wytworzenia piany podczas wstrząsania próbki
wody z mydłem.
Jest to spowodowane obecnością jonów wapnia i magnezu, rzadziej żelaza, manganu, cynku
oraz innych ciężkich kationów, które z mydłem dodawanym do wody tworzą
nierozpuszczalne mydła wapienne, magnezowe i inne. Piana zaczyna się wytwarzać
wówczas, gdy nastąpi ich całkowite strącenie.
Mydło jest solą sodową wyższego kwasu tłuszczowego, najczęściej stearynowego, które
reaguje z jonami wapnia (magnezu) wg równania reakcji:
Ca
2+
+ 2 C
17
H
35
COO
_
Æ Ca(C
17
H
35
COO)
2
stearynian wapnia
Rozróżnia się następujące rodzaje twardości wody:
• Twardość ogólna – odpowiada całkowitej zawartości jonów wapnia i magnezu oraz
innych jonów metali powodujących twardość wody.
• Twardość węglanowa – odpowiada zawartości węglanów, wodorowęglanów
i wodorotlenków wapnia i magnezu. Zwana też bywa twardością przemijającą,
ponieważ podczas gotowania wody zanika (wytrącają się osady węglanu wapnia,
wodorotlenku magnezu i żelaza, tworząc tzw. kamień kotłowy powodujący straty
ciepła i większe zużycie paliwa podczas wody). Jednak po przegotowaniu w wodzie
pozostają węglany i wodorotlenki, w ten sposób twardość węglanowa jest wyższa od
twardości przemijającej.
Ca(HCO
3
)
2
Ù CaCO
3
↓ + H
2
O + CO
2
↑
Mg(HCO
3
)
2
Ù MgCO
3
↓ + H
2
O + CO
2
↑
MgCO
3
+ H
2
OÙ Mg(OH)
2
↓ + CO
2
↑
Twardość wody pozostająca po przegotowaniu nazywa się twardością stałą (= twardość
ogólna – twardość przemijająca) i jej wartość jest wyższa od twardości niewęglanowej.
• Twardość niewęglanowa – stanowi różnicę między twardością ogólną a twardością
węglanową i określa zawartość chlorków, siarczanów, azotanów i innych
rozpuszczalnych soli, głównie wapnia i magnezu.
1
Ćwiczenie 2.
Tw
og.
= Tw
nwęg.
+ Tw
węg.
Ponieważ twardość wody naturalnej zależy przede wszystkim od zawartości jonów Ca
2+
i Mg
2+
to często stosowany jest podział na twardość wapniową i twardość magnezową .
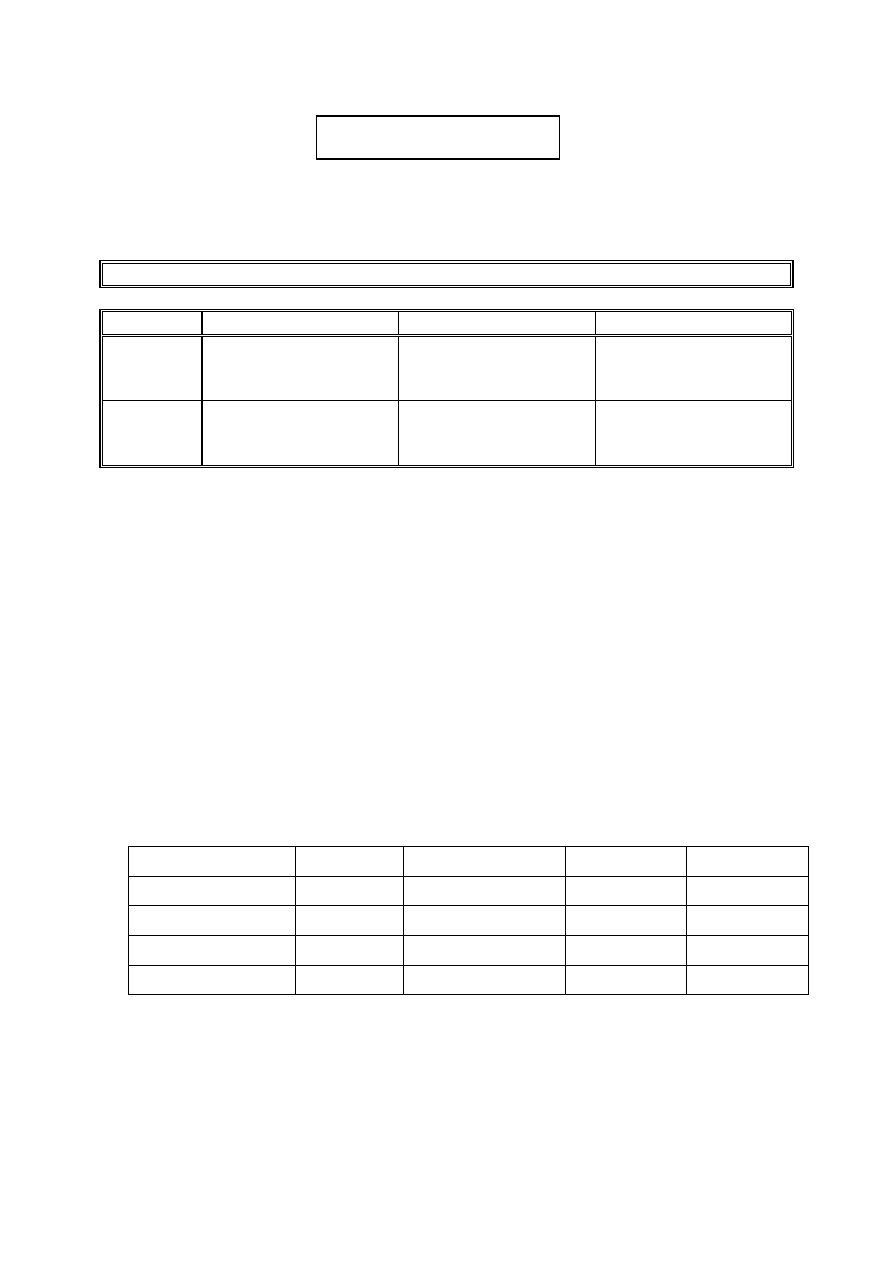
Twardość ogólna Tw
og
symbol
rodzaj twardości
twardość węglanowa
twardość niewęglanowa
Tw
Ca
wapniowa
Ca(HCO
3
)
2
Ca(OH)
2
CaCO
3
CaSO
4
CaCl
2
Ca(NO
3
)
2
Tw
Mg
magnezowa
Mg(HCO
3
)
2
Mg(OH)
2
MgCO
3
MgSO
4
MgCl
2
Mg(NO
3
)
2
JEDNOSTKI TWARDOŚCI WODY I WSPÓŁCZYNNIKI
PRZELICZENIOWE
Twardość wody podaje się w milimolach jonów wapnia i magnezu w 1 dm
3
wody lub w
stopniach twardości (niemieckich, francuskich i innych).
1 mmol jest równy 5,61
o
n lub 10
o
F
Dawniej stosowano jednostkę mval (miligramorównoważnik) jonów wapnia lub
jonów magnezu w 1 dm
3
wody;
1 mval = 20,04 mg Ca
2+
(lub 12,16 mg Mg
2+
) w 1 dm
3
.
TAB.1. JEDNOSTKI TWARDOŚCI WODY I WSPÓŁCZYNNIKI PRZELICZENIOWE
Jednostka
mmol
⋅ dm
-3
mg (CaCO
3
) · dm
-3
niemiecka (ºn) francuska (ºF)
mmol
⋅ dm
-3
1 100,08 5,61
10,00
mg (CaCO
3
)
⋅ dm
-3
0,01 1 0,056
0,10
niemiecka (ºn)
0,178 17,84
1 1,784
francuska (ºF)
0,10 10,00 0,560 1
gdzie:
1 stopień niemiecki (1
o
n) = 10 mg CaO (lub 7,19 mg MgO) w 1 dm
3
wody,
1 stopień francuski (1
o
F) = 10 mg CaCO
3
w 1 dm
3
wody,
1 mmol = 40,08 mg Ca
2+
(lub 24,32 mg Mg
2+
) w 1 dm
3
wody,
1ºn = 0,356 mval/dm
3
.
2

Ćwiczenie 2.
SKALA TWARDOŚCI WODY
Wodę pod względem stopnia twardości można podzielić na różne kategorie,
podane w tabeli 2.
TAB. 2. OKREŚLENIE SKALI TWARDOŚCI WODY
TWARDOŚĆ OGÓLNA
mmol · dm
-3
ºn – stopień niemiecki
skala twardości
0 – 0,89
0 – 5
bardzo miękka
0,89 – 1,78
5 – 10
miękka
1,78 – 2,68
10 – 15
o średniej twardości
2,68 – 3,57
15 – 20
o znacznej twardości
3,57 – 5,35
20 – 30
twarda
powyżej 5,35
powyżej 30
bardzo twarda
Wody twardej nie powinno się używać w gospodarstwach domowych i przemyśle
z następujących powodów:
• wzrasta zużycie mydła i środków piorących;
• przy częstym myciu powoduje podrażnienie skóry;
• powstaje kamień kotłowy (gł. siarczan wapnia), który utrudnia wymianę
ciepła;
• wywołuje korozję w wymiennikach ciepła (gł. chlorek magnezu) wskutek
hydrolizy soli magnezu i wzrostu stężenia jonów H
+
zgodnie z równaniem
reakcji:
Mg
2+
+ 2 H
2
O Ù Mg(OH)
2
+ 2 H
+
Dopuszczalna twardość wody do picia nie powinna przekraczać 500mg
(CaCO
3
)
/dm
3
(5 mmol/dm
3
), natomiast twardość wody dla wód w poszczególnych
klasach czystości powinna wynosić (w mmol/dm
3
): w klasie I – 3,50, klasie II – 5,50, w
klasie III – 7,00.
OZNACZANIE TWARDOŚCI WODY
Twardość ogólną wody oznacza się metodą wagową lub metodami
miareczkowymi.
a) Metoda wagowa – polega na oddzielnym wagowym oznaczeniu
zawartości wapnia i magnezu. Po zsumowaniu zawartości tych
składników otrzymuje się twardość ogólną wody.
Metody miareczkowe:
b) metoda palmitynianowa (Blachera) – jest obecnie rzadko stosowana.
Czynnikiem miareczkującym w tej metodzie jest alkoholowy roztwór
3

Ćwiczenie 2.
palmitynianu potasu. Oznaczenie polega na strąceniu trudno
rozpuszczalnego osadu palmitynianu wapnia i magnezu:
Ca
2+
+ 2 C
15
H
31
COO
_
→ (C
15
H
31
COO)
2
Ca
↓
Po ilościowym związaniu jonów wapnia i magnezu nadmiar palmitynianu
potasu ulega hydrolizie,
C
15
H
31
COOK + H
2
O Ù C
15
H
31
COOH + K
+
+ OH
_
zmieniając odczyn wody na zasadowy, co w obecności fenoloftaleiny
powoduje zabarwienie na różowo.
c) metoda mydlana (Clarka) – polega na określeniu ilości mianowanego
alkoholowego roztworu mydła potasowego, potrzebnego do ilościowego
związania jonów Ca
2+
i Mg
2+
w postaci trudno rozpuszczalnych osadów
mydła:
Ca
2+
+ 2 RCOO
_
→ (RCOO)
2
Ca
↓
Po strąceniu jonów Ca
2+
i Mg
2+
nadmiar wprowadzonego do wody
mydła powoduje po wstrząśnięciu powstanie trwałej piany.
d) metoda Wartha – Pfeifera. Oznaczenie tą metodą składa się z dwóch
etapów. Najpierw oznacza się twardość węglanową przez
odmiareczkowanie mianowanym roztworem HCl w obecności oranżu
metylowego wodorowęglanów wapnia i magnezu:
Ca(HCO
3
)
2
+ 2 HCl
→ CaCl
2
+ 2 H
2
O + 2 CO
2
Mg(HCO
3
)
2
+ 2 HCl
→ MgCl
2
+ 2 H
2
O + 2 CO
2
Następnie strąca się jony Ca
2+
i Mg
2+
znanym nadmiarem mieszaniny
Pfeifera zawierającej wodorotlenek i węglan sodu:
Ca
2+
+ Na
2
CO
3
→ CaCO
3
↓ + 2 Na
+
Mg
2+
+ 2NaOH
→ Mg(OH)
2
↓ + 2 Na
+
Nadmiar mieszaniny Pfeifera odmiareczkowuje się mianowanym
roztworem kwasu solnego.
e) metoda wersenianowa - oznacza się łącznie zawartość jonów Ca
2+
i Mg
2+
przez miareczkowanie próbki wody wersenianem disodowym
(EDTA), przy pH około 9 – 10. EDTA jest solą dwusodową kwasu
etylenodiaminotetraoctowego, która dysocjuje zgodnie z równaniem
reakcji:
Na
2
H
2
Y Ù 2Na
+
+ H
2
Y
2-
4

Ćwiczenie 2.
Jon dwuwodorowersenianowy (H
2
Y
2-
) tworzy kompleksy prawie z
wszystkimi kationami metali (poza litowcami), a ich trwałość zależy od
rodzaju metalu i pH środowiska. Podczas oznaczania twardości wody
powstają kompleksy wszystkich obecnych w wodzie kationów metali.
Przeszkadzające kationy metali maskuje się przez dodanie odpowiednich
odczynników, takich jak: Na
2
S, który wiąże jony Cd
2+
, Ni
2+
, Zn
2+
, Co
2+
,
Mn
2+
, Pb
2+
, Cu
2+
, Al
3+
, Fe
3+
oraz chlorowodorku hydroksyloaminy,
maskującego jony Cu
2+
, Fe
3+
i Al
3+
. Powstające w metodzie
wersenianowej kompleksy Ca
2+
i Mg
2+
są bezbarwne. Do
miareczkowania używa się czerni eriochromowej (T), która dysocjuje
trójstopniowo i w zależności od pH środowiska przyjmuje różną barwę.
Przy pH około 10, anion HT
2-
ma barwę niebieską, natomiast z kationem
magnezu tworzy kompleks o barwie intensywnie czerwonej, zgodnie z
równaniem reakcji:
Mg
2+
+ HT
2-
Ù MgT
_
+ H
+
(1)
Powstały kompleks jest słabszy niż kompleks jonów magnezu z
wersenianem, toteż po dodaniu wersenianu zachodzi reakcja:
MgT
_
+ H
2
Y
2-
Ù MgY
2-
+ HT
2-
+ H
+
(2)
czerwony
niebieski
Zarówno wersenian, jak i kompleks wersenianu z jonami magnezu,
reagują z jonami Ca
2+
zgodnie z równaniami reakcji (3) i (4):
Ca
2+
+ H
2
Y
2-
Ù CaY
2-
+ 2H
+
(3)
Ca
2+
+ MgY
2-
Ù CaY
2-
+ Mg
2+
(4)
Uwolnione jony Mg
2+
reagująze wskaźnikiem (reakcja 1). Po związaniu
wszystkich jonów Ca
2+
wersenian wiąże najpierw wolne jony Mg
2+
, a
następnie związane ze wskaźnikiem (reakcja 2). Podczas przebiegu
ostatniej reakcji zachodzi zmiana barwy z czerwonej na niebieską.
5
Wyszukiwarka
Podobne podstrony:
Chemia- OZNACZANIE TWARDOŚCI WODY, ?WICZENIE NR 6_
Sprawozdanie oznaczanie twardosci wody
Oznaczanie twardości wody, Energetyka, I rok, chemia
Oznaczanie twardości wody(0.9 pkt), Mechanika i Budowa Maszyn, Chemia sprawozdania
Sprawozdanie nr 4 Oznaczanie odczynu i twardości wody
Oznaczenie twardości ogólnej metodą werenianową, inżynieria ochrony środowiska kalisz, Analiza Chemi
Oznaczenie twardości i zasadowoś, Akademia Morska, 2 rok', Semestr IV, Chemia wody, paliw i smarów
oznaczanie twardosci weglanowej wody F4RT43YQYZEQK4QDN76BAQX3PI2SNVVAJI3UOLY
Sprawozdanie nr 4 Oznaczanie odczynu i twardości wody
c twardosc wody, studia ochrona środowiska
Badanie twardości wody
Twardość wody
twardosc wody
oznaczanie twardości węglanowej, 1
14.Oznaczanie utlenialności wody., Państwowa Wyższa Szkoła Zawodowa
ph i twardość wody
więcej podobnych podstron