
Wyk
łady z chemii
dla studentów Wydzia
łu Inżynierii Lądowej i Geodezji
Wojskowej Akademii Technicznej
Prowadz
ący:
Dr hab. in
ż. Andrzej Sadkowski, profesor W.A.T.
Wydzia
ł Nowych Technologii i Chemii.
Wyk
ład 9.
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro
2
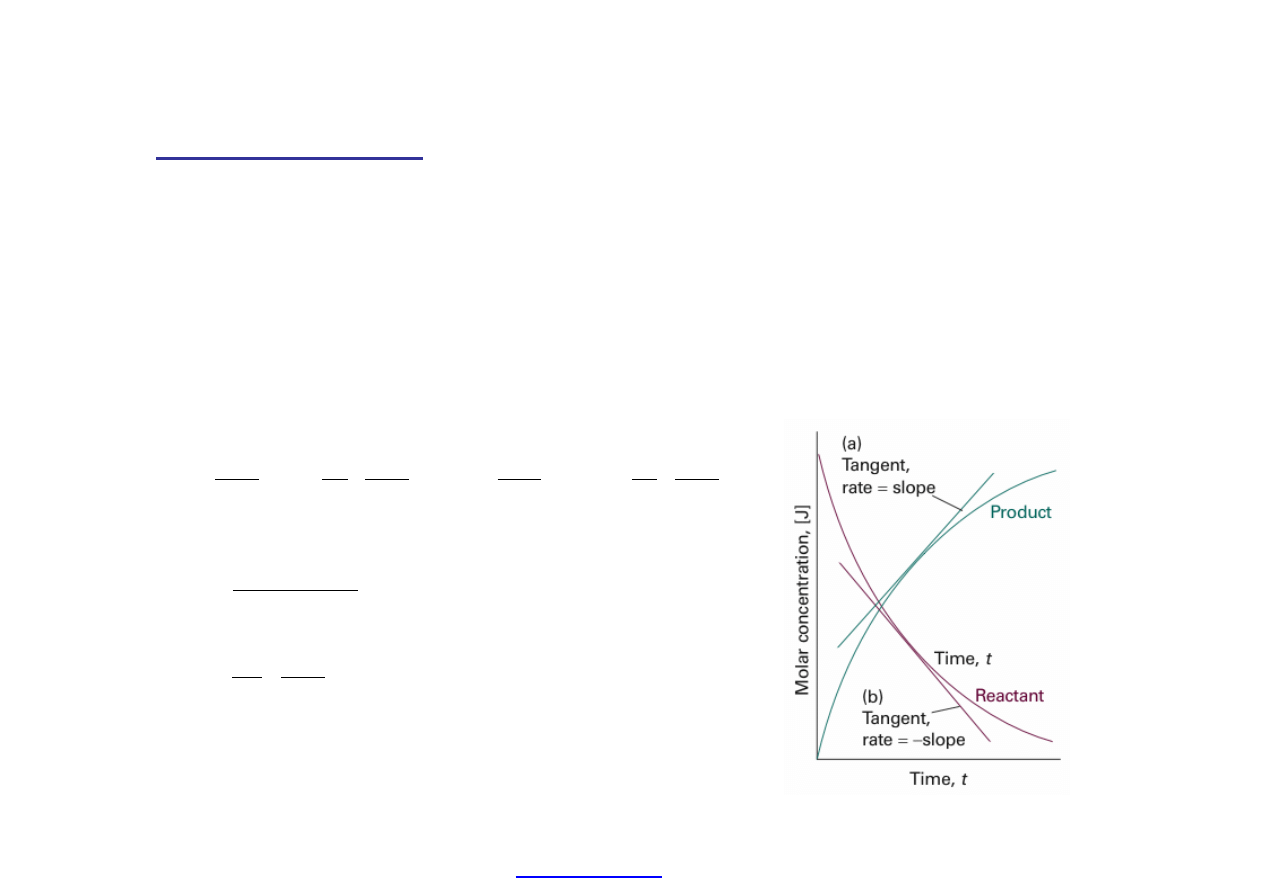
Kinetyka chemiczna: Badanie szybko
ści reakcji chemicznych.
Wyobra
źmy sobie reakcję:
A + 2 B -> 3 C + D
Szybko
ść tej reakcji możemy zdefiniować śledząc stężenie dowolnego
reagenta (substratu: A, B lub produktu: C, D).
v
dD
dt
1
3
dC
dt
dA
dt
1
2
dB
dt
ν
j
= -1, -2, 3, 1 = wspó
łczynniki
stechiometryczne substancji reaguj
ących.
j
n
j
n
j
0
j
v
1
V
d
dt
ξ
j
- post
ęp reakcji; n
j
– liczba
moli sk
ładnika j. n
j
0
–
pocz
ątkowa liczba moli skł. j.
V – obj
ętość. v – szybkość
(sumaryczna) reakcji.
A, B, C, D – st
ężenia molowe [mol dm
-3
].
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro
3
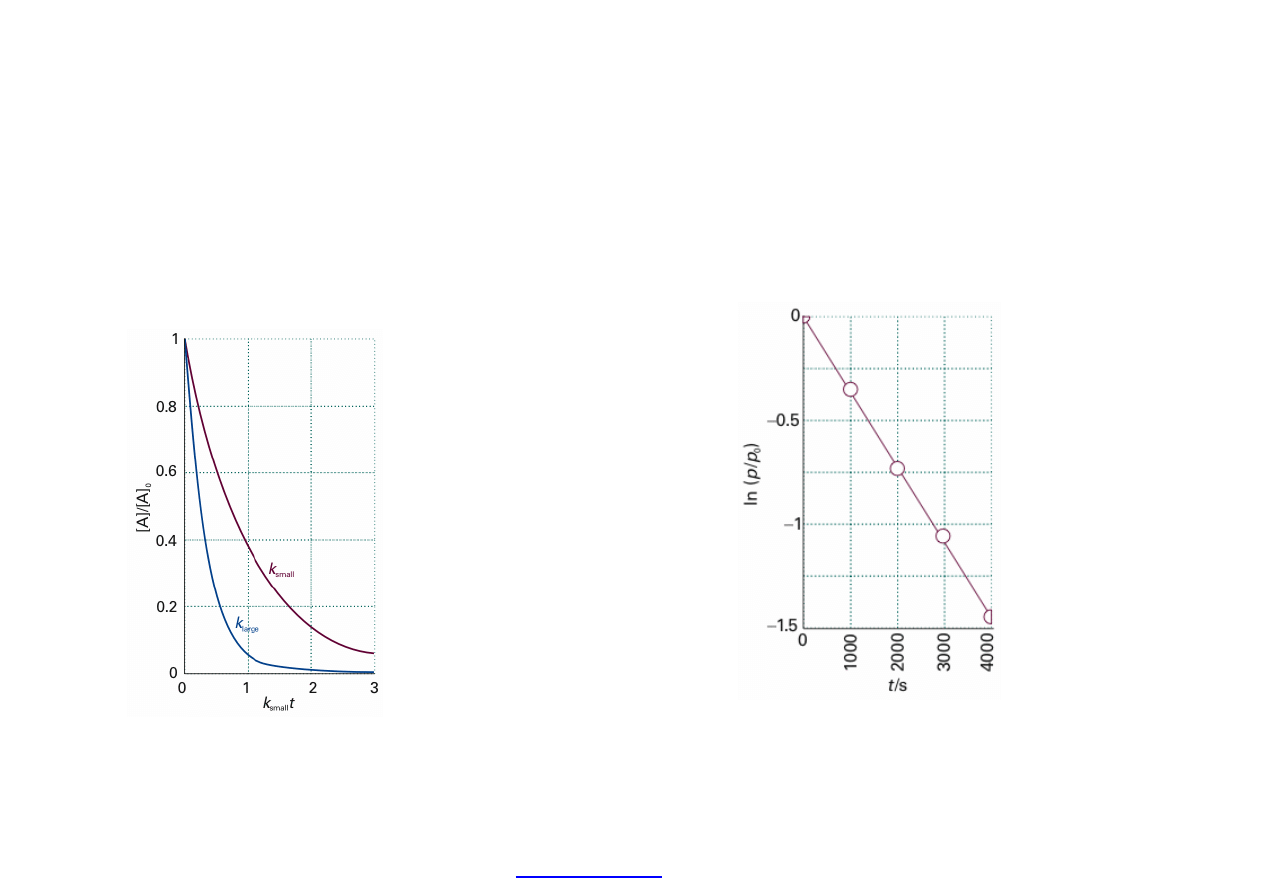
Spadek st
ężenia w czasie reagenta
A dla ma
łej wartości stałej szybkości
i du
żej wartości stałej szybkości.
Równanie kinetyczne:
v = k (c – c
0
)
kinetyka I rz
ędu reakcji
nieodwracalnej.
k – sta
ła szybkości; c, c
0
– st
ężenia molowe reagenta aktualne i w stanie
równowagi.
V = k c
A
c
B
równanie kinetyczne II rz
ędu ze stałą szybkości II rzędu
(oznaczenia sta
łej są takie same dla różnych rzędów szybkości).
Spadek st
ężenia dla r-nia I rzędu z
dobrym mieszaniem. Z nachylenia
wyznaczamy sta
łą szybkości k
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro
4
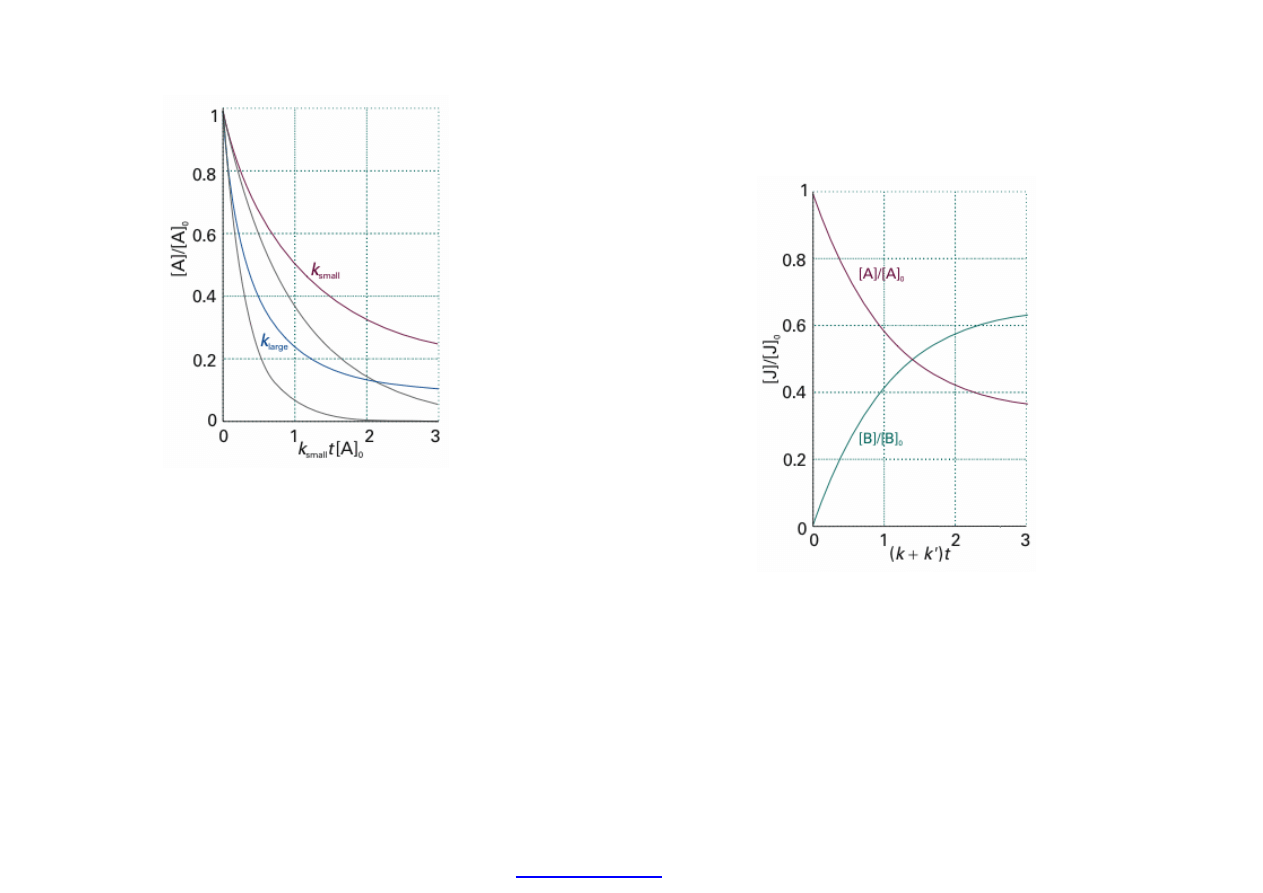
Zale
żność zmian stężenia substratu A od czasu dla wolnej i szybkiej reakcji i
dla sta
łych szybkości I i II rzędu (z lewej).
v
k c
A
k
'
c
B
Szybko
ść reakcji A - > B I rzędu odwracalnej, tj. z udziałem „wstecznej”
reakcji produktu: B - > A (z prawej).
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro

Szybko
ść reakcji wzrasta ze wzrostem temperatury:
Równanie kinetyczne I rz
ędu reakcji
nieodwracalnej ma najprostsza posta
ć:
Po jego sca
łkowaniu (t = 0, A = A
0 –
st
ężenie początkowe) dostajemy:
A
A
0
e
k t
Równanie Arrheniusa
(dwie postaci):
ln
k
ln
A
E
a
R T
k
A e
Ea
R T
Zale
żność stałej szybkości k od temperatury T.
E
a
– energia aktywacji; A cz
ęstotliwość zderzeń; R – stała gazowa.
dA
dt
k A
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro
6
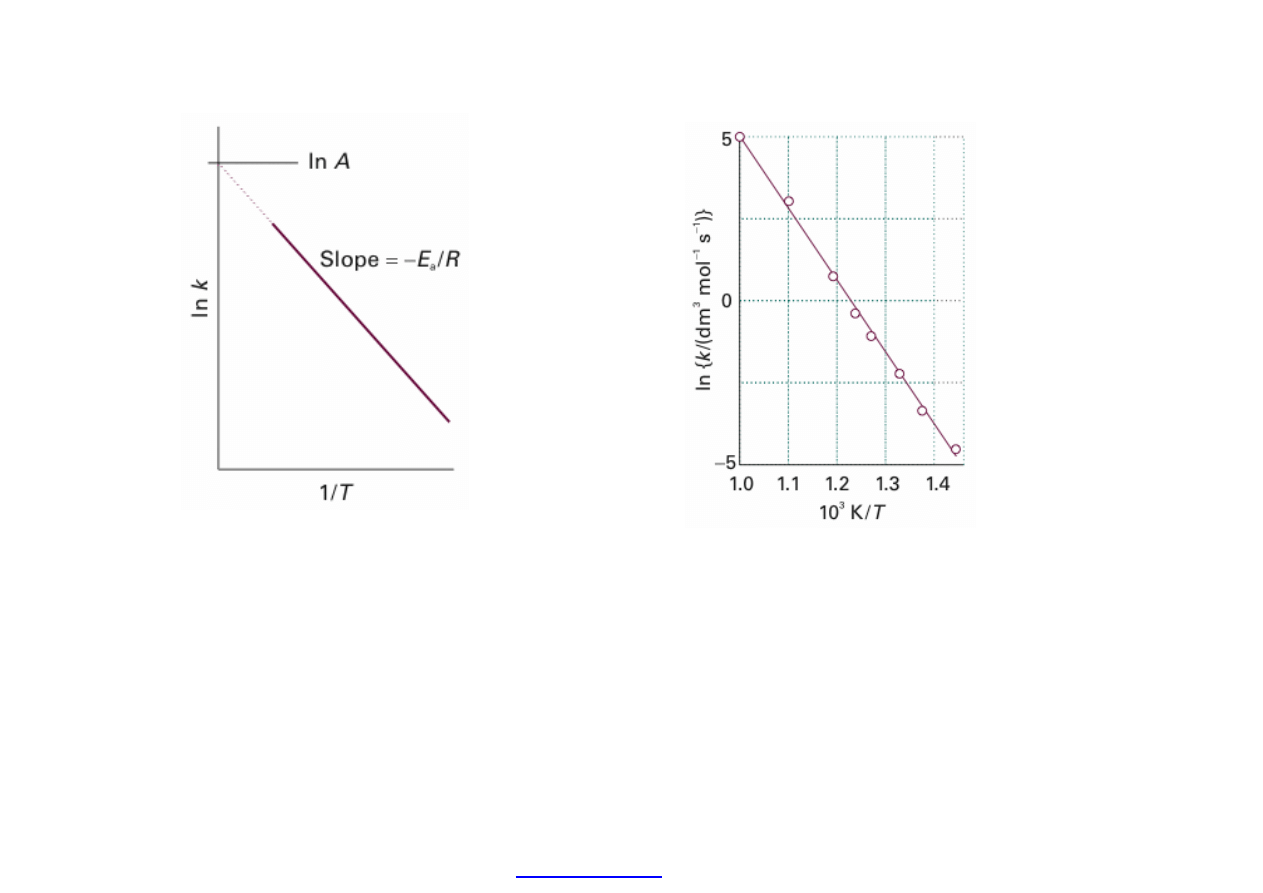
Sposób wyznaczania energii
aktywacji i cz
ęstotliwości zderzeń
z równania Arrheniusa (teoria)
A tak to wygl
ąda dla danych
do
świadczalnych szybkość
dysocjacji aldehydu octowego w
zakresie temperatur 700K – 1000K.
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro
7
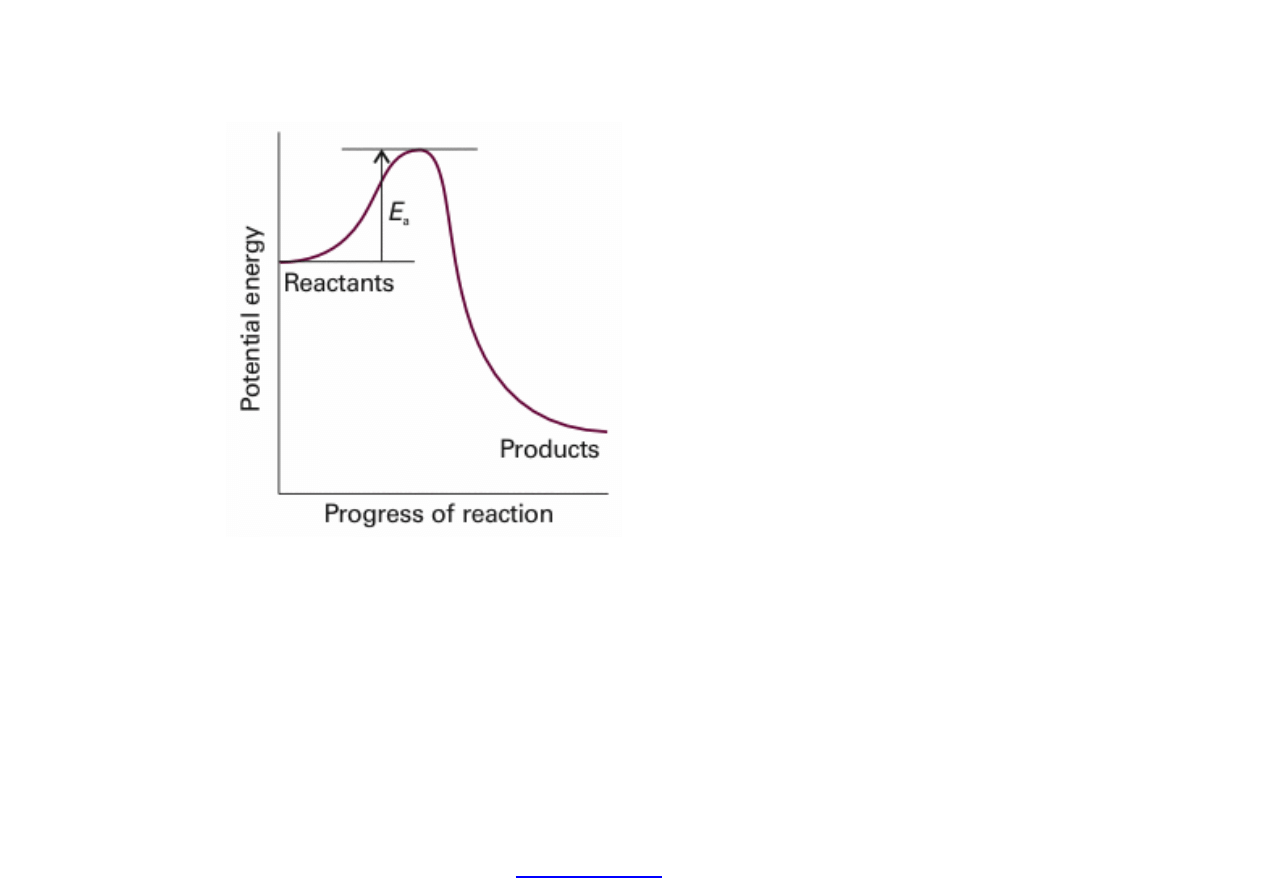
Obja
śnienie znaczenia energii aktywacji – bariery energetycznej, jaką
cz
ąsteczki substratu muszą pokonać, by stać się produktem. Na osi
poziomej tzw. wspó
łrzędna reakcji (np. odległość między
cz
ąsteczkami reagującymi).
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro
Wyszukiwarka
Podobne podstrony:
No9
WTC1 BWV854 Prelude No9
concierto no9 en Dminor violinosolo vivaldi
KONSPEKT LEKCJI Z PILKI NO9
więcej podobnych podstron