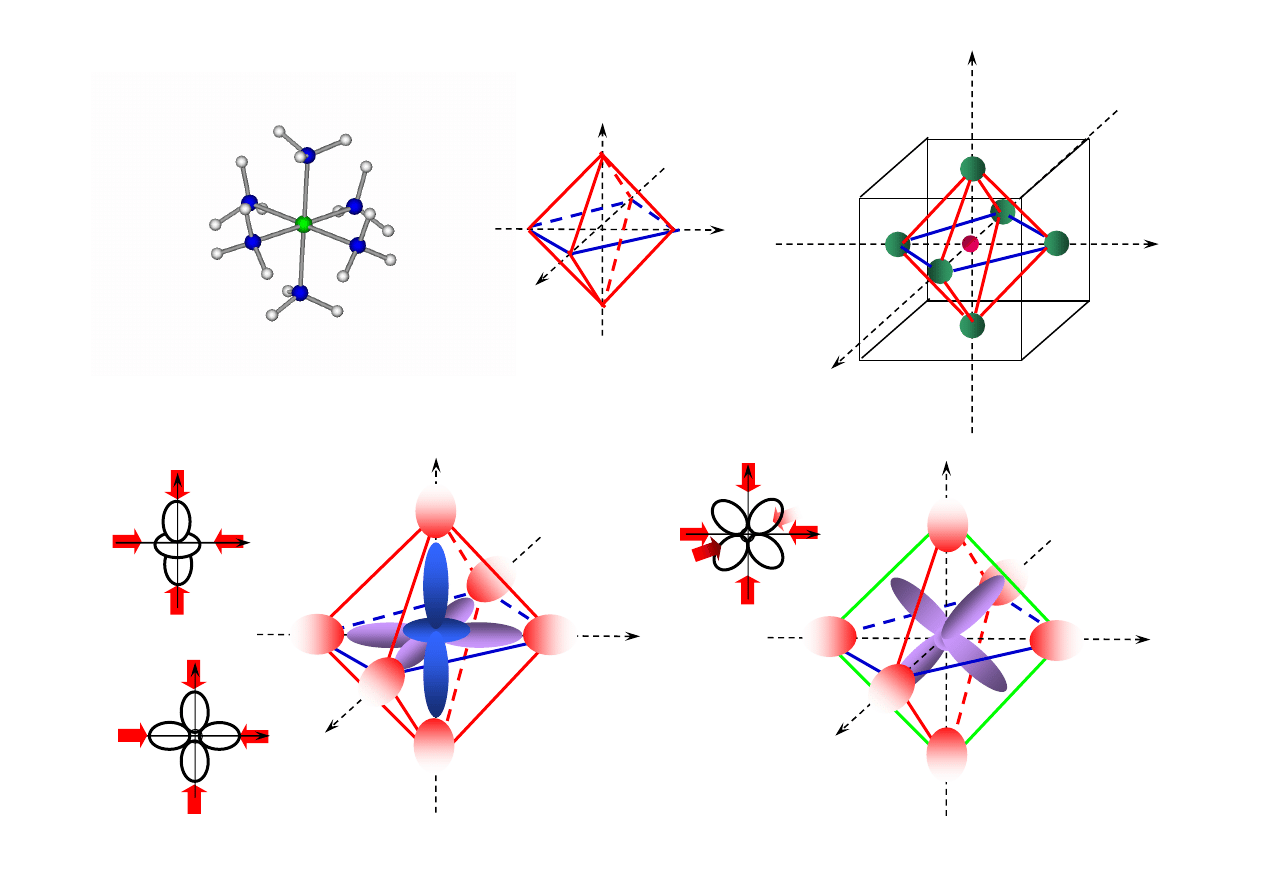
7.2. Koordynacja oktaedryczna (O
h
)
[Ni(NH
3
)
6
]
2+
oktaedr
z
y
x
z
y
x
z
x
d
z2
d
x2 – y2
y
x
z
x
d
xz
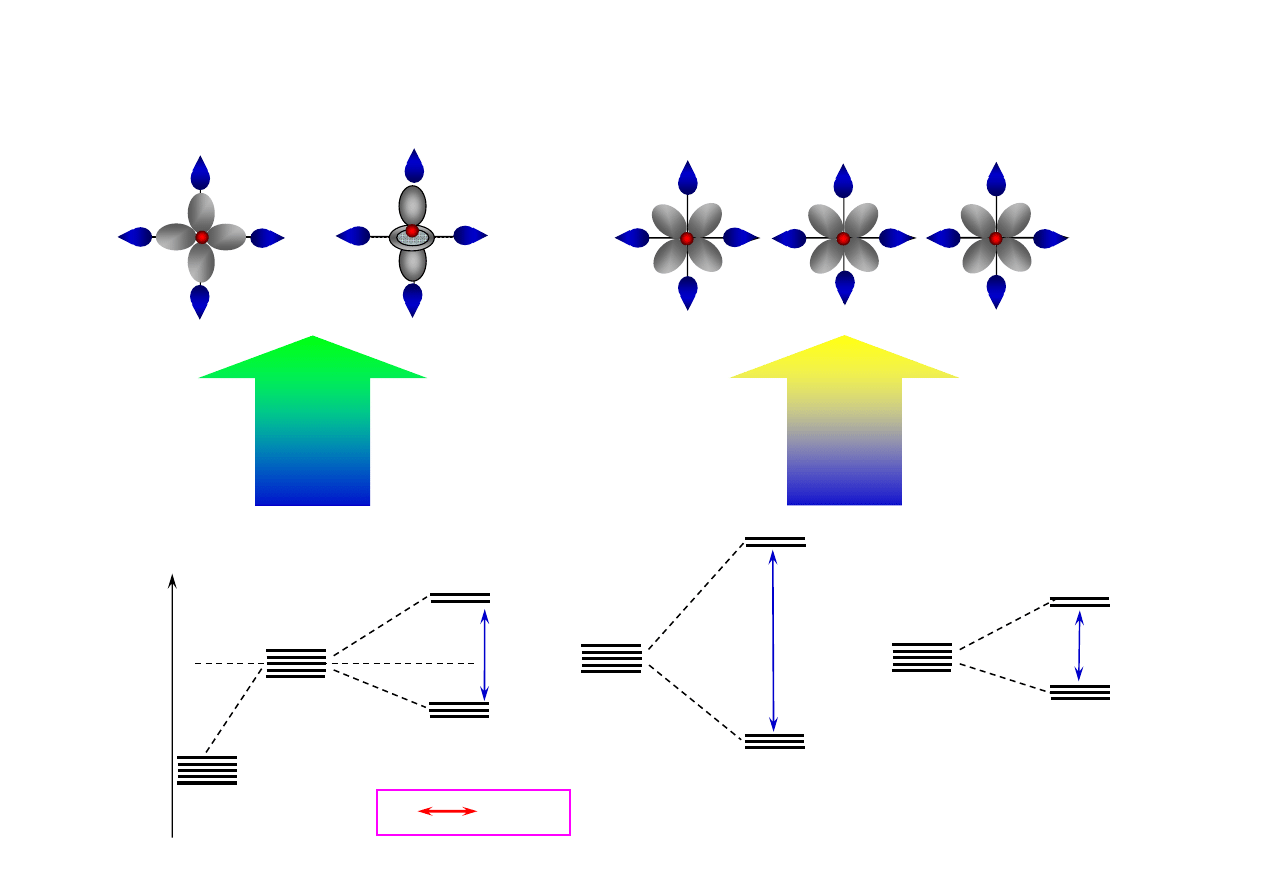
7.3. Teoria pola ligandów dla kompleksów oktaedrycznych
7.3.1. Parametr rozszczepienia
∆
d
x2 – y2
d
z2
y
x
z
x
d
xz
d
yz
d
xy
z
y
z
x
y
x
efektywne oddziaływanie ligandów
z orbitalami d atomu centralnego
symetria typu
σ
(e
g
)
brak efektywnego oddziaływania
ligandów z orbitalami mi
ę
dzyosiowymi :
te orbitale maj
ą
symetri
ę
typu
π
(t
2g
)
E
∆
0.6
0.4
izolowany atom
d
e
g
t
2g
atom w polu ligandów
e
g
∆
1
t
2g
∆
2
e
g
t
2g
SILNE POLE
SŁABE POLE
∆
1
>>
∆
2
∆
10 D
q
Czynniki wpływaj
ą
ce na warto
ść
parametru
∆
ATOM CENTRALNY
►
rodzaj atomu / jonu centralnego
►
ładunek jonu centralnego: im jest wi
ę
kszy, tym wi
ę
ksza warto
ść ∆
►
typ orbitali d :
∆
5d
>
∆
4d
>
∆
3d
(
∆
5d
~ 1.8
∆
3d
;
∆
4d
~ 1.5
∆
3d
)
LIGAND
►
wła
ś
ciwo
ś
ci steryczne ligandu
►
budowa chemiczna (dost
ę
pno
ść
elektronów ligandu do tworzenia wi
ą
za
ń
)
►
rodzaj atomu donorowego ligandu (bezpo
ś
rednio oddziałuj
ą
cego z
atomem centralnym) oraz jego otoczenie
Wymienione czynniki determinuj
ą
wła
ś
ciwo
ś
ci
akceptorowe
atomu centralnego oraz wła
ś
ciwo
ś
ci
donorowe
(a czasem równie
ż
"akceptorowe") ligandu
NH
3
NH
4
+
ClO
4
–
e
–
e
–
e
–
e
–
F
–
Cl
–
►
Ligandy słabego pola : I
–
< Cl
–
≈
SCN
–
< F
–
< CO
3
2–
< H
2
O
►
Ligand "
ś
redni" : NH
3
►
Ligandy silnego pola : NO
2
(nitro) < CN
–
< CO
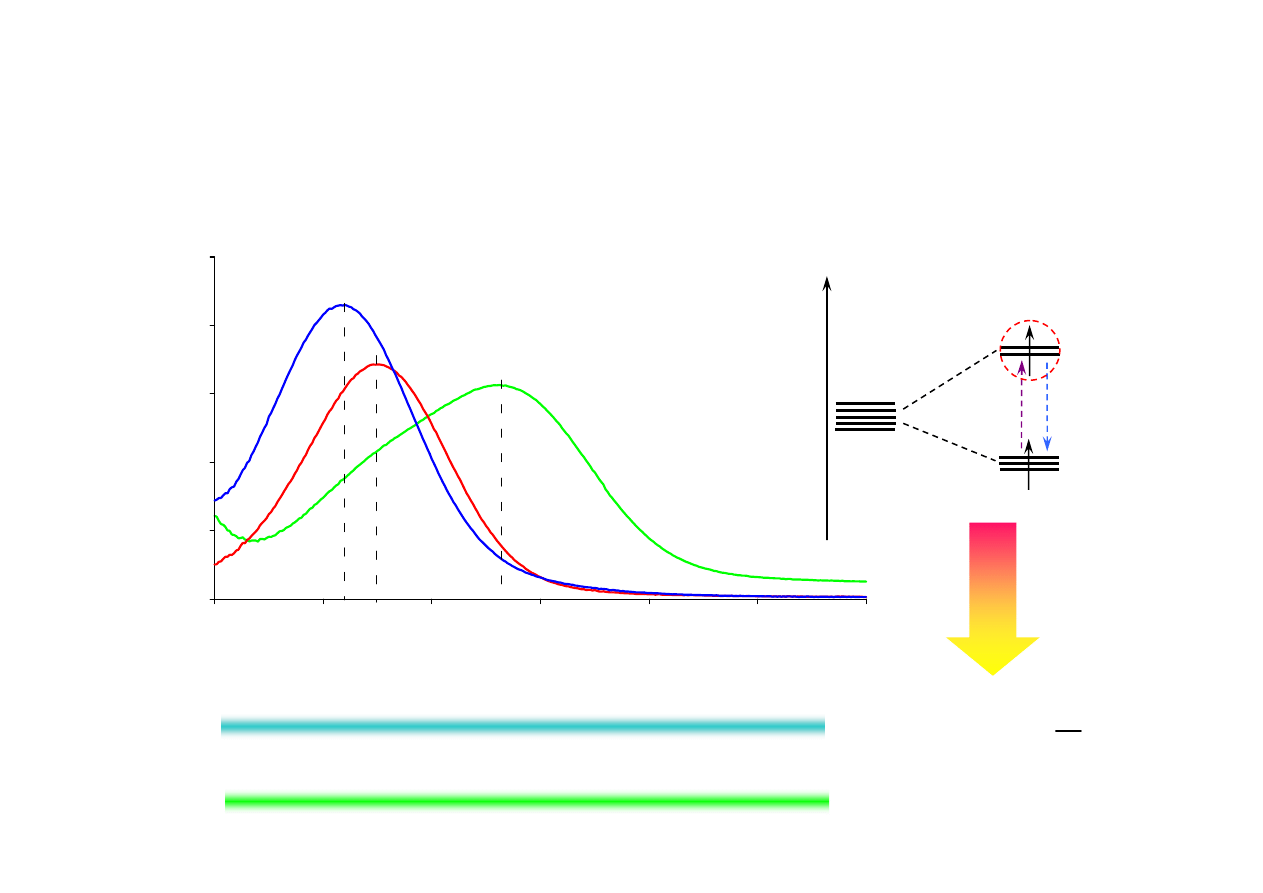
7.3.2. Szereg spektrochemiczny ligandów
400
450
500
550
600
650
700
Długość fali ( ), nm
0.0
0.3
0.6
0.9
1.2
1.5
A
B
S
O
R
B
A
N
C
J
A
λ
[CoNO
2
(NH
3
)
5
]Cl
2
[Co(NH
3
)
6
]Cl
2
[CoCl(NH
3
)
5
]Cl
2
∆
≈
⋅
=
=
λ
ν
c
h
h
E
E
e
g
t
2g
E ~
∆
stan podstawowy
stan wzbudzony
[CoNO
2
(NH
3
)
5
]Cl
2
[Co(NH
3
)
6
]Cl
2
[CoCl(NH
3
)
5
]Cl
2
λ
< <
∆
> >
Wyszukiwarka
Podobne podstrony:
ChN sem I kol pytania[1]
Readme UDK CHN
ChN i F 2
ChN-sem I-kol pytania[1]
Wykład 4 Tlenowce CH13005w, III. Tlenowce ChN - II
ChN - zagadnienia, POMOCNE W SZKOLE-STUDIA, chemia
ChN i F 6
Wykład 5 Azotowce CHC13005w, IV. AZOTOWCE - ChN II
więcej podobnych podstron