
CHEMIA MAKROCZĄSTECZEK
(materiały pomocnicze do wykładu)
Opracował: Mirosław Gibas

2
Chemia makrocząsteczek – literatura zalecana.
1. S.Porejko, J.Fejgin, L.Zakrzewski, Chemia związków wielkocząsteczkowych,
WNT, Warszawa 1973
2. M.P.Stevens, Wprowadzenie do chemii polimerów, PWN, Warszawa 1983
3. J.J.Pielichowski, A.A.Puszyński, Technologia tworzyw sztucznych, wyd.3,
WNT, Warszawa 1992
4. Z.Florjańczyk, S.Penczek, (red.) Chemia polimerów, tom 1, Makrocząsteczki
i metody ich otrzymywania, Oficyna Wydawnicza Politechniki Warszawskiej,
Warszawa 1995
5. Z.Florjańczyk, S.Penczek, (red.) Chemia polimerów, tom 2, Podstawowe
polimery syntetyczne i ich zastosowania, Oficyna Wydawnicza Politechniki
Warszawskiej, Warszawa 1997
6. H.Galina, Fizykochemia polimerów, Oficyna Wydawnicza Politechniki
Rzeszowskiej, Rzeszów 1998
3
PODSTAWOWE DEFINICJE
MIĘDZYNARODOWA
UNIA
CHEMII
CZYSTEJ
I STOSOWANEJ
(IUPAC – International Union of Pure and Applied Chemistry)
Polimery 1998, 43, zeszyt 9 i 10, zalecenia IUPAC z 1996r
MAKROCZĄSTECZKA (cząsteczka
polimeru
) – jest to
cząsteczka o dużej względnej masie cząsteczkowej, której
struktura
obejmuje
w
zasadzie
wielokrotność
jednostek
wywodzących się w sposób rzeczywisty lub koncepcyjny ,
z cząsteczek o małej względnej masie cząsteczkowej.
POLIMER
– substancja złożona z makrocząsteczek
CZĄSTECZKA MONOMERU – cząsteczka, która może ulegać
polimeryzacji, tym samym wnosząc
jednostki konstytucyjne
do
zasadniczej struktury makrocząsteczki.
MONOMER – substancja złożona z cząsteczek monomeru.
POLIMERYZACJA – proces przemiany monomeru (lub
mieszaniny monomerów) w polimer.
JEDNOSTKA KONSTYTUCYJNA
– atom lub grupa atomów
(z podwieszonymi atomami lub grupami atomów) obejmująca
część zasadniczej struktury makrocząsteczki.

4
PODZIAŁ PROCESÓW POLIMERYZACJI
Staudinger (polireakcje)
- Polimeryzacja
łańcuchowa
- Polikondensacja
stopniowa
- Poliaddycja
stopniowa
Flory (podział ze względu na stechiometrię)
- Polimeryzacja addycyjna (poliaddycja)
łańcuchowa lub stopniowa
- Polimeryzacja kondensacyjna (polikondensacja)
stopniowa
IUPAC, PTChem
- Polimeryzacja łańcuchowa
łańcuchowa
- Polimeryzacja addycyjna (poliaddycja)
stopniowa
- Polimeryzacja kondensacyjna (polikondensacja)
stopniowa

5
POLIMERYZACJA MONOMERÓW Z WIĄZANIEM PODWÓJNYM
Inicjowanie
I I
*
(wytworzenie centrum aktywnego)
* = polimeryzacja wolnorodnikowa (rodnikowa)
* = + polimeryzacja jonowa kationowa
* = - polimeryzacja jonowa anionowa
I
*
+ CH
2
=CHR → I-CH
2
-CHR
*
Propagacja (wzrost)
I-CH
2
-CHR
*
+ CH
2
=CHR I-CH
2
-CHR-CH
2
-CHR
*
I-CH
2
-CHR-CH
2
-CHR
*
+ CH
2
=CHR I-(CH
2
-CHR)
2
-CH
2
-CHR
*
I-(CH
2
-CHR)
2
-CH
2
-CHR
*
+CH
2
=CHR I-(CH
2
-CHR)
3
-CH
2
-CHR
*
I tak dalej
I-CH
2
-CHR
*
+ n CH
2
=CHR I-(CH
2
-CHR)
n
-CH
2
-CHR
*
I-(CH
2
-CHR)
n
CH
2
-CHR
*
+ CH
2
=CHR I-(CH
2
-CHR)
n+1
CH
2
-CHR
*
(polimeryzacja łańcuchowa)
Zakańczanie (terminacja) w polimeryzacji rodnikowej
Rekombinacja
I-( CH
2
-CHR)
n
-CH
2
-CHR
+
CHR-CH
2
-( CH
2
-CHR)
m
I-( CH
2
-CHR)
n+m+2
-I
Dysproporcjonowanie
I-( CH
2
-CHR)
n
-CH
2
-CHR
+
CHR-CH
2
-( CH
2
-CHR)
m
I-( CH
2
-CHR)
n
-CH=CHR + CH
2
R-CH
2
-( CH
2
-CHR)
m
Inne reakcje ….

6
POLIMERYZACJA MONOMERÓW CYKLICZNYCH
Tylko jonowo lub jonowo-koordynacyjnie
X
(CH
2
)
m
(
X )
n
(CH
2
)
m
n
X = O, NH, CO, CNH, OCH
2
O, OCO, S, etc.
O
O
O
Inicjowanie
I + M IM*
Propagacja
IM* + M IM
2
*
IM
2
* + M IM
3
*
IM
n
* + M IM
n+1
*
Terminacja
IM
n
* IM
n
(bardzo różne reakcje)
W anionowej może nie być zakańczania – POLIMERYZACJA ŻYJĄCA

7
POLIMERYZACJA KONDENSACYJNA
Wydziela się niskocząsteczkowy produkt uboczny, reakcja na ogół
równowagowa
n HO-R
1
-OH + n HOOC-R
2
-COOH H-(-O-R
1
-
OOC
-R
2
-CO-)
n
-OH
+ (n-1) H
2
O
(poliestryfikacja - poliestry)
n NH
2
-R
1
-NH
2
+ n HOOC-R
2
-COOH H-(-NH-R
1
-
NHOC
-R
2
-CO-)
n
-OH
+ (n-1) H
2
O
(poliamidy)
(n HO-R-COOH H-(-
O
-R-
CO
-)
n
-OH + (n – 1) H
2
O
M + M M
2
M
2
+ M M
3
M
3
+ M M
4
2 M
2
M
4
M
3
+ M
2
M
5
M
n
+ M
m
M
n+m
(polimeryzacja stopniowa)

8
POLIADDYCJA
(nie wydziela się niskocząsteczkowy produkt a reakcja jest stopniowa)
(reakcja jest nierównowagowa)
n HO-R
1
-OH + n OCN-R
2
-NCO
H-(-O-R
1
-OCONH-R
2
-NHCO-)
n-1
-O-R
1
-
OCONH
-R
2
-NCO
(poliuretan)
HO-R-NCO
Takiego monomeru nie ma !!!
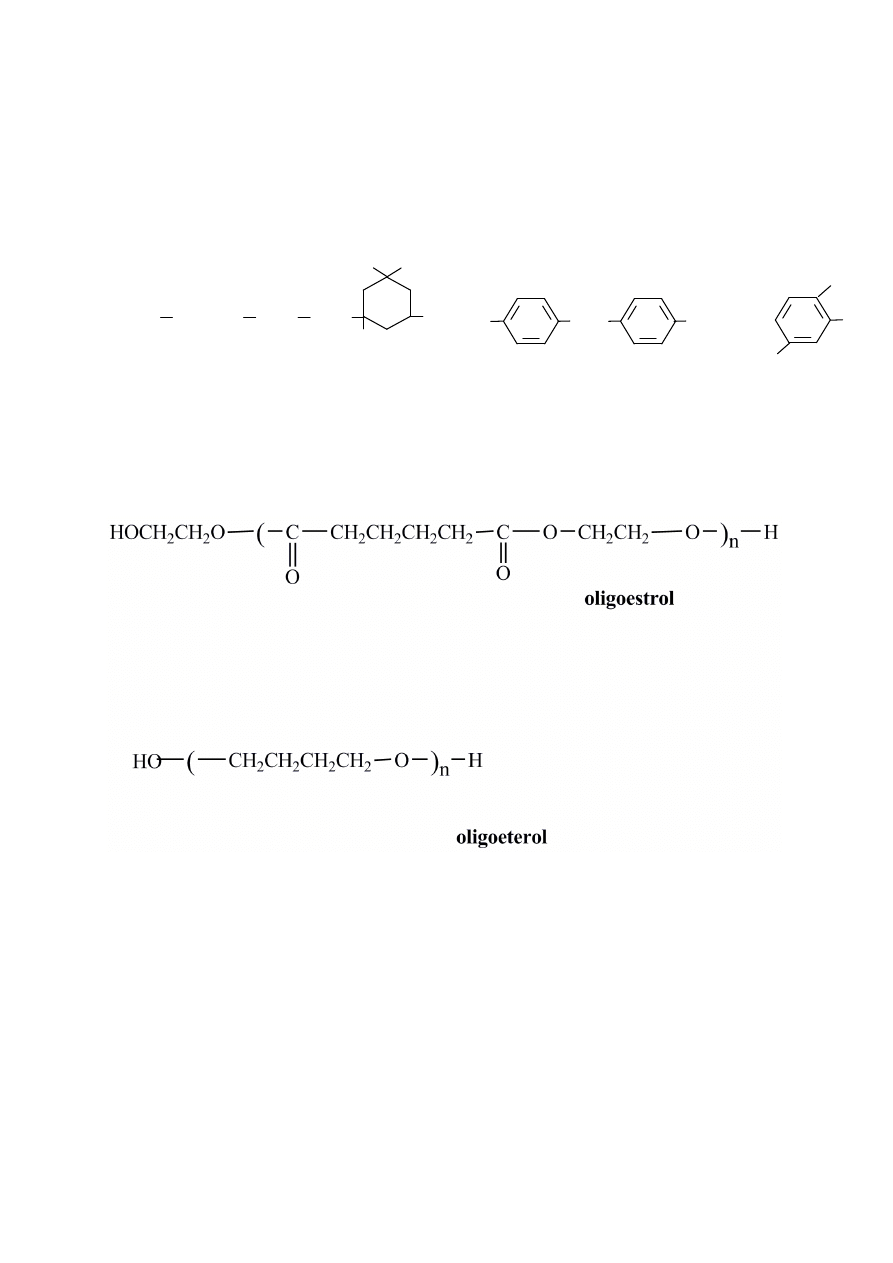
ol + diz oldiz
oldiz + ol oldizol
oldiz + diz dizoldiz
dizoldiz + oldiz dizoldizoldiz
oldizol + diz oldizoldiz
dizoldizoldiz + oldizol dizoldizoldizoldizol
9
Diizocyjaniany (diz): OCN-R-NCO
(CH )
6
2
DI:
R=
CH
2
CH
3
CH
3
CH
3
HMDI
IPDI
CH
2
3
CH
MDI
TDI
Diole (ol):

10
POLIMERYZACJA KATIONOWA
INICJATORY
(katalizatory ?????)
Związki (KatAn) zdolne do generowania reaktywnego względem
monomeru kationu (Kat
) i niereaktywnego względem monomeru
anionu (An
)
- silne kwasy protonowe (Brönsteda)
H
2
SO
4
, HClO
4,
CF
3
COOH, CF
3
SO
2
OH
- kwasy aprotyczne (Lewisa)
(właściwy inicjator/katalizator powstaje w obecności
koinicjatora/kokatalizatora, np. ślady wody)
BF
3
+ H
2
O BF
3
OH
H
BF
3
+ Et
2
O BF
3
Et
Et
(eterat trifluorku boru)
AlCl
3
+ HCl H
AlCl
4
AlCl
3
+ EtCl Et
AlCl
4
FeCl
3
, ZnO, ZnCl
2
, TiCl
4
, SnCl
4
, etc.
- sole karboniowe (karbeniowe)
Ph
3
C
SbCl
6
, Ph
3
C
SbF
6
, Ph
3
C
BF
4
- sole karboksoniowe, oksoniowe (oniowe)
(C
2
H
5
)
3
O
A
- inne – np. jod
2I
2
I
I
3
- promieniowanie (
60
Co)
Heterogeniczny rozpad wiązania:
Kat-An Kat
, An
Kat
An
Kat
+ An
jonizacja dysocjacja
para jonowa para jonowa wolne jony
kontaktowa rozdzielona
(zależnie od rozpuszczalnika)
11
MONOMERY
- Większość monomerów zawierających wiązanie C=C (izobutylen,
styren, -metylostyren, etery winylowo-alkilowe);
CH
CH
2
CH
CH
2
O R
C
CH
2
CH
3
CH
3
C
CH
2
CH
3
- Monomery heterocykliczne, szczególnie oksacykliczne (cykliczne
etery - oksirany, oksetany, trioksan, dioksolan, tetrahydrofuran;
cykliczne estry – laktony, cykliczne siarczki)
O
R
O
O
O
O
O
O
O
S
O
O
O
CH
2
Cl
CH
2
Cl

12
INICJOWANIE PRZEZ SOLE TRITYLIOWE
Ph
3
CSbCl
6
Ph
3
C
SbCl
6
+
Ph
3
C
+
O O
Ph
3
CH
O O
+
O O
C
O
H
OCH
2
CH
2
O O
C
O
H
OCH
2
CH
2
OCH
2
CH
2
O CH
2

13
Najważniejsze:
Przemysłowa polimeryzacja izobutylenu:
Inicjowanie
BF
3
OH
H
+ CH
2
=C(CH
3
)
2
CH
3
-C(CH
3
)
2
, BF
3
OH
Propagacja
CH
3
-C(CH
3
)
2
-BF
3
OH
+ CH
2
=C(CH
3
)
2
CH
3
-C(CH
3
)
2
-CH
2
-C(CH
3
)
2
, BF
3
OH
+ n CH
2
=C(CH
3
)
2
CH
3
-C(CH
3
)
2
-[CH
2
-C(CH
3
)
2
]
n
-CH
2
-C(CH
3
)
2
, BF
3
OH
Terminacja
- Terminacja kinetyczna
CH
3
-C(CH
3
)
2
-[CH
2
-C(CH
3
)
2
]
n
-CH
2
-C(CH
3
)
2
, BF
3
OH
CH
3
-C(CH
3
)
2
-[CH
2
-C(CH
3
)
2
]
n
-CH
2
-C(CH
3
)=CH
2
+ H
BF
3
OH
- Przeniesienie łańcucha na monomer
CH
3
C(CH
3
)
2
[CH
2
C(CH
3
)
2
]
n
CH
2
C(CH
3
)
2
,BF
3
OH
+CH
2
=C(CH
3
)
2
CH
3
C(CH
3
)
2
[CH
2
C(CH
3
)
2
]
n
CH
2
C(CH
3
)=CH
2
+
CH
3
C(CH
3
)
2
,BF
3
OH
- Kombinacja (rekombinacja)
CH
3
-C(CH
3
)
2
-[CH
2
-C(CH
3
)
2
]
n
-CH
2
-C(CH
3
)
2
, BF
3
OH
CH
3
C(CH
3
)
2
[CH
2
C(CH
3
)
2
]
n
CH
2
C(CH
3
)
2
OH + BF
3
- Inne reakcje – z zanieczyszczeniami, „zabijanie” centrów
aktywnych

14
Polimeryzacja trioksanu:
O
O
O
Kat
+
, An
-
+
Kat
O
+
O
O
, An
-
O
O
O
An
-
,
O
+
O
O
OCH
2
OCH
2
OCH
2
Kat
An
-
,
O
+
O
O
(OCH
2
OCH
2
OCH
2
)
n
Kat
O
O
O
(OCH
2
)
n
polioksymetylen
HCH
O
poliformaldehyd
terminacja
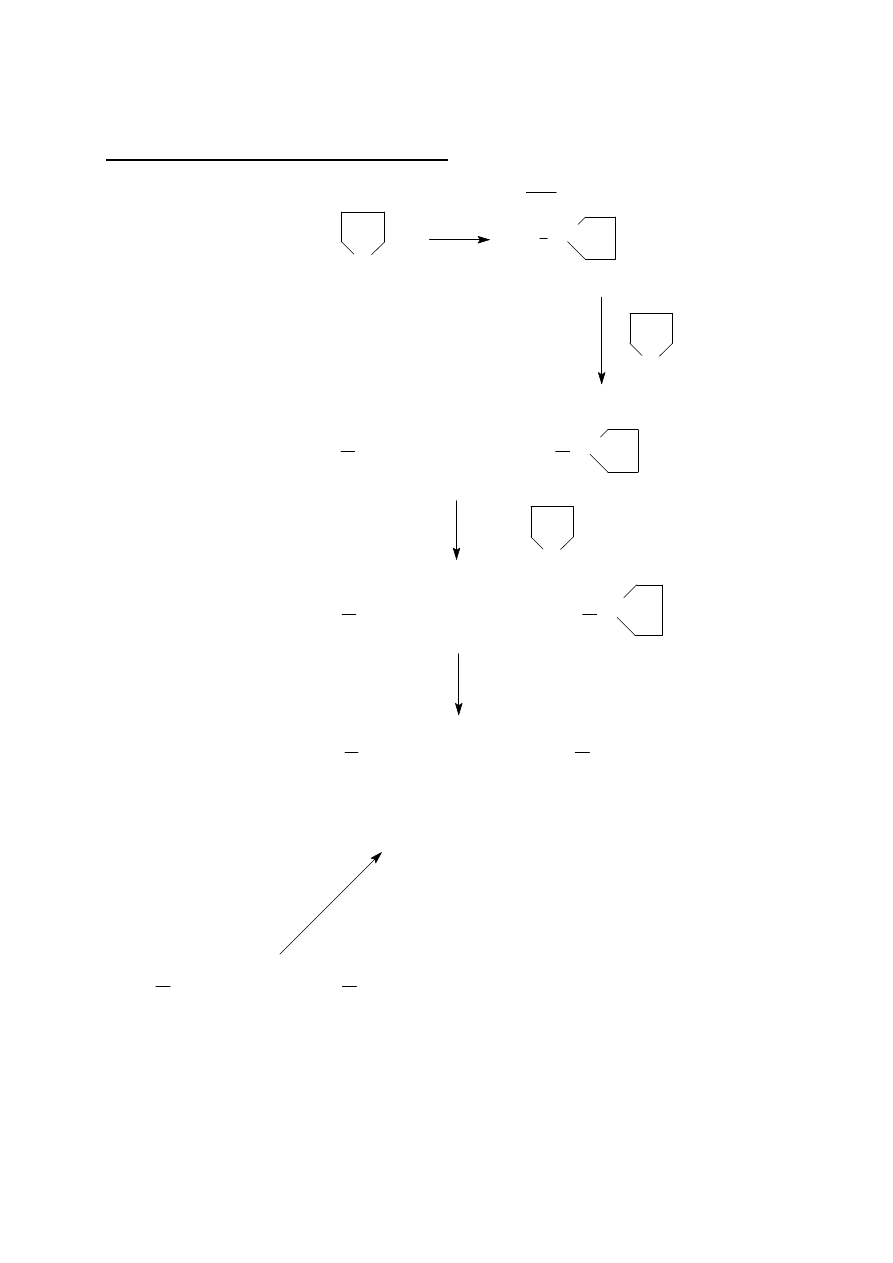
15
Polimeryzacja tetrahydrofuranu:
O
Kat
+
, An
-
+
Kat
O
+
, An
-
An
-
,
O
+
OCH
2
CH
2
CH
2
CH
2
Kat
An
-
,
O
+
(OCH
2
CH
2
CH
2
CH
2
)
n
Kat
(OCH
2
CH
2
CH
2
CH
2
)
n
OH
H
polioksybutylen
terminacja
O
O
CH
2
CH
2
CH
2
CH
2
OH
HO
polikondensacja butandiolu
(polieterol)

16
POLIMERYZACJA ANIONOWA
INICJATORY
(katalizatory ?????)
Związki (AnKat) zdolne do generowania reaktywnego względem
monomeru anionu (An
) i niereaktywnego względem monomeru
kationu (Kat
)
- metale alkaliczne (K, Li, Na)
Np. 2K K
+ K
(w rozpuszczalnikach eterowych, np. THF;
szczególnie w obecności eterów koronowych kompleksujących kation
metalu – 18korona6)
- amidki (KNH
2
, NaNH
2
)
(rozpuszczanie metalu w ciekłym amoniaku)
- niektóre związki metaloorganiczne (n-C
4
H
9
Li, PhCH
2
Na, PhMgBr)
- zasady (KOH, NaOH, K
2
CO
3
)
- alkoholany (CH
3
ONa, t-BuOK)
- ELEKTRON!!!
Heterogeniczny rozpad wiązania:
An-Kat An
, Kat
An
Kat
An
+ Kat
jonizacja dysocjacja
para jonowa para jonowa wolne jony
kontaktowa rozdzielona
(zależnie od rozpuszczalnika)
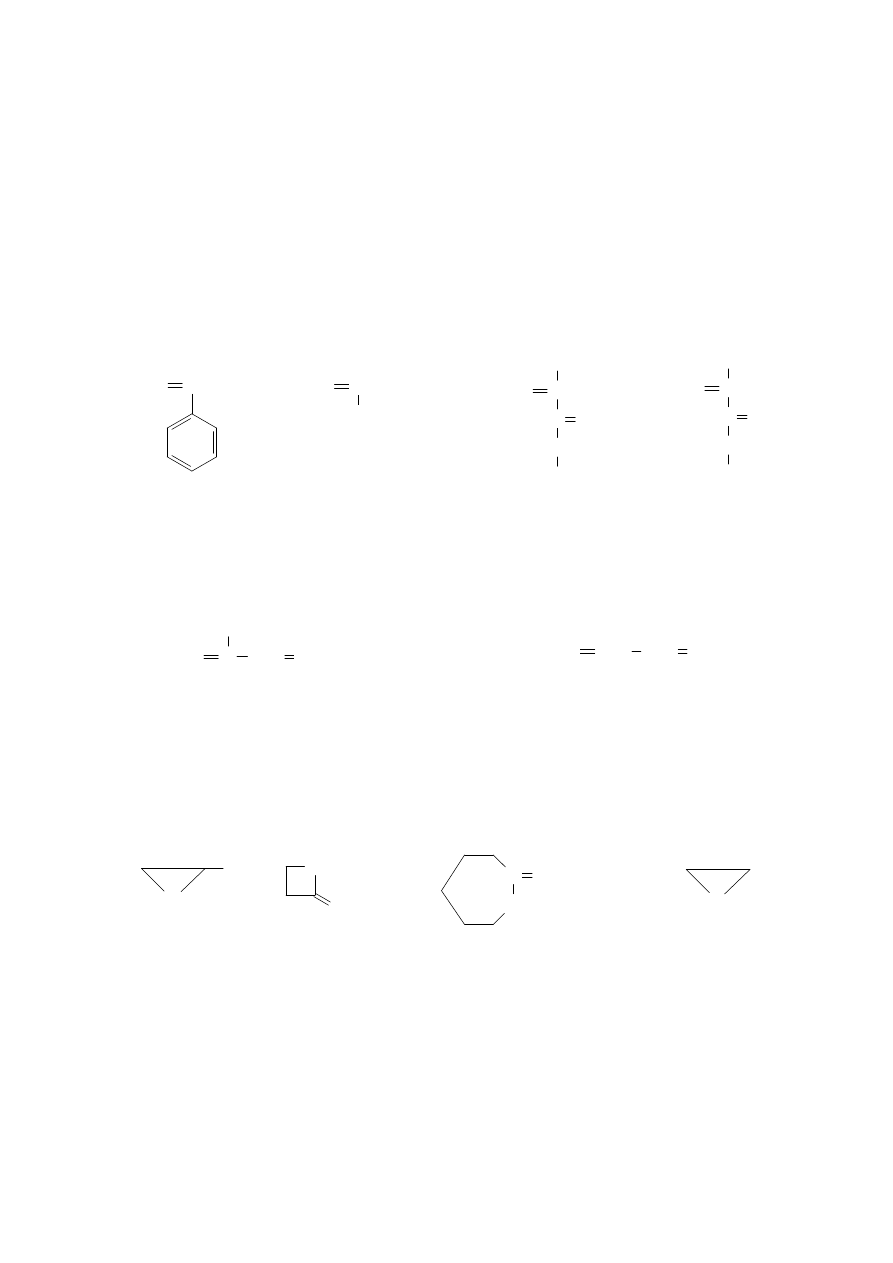
17
MONOMERY
- Niektóre monomery zawierających wiązanie C=C; szczególnie z
podstawnikami elektronoakceptorowymi (styren, akrylonitryl,
cyjanoakrylany, akrylany i metakrylany alkilowe);
CH
CH
2
CH
CH
2
CN
C
CH
2
CN
C O
O
R
C
CH
2
C O
O
R
CH
3
- Dieny (izopren, butadien)
CH
CH
2
CH CH
2
C
CH
2
CH
3
CH CH
2
- Monomery heterocykliczne, szczególnie oksacykliczne (cykliczne
etery - oksirany, cykliczne estry – laktony, cykliczne amidy –
laktamy, cykliczne siarczki)
O
R
O
O
S
NH
C O

18
Polimeryzacja wg. mechanizmu anionowego:
Inicjowanie
Addycja anionu lub elektronu do monomeru
Propagacja
Sukcesywna „insercja” monomeru w wiązanie anion-
przeciwjon
Terminacja
- Przeniesienie łańcucha na monomer
- Kombinacja (rekombinacja)
- Inne reakcje – z zanieczyszczeniami, „zabijanie” centrów
aktywnych
-
NAJWAŻNIEJSZYM Z MECHANIZMÓW TERMINACJI W
POLIMERYZACJI ANIONOWEJ JEST BRAK TERMINACJI –
JEST TO WTEDY POLIMERYZACJA ŻYJĄCA
Prof. Michael (Michał) Szwarc
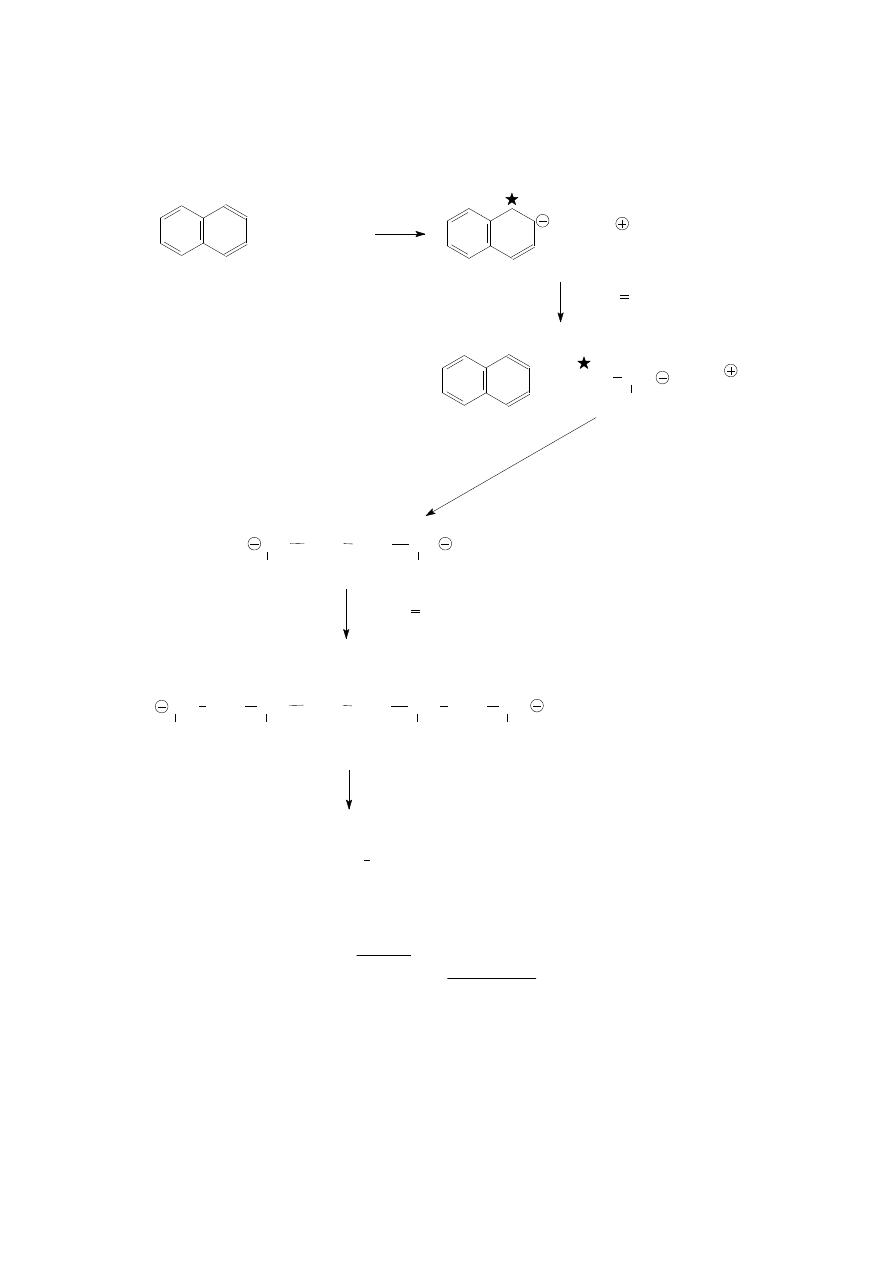
19
+
Na
+
Na
CH
2
CHPh
+
CH
2
CH
Ph
+
Na
CH CH
2
CH
2
CH
Ph
Ph
CH
2
CHPh
CH CH
2
CH
2
CH
Ph
Ph
CH
2
CH
2
CH
CH
Ph
Ph
(CH
2
CHPh)
n
"żyjący"
]
[
]
[
2
0
0
I
M
DP
n
MWD 1

20
POLIMERYZACJA KOORDYNACYJNA
(JONOWO-KOORDYNACYJNA)
KATALIZATORY
(inicjatory ?????)
Katalizatory, których centrum aktywne stanowi atom metalu
w otoczeniu ligandów, z których jeden tworzy z metalem
aktywne wiązanie kowalencyjne.
- Katalizatory Zieglera-Natty
SĄ TO NA OGÓŁ KATALIZATORY
HETEROGENICZNE!!
Połączenie związku metalu przejściowego grup IV-VIII (Ti,
Cr, Th, Zr, V, Nb, Ta, Mo) oraz wodorku lub związku
organicznego metalu grup I-III (Al., Li, Mg, Zn, Pb) układu
okresowego
Klasyczny układ TiCl
4
-AlEt
3
- katalizatory tlenkowe
Tlenki metali grup V-VII osadzone na nośnikach (Al
2
O
3
,
SiO
2
); najważniejszy – katalizator Philipsa: CrO
3
osadzony
na nośnikach krzemianowych i glinokrzemianowych
- koordynacyjne katalizatory homogeniczne
Np. VCl
4
-Al.(C
6
H
13
)
3
; VOCl
3
-AlEt
2
Cl; V(Acac)
3
-AlEt
2
Cl, etc.
- Katalizatory metalocenowe (homogeniczne; przyszłościowo
również heterogeniczne)
MONOMERY
Etylen, -olefiny (propylen), aryloolefiny (styren), dieny (izopren,
butadien), podstawione oksirany i tiirany, laktony, etc.

21
MECHANIZM POLIMERYZACJI
Inicjowanie
(?????)
i propagacja
Monomer tworzy kompleks z katalizatorem – koordynacja z
wakantowym orbitalem atomu metalu poprzez wiązanie
(monomery nienasycone) lub parę elektronową (monomery
heterocykliczne), po czym następuje „insercja” monomeru
pomiędzy atom metalu i ligand:
Mt-L + M [MtM]-L Mt-M-L
Mt-M-L + M [MtM]-M-L Mt-(M)
2
-L Mt-(M)
n
-L
Terminacja
- reakcje ze związkami z aktywnym wodorem
Mt-CH
2
-CHRL + HY Mt-Y + CH
3
-CHRL
- przeniesienie na monomer
Mt-CH
2
-CHRL+CH
2
=CHR Mt-CH
2
-CH
2
R +
CH
2
=CRL
- wewnątrzcząsteczkowe przeniesienie wodorkowe
Mt-CH
2
-CHRL Mt-H + CH
2
=CRL
- bardzo wiele innych reakcji
Polimeryzacja koordynacyjna jest na ogół stereospecyficzna –
prowadzi do powstawania polimerów stereoregularnych. Wynika
to z określonego orientowania się przestrzennego cząsteczki
monomeru w momencie insercji w rosnący łańcuch.
GŁÓWNE ZASTOSOWANIA PRZEMYSŁOWE
- liniowy polietylen (HDPE, LLDPE);
- izoaktyczny i syndiotaktyczny polipropylen;
- syndiotaktyczny polistyren;
- cis-1,4 poliizopren i polibutadien;
- kopolimery o określonej strukturze i polimery stereoblokowe.
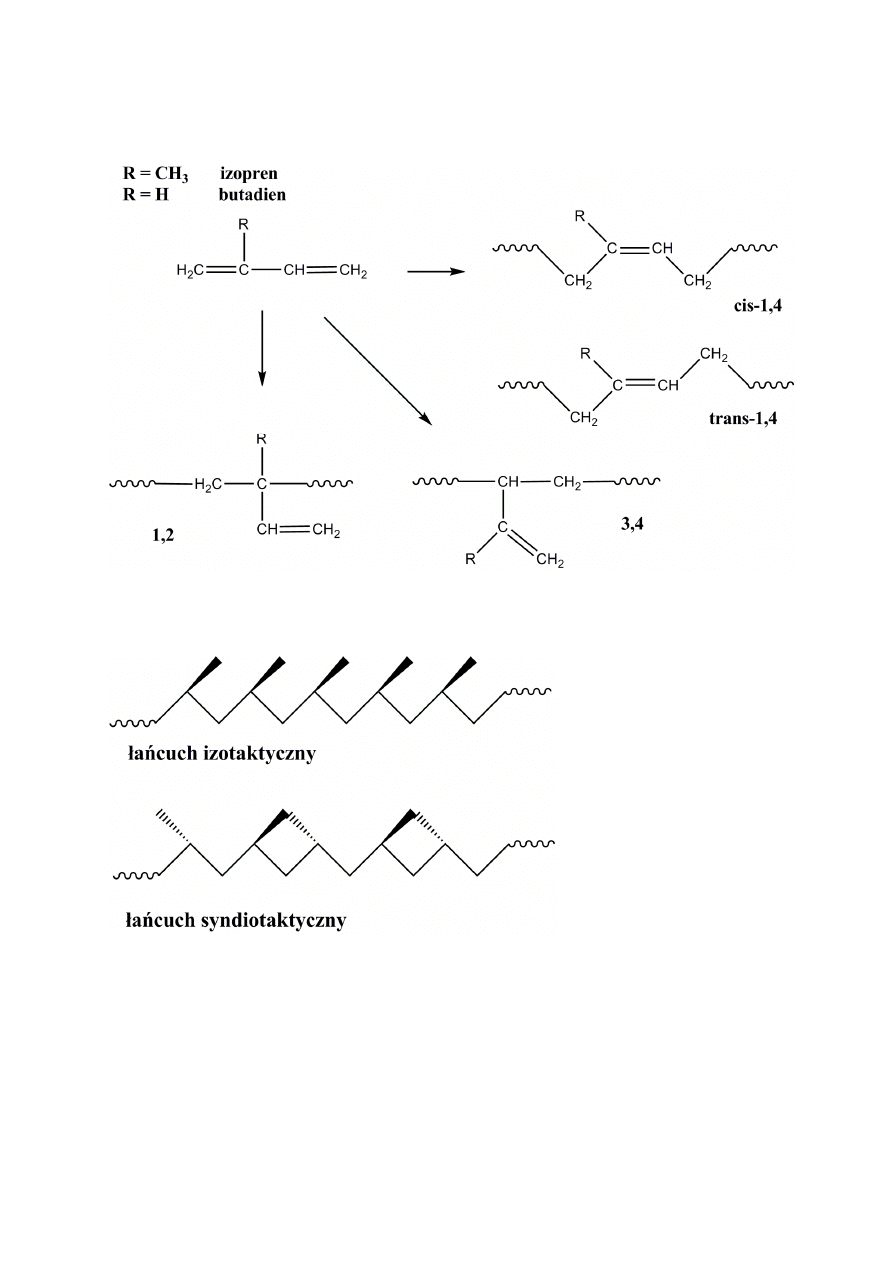
22
Mikrostruktura łańcucha polimerowego
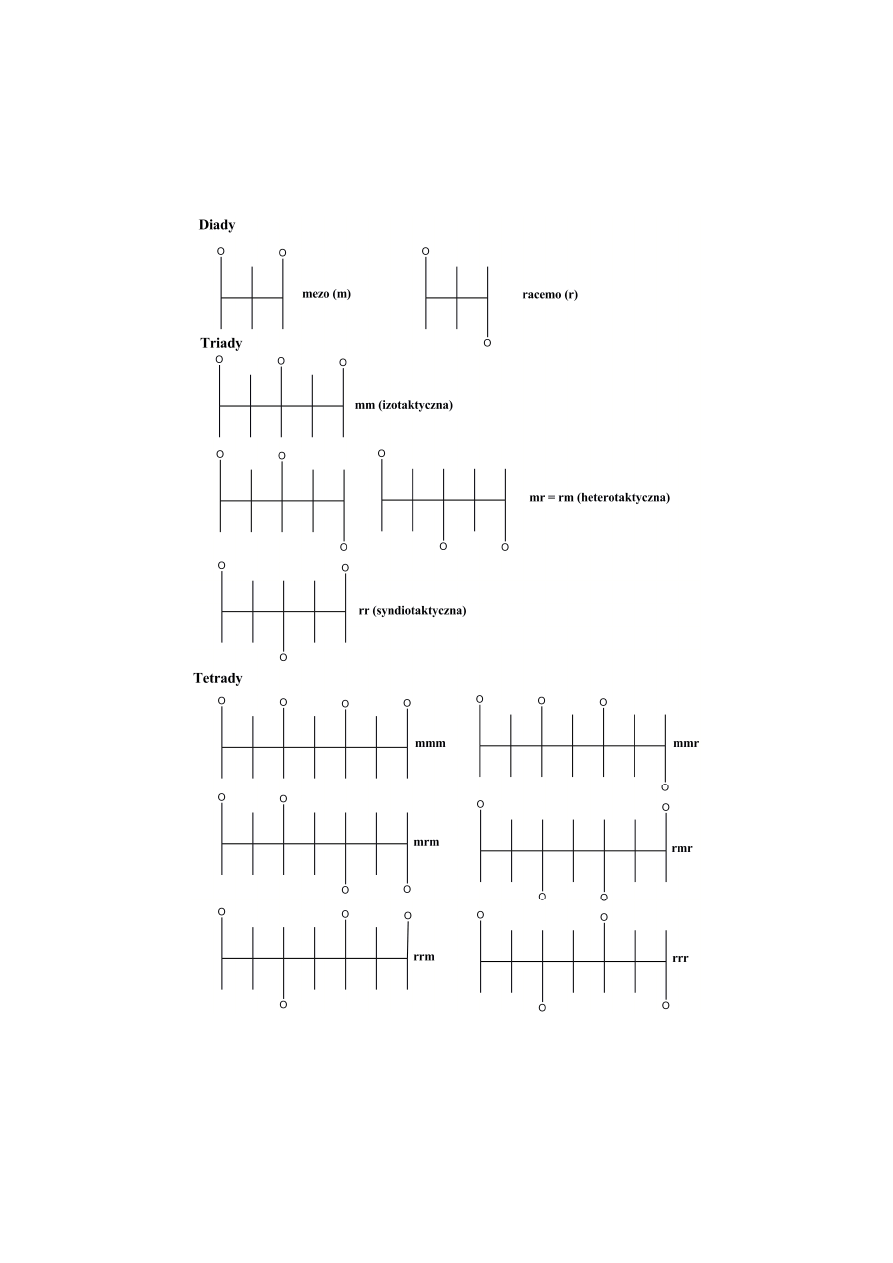
23
SEKWENCJE KONFIGURACYJNE WIDOCZNE W
WIDMACH NMR POLIMERÓW TYPU –(-CH
2
CHR-)
n
-

24
BASIC CONFIGURATIONAL STATISTICS
Probabilities
Intensities in NMR
Diads:
P
m
+ P
r
= 1
[m] + [r] = 1
Triads:
P
mm
+ P
mr
+ P
rr
= 1
[mm] + [mr=rm] + [rr] = 1
P
m
= P
mm
+ P
mr
P
r
= P
rr
+ P
rm
For ideally atactic (random) polymer:
[m] = [r] =
[mm] = [rr] =
[mr = rm] =
Average sequence length:
]
[
]
[
2
mr
m
m
[m] = [r] =
→
<m> = 2
]
[
]
[
2
rm
r
r
[m] = [r] =
→
<r> = 2
Hyphotetical “heterotactic” polymer:
…….rmrmrmrmrmrmrmrmrmrmrmrmr….
[m] = [r] = ; [mr] = [rm] = 1
→
<m> = <r> = 1
Discrepancy:
Hyphotetical polymer consisting exclusively of [mmr] and [rrm] tetrads:
…..mmrrmmrrmmrrmmrrmmrrmmrrmmrr….
[m] = [r] =
Evidently, [mmr] = [rrm] =
(because there’s no other ones)
and <m> = <r> = 2
(like as in ideally atactic polymer)
Whereas,
according to Bernoulli:
P
mmr
= P
rrm
=2P
m
2
(1 – P
m
) = 2•()
2
• =
and certainly this is not an atactic polymer

25
INNE POLIMERYZACJE
CH
2
CH
C O
NH
2
CH
2
CH
C O
NH
2
)
n
(
polim. rodnikowa
anionowa polimeryzacja
"z przeniesieniem protonu"
( CH
2
CH
2
C NH )
n
O
akrylamid
poliakrylamid
poli
_
alanina

26
CH
2
CH C O
O
CH
2
C
CH
3
CH
2
OH
CH
2
OH
CH
2
CH
2
C O
O
CH
2
C
CH
3
CH
2
O
CH
2
O
(
)
n
)
n
Synteza polimerów "hiperrozgałęzionych" z dihydroksyakrylanów
poprzez polimeryzację z przeniesieniem protonu
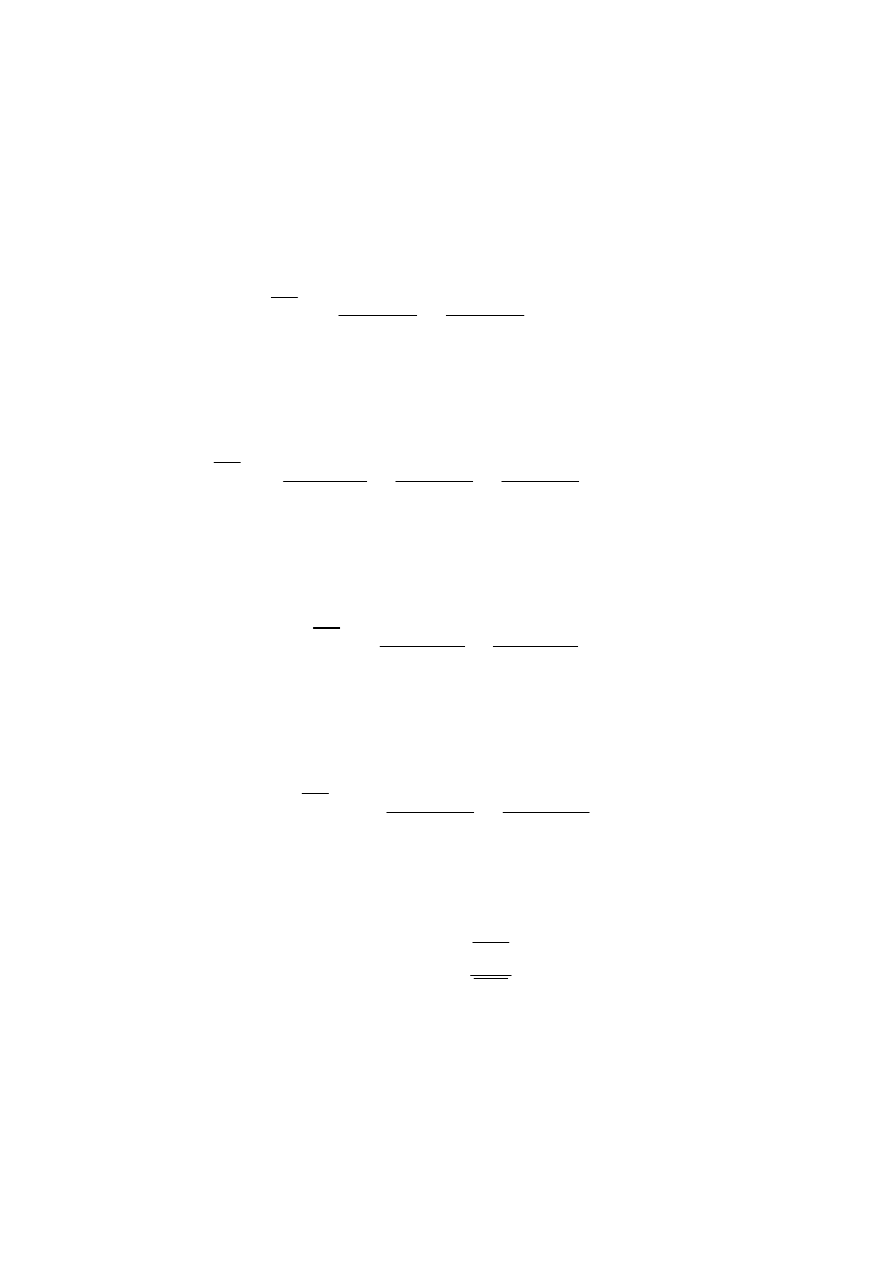
27
MASA CZĄSTECZKOWA POLIMERÓW
(CIĘŻAR CZĄSTECZKOWY)
Średnia liczbowo masa cząsteczkowa
i
i
i
i
i
i
i
n
M
n
N
M
N
N
M
N
M
Średnia wagowo masa cząsteczkowa
i
i
i
i
i
i
i
i
i
i
i
w
M
w
m
M
m
m
M
m
M
N
M
N
M
2
Z-średnia masa cząsteczkowa
i
i
i
i
i
i
i
i
z
M
m
M
m
M
N
M
N
M
2
2
3
(Z + 1)-średnia masa cząsteczkowa
2
3
3
4
1
i
i
i
i
i
i
i
i
z
M
m
M
m
M
N
M
N
M
Rozkład mas cząsteczkowych (stopień polidyspersyjności)
n
w
M
M
MWD
(rozkład „normalny” – MWD = 2)
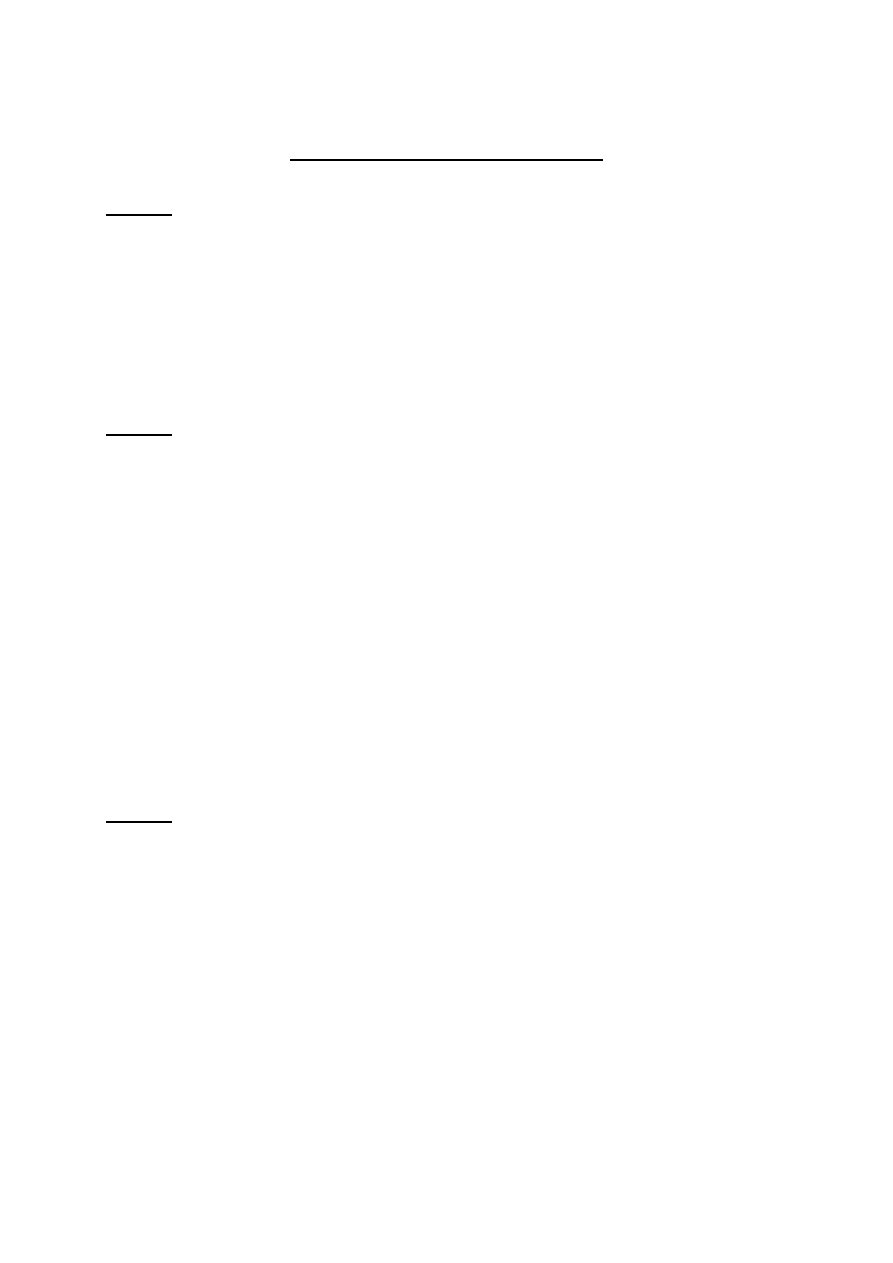
28
ZADANIA OBLICZENIOWE
Zad.1.
1 mol substancji o masie cząsteczkowej M = 1000
zmieszano z 1 molem substancji o masie cząsteczkowej M = 2000.
M
n
= ½ • 1000 + ½ • 2000 = 1500
M
w
= ⅓ • 1000 + ⅔ • 2000 = 1667
Zad.2.
Równe
masy
liczby cząsteczek
o masach cząsteczkowych
10.000 i 100.000
dają po zmieszaniu
M
n
= 18.200
M
n
= 55.000
M
w
= 55.000
M
w
= 92.000
Zad.3.
100 g poliestru A (M
n
=5000, M
w
=10000) wymieszano z 100 g
poliestru B (M
n
=20000, M
w
=40000).
Otrzymano 200 g poliestru (A+B; M
n
=8000, M
w
=25000).
Po kilkugodzinnym ogrzewaniu (200C) M
n
=8000, M
w
=16000.
Jest to skutek wymiany estrowej.

29
KOPOLIMERY I KOPOLIMERYZACJA
Homopolimeryzacja – polimeryzacja, w której powstaje
homopolimer
Kopolimeryzacja – polimeryzacja, w której powstaje kopolimer
Kopolimer – polimer otrzymany z więcej, niż jednego rodzaju
monomeru
bipolimer, terpolimer, kwaterpolimer, etc.
KOPOLIMERY (dla monomerów A i B)
- nieokreślone
poli(A-ko-B)
- bezładne (przypadkowe)
poli(A-ran-B)
- statystyczne
poli(A-stat-B)
- przemienne
poli(A-alt-B)
- blokowe
poli(A-blok-B)
- szczepione
poli(A-graft-B)
30
Pseudokopolimer
O
O
CH CH
2
( CH
2
CH )
n
O
O
( CHC OCH
2
CH
2
CH
)
m
CH
2
O
Czy kopolimer naprzemienny jest kopolimerem, czy homopolimerem
monomeru „domniemanego”???
C
C
O
O
O
+
CH
2
CHR
( CH CH
O
O
O
CH
2
CHR )
n
A jak to zaklasyfikować?
O
O
(OCH
2
OCH
2
CH
2
)
n
(OCH
2
)
n
(OCH
2
CH
2
)
n
polidioksolan
poli(oksymetylen-ko-oksyetylen)
back
_
biting
O
O
O
+
O
1 : 3
CZY POLIKONDENSACJA DIKWASU Z DIOLEM LUB
DIAMINĄ JEST PROCESEM KOPOLIMERYZACJI??????????
31
RÓWNANIE KOPOLIMERYZACJI MAYO-LEWISA
Dla pary komonomerów M
1
, M
2
:
m
1 +
M
1
m
1
k
11
szybkość
k
11
[m
1
][M
1
]
m
1 +
M
2
k
12
m
2
k
12
[m
1
][M
2
]
m
2 +
M
1
k
21
m
1
k
21
[m
2
][M
1
]
m
2 +
M
2
k
22
m
2
k
22
[m
2
][M
2
]
Współczynniki reaktywności monomerów w kopolimeryzacji:
r
1
= k
11
/k
12
r
2
= k
22
/k
21
Sens:
r < 1
rosnący łańcuch preferuje przyłączenie
komonomeru
r > 1
rosnący łańcuch preferuje przyłączenie
„własnego” monomeru
]
[
]
[
]
[
]
[
]
[
]
[
]
[
]
[
1
2
2
2
1
1
2
1
2
1
M
M
r
M
M
r
M
M
m
m
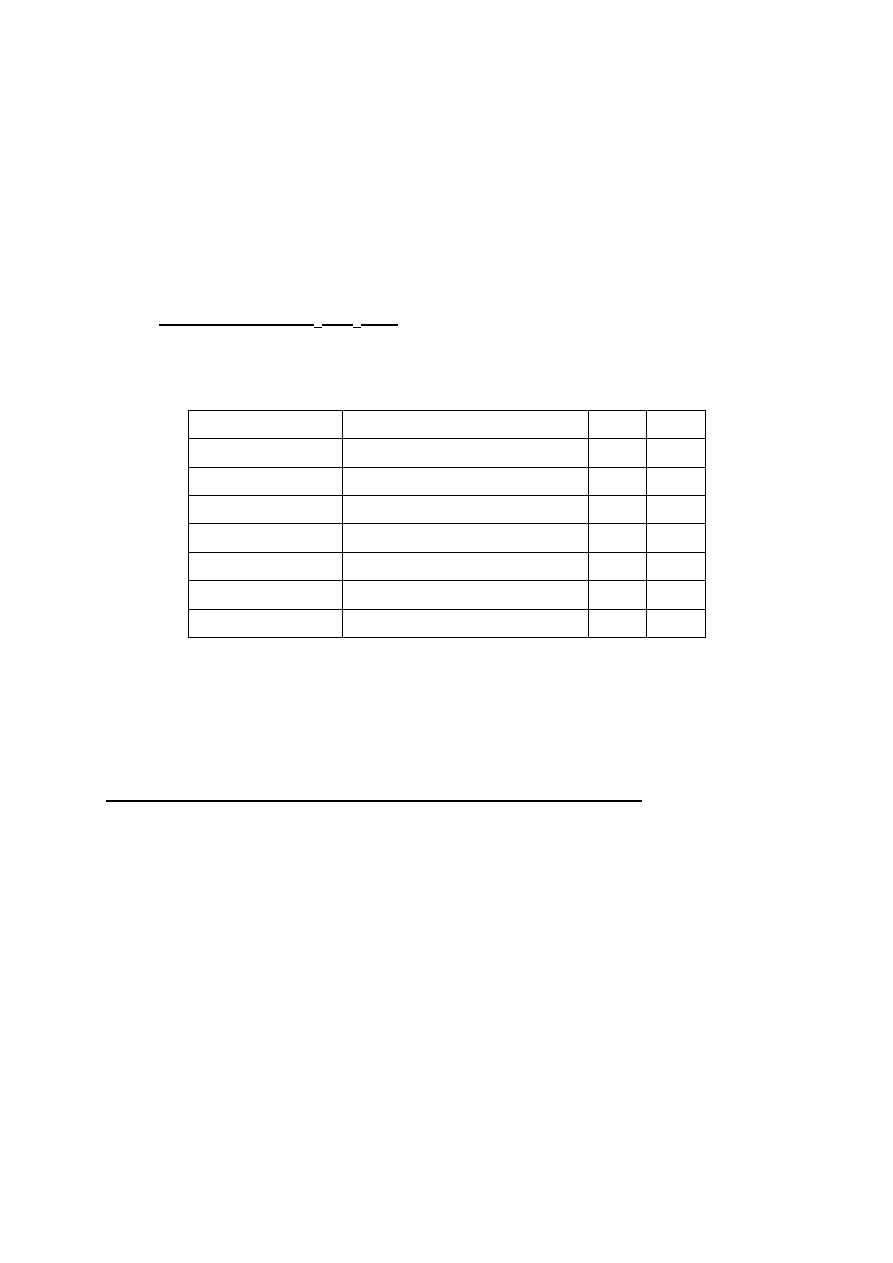
32
Jeżeli:
r
1
= r
2
= 0
kopolimer przemienny
r
1
>> 1, r
2
>> 1
mieszanina homopolimerów
r
1
• r
2
= 1
kopolimer idealnie statystyczny
r
1
= r
2
= 1
kopolimer azeotropowy
na ogół 0 < r
1
• r
2
< 1
M
1
M
2
r
1
r
2
Styren
Butadien
0,78 1,39
Styren
Metakrylan metylu
0,52 0,46
Styren
Octan winylu
55 0,01
Akrylonitryl
Chlorek winylu
3,3
0,4
Octan winylu
Metakrylan metylu
0,03 20
Octan winylu
Chlorek winylu
0,23 1,68
Styren
Bezwodnik maleinowy 0,05 0,0
STRUKTURA KOPOLIMERU A WŁAŚCIWOŚCI
- BLOKOWY: jak mieszanina homopolimerów
- NAPRZEMIENNY: inny niż homopolimery lub ich mieszanina
- STATYSTYCZNY: pośrednie między homopolimerami; zależnie
od rozkładu jednostek w łańcuchu

33
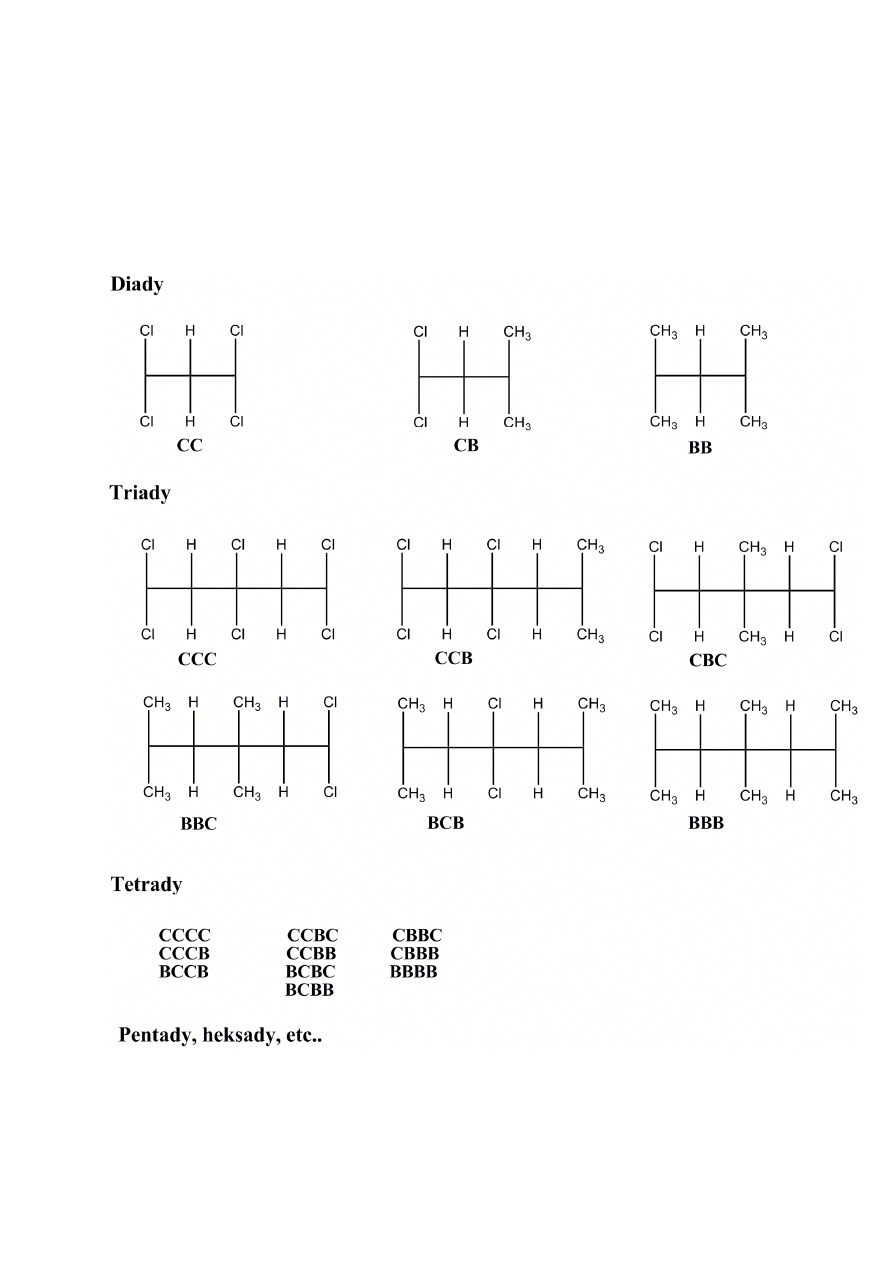
SCHEMAT Q-e ALFREY’A-PRICE’A
Dla C=C:
- Q – miara reaktywności monomeru (stabilizacji rezonansowej
wiązania podwójnego)
- e – miara polaryzacji cząsteczki monomeru; wprost
proporcjonalna do stałej w równaniu Hammetta
Dla wartości e:
-1,0
1,7
polim. kationowa
rodnikowa
anionowa
Monomer
Q
e
-metylostyren
0,50 – 0,70
-0,8 - -0,2
Izobutylen
0,2
-1,1
Styren
1,0
-0,8
???
Butadien
1,33
-0,8
Octan winylu
0,01 – 0, 47
-0,5 - -0,1
Chlorek winylu
0,024 – 0,074
0,2 – 0,4
Metakrylan metylu
0,74
0,4
Akrylonitryl
0,37 – 0,9
0,9 – 1,6
Eter etylowo-
winylowy
0,015
-1,6
)]}
(
[
exp{
2
1
1
2
1
1
e
e
e
Q
Q
r
)]}
(
[
exp{
1
2
2
1
2
2
e
e
e
Q
Q
r
34
SEKWENCJE KOPOLIMERYCZNE (KOMPOZYCYJNE)
WIDOCZNE W WIDMACH NMR KOPOLIMERÓW
STATYSTYCZNYCH NA PRZYKŁADZIE KOPOLIMERU
CHLORKU WINYLIDENU Z IZOBUTYLENEM
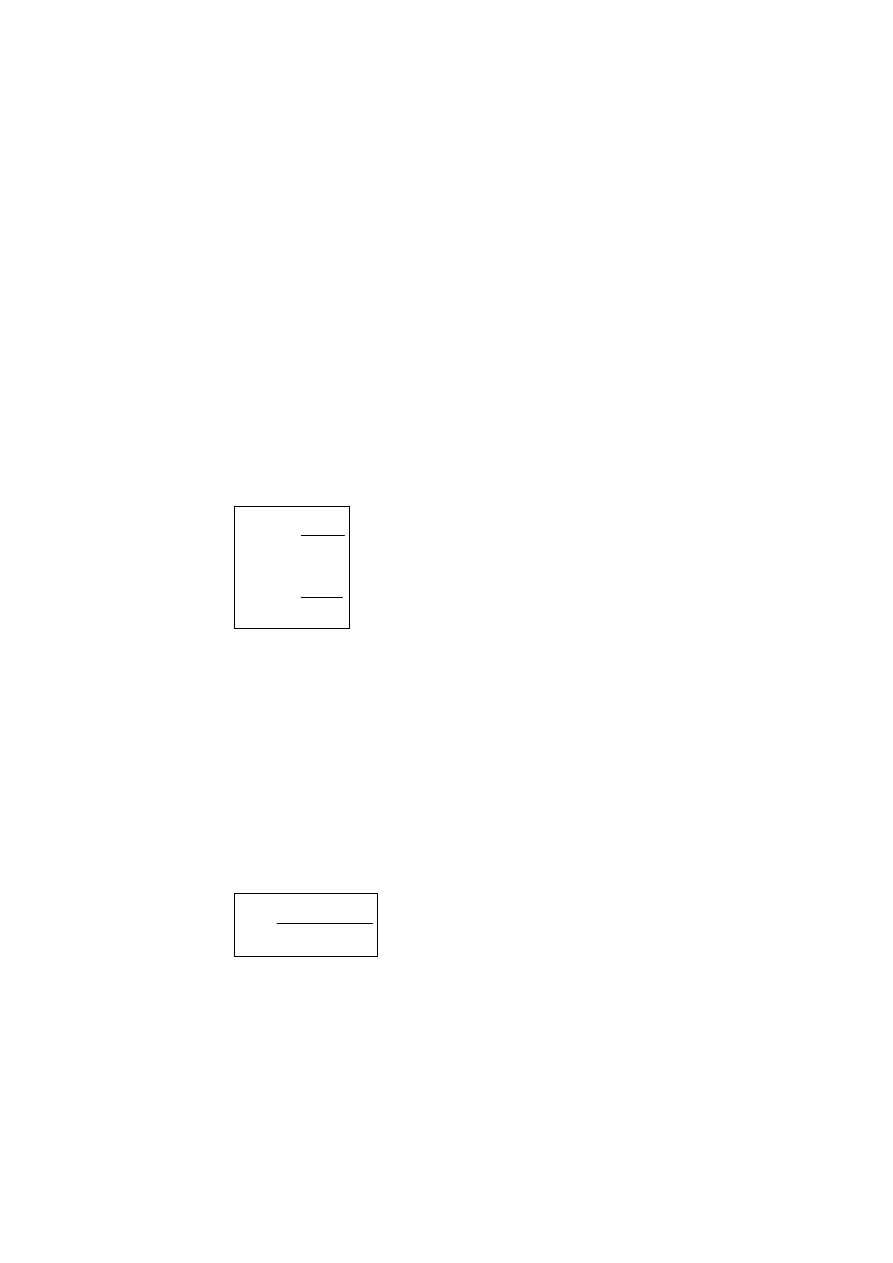
35
COPOLYMER STATISTICS
Non-Markovian statistics:
[A] + [B] = 1; [AA] + [AB=BA] + [BB] = 1; ….
[AA] = [A]
2
; [AAA] = [A]
3
; …
[A] = [AA] + [AB]
[B] = [BB] + [BA]
[AA] = [AAA] + [AAB]
[BB] = [BBB] + [BBA]
Average sequence length:
]
[
]
[
2
]
[
]
[
2
BA
B
B
AB
A
A
Block:
<A> =
Random:
<A> = 2
Alternating: <A> = 1
L.Merle, Y.Merle, Macromolecules, 15, 360 (1982)
“Alternating character parameter” (a measure of deviation of
random statistics):
]
][
[
2
]
[
B
A
BA
AB
Diblock:
= 0
Random:
= 1
Alternating: = 2
K.Ito, Y.Yamashita, J.Polym.Sci., A, 3, 2165 (1965)
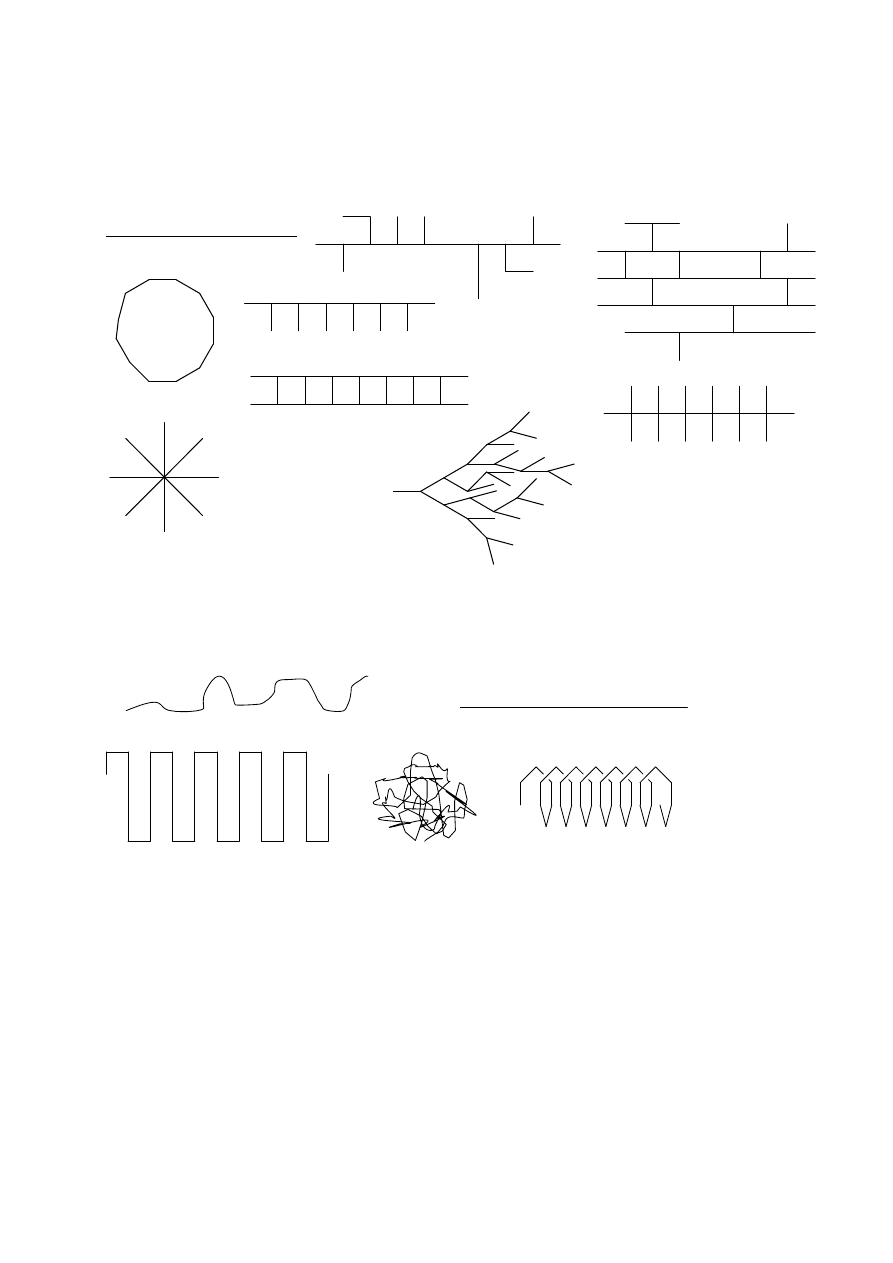
36
KSZTAŁT MAKROCZĄSTECZEK
linear
branched
cyclic
comb
- like
brush - like
ladder
star
dendrimer
crosslinked
Makrokonformacja makrocząsteczek liniowych
unperturbed
rod like
folded
globular
helical

37
ŻYWICE AMINOWO-FORMALDEHYDOWE
+
HCH
O
C
O
NH
2
NH
2
C
O
NH
NH
2
CH
2
OH
C
O
NH
NH
CH
2
OH
HOCH
2
C
O
N
NH
2
CH
2
OH
CH
2
OH
C
O
N
NH
CH
2
OH
HOCH
2
CH
2
OH
C
O
N
NH
CH
2
OH
OCH
2
CH
2
O
C
O
N
NH
CH
2
O
CH
2
C
O
N
N
CH
2
O
CH
2
CH
2
OCH
2
C
O
N
NH
CH
2
CH
2
CH
2
OH
C
O
N
NH
CH
2
OH
CH
2
O
N
C
N
C
C
N
NH
2
NH
2
NH
2
+
HCH
O
N
C
N
C
C
N
NHCH
2
OH
NH
2
NH
2
N
C
N
C
C
N
N
N
N
CH
2
OH
HOCH
2
CH
2
OH
CH
2
OH
HOCH
2
HOCH
2
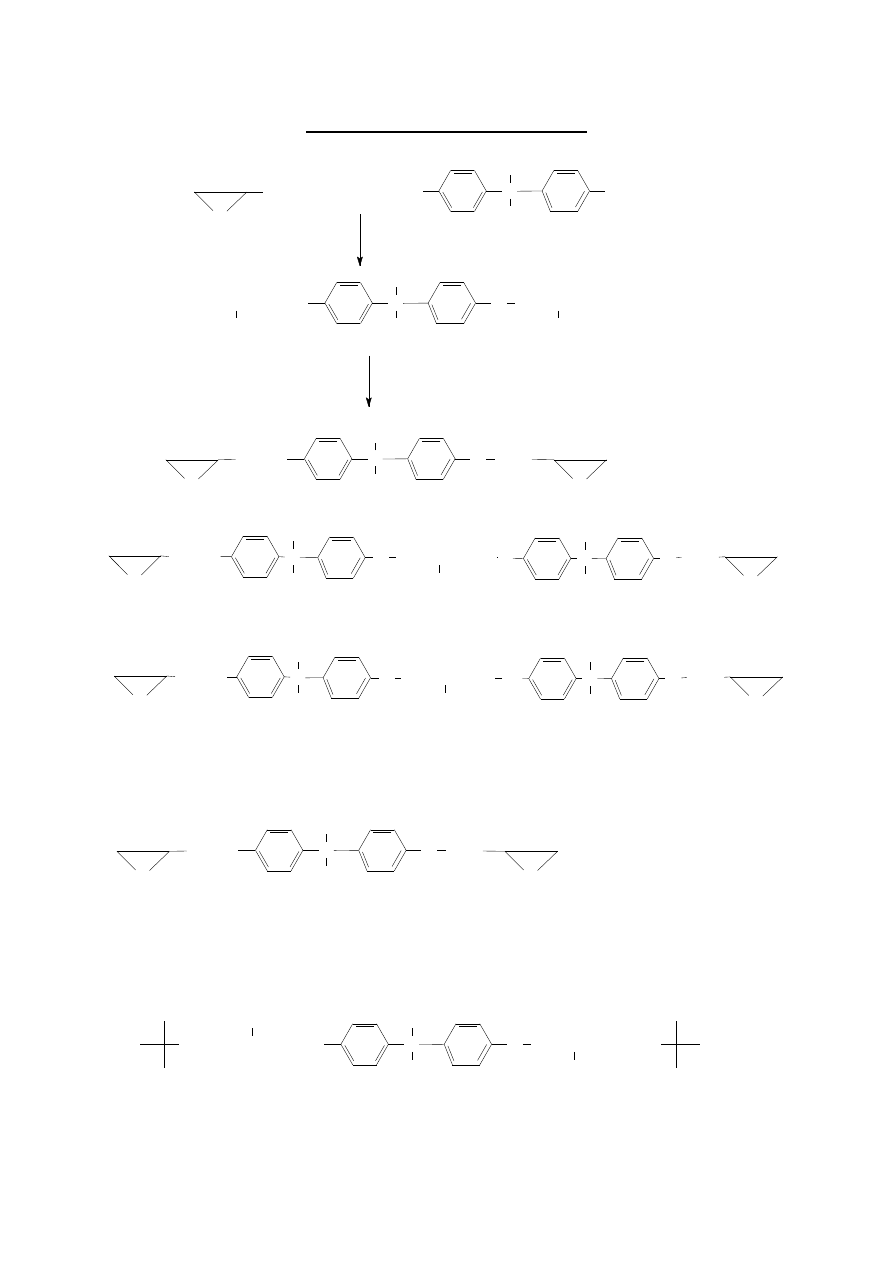
38
ŻYWICE EPOKSYDOWE
O
CH
2
Cl
+
C
CH
3
CH
3
HO
OH
C
CH
3
CH
3
ClCH
2
CHCH
2
O
O CH
2
CHCH
2
Cl
OH
OH
NaOH
C
CH
3
CH
3
CH
2
O
O CH
2
O
O
+
C
CH
3
CH
3
CH
2
O
O CH
2
CHCH
2
O
OH
O
C
CH
3
CH
3
O CH
2
O
C
CH
3
CH
3
CH
2
O
O CH
2
CHCH
2
O
OH
O
]
C
CH
3
CH
3
O CH
2
O
+
[
n
+
H
2
NCH
2
CH
2
NHCH
2
CH
2
NH
2
H
2
NCH
2
CH
2
NHCH
2
CH
2
NHCH
2
CH
2
NH
2
C
CH
3
CH
3
NHCH
2
CHCH
2
O
O CH
2
CHCH
2
NH
OH
OH
C
CH
3
CH
3
CH
2
O
O CH
2
O
O
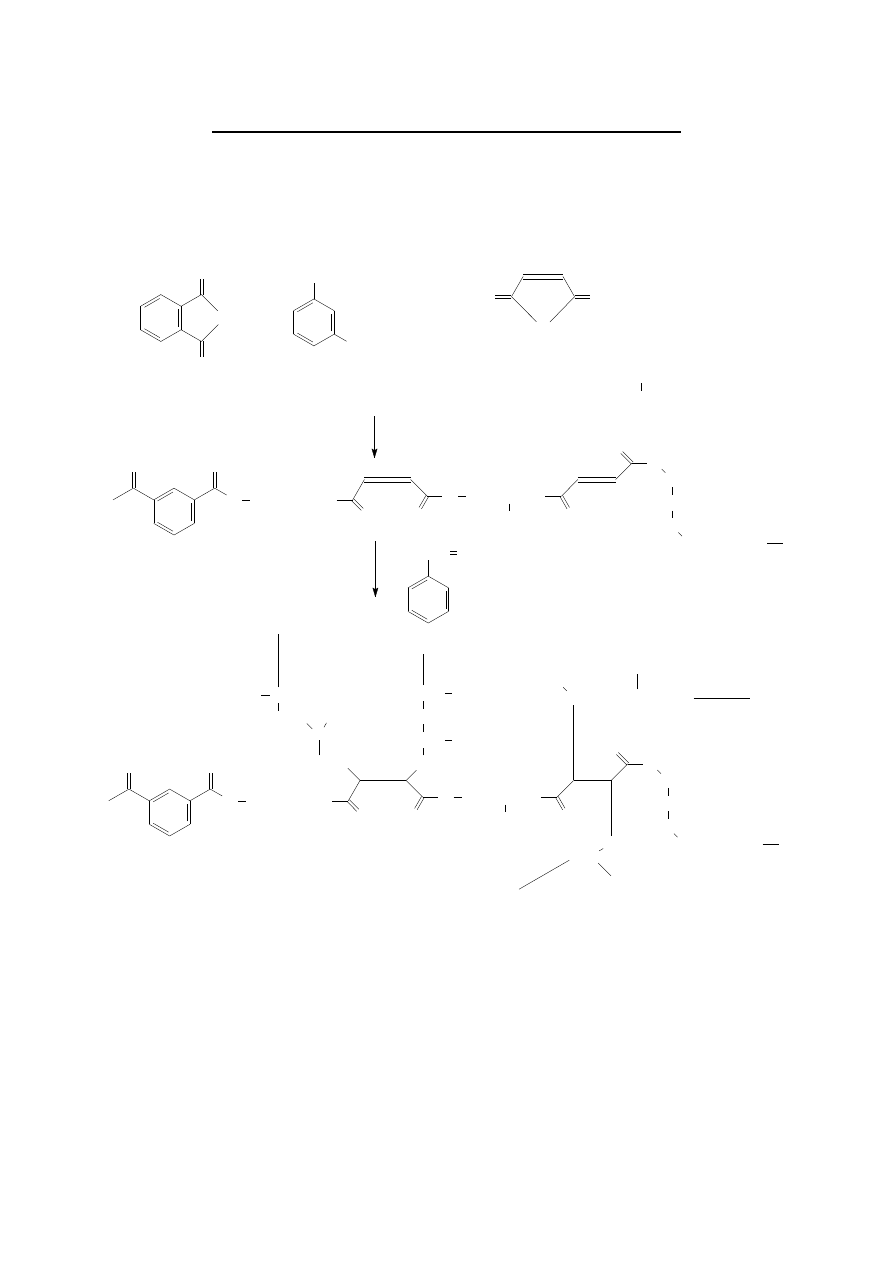
39
NIENASYCONE ŻYWICE POLIESTROWE
O
O
O
COOH
COOH
O
O
O
HOCH
2
CH
2
OH
HOCH
2
CH
2
OCH
2
CH
2
OH
HOCH
2
CHOH
CH
3
O
O
O CH
2
CH
2
O
O
O
O CH
2
CHO
CH
3
O
O
O
CH
2
CH
2
O
CH
2
CH
2
O
CH CH
2
O
O
O CH
2
CH
2
O
O
O
O CH
2
CHO
CH
3
O
O
O
CH
2
CH
2
O
CH
2
CH
2
O
CH
2
CH
2
CH
CH
2
CH Ph
Ph
CHCH
2
CHCH
2
CH
2
Ph
CH
Ph
CH
CH
2
CH
Ph
Ph
Ph
Wyszukiwarka
Podobne podstrony:
Materiały pomocnicze do wykładów, FiR, Notatki, Rynki finansowe
materiały pomocnicze do wykładu nr 5
materialy pomocnicze do wykladow z genoterapii, Biotechnologia CM UMK USM, Semestr II, Genoterapia (
Gospodarka przestrzenna - materiały pomocnicze do wykładów, Polibuda, Gospodarka przestrzenna
materiały pomocnicze do wykładu nr 4
materiały pomocnicze do wykładu nr 3
materiały pomocnicze do wykładu nr 2
Ekologia materialy pomocnicze do wykladow
Jerzy Pogonowski Dwa paradygmaty metalogiki Materiały pomocnicze do wykładów 2 5
material pomocniczy do zaliczenia ustnego ćwiczen, wsr rok 1 2012, wykłady, I semestr, fizjo
Materialy pomocnicze do cwiczen Statystyka cz I
Ciania PKM, Materiały pomocnicze do projektowania
Materialy pomocnicze do testu II Gospodarka finansowa zakl
materialy pomocnicze do projektu skrzyzowania kl 1
więcej podobnych podstron