
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
MINISTERSTWO EDUKACJI
NARODOWEJ
Alicja Królak
Wykonywanie objętościowej analizy żywności
321[09].Z4. 02
Poradnik dla ucznia
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy
Radom 2006

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
1
Recenzenci:
mgr inż. Teresa Kubiak
mgr inż. Aleksandra Ptak
Opracowanie redakcyjne:
Konsultacja:
mgr inż. Maria Majewska
Korekta:
Poradnik stanowi obudowę dydaktyczną programu jednostki modułowej 321[09].Z4.02
„Wykonywanie objętościowej analizy żywności” zawartego w modułowym programie
nauczania dla zawodu technik technologii żywności.
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy, Radom 2006

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
2
SPIS TREŚCI
1. Wprowadzenie
3
2. Wymagania wstępne
5
3. Cele kształcenia
6
4. Materiał nauczania
7
4.1. Technika analizy miareczkowej
7
4.1.1. Materiał nauczania
7
4.1.2. Pytania sprawdzające
16
4.1.3. Ćwiczenia
17
4.1.4. Sprawdzian postępów
18
4.2. Metody zobojętniania w analizie miareczkowej
19
4.2.1. Materiał nauczania
19
4.2.2. Pytania sprawdzające
19
4.2.3. Ćwiczenia
20
4.2.4. Sprawdzian postępów
22
4.3. Metody strąceniowe w analizie miareczkowej
23
4.3.1 Materiał nauczania
23
4.3.2. Pytania sprawdzające
23
4.3.3. Ćwiczenia
23
4.3.4. Sprawdzian postępów
25
4.4 Metody redoksymetryczne w analizie miareczkowej
26
4.4.1. Materiał nauczania
26
4.4.2.Pytania sprawdzające
29
4.4.3. Ćwiczenia
29
4.4.4. Sprawdzian postępów
32
5. Sprawdzian osiągnięć
33
6. Literatura
38

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
3
1. WPROWADZENIE
Poradnik będzie Ci pomocny w przyswajaniu treści dotyczących wykonywania
objętościowej analizy żywności.
W poradniku zamieszczono:
−
wymagania wstępne, w których określono co powinieneś umieć przystępując do realizacji
tej jednostki modułowej,
−
cele kształcenia, które określają umiejętności jakie powinieneś opanować w wyniku
procesu kształcenia,
−
materiał nauczania, który pomoże Ci samodzielne przygotować się do wykonania ćwiczeń
i zaliczenia sprawdzianów. Wykorzystaj do poszerzenia wiedzy wskazaną literaturę oraz
inne źródła informacji. Obejmuje on również ćwiczenia zawierające polecenie, sposób
wykonania oraz wyposażenie stanowiska pracy.
−
sprawdzian postępów, który umożliwi Ci sprawdzenie poziomu wiedzy po wykonaniu
ćwiczeń,
−
wykaz literatury.
Sprawdzian osiągnięć opracowany w formie testu zawierającego:
−
instrukcję,
−
zestaw zadań testowych,
−
punktację zadań,
−
kartę odpowiedzi.
Bezpieczeństwo i higiena pracy
Przebywając w laboratorium analizy żywności musisz przestrzegać regulaminu pracowni,
przepisów bezpieczeństwa i higieny pracy oraz przepisów przeciwpożarowych. Przy
wykonywaniu ćwiczeń zachowaj ostrożność podczas ogrzewania roztworów. Szyjkę kolby lub
probówki trzymaj otworem od siebie. Postępuj ostrożnie z roztworami kwasów i zasad
szczególnie stężonych. Kwasy do pipety naciągaj za pomocą pompki a nie ustami.
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
4
Schemat układu jednostek modułowych
321[09].04
Analiza żywności w przetwórstwie spożywczym
321[09].04.01
Wykonywanie wagowej analizy żywności
321[09].04.02
Wykonywanie objętościowej analizy żywności
321[09].04.05
Wykonywanie towaroznawczych badań żywności
321[09].04.03
Wykonywanie
instrumentalnej analizy
żywności
321[09].04.04
Wykonywanie
mikrobiologicznych
badań żywności

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
5
2. WYMAGANIA WSTĘPNE
Przystępując do realizacji programu jednostki modułowej powinieneś umieć:
−
korzystać z różnych źródeł informacji,
−
posługiwać się normą,
−
stosować odczynniki w wykonywaniu analiz,
−
łączyć w zestawy sprzęt laboratoryjny,
−
przygotowywać odważki analityczne,
−
korzystać z wag analitycznych,
−
przeliczać stężenia molowe na procentowe i odwrotnie,
−
przestrzegać zasady Dobrej Praktyki Laboratoryjnej.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
6
3. CELE KSZTAŁCENIA
W wyniku realizacji programu jednostki modułowej powinieneś umieć:
−
określić rodzaje analizy objętościowej,
−
wykonać
algorytm
postępowania
w
alkacymetrii
i
w
technikach
metody
oksydoredukcyjnej,
−
sporządzić odczynniki (wskaźniki) stosowane w alkacymetrii i oksydymetrii:
manganometrii, jodometrii, bromianometrii, cerometrii, chromianometrii,
−
zastosować odczynniki w wykonywaniu analiz,
−
przeliczyć stężenia molowe na procentowe i odwrotnie,
−
wykonać miareczkowanie badanej próby,
−
obliczyć stężenie badanego składnika w próbie laboratoryjnej,
−
opracować wyniki badań laboratoryjnych z zastosowaniem programów komputerowych,
−
zinterpretować wyniki badań laboratoryjnych,
−
zarejestrować wyniki badań,
−
posłużyć się dokumentacją techniczną i technologiczną przy wykonywaniu analiz
objętościowych żywności,
−
zastosować zasady Dobrej Techniki Laboratoryjnej GLP w analizie objętościowej
żywności,
−
ustalić krytyczne punkty kontroli (HACCP) w procesach produkcji artykułów
spożywczych poprzez wykonywanie monitorujących analiz objętościowych,
−
zastosować przepisy bezpieczeństwa i higieny pracy, ochrony przeciwpożarowej, ochrony
środowiska i wymagania ergonomii na stanowisku pracy,
−
skorzystać z literatury i innych źródeł informacji.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
7
4. MATERIAŁ NAUCZANIA
4.1. Technika analizy miareczkowej
4.1.1. Materiał nauczania
Klasyfikacja metod miareczkowych
Celem analizy objętościowej jest oznaczanie składu chemicznego badanych materiałów.
Metody analizy miareczkowej polegają na oznaczaniu składnika w roztworze badanym za
pomocą roztworu odczynnika o znanym stężeniu czyli mianie, odmierzanego za pomocą
biurety. Roztwory odczynników o znanym stężeniu używane do miareczkowania nazywamy
roztworami mianowanymi. W metodach miareczkowych wykorzystywane są reakcje
chemiczne, które przebiegają:
−
stechiometrycznie (ilościowo)
−
dostatecznie szybko,
−
w których biorą udział związki chemiczne dające roztwory dostatecznie trwałe
w warunkach miareczkowania,
−
których punkt równoważnikowy można wyznaczyć z odpowiednią dokładnością.
Dokładność metod miareczkowych zależy od dokładności nastawienia miana roztworu, którym
się miareczkuje.
Metody miareczkowe są o wiele szybsze niż metody wagowe. Metody miareczkowe
opierają się na czterech podstawowych typach reakcji chemicznych, a mianowicie:
−
reakcjach zobojętniania, czyli łączenia się jonów wodorowych kwasów z jonami
wodorotlenowymi zasad w obojętne cząsteczki wody (alkacymetria):
H
+
+ OH
–
→
H
2
O
−
reakcjach strąceniowych, w których jony łącząc się ze sobą tworzą związki trudno
rozpuszczalne (argentometria):
Cl
-
+ Ag
+
+ NO
3
–
→
AgCl + NO
3
–
−
reakcjach kompleksowania polegających na oznaczaniu pierwiastków za pomocą
związków tworzących z tymi pierwiastkami trwałe połączenia typu chelatowego
(komleksometria).
−
reakcjach redoks opartych na przekazywaniu elektronów (nadmanganianometria,
jodometria, bromianometria).
Nazwy metod tworzy się od nazwy odczynnika z końcówką - metryczny np.: metody
wykorzystujące
mianowane
roztwory
kwasów
nazywa
się
acydymetrycznymi,
metody,warunkach których miareczkuje się mianowanymi roztworami bromianu potasowego
bromianometrycznymi. W celu oznaczenia danej substancji w roztworze należy znaleźć
odpowiedni odczynnik reagujący z nią w sposób stechiometryczny (ilościowo) i dostatecznie
szybko. Należy również znaleźć sposób, który pozwoli wyznaczyć punkt, w którym cały
oznaczany składnik przereaguje z odczynnikiem, aby właśnie wtedy zakończyć
miareczkowanie i odczytać na biurecie objętość odczynnika.
Punkt miareczkowania, w którym składnik przereagował ilościowo z dodawanym
z biurety odczynnikiem , nazywa się punktem równowagowego nasycenia lub punktem
równowagowym.
W celu uchwycenia punktu równowagowego nasycenia, do roztworu badanego należy
dodać odpowiednie wskaźniki (indykatory), które zmianą barwy sygnalizują osiągnięcie punktu
końcowego miareczkowania. Punkt końcowy miareczkowania powinien pokryć się z punktem

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
8
równowagowym. Rozbieżność między tymi punktami nazywa się błędem miareczkowania.
Dobierając najlepsze wskaźniki błąd można zmniejszyć. Aby uniknąć błędów w oznaczeniach
ilościowych metodą miareczkowania należy spełnić trzy warunki:
−
dokładnie odmierzać objętości roztworów,
−
znać dokładnie stężenie roztworu mianowanego,
−
precyzyjnie uchwycić końcowy punkt miareczkowania możliwie zbieżnego z punktem
równowagowego nasycenia.
Naczynia miarowe
Podstawowymi naczyniami miarowymi w analizie miareczkowej są kolby miarowe, pipety
i biurety.
Kolby miarowe to płaskodenne naczynia o kształcie gruszkowatym z wąską długą szyjką.
Pojemność kolby w temperaturze 20°C jest zaznaczona kreską na obwodzie mniej więcej
pośrodku szyjki. Na kolbie miarowej są wytrawione liczby wskazujące pojemność naczynia
oraz temperaturę kalibrowania. Pojemności kolb miarowych wynoszą: 5, 10, 50, 100, 200,
250, 500 dm
3
oraz 1,2, i 5 dm
3
. Zamykane są doszlifowanymi korkami.
Pipety to naczynia miarowe w kształcie rurek rozszerzonych w środku ze zwężonym
i wyciągniętym dolnym końcem. Pojemność pipety jest zaznaczona kreską na obwodzie górnej,
wąskiej części. Pipety mają pojemności: 1, 2, 5, 10, 20, 25, 50, i 100dm
3
.
Biurety służą do dozowania roztworów mianowanych podczas miareczkowania. Biurety
to rurki o jednakowym przekroju, zwężone u dołu i zakończone doszlifowanym kurkiem
szklanym. Kurki smaruje się cienką warstwą wazeliny lub smarem. Najczęściej stosowane
biurety mają pojemność 50 dm
3
z podziałkami co 0,1 dm
3
. Rzadziej stosowane są biurety
o pojemności 25, 75 i 100dm
3
. Występują również mikro i półmikro biurety o pojemności
1÷10 cm
3
, wyskalowane podziałkami co 0,01cm
3
. Przy dokonywaniu odczytów na biurecie
ważne jest, by oczy obserwatora znajdowały się na poziomie menisku cieczy, ponieważ można
wówczas uniknąć błędów spowodowanych paralaksą (rys.3.). Stosując na biuretę nasadkę z
białej tektury, na którą nakleja się pasek z czarnego papieru można zwiększyć precyzję
odczytów.
Biureta przed użyciem powinna być umyta chromianką, potem kilkakrotnie wypłukana
wodą zwykłą, a na koniec destylowaną. Po napełnieniu biurety należy sprawdzić czy nie
wytworzył się pęcherzyk powietrza w jej dolnej części, który można usunąć prze kilkakrotne
otwarcie i zamknięcie kurka. Każde miareczkowanie należy rozpocząć od podziałki zerowej.
Ciecz z biurety musi spływać wolno (3÷5 kropli na sekundę). Powinno się znać w przybliżeniu
objętość jednej kropli, by móc dokonywać korekty odczytu w przypadku przemiareczkowania.
Objętość jednej kropli można ustalić przez podzielenie objętości cieczy odpowiadającej np. 20
kroplom przez ich liczbę. Na pojedyncze miareczkowanie powinna wystarczyć pojemność
biurety. Błąd miareczkowania wynosi wówczas do około 0,1%. Biurety przed użyciem należy
przepłukiwać roztworem używanym do miareczkowania.
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
9
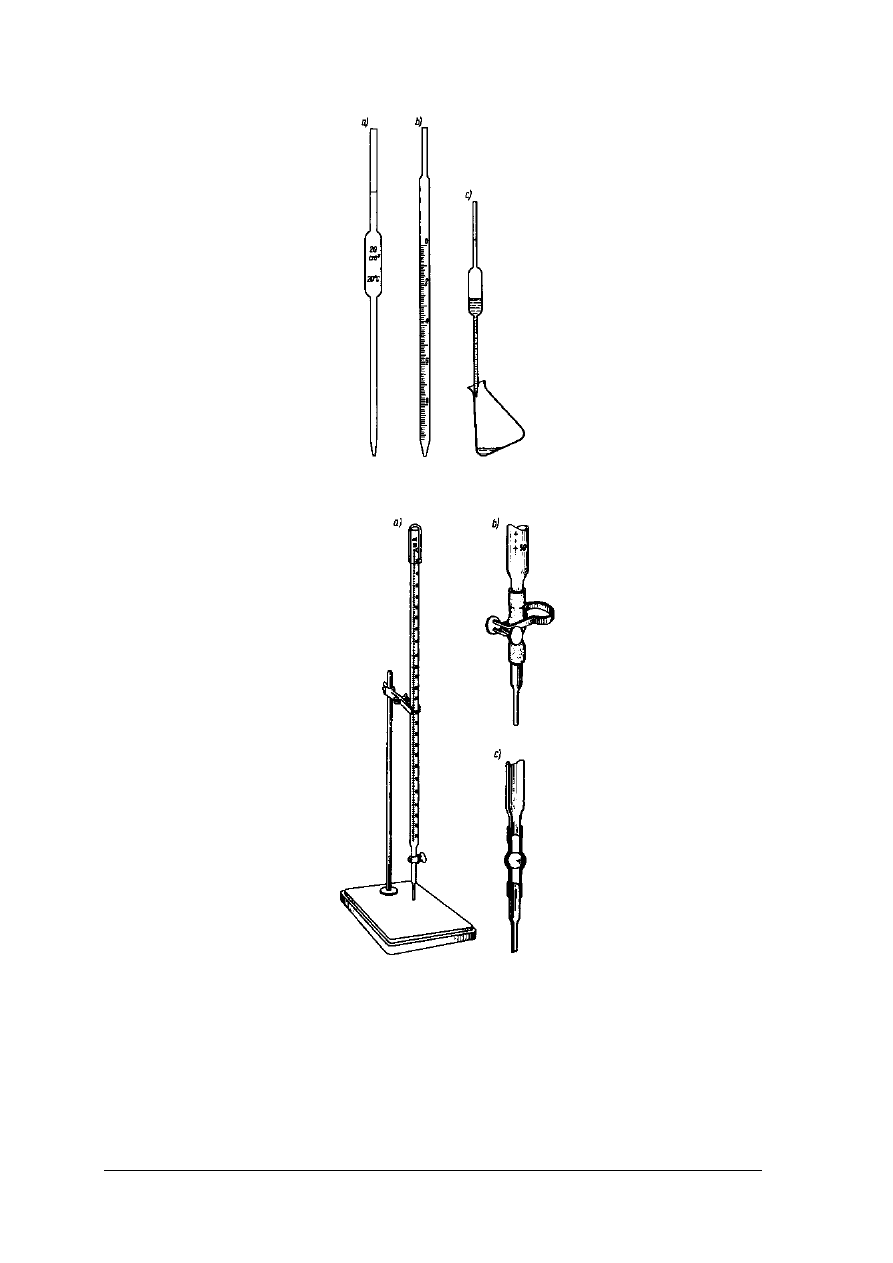
Rys.1. Pipety: a) jednomiarowa, b) wielomiarowa, c) opróżnianie pipety [ 2, s.89]
Rys. 2. Biurety: a) z kurkiem szklanym, b) ze ściskaczem Mohra, c) z perełką szklaną [2, s.89]
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
10
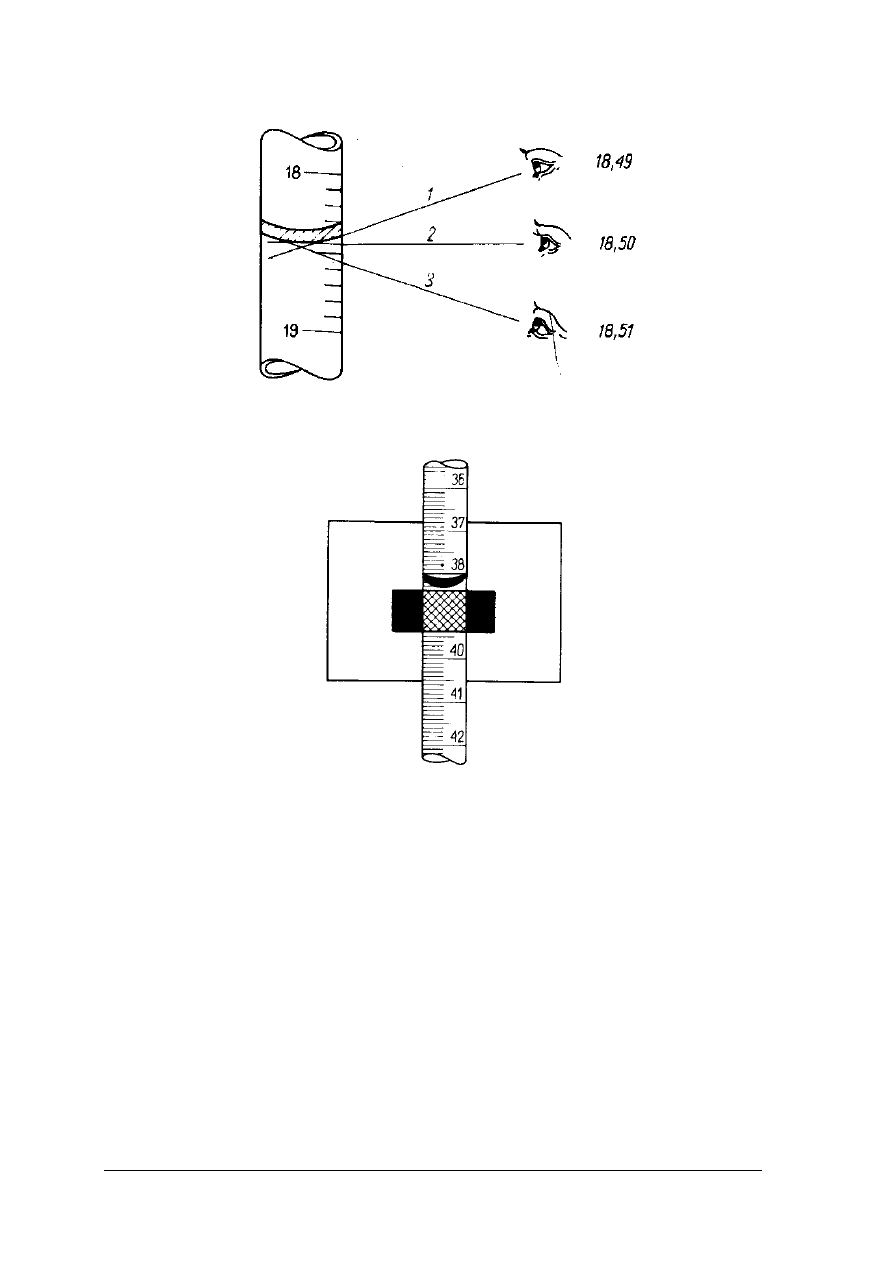
Rys. 3. Zjawisko paralaksy [2. s. 91]
Rys. 4. Nasadka na biurecie zwiększająca precyzję odczytów [2, s. 91]
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
11
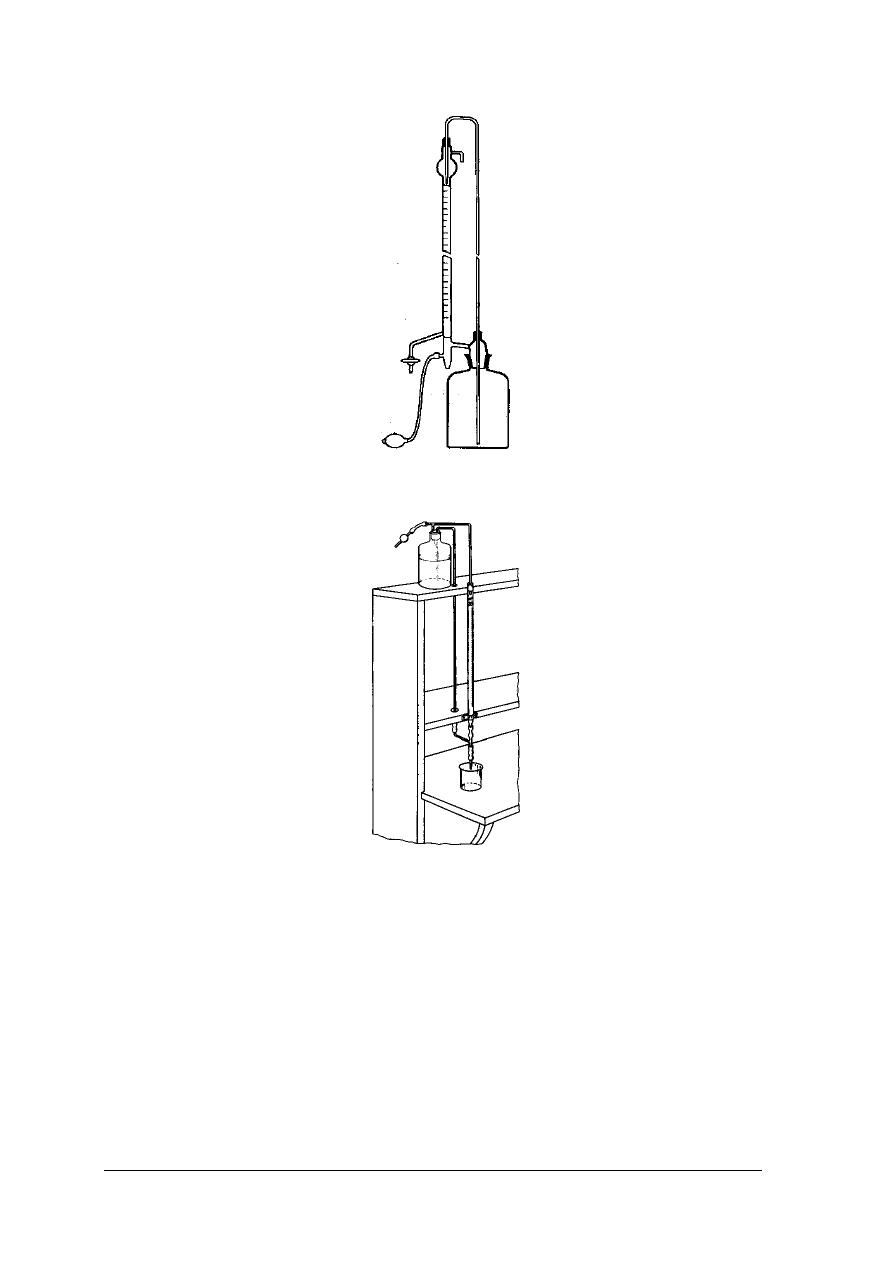
Rys. 5. Biureta podłączona do butli z roztworem [2, s. 94]
Rys. 6. Biureta automatyczna [2, s. 94]
Kolby miarowe to naczynia szklane, kuliste lub gruszkowate, płaskodenne z długą, wąską
szyjką. W połowie szyjki znajduje się wyżłobiona kreska wskazująca określoną pojemność
kolby kalibrowanej. Kolby miarowe służą do sporządzania roztworów. Przy dokonywaniu
rozcieńczeń nie uzupełnia się od razu objętości kolby do kreski umożliwiając w ten sposób
dokładne wyrównanie stężenia roztworu (odwracanie kolby do góry dnem). Kolby skalowane
są w temperaturze 20°C.
Naczynia miarowe używane w analizie chemicznej powinny być tak umyte, aby podczas
opróżniania naczynia ciecz spływała równomiernie, nie pozostawiając kropelek. Środki
używane do mycia zależą od rodzaju zabrudzenia. Zanieczyszczone zasadami myje się kwasem
solnym. Zanieczyszczenia o charakterze kwaśnym usuwają roztwory wodorotlenków metali
alkalicznych lub amoniaku. Zanieczyszczenia dwutlenkiem manganu usuwa kwas solny.
Naczyń miarowych nie należy myć gorącą wodą.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
12
Sprawdzanie pojemności naczyń miarowych
Sprawdzanie pojemności naczyń miarowych polega na napełnieniu wykalibrowanego
naczynia wodą do oznaczonego poziomu, waży i na tej podstawie ustala rzeczywistą
pojemność, którą porównuje się z deklarowaną przez obliczenie wielkości błędu.
Dopuszczalne wielkości błędów kalibrowania naczyń miarowych wynoszą: dla pipet i biuret
temperaturze pojemności 10 cm
3
, 25 cm
3
, i 50 cm
3
wynoszą odpowiednio: 0,2 i 0,1%., dla
kolb miarowych o pojemności 100 cm
3
, 200 cm
3
, 500 cm
3
i 1000 cm
3
błędy nie mogą
przekraczać 0,08%, 0,05%, 0,03%.
Pipety
W celu sprawdzenia pojemności pipety należy określić masę wody destylowanej
o temperaturze określonej z dokładnością do 0,5ºC po opróżnieniu pipety i porównuje z masą
teoretyczną wody odczytaną z tabeli (tabele można znaleźć np. w podręczniku „Analiza
techniczna w przemyśle spożywczym” B. Drzazgi). Wodę z pipety należy wylać do
wyważonego uprzednio naczyńka wagowego i po jego zamknięciu zważyć na wadze
analitycznej z dokładnością do 0,1mg. Pomiaru należy dokonać w trzech równoległych
powtórzeniach, a do obliczeń wziąć ich średnią. Wyniki pomiaru nie powinny różnić się między
sobą więcej niż o 0,01g.
Kolby miarowe
Sprawdzanie pojemności polega na oznaczeniu masy wody o określonej temperaturze
wypełniającej kolbę do kreski. Ważenie prowadzić należy na wagach technicznych. Ważenie
najlepiej prowadzić metodą podstawiania. Na prawą szalkę wagi należy postawić kolbę, której
pojemność chcemy sprawdzić, a na lewą drugą kolbę o tej samej pojemności i doprowadzić do
stanu równowagi przez dodanie perełek szklanych lub śrutu. Następnie obok kolby na prawej
szalce położyć odpowiedni odważnik o masie równej nominalnej pojemności kolb, po czym do
kolby na lewej szalce wlać pipetą wodę do momentu ponownego zrównoważenia wagi.
Z kolei należy zdjąć odważnik z prawej szalki, a kolbę znajdującą się na tej szalce dopełnić do
kreski wodą destylowaną o temperaturze pomieszczenia, w którym jest prowadzony pomiar
i postawić na szalce. Po odaretowaniu wagi należy położyć odpowiedni odważnik na prawej
szalce wagi do chwili uzyskania stanu równowagi, przy czym masa tych odważników
w przypadku nakładania na prawą szalkę, po odjęciu od masy odważnika o wartości
nominalnej kolby, daje masę wody, natomiast przy ich kładzeniu na lewą szalkę wagi, po
dodaniu do masy odważnika , odpowiada masie wody, która wypełnia do kreski sprawdzaną
kolbę miarową. Na podstawie wyniku pomiaru i jego porównania z teoretyczną masą wody
można obliczyć faktyczną pojemność kolby oraz poprawkę, jaką ewentualnie należy
uwzględniać.
Biurety
Biurety należy napełnić wodą destylowaną o temperaturze pomieszczenia, w którym
wykonuje się pomiar, usunąć ewentualny pęcherzyk powietrza i ustawić menisk cieczy na
podziałce zerowej. Wiszącą kroplę wody na końcówce biurety usunąć przez dotknięcie do
ścianki jakiegoś naczynia. Do przygotowanego wcześniej wytarowanego naczyńka wagowego
należy wlać 10cm
3
wody z prędkością wypływu 3÷5 kropli na sekundę, przy łącznym
wypływie ok. 1 min. Po tym czasie i odczekaniu jeszcze 30 sekund należy dokonać odczytu na
skali biurety z dokładnością do 0,01cm
3
, a wiszącą kroplę wprowadza się do naczyńka przez
dotknięcie końcówką do jego wewnętrznej ścianki. Naczyńko należy zamknąć przykrywką
i zważyć na wadze analitycznej z dokładnością do 0,005g. Rzeczywistą pojemność biurety
należy obliczyć na podstawie przynajmniej dwóch wyników ważenia mogących różnić się
między sobą nie więcej niż o 0,01cm
3.
. ( Przykłady wykonania obliczeń możesz znaleźć
w podręczniku B. Drzazgi „ Analiza techniczna w przemyśle spożywczym).

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
13
Przygotowywanie roztworów mianowanych
Najłatwiej przygotować roztwory mianowane z substancji absolutnie czystych lub prawie
czystych np. dwuchromian potasu (K
2
Cr
2
O
7
)
,
azotan srebra AgNO
3
, chlorek sodu NaCl, jod,
kwas szczawiowy. W praktyce takich substancji jest niewiele. Należy więc sporządzać
roztwory o stężeniach w przybliżeniu równych molowości żądanej i dokładnie je określić
w procesie miareczkowania roztworu wzorcowego substancji podstawowej lub też innego
roztworu mianowanego. Substancje podstawowe muszą spełniać pewne warunki:
−
muszą mieć ściśle określony skład jakościowy i ilościowy ujęty odpowiednim wzorem
chemicznym,
−
reakcje tych substancji z roztworami mianowanymi muszą przebiegać stechiometrycznie,
−
najlepsze są substancje nie zawierające wody krystalizacyjnej,
−
zawartość zanieczyszczeń nie może przekraczać 0,01%,
−
substancje podstawowe nie mogą być higroskopijne, muszą być dobrze rozpuszczalne
w wodzie,
−
powinny posiadać wysokie masy molowe, ponieważ większa jest wówczas dokładność
ważenia.
Mianowanie roztworów prowadzi się na oddzielnych naważkach substancji podstawowej
w procesie miareczkowania, po ich uprzednim rozpuszczeniu w wodzie destylowanej. Należy
wykonać trzy pomiary i jako wynik przyjmuje się średnią arytmetyczną. Dokładność oznaczeń
miareczkowych zależy od objętości roztworu mianowanego, zużytego w czasie
miareczkowania. Należy dążyć, aby zużycie roztworu nie było mniejsze niż 20cm
3
. Proces ten
reguluje się doborem odpowiedniej ilości substancji w roztworze miareczkowanym. Podczas
mianowania roztworów należy zachowywać zawsze takie same warunki jak w czasie oznaczeń
wykonywanych późniejszym roztworem. Roztwór po składowaniu należy zawsze dobrze
wymieszać. Roztwory przechowywane muszą być w odpowiednich warunkach dotyczących
temperatury i naświetlenia.
Roztwory jodu, azotanu srebra, nadmanganianu potasu, tiosiarczanu sodu przechowuje
się zawsze w ciemnych butelkach.
Stężenia roztworów
W analizie objętościowej posługujemy się odczynnikami chemicznymi rozpuszczonymi lub
rozcieńczonymi w odpowiednim rozpuszczalniku. Roztwory mogą być nasycone, nienasycone
i przesycone.
Rozpuszczalność to ilość substancji wyrażona w gramach, która w danej temperaturze
może maksymalnie rozpuścić się w 100g wody. W laboratoriach analitycznych stężenia
roztworów określa się jako stężone i rozcieńczone. Stężenia roztworów wyrażone są
w procentach masowych wskazujących ilość substancji w gramach, która jest zawarta w 100g
roztworu.
W procentach objętościowych wyraża się niektóre ciekłe odczynniki chemiczne. Wskazują
one ile cm
3
substancji jest zawarte w 100cm
3
roztworu.
Procenty mieszane wskazują gramy substancji rozpuszczonej zawarte w 100cm
3
roztworu.
Przy obliczeniach dotyczących mieszania roztworów w określonym stosunku w celu
otrzymania roztworu o odpowiednim stężeniu można mieć większe kłopoty .Często należy
uwzględniać gęstości roztworów. Zależności między gęstością i stężeniami najczęściej
stosowanych w pracach analitycznych kwasów: solnego i siarkowego przedstawia tabela 1i 2

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
14
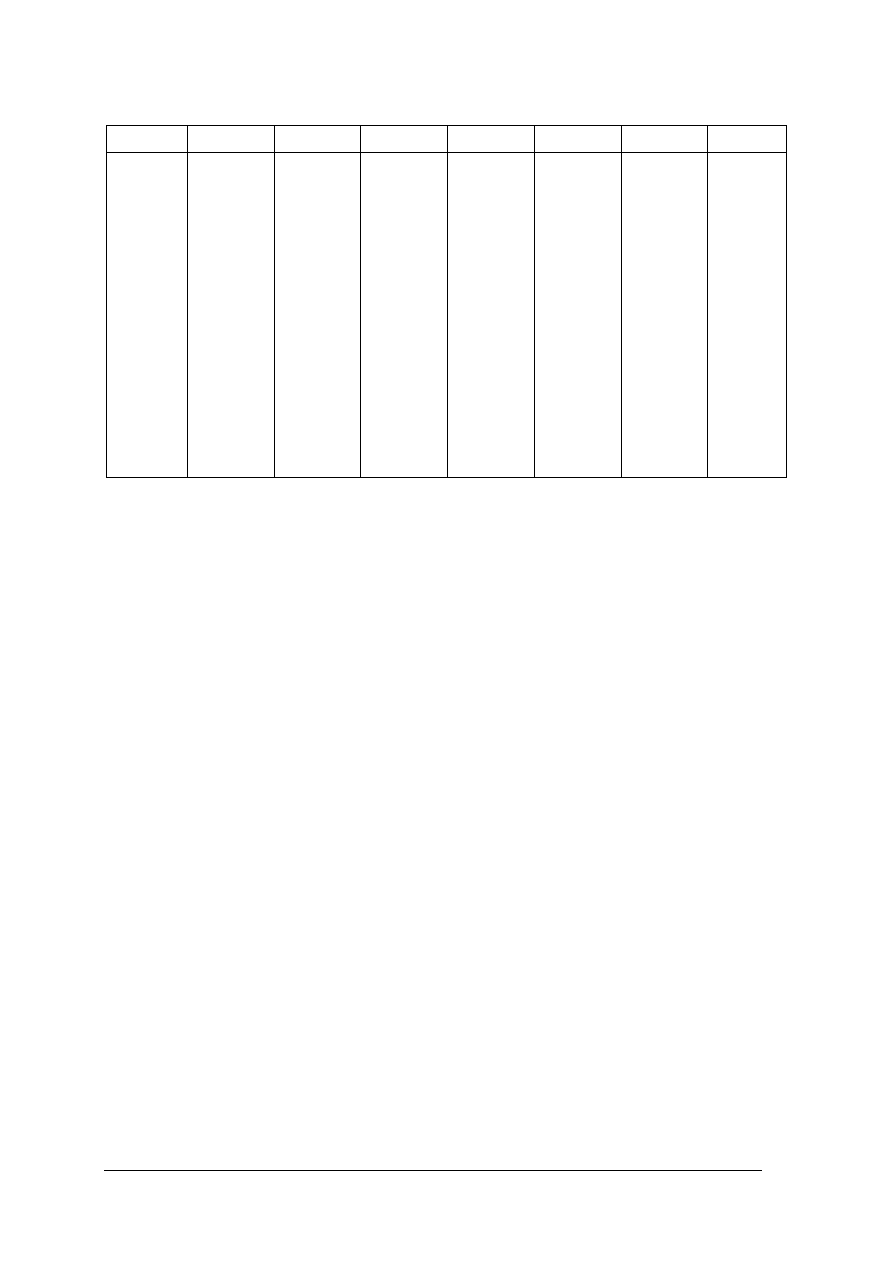
Tabela1 (2, s. 109). Stężenia (w %) przy różnych gęstościach roztworów wodnych (wg/cm
3
)
15
4
d
HCl
%
15
4
d
HCl
%
15
4
d
HCl
%
15
4
d
HCl
%
15
4
d
HCl
%
1,100
1,105
1,110
1,115
20,01
20,97
21,92
22,86
1,120
1,125
1,130
1,135
23,82
24,78
25,75
26,70
1,140
1,145
1,150
1,155
27,66
28,61
29,57
30,55
1,160
1,165
1,170
1,175
31,52
32,49
33,46
34,42
1,180
1,185
1,190
1,200
35,38
36,31
37,23
39,11

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
15
Tabela 2 (2, s. 110) Stężenia H
2
SO
4
(w %) przy różnych gęstościach roztworów wodnych (w g/cm
3
)
15
4
d
H
2
SO
4
%
15
4
d
H
2
SO
4
%
15
4
d
H
2
SO
4
%
15
4
d
H
2
SO
4
%
1,000
1,005
1,010
1,015
1,020
1,025
1,030
1,035
1,040
1,045
1,050
1,055
1,060
1,065
1,070
1,075
1,080
1,085
1,090
1,095
1,100
1,105
1,110
1,115
1,120
1,125
1,130
1,135
1,140
1,145
1,600
1,605
1,610
1,615
1,620
1,625
1,630
1,635
1,640
1,645
1,650
1,655
1,660
1,665
1,670
1,675
1,680
1,685
1,690
0,09
0,95
1,57
2,30
3,03
3,76
4,49
5,23
5,96
6,67
7,37
8,07
8,77
9,48
10,19
10,90
11,60
12,30
12,99
13,67
14,35
15,03
15,71
16,36
17,01
17,66
18,31
18,96
19,61
20,26
68,70
69,13
69,56
70,00
70,42
70,85
71,27
71,70
72,12
72,55
72,96
73,40
73,81
74,24
74,66
75,08
75,50
75,94
76,38
1,150
1,155
1,160
1,165
1,170
1,175
1,180
1,185
1,190
1,195
1,200
1,205
1,210
1,215
1,220
1,225
1,230
1,235
1,240
1,245
1,250
1,255
1,260
1,265
1,270
1,275
1,280
1,285
1,290
1,295
1,695
1,700
1,705
1,710
1,715
1,720
1,725
1,730
1,735
1,740
1,745
1,750
1,755
1,760
1,765
1,770
1,775
1,780
1,785
20,91
21,55
22,19
22,83
23,47
24,12
24,76
25,40
26,04
26,68
27,32
27,95
28,57
29,21
29,84
30,48
31,11
31,70
32,28
32,86
33,43
34,00
34,57
35,14
35,71
36,29
36,87
37,45
38,03
38,61
76,76
77,17
77,60
78,04
78,48
78,92
79,36
79,80
80,24
80,68
81,12
81,56
82,00
82,44
83,01
83,51
84,02
84,50
85,10
1,300
1,305
1,310
1,315
1,320
1,325
1,330
1,335
1,340
1,345
1,350
1,355
1,360
1,365
1,370
1,375
1,380
1,385
1,390
1,395
1,400
1,405
1,410
1,415
1,420
1,425
1,430
1,435
1,440
1,445
1,790
1,795
1,800
1,805
1,810
1,815
1,820
1,821
1,822
1,823
1,824
1,825
1,826
1,827
1,828
1,829
1,830
1,831
1,832
39,19
39,77
40,35
40,99
41,50
42,08
42,66
43,20
43,74
44,28
44,82
45,35
45,88
46,41
46,94
47,47
48,00
48,53
49,06
49,59
50,11
50,63
51,15
51,66
52,15
52,63
53,11
53,59
54,07
54,55
85,70
86,30
86,92
87,60
88,30
89,16
90,05
90,20
90,40
90,60
90,80
91,00
91,25
91,50
91,70
91,90
92,10
92,43
92,70
1,450
1,455
1,460
1,465
1,470
1,475
1,480
1,485
1,490
1,495
1,500
1,505
1,510
1,515
1,520
1,525
1,530
1,535
1,540
1,545
1,550
1,555
1,560
1,565
1,570
1,575
1,580
1,585
1,590
1,595
1,833
1,834
1,835
1,836
1,837
1,838
1,839
1,840
1,8405
1,8410
1,8415
1,8410
1,8405
1,8400
1,8395
1,8390
1,8385
1,837
53,03
55,50
55,97
56,43
56,90
57,37
57,83
58,28
58,74
59,22
59,70
60,18
60,65
61,12
61,59
62,06
62,53
63,00
63,43
63,85
64,26
64,67
65,20
65,65
66,09
66,53
66,95
67,40
67,83
68,26
92,97
93,25
93,56
93,80
94,25
94,60
95,00
95,60
95,95
96,38
97,35
98,20
98,52
98,72
98,77
99,12
99,31
100,00
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
16
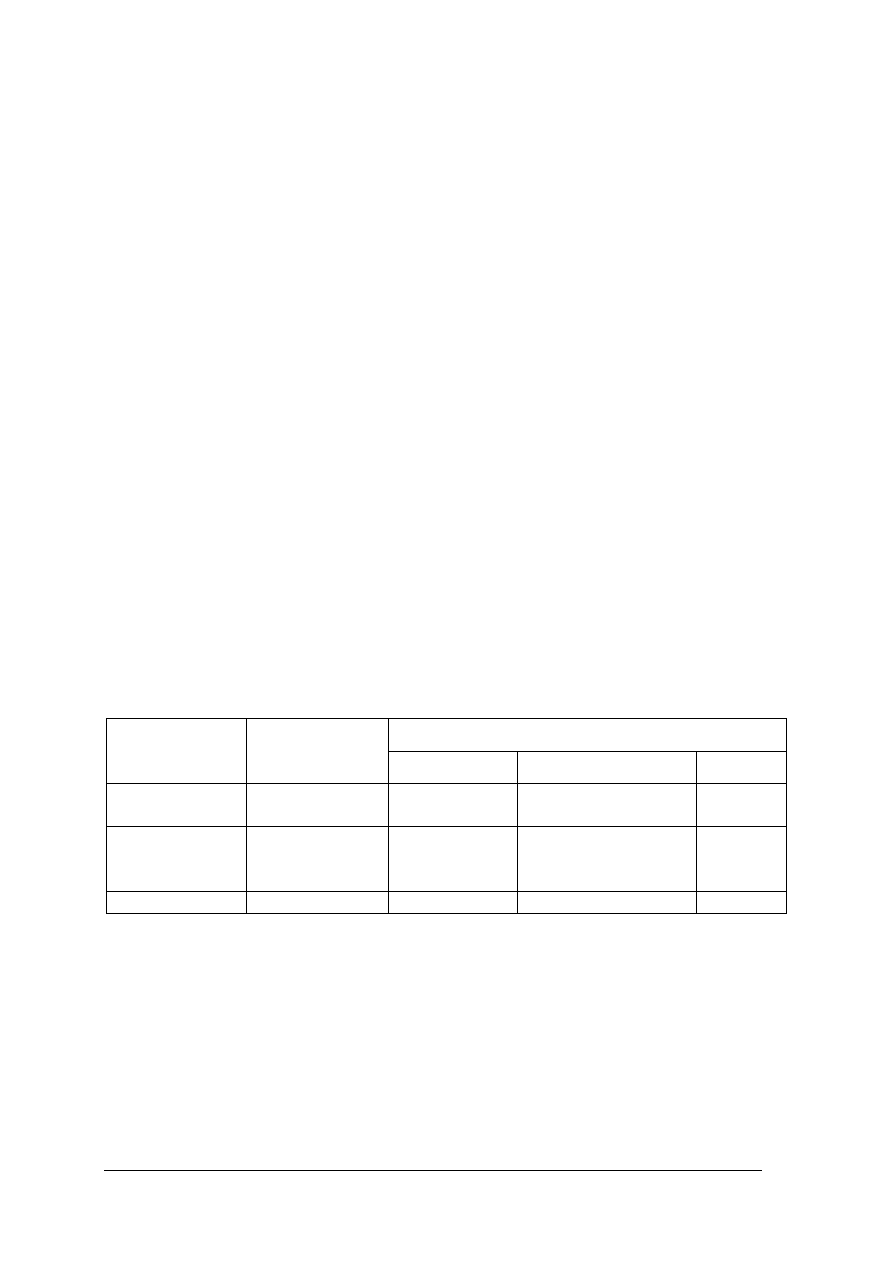
Tabela 3 NaOH (w%) w roztworach wodnych przy różnych gęstościach (wg/cm
3
)
15
4
d
NaOH
15
4
d
NaOH
15
4
d
NaOH
15
4
d
NaOH
1,005
1,010
1,015
1,020
1,025
1,030
1,035
1,040
1,045
1,050
1,055
1,060
1,065
1,070
1,075
1,080
1,085
1,090
0,50
0,96
1,38
1,82
2,27
2,72
3,17
3,61
4,06
4,50
4,95
5,40
5,85
6,30
6,75
7,19
7,64
8,08
1,095
1,100
1,105
1,110
1,115
1,120
1,125
1,130
1,135
1,140
1,145
1,150
1,155
1,160
1,165
1,170
1,175
1,180
8,54
8,99
9,24
9,89
10,34
10,79
11,24
11,69
12,14
12,59
13,04
13,49
13,94
14,39
14,84
15,29
15,74
16,19
1,185
1,190
1,195
1,200
1,205
1,210
1,215
1,220
1,225
1,230
1,235
1,240
1,245
1,250
1,255
1,260
1,265
1,270
16,64
17,09
17,54
17,99
18,44
18,89
19,35
19,80
20,25
20,70
21,14
21,60
22,05
22,50
22,96
23,42
23,87
24,33
1,275
1,280
1,285
1,290
1,295
1,300
1,305
1,310
1,315
1,320
1,325
1,330
1,335
1,340
1,345
1,350
24,79
25,25
25,70
26,15
26,61
27,07
27,53
27,99
28,45
28,92
29,38
29,84
30,31
30,78
31,25
31,72
Wykonanie miareczkowania
Podstawowym przyrządem w analizie miareczkowej jest biureta. Miareczkując odmierza
się za pomocą biurety objętość roztworu mianowanego równoważną oznaczanemu
składnikowi.
Do części badanego roztworu przeniesionego pipetą do kolby stożkowej dodaje się
z biurety mianowany roztwór odczynnika. Roztwór dodawany jest do momentu osiągnięcia
punktu końcowego miareczkowania. Osiągnięcie tego punktu można stwierdzić wizualnie na
podstawie zmiany zabarwienia wskaźnika. Naczyniem, w którym miareczkuje się badany
roztwór jest kolba stożkowa o pojemności 250 lub 500cm
3
. Biureta musi być umocowana na
statywie. Roztwór mianowany należy wlać do czystej biurety kilka centymetrów nad kreską
zerową. Następnie należy ustawić poziom roztworu w biurecie na zerze. Oko patrzącego musi
być ustawione na tym samym poziomie co poziom cieczy, by uniknąć błędu paralaksy (rys. 3)
W przypadku cieczy nieprzezroczystych poziom cieczy w biurecie odczytuje się według
górnej krawędzi menisku.
Po ustaleniu poziomu roztworu odczynnika w biurecie na zerze podstawia się pod biuretę
naczynie z badanym roztworem. Palcami lewej ręki otwiera się kurek biurety, a lewą ręką
trzyma kolbę stożkową mieszając ciecz ruchem wirowym. Roztwór na początku
miareczkowania spuszcza się dość szybko, a w miarę zbliżania do punktu końcowego
miareczkowania coraz wolniej, wreszcie po kropli. Podczas miareczkowania należy
obserwować naczynie z roztworem miareczkowanym, a nie biuretę. Miareczkowanie należy
prowadzić w miejscu dobrze oświetlonym lecz zabezpieczonym przed promieniami
słonecznymi.
Miareczkowanie powtarza się do uzyskania zgodnych wyników tzn. różniących się nie
więcej niż o 0,05-0,15cm
3
.
4.1.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1. Jakie naczynia miarowe są stosowane w oznaczeniach ilościowych metodą miareczkową?
2. Jakie są kryteria podziału metod miareczkowych?

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
17
3. Jakie znasz typy metod miareczkowych?
4. Jakie znaczenie w analizie objętościowej pełni punkt równowagowego nasycenia i punkt
końcowy miareczkowania?
5. Co nazywamy roztworem?
6. Jak umyć naczynia miarowe?
7. Jak wykonać miareczkowanie?
4.1.3. Ćwiczenia
Ćwiczenie 1
Przygotuj naczynia i sprzęt laboratoryjny do zaplanowanych analiz miareczkowych.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) wskazać naczynia miarowe używane w analizie objętościowej,
2) określić pojemność naczyń miarowych,
3) dobrać środki do mycia naczyń miarowych zależnie od ich zanieczyszczenia i umyć je,
4) przygotować zestaw do miareczkowania,
5) określić sposób użytkowania kolb miarowych i pipet,
6) odczytać poziom cieczy w biurecie z barwnym paskiem,
7) zastosować zasady miareczkowania, określać błąd paralaksy.
Wyposażenie stanowiska pracy:
−
naczynia miarowe: kolby miarowe, pipety, biurety, statyw do pipet,
−
zestaw do miareczkowania,
−
środki myjące: detergenty, kwasy i zasady, mieszanina chromowa.
Ćwiczenie 2
Oblicz, ile cm
3
stężonego roztworu NaOH (d
4
15
= 1,340 g/cm
3
)
należy użyć do
sporządzenia 2000cm
3
roztworu mianowanego o stężeniu ok. 0,1 mol/dm
3
.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) odczytać stężenie roztworu NaOH odpowiadające danej gęstości,
2) obliczyć masę absolutnego NaOH, która ma się znajdować w 2000cm
3
roztworu,
3) obliczyć w jakiej masie stężonego roztworu NaOH znajduje się obliczona ilość NaOH
absolutnego,
4) obliczyć
objętość
obliczanej
masy
stężonego
roztworu
NaOH
korzystając
z podstawowego wzoru na gęstość.
Wyposażenie stanowiska pracy:
–
tablice stężeń NaOH w roztworach wodnych przy różnych gęstościach.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
18
Ćwiczenie 3
Sporządź mianowany roztwór NaOH zgodnie z obliczeniami z poprzedniego ćwiczenia.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) pobrać do kolby miarowej o pojemności
2000cm
3
około 3/4 objętości wody destylowanej,
2) dodać 19,5cm
3
stężonego roztworu NaOH, wymieszać, uzupełnić wodą destylowaną do
kreski,
3) ustalić dokładne stężenie roztworu NaOH w procesie miareczkowania mianowanego
roztworu kwasu solnego,
4) nastawić miano roztworu NaOH wykorzystując kwas solny o ściśle określonym stężeniu
molowym. Odmierzyć w tym celu do trzech kolb stożkowych, o pojemności 250cm
3
każda po 25cm
3
mianowanego roztworu HCl, dodać po 2 krople 0,1% oranżu
metylowego jako wskaźnika i miareczkować z biurety roztworem NaOH do chwili
przejścia barwy czerwonej w żółtą (nie cebulastą). Wyniki trzech miareczkowań nie
powinny różnić się między sobą więcej niż o 0,1cm
3
,
5) obliczyć stężenie molowe roztworu NaOH.
Wyposażenie stanowiska pracy:
–
zestaw do miareczkowania,
–
stężony roztwór NaOH,
–
woda destylowana, wskaźnik alkacymetryczny,
–
mianowany roztwór HCl.
4.1.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) zdefiniować pojęcie punktu równowagowego nasycenia?
2) określić kryteria podziału metod miareczkowych ?
3) określić typy metod miareczkowych?
4) rozróżnić naczynia miarowe ?
5) dobrać wskaźniki do metody miareczkowania?
6) dokonać odczytu na biurecie?
7) sprawdzić pojemność naczyń miarowych?
8) przeliczyć stężenia procentowe na molowe i odwrotnie?
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
19
4.2. Metody zobojętniania w analizie miareczkowej
4.2.1. Materiał nauczania
Znaczenie metod alkacymetrycznych
Alkacymetria jest działem analizy ilościowej opierającym się na reakcji zobojętniania.
Alkacymetria obejmuje:
−
alkalimetrię tj. oznaczanie w roztworze zawartości kwasów za pomocą miareczkowania
mianowanym roztworem zasady,
−
acydymetrię, czyli oznaczanie w badanym roztworze zasad za pomocą miareczkowania
mianowanym roztworem kwasu.
Metody alkacymetryczne stosowane są zarówno do oznaczania kwasów i zasad
nieorganicznych jak i organicznych. W praktyce alkacymetrii rozróżnia się trzy typy
miareczkowania:
1. miareczkowanie mocnych kwasów i mocnych zasad,
2. miareczkowanie słabych kwasów i słabych zasad,
3. miareczkowanie mieszanin kwasów (zasad) o różnej mocy.
Wskaźniki alkacymetryczne
Wskaźnikami nazywane są słabe kwasy lub słabe zasady organiczne, które reagując
z wodą tworzą układy sprzężone kwas-zasada. Jeżeli człony układu mają różne zabarwienia są
wskaźnikami dwubarwnymi np. oranż metylowy. Jeżeli jeden z członów układu jest
zabarwiony wskaźniki są jednobarwne np. fenoloftaleina. Najczęściej stosowanymi
wskaźnikami w alkacymetrii są: oranż metylowy, lakmus i fenoloftaleina. Zakresy pH dla tych
wskaźników uwzględnia tabela 1.
Tabela 4 Wskaźniki alkacymetryczne, zakresy pH ich dysocjacji oraz zabarwienia w stanach cząsteczkowym,
częściowej dysocjacji i jonowym
[ 2, s. 117]
Barwa w formie
Wskaźnik
Zakres pH
dysocjacji
cząsteczkowej
dysocjacji
jonowej
oranż metylowy
3,1÷4,4
czerwona
żółtopomarańczowa
przejściowa
żółta
lakmus
5,8÷8,0
czerwona
żółtopomarańczowa
przejściowa
(wody
destylowanej)
niebieska
fenoloftaleina
8,2÷10
bezbarwna
różowa
fiołkowa
Zakresy zmian barwy wskaźników pozwalają ocenić, jakie wskaźniki można stosować
w poszczególnych przypadkach.
4.2.2. Pytania sprawdzające
Odpowiadając na pytania sprawdzisz czy jesteś przygotowany do wykonania ćwiczeń.
1. Jak
przygotowywać
i
mianować
roztwory
odczynników
stosowanych
w alkacymetrii?
2. Na jakich reakcjach opiera się analiza alkacymetryczna?
3. W jaki sposób przedstawić mechanizm działania wskaźników alkacymetrycznych?

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
20
4.2.3. Ćwiczenia
Ćwiczenie 1
Przygotuj 200cm
3
mianowanego roztworu HCl o stężeniu ok. 0,1mol/dm
3
.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) dobrać sprzęt i odczynniki do wykonania ćwiczenia,
2) odczytać stężenie kwasu solnego w % masowych odpowiadające jego gęstości,
3) obliczyć ile cm
3
roztworu kwasu należy użyć do sporządzenia 200cm
3
roztworu o stężeniu
0,1 mol/dm
3
,
4) odmierzyć cylindrem stężony kwas,
5) pobrać ok. 150cm
3
wody destylowanej do kolby miarowej o pojemności 200cm
3
,
6) wlać cylindrem do kolby z wodą destylowaną, obliczoną ilość stężonego kwasu solnego,
7) wymieszać ruchem kołowym zawartość kolby i uzupełnić do kreski wodą destylowaną,
8) zamknąć doszlifowanym korkiem i jeszcze raz dokładnie wymieszać przez odwracanie
kolby do góry dnem,
9) użyć przygotowany roztwór HCl o stężeniu ok. 0,1mol/dm
3
do mianowania w następnym
ćwiczeniu.
Wyposażenie stanowiska pracy:
−
kolba miarowa o pojemności 200dm
3
,
−
cylinder miarowy o pojemności 50dm
3
,
−
kwas solny stężony o określonej gęstości,
−
tablica stężeń HCl (w%) przy różnych gęstościach roztworów wodnych (w g/cm
3
),
−
woda destylowana.
Ćwiczenie 2
Wykonaj mianowanie roztworu HCl o stężeniu ok. 0,1 mol/dm
3
na węglan sodu.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) sprawdzić współmierność kolby i pipety,
2) przygotować mianowany roztwór węglanu sodu,
3) wypłukać biuretę niewielką ilością mianowanego roztworu HCl oraz napełnić ją tym
roztworem,
4) popłukać pipetę o pojemności 25cm
3
roztworem przygotowanego węglanu sodu,
5) odmierzyć po 25cm
3
węglanu sodu do trzech kolb stożkowych i dodać po 2 krople oranżu
metylowego jako wskaźnika,
6) miareczkować próbki,
7) zapisać wyniki miareczkowania,
8) obliczyć średnią arytmetyczną, na podstawie której obliczyć szukane stężenie molowe
roztworu HCl.
Wyposażenie stanowiska pracy:
–
pipeta jednomiarowa o pojemności 25cm
3
,
–
biureta o pojemności 50cm
3
,

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
21
–
kolby stożkowe o pojemności 200cm
3
- 3 sztuki,
–
kolba miarowa o pojemności 100cm
3
,
–
lejek szklany,
–
naczyńko wagowe,
–
waga techniczna, komplet odważników,
–
kwas solny, roztwór o stężeniu ok. 0,1 mol/dm
3
(z poprzedniego ćwiczenia),
–
węglan sodu, wyprażony przez godzinę w temperaturze 270÷300°C,
–
oranż metylowy, roztwór wodny 0,1%.
Ćwiczenie 3
Przygotuj 200cm
3
roztworu NaOH o stężeniu około 0,1 mol/dm
3
.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś
1) odczytać z tablic gęstości zawartość NaOH w roztworze stężonym w procentach
masowych odpowiadające jego gęstości,
2) obliczyć, ile cm
3
roztworu należy użyć do sporządzenia 200cm
3
roztworu rozcieńczonego
o stężeniu ok. 0,1 mol/dm
3
,
3) pobrać do kolby miarowej o pojemności 200cm
3
około 150cm
3
wody destylowanej,
4) wlać do kolby miarowej obliczoną ilość stężonego roztworu NaOH,
5) wymieszać zawartość kolby i i uzupełnić do kreski wodą destylowaną i po zamknięciu
wymieszać przez odwracanie do góry dnem,
6) użyć przygotowany roztwór do mianowania w następnym ćwiczeniu.
Wyposażenie stanowiska pracy:
–
cylinder miarowy o pojemności 50cm
3
-,
–
kolba miarowa o pojemności 200cm
3
,
–
wodorotlenek sodu, roztwór stężony o określonej gęstości,
–
woda destylowana, wolna od CO
2
Ćwiczenie 4
Wykonaj mianowanie roztworu NaOH o stężeniu ok. 0,1 mol/dm
3
na kwas solny.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) przygotować biuretę,
2) odmierzyć do trzech kolb stożkowych po 25cm
3
mianowanego roztworu HCl,
3) dolać do odmierzonych próbek kwasu solnego po 2 krople oranżu metylowego,
4) miareczkować roztworem NaOH do chwili przejścia barwy czerwonej w cebulastą,
5) zapisać wyniki poszczególnych miareczkowań,
6) obliczyć średnią arytmetyczną,
7) obliczyć szukane stężenie molowe roztworu NaOH.
Wyposażenie stanowiska pracy:
–
pipeta jednomiarowa, o pojemności 25cm
3
,
–
biureta o pojemności 50cm
3
, z wężykiem gumowym i ściskaczem Mohra lub perełką
szklaną,

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
22
–
kolby stożkowe o pojemności 250cm
3
– 3 sztuki,
–
wodorotlenek sodu, roztwór o stężeniu ok. 0,1 mol/dm
3
(przygotowany jak w ćwiczeniu
3),
–
kwas solny, roztwór o stężeniu ok. 0,1 mol/dm
3
(przygotowany jak w ćwiczeniu 1 i 2),
–
oranż metylowy, roztwór wodny 0,1 %.
4.2.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) zdefiniować pojęcie alkacymetrii?
2) zdefiniować pojęcie wskaźnika alkacymetrycznego i określić mechanizm
jego działania ?
3) wykorzystać wyniki miareczkowań do obliczenia stężenia roztworu?
4) sporządzić roztwory o żądanym stężeniu?

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
23
4.3. Metody strąceniowe w analizie miareczkowej
4.3. 1. Materiał nauczania
W argentometrii stosowane są mianowane roztwory azotanu srebra. Podstawą
argentometrycznych metod oznaczania jest powstawanie podczas miareczkowania trudno
rozpuszczalnych związków srebra, np. AgCl, AgJ, AgSCN. W praktyce oznaczane są
najczęściej jony chlorkowe. Roztwór zawierający chlorki miareczkuje się mianowanym
roztworem azotanu srebra. Zgodnie z metodą Mohra obecności 5-procentowego roztworu
chromianu potasu (K
2
CrO
4)
jako wskaźnika. Po wytrąceniu chlorków w postaci trudno
rozpuszczalnego w wodzie chlorku srebra, nadmiar AgCl reaguje z K
2
CrO
4
. W wyniku tej
reakcji powstaje chromian srebra (Ag
2
CrO
4
) o zabarwieniu czerwonobrunatnym wskazującym
końcowy punkt miareczkowania.
2AgNO
3
+ K
2
CrO
4
→
Ag
2
CrO
4
+ 2 KNO
3
Metoda Volharda polega na miareczkowaniu odwrotnym w stosunku do metody Mohra.
Badaną próbkę należy zakwasić kwasem azotowym i zadać roztworem AgNO
3
w nadmiarze
w stosunku do spodziewanej zawartości chlorków. W wyniku tej reakcji wytrącają się chlorki
pod postacią AgCl. Nadmiar azotanu srebra miareczkuje się mianowanym roztworem rodanku
amonu (NH
4
SCN) w obecności soli żelazowej jako wskaźnika do chwili uzyskania
czerwonego zabarwienia.
4.3.2. Pytania sprawdzające
Odpowiadając na pytania sprawdzisz czy jesteś przygotowany do wykonania ćwiczeń.
1. Jakie metody stosowane są do oznaczania ilościowego w argentometrii?
2. Jakie odczynniki i wskaźniki zastosujesz w oznaczeniach argentometrycznych?
3. Czym różnią się metody: Mohra i Volharda?
4. Jak przeliczać stężenia molowe na procentowe i odwrotnie?
4.3.3. Ćwiczenia
Ćwiczenie 1
Przygotuj 200cm
3
roztworu azotanu srebra o stężeniu ok. 0,1 mol/dm
3
.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) odważyć na wadze technicznej 3,4 krystalicznego AgNO
3,
2) przenieść odważkę do kolby miarowej o pojemności 200cm
3
popłukując naczyńko
kilkakrotnie wodą destylowaną,
3) uzupełnić zawartość kolby wodą destylowaną do około połowy objętości i wymieszać
ruchem kołowym do chwili rozpuszczenia kryształów AgNO
3,
4) uzupełnić zawartość kolby wodą destylowaną do kreski i po zamknięciu wymieszać
odwracając kolbę do góry dnem,
5) przelać roztwór do butelki z ciemnego szkła,

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
24
6) użyć przygotowany roztwór o stężeniu około 0,1 mol/dm
3
do mianowania w następnym
ćwiczeniu.
Wyposażenie stanowiska pracy:
–
kolba miarowa o pojemności 200cm
3
,
–
lejek szklany,
–
bagietka szklana,
–
butelka o pojemności 250cm
3
z ciemnego szkła z doszlifowanym korkiem,
–
naczyńko wagowe,
–
waga techniczna, komplet odważników,
–
azotan srebra krystaliczny,
–
woda destylowana.
Ćwiczenie 2
Wykonaj mianowanie roztworu azotanu srebra (AgNO
3
) o stężeniu ok. 0,1 mol/dm
3
na
roztwór NaCl.
Sposób wykonania ćwiczenia:
Aby wykonać ćwiczenie powinieneś:
1) napełnić biuretę badanym roztworem AgNO
3
, wcześniej przepłukując ją niewielką ilością
tego roztworu,
2) usunąć z biurety pęcherzyki powietrza,
3) odmierzyć do trzech kolb stożkowych po 25cm
3
mianowanego roztworu NaCl, dodać po
0,5 cm
3
5-procentowego roztworu K
2
CrO
4
jako wskaźnika,
4) miareczkować
intensywnie
mieszając
roztworem
z
biurety
do
uzyskania
czerwonobrunatnego zabarwienia, utrzymującego się ci najmniej 15s.
5) zapisać wyniki poszczególnych miareczkowań,
6) przeprowadzić próbę w celu ustalenia poprawki na przesunięcie końcowego punktu
miareczkowania w stosunku do punktu nasycenia,
7) odmierzyć 50 cm
3
wody destylowanej do kolby stożkowej o pojemności 250cm
3
,
8) dodać 0,5 cm
3
5-procentowego roztworu K
2
CrO
4
i miareczkować z biurety roztworem
AgNO
3
do uzyskania czerwonobrunatnego zabarwienia,
9) pomniejszyć wyniki poszczególnych miareczkowań o poprawkę,
10) obliczyć stężenie molowe roztworu AgNO
3
przyjmując wartość średniej arytmetycznej
skorygowanych wyników poszczególnych miareczkowań.
Wyposażenie stanowiska pracy:
–
kolba miarowa o pojemności 100cm
3
,
–
pipeta jednomiarowa o pojemności 25cm
3
i 1cm
3
,
–
biureta o pojemności 250cm
3
,
–
kolby stożkowe – 4 sztuki,
–
chlorek sodu,
–
azotan srebra, roztwór o stężeniu ok. 0,1 mol/dm
3
, przygotowany jak w poprzednim
ćwiczeniu,
–
wskaźnik 5-procentowy roztwór wodny K
2
CrO
4
.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
25
4.3.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) zdefiniować pojęcie analizy argentometrycznej?
2) scharakteryzować metody: Mohra i Volharda wykorzystywane
w oznaczeniach argentometrycznych ?
3) przygotować odczynniki do oznaczeń argentometrycznych?
4) dobrać naczynia miarowe do wykonania oznaczeń?
5) dobrać wskaźniki do metody miareczkowania?
6) dokonać odczytu na biurecie?
7) wykonać obliczenia związane z oznaczeniem stężenia molowego
roztworu AgNO
3
?

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
26
4.4. Metody redoksymetryczne w analizie miareczkowej
4.4.1 Materiał nauczania
Metody redoksymetryczne obejmują metody oksydymetryczne i reduktometryczne.
W metodach oksydymetrycznych miareczkuje się odczynnikiem o właściwościach utleniających
i służą one do bezpośredniego oznaczania substancji o charakterze redukującym. Metody
reduktometryczne to takie, w których miareczkuje się odczynnikiem redukującym. Służą one
do oznaczania substancji o właściwościach utleniających. W metodach reduktometrycznych
wyróżniamy:
–
nadmanganiometrię,
–
jodometrię,
–
bromianometrię,
–
chromianometrię,
–
cerometrię,
–
tytanometrię.
W nadmanganianometrii wykorzystywane są mianowane roztwory nadmanganianu potasu
(KMnO
4
) jako utleniacza do oznaczania zawartości niektórych pierwiastków np. żelaza,
miedzi, wapnia, a także związki chemiczne jak kwas szczawiowy i jego sole, które
wykorzystuje się jako reduktory. Nadmanganian posiada bardzo silne właściwości utleniające.
Jego roztwory mają silne zabarwienie, dlatego nie zachodzi potrzeba stosowania specjalnych
wskaźników. Już od jednej kropli miareczkowany roztwór zabarwia się na różowo co
świadczy o końcowym punkcie miareczkowania. Reakcja nadmanganianu potasu
z substancjami o charakterze reduktorów zależna jest od czynu środowiska. W odczynie
mocno kwaśnym KMnO
4
ulega redukcji:
MnO
4
–
+ 8 H
+
+ 5e
–
→
Mn
2+
+ 4 H
2
O
W środowiskach lekko kwaśnym, obojętnym i lekko alkalicznym mangan redukuje się
w mniejszym stopniu mianowicie do manganu czterowartościowego zgodnie z reakcją:
MnO
4
–
+ 2 H
2
O + 3e
–
→
MnO
2
+ 4 OH
–
W środowisku mocno alkalicznym redukcja nadmanganianu jest najsłabsza:
MnO
4
+ e
–
→
MnO
4
2–
Należy o tym pamiętać przy obliczeniach wykonywanych na podstawie reakcji utleniania
i redukcji. W laboratoriach przemysłu spożywczego utlenianie nadmanganianem prowadzi się
wyłącznie w środowiskach mocno kwaśnych.
Przygotowywanie i mianowanie roztworów KMnO
4
Kryształki KMnO
4
zawierają pewne ilości MnO
2
oraz zanieczyszczenia organiczne
występujące w wodzie destylowanej, które powodują dalszą redukcję KMnO
4
do MnO
2
.
Obecność MnO
2
w mianowanych roztworach KMnO
4
jest niepożądana, ponieważ katalizuje
on samorzutny rozkład KMnO
4
. Ponadto może wchodzić w reakcję z substancją podlegającą
utlenieniu, co powoduje błędy oznaczeń. Wpływu tego nie można eliminować w procesie
mianowania roztworu KMnO
4
, ponieważ MnO
2
występuje w formie zawiesiny i podlega
sedymentacji, a zatem w różnych partiach roztworu (górne, dolne) może występować
w zróżnicowanych ilościach.
Dlatego roztwory KMnO
4
przed mianowaniem poddaje się sączeniu przez gęste sączki ze
szkła spiekanego w celu oddzielenia osadu MnO
2
.
Sączenie jest konieczne, ponieważ nie
można otrzymać mianowanego roztworu KMnO
4
przez bezpośrednie rozpuszczenie
odważonej naważki krystalicznych preparatów tej substancji
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
27
Ponieważ rozkład nadmanganianu potasu zachodzi szybciej w środowisku kwaśnym aniżeli
w obojętnym zwłaszcza w podwyższonej temperaturze należy unikać zakwaszania roztworów
KMnO
4
i przechowywać je w hermetycznie zamkniętych butelkach z ciemnego szkła. W celu
przygotowania 1000cm
3
roztworu KMnO
4
o stężeniu ok. 0,1 mol/dm
3
należy odważyć nieco
więcej niż 1/10 część mola tej substancji, rozpuścić w wodzie destylowanej i uzupełnić
objętość w kolbie miarowej do kreski. Po wymieszani roztwór należy przelać do butelki
z ciemnego szkła z doszlifowanym korkiem i przechować przez 10 - 14 dni w celu utlenienia
reduktorów zawartych w roztworze i wydzielenia odpowiedniej ilości MnO
2
towarzyszącego
temu procesowi. Zamiast przechowywania przez kilka dni roztwór można utrzymać w stanie
wrzenia przez godzinę w kolbie płaskodennej pod przykryciem, a potem pozostawić na
kilkanaście godzin np. na noc.
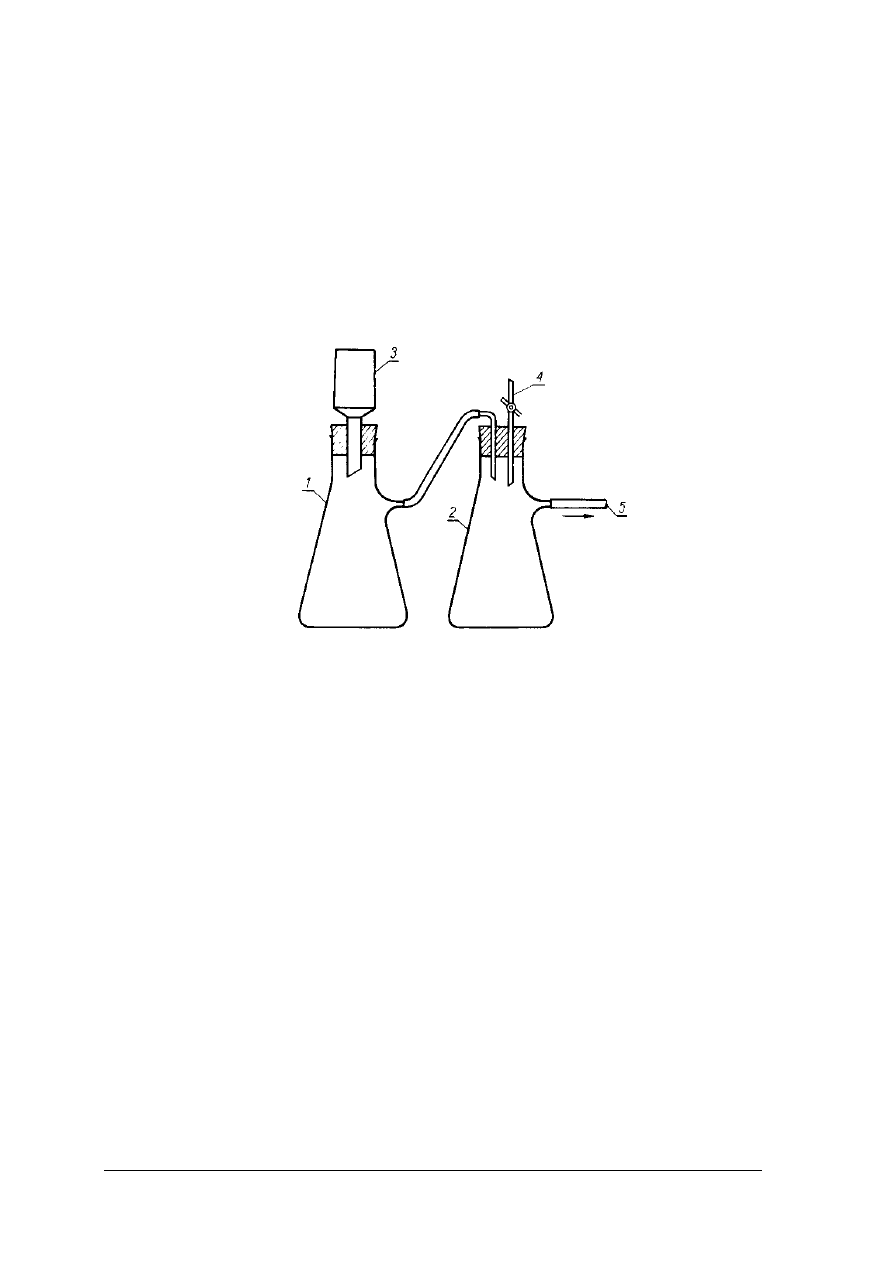
Rys. 7. Zestaw do sączenia pod zredukowanym ciśnieniem 1- kolba ssawkowa na przesącz, 2- kolba ssawkowa
zabezpieczająca, 3- sączek ze szkła spiekanego 3G-4, 4-kurek regulacji i redukcji ciśnienia w kolbach
ssawkowych, 5-połączenie z pompą wodną [2, s. 161]
Przygotowane w ten sposób roztwory KMnO
4
sączy się przez sączki ze szkła spiekanego
(3G-4) do butelek z ciemnego szkła i poddaje mianowaniu w procesie miareczkowania
roztworu substancji podstawowej, najczęściej kwasu szczawiowego lub jego soli sodowej.
Najlepszą substancją podstawową do mianowania roztworów KMnO
4
jest szczawian sodu
N
2
C
2
O
4
, ponieważ jest substancją bezwodną, niehigroskopijną i łatwą do otrzymania w stanie
wysokiej czystości. Przed użyciem krystaliczny szczawian sodu należy suszyć przez godzinę w
temperaturze 105÷110°C. Mianowanie roztworów KMnO
4
na szczawian jak i kwas
szczawiowy oparte jest na reakcjach:
2 MnO
4
+ 5 C
2
O
4
+ 16 H
+
→
2 Mn
2+
+ 10 CO
2
+ 8 H
2
O
2 KMnO
4
+ 5 Na
2
C
2
O
4
+ 8 H
2
SO
4
→
2 MnSO
4
+10 CO
2
+8 H
2
O + K
2
SO
4
+ 5 Na
2
O
4
2 KMnO
4
+ 5 H
2
C
2
O
4
+ 3 H
2
SO
4
→
2 MnSO
4
+10 CO
2
+ 8 H
2
O + K
2
SO
4
Reakcje zachodzą powoli w początkowym okresie miareczkowania. Dopiero gdy nagromadzi
się pewna ilość jonów Mn
2+
, które działają katalitycznie reakcje zachodzą szybciej.
Aby
zapewnić
odpowiednią
szybkość
reakcji miareczkowanie należy prowadzić
temperaturze temperaturze ok. 60°C.Temperatury nie można podwyższać, ponieważ może
dojść do rozkładu KMnO
4
w myśl reakcji:
H
2
C
2
O
4
→
CO
2
+ CO + H
2
O

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
28
Miareczkowane próbki szczawianu sodu lub kwasu szczawiowego zakwasza się kwasem
siarkowym, aby zapewnić środowisko mocno kwaśne. Nie można używać kwasu solnego,
gdyż może doprowadzić do błędnych wyników z powodu zużywania pewnej ilości KMnO
4
na
utlenienie HCl. Dokładnie mianowane roztwory KMnO
4
zachowują stałe stężenie przez wiele
miesięcy.
Jodometria
Jodometria obejmuje oznaczenia, w których jod występuje w następującym układzie
redoksowym:
J
2
+ 2e
–
→
2J
–
Ponieważ układ ten jest odwracalny zatem wśród oznaczeń jodometrycznych można
wyróżnić dwa typy oznaczeń: reduktorów i utleniaczy. Oznaczając reduktory czyli substancje
o słabszym potencjale utleniającym niż układ J
2
→
J
–
roztwory można bezpośrednio
miareczkować mianowanymi roztworami jodu w obecności skrobi jako wskaźnika. Jako
przykład mogą służyć jodometryczne oznaczenia zawartości kwasu siarkowego lub
tiosiarczanu sodu zachodzące według reakcji:
H
2
SO
3
+ J
2
+ H
2
O
→
H
2
SO
4
+ 2HJ
2Na
2
S
2
O
3
+ J
2
→
Na
2
S
4
O
6
+ 2NaJ
Drugi typ oznaczeń jodometrycznych dotyczy utleniaczy czyli substancji o wyższym
potencjale od układu I
2
→
2I
–
. Substancje te wydzielają równoważną sobie ilość jodu z jodku
potasu, a wydzielony wolny jod miareczkuje się mianowanym roztworem tiosiarczanu sodu:
I
2
+ 2Na
2
S
2
O
3
→
2 NaJ + Na
2
S
4
O
6
Wskaźnikiem w oznaczeniach jodometrycznych jest skrobia, która w obecności jodku
potasu tworzy z jodem związek o intensywnym granatowym zabarwieniu. W przypadku
dodawania mianowanych roztworów jodu miareczkowanie kontynuuje się do momentu
powstania granatowego zabarwienia , pochodzącego od nadmiarowej kropli jodu
wchodzącegow reakcję ze skrobią. Przy dodawaniu mianowanego roztworu tiosiarczanu sodu
miareczkowanie kontynuuje się do zaniku granatowego zabarwienia na skutek przejścia całej
ilości wolnego jodu w jodek sodu.
Kompleksometria
Kompleksometria należy do działów analizy objętościowej, której podstawa jest tworzenie
trwałych, rozpuszczalnych w wodzie, ale nie dysocjujących związków kompleksowych. Istotny
rozwój kompleksometrii spowodowało odkrycie kompleksotwórczych właściwości kwasów
aminopolikarboksylowych, których głównym i najczęściej stosowanym przedstawicielem jest
kwas etylenodiamintetraoctowy oznaczany skrótem EDTA. Związek ten zwany jest także
kwasem wersenowym i kompleksonem II. Od nazwy komplekson pochodzi nazwa działu
kompleksometria. Ze względu na słabą rozpuszczalność kwasu wersenowego stosowana jest
jego sól sodowa zwana kompleksonem III lub wersenianem dwusodowym. Kompleksony mają
zdolność
tworzenia
trwałych
związków
kompleksowych
z
kationami
metali
wielowartościowych, dzięki występowaniu w ich cząsteczkach grup karboksylowych oraz
azotu
w
ugrupowaniu
pozwalającym
na
tworzenie
wiązań
typu
chelatowego.
Charakterystyczną cechą połączeń chelatowych metali z kompleksonami jest fakt, że jedna
cząsteczka kompleksonu wiąże zawsze tylko jeden atom metalu, niezależnie od jego
wartościowości. Połączenia te wykazują zróżnicowaną trwałość w środowisku o różnej
kwasowości, dlatego należy w czasie miareczkowania zachować odpowiednie wartości pH
przez dodatek buforów.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
29
Cerometria
Cer IV w środowisku kwaśnym ma silne właściwości utleniające. W cerometrii najczęściej
miareczkuje się mianowanym roztworem siarczanu cerowego.
Roztwory siarczanu cerowego przygotowuje się przez rozpuszczenie w rozcieńczonym
kwasie siarkowym bezwodnego siarczanu cerowego, albo łatwiej rozpuszczalnego siarczanu
cerowo-amonowego. Miano roztworu cerowego, podobnie jak roztworu nadmanganianu
potasu nastawia się na trójtlenek arsenu, szczawian sodowy, czyste żelazo (otrzymane
elektrolitycznie) lub żelazocyjanek potasowy.
4.4.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1. Jaki jest podział metod redoksymetrycznych?
2. Co to są wskaźniki redoksymetryczne.
3. W jakim środowisku prowadzi się reakcje utleniania nadmanganianem potasu?
4. Jak otrzymać mianowany roztwór KMnO
4
?
5. W jaki sposób przygotować naczynia miarowe do użytku?
4.4.3. Ćwiczenia
Ćwiczenie 1
Przygotuj 200cm
3
roztworu KMnO
4
o stężeniu ok. 0,1 mol/dm
3+
.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) zważyć kilka kryształków KMnO
4
o masie ok. 3,2g z dokładnością do 10mg,
2) przenieść naważkę do kolby miarowej o pojemności 200cm
3
, popłukać naczyńko i lejek
wodą destylowaną,
3) napełnić kolbę miarową do połowy objętości, zawartość wymieszać ruchem kołowym do
momentu rozpuszczenia się kryształów KMnO
4
,
4) uzupełnić wodą destylowaną do kreski, jeszcze raz wymieszać,
5) przelać roztwór do butelki z ciemnego szkła, zamknąć doszlifowanym korkiem
i pozostawić na dwa tygodnie,
6) wykorzystać roztwór w następnym ćwiczeniu.
Wyposażenia stanowiska pracy:
–
kolba miarowa o pojemności 200cm
3
,
–
butelka z ciemnego szkła o pojemności 200cm
3
,
–
naczyńko wagowe, łyżeczka porcelanowa,
–
lejek szklany,
–
waga techniczna, komplet odważników,
–
nadmanganian potasu, krystaliczny,
–
woda destylowana.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
30
Ćwiczenie 2
Przygotuj 200cm
3
roztworu Na
2
C
2
O
4
o stężeniu ok. 0,1 mol/dm
3
.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) wytarować naczyńko na wadze technicznej i odważyć ok. 1,35g krystalicznego
szczawianu sodu,
2) zważyć naczyńko z zawartością na wadze analitycznej z dokładnością do 0,1mg,
3) zapisać wynik ważenia,
4) przesypać zawartość naczyńka przez lejek do kolby miarowej o pojemności 200cm
3
,
5) zważyć ponownie naczyńko na wadze analitycznej, otrzymując z różnicy masę naważki
szczawianu sodu przeniesionej do kolby miarowej,
6) lejek szklany popłukać wodą destylowaną,
7) po rozpuszczeniu szczawianu sodu uzupełnić zawartość kolby wodą do kreski, dokładnie
wymieszać,
8) obliczyć stężenie przygotowanego roztworu szczawianu sodu na podstawie masy
naważki.
Wyposażenie stanowiska pracy:
–
kolba miarowa o pojemności 200cm
3
–
lejek szklany,
–
bagietka szklana,
–
waga techniczna z kompletem odważników,
–
waga analityczna,
–
szczawian sodu krystaliczny (wysuszony w ciągu godziny w temperaturze 105÷110°C),
–
woda destylowana.
Ćwiczenie 3
Wykonaj mianowanie roztworu KMnO
4
o stężeniu ok. 0,1 mol/dm
3
na szczawian sodu.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) przesączyć przez sączek ze szkła spiekanego przeznaczony do mianowania roztwór
KMnO
4
,
2) użyć zestaw do sączenia pod zredukowanym ciśnieniem,
3) przelać przesącz do butelki z ciemnego szkła,
4) napełnić biuretę przygotowanym roztworem,
5) odmierzyć 25cm
3
szczawianu sodu do kolby stożkowej o pojemności 250cm
3
,
6) dodać do pobranej próbki cylindrem 25cm
3
roztworu H
2
SO
4
o stężeniu 1 mola/dm
3
w celu zakwaszenia i 50cm
3
wody destylowanej w celu rozcieńczenia,
7) ogrzewać roztwór do temperatury 70÷80°C (pojawienie się mgiełki pary wodnej nad
cieczą),
8) dodawać z biurety (przy ciągłym mieszaniu) kolby stożkowej mianowany roztwór KMnO
4
najpierw kroplami do zniknięcia różowego, potem znacznie szybciej do chwili gdy od
jednej kropli pojawi się różowe zabarwienie i utrzymuje się co najmniej 20 sekund,
9) zapisać wynik miareczkowania,

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
31
10) przeprowadzić jeszcze dwie takie próby, przyjąć do obliczeń średnią arytmetyczną
przynajmniej z dwóch wyników miareczkowań nie różniących się między sobą więcej niż
o 0,2 cm
3
,
11) obliczyć stężenie molowe mianowanego roztworu KMnO
4
wykorzystując równanie
chemiczne:
2 KMnO
4
+ 5 Na
2
C
2
O
4
+ 8 H
2
SO
4
→ 2 MnSO
4
+ 10 CO
2
+ 8 H
2
O + K
2
SO
4
+ 5 Na
2
SO
4
Z równania wynika, że dwa mole KMnO
4
w mocno kwaśnym środowisku reagują z 5
molami Na
2
C
2
O
4
. Pamiętając o odwrotnej zależności objętości roztworu od jego stężenia,
można zapisać:
5
2
4
2
2
4
2
2
4
4
=
⋅
⋅
O
C
Na
O
C
Na
KMnO
KMnO
V
Cm
V
Cm
Po przekształceniu równania otrzymuje się wzór na obliczenie stężenia molowego
mianowanego roztworu KMnO
4
:
5
2
4
4
2
2
4
2
2
4
⋅
⋅
⋅
=
KMnO
O
C
Na
O
C
Na
KMnO
V
V
Cm
Cm
Wyposażenie stanowiska pracy:
–
pipeta jednomiarowa o pojemności 25cm
3
,
–
biureta o pojemności 50cm
3
,
–
kolby stożkowe o pojemności 250cm
3
- 3 sztuki,
–
trójnóg z palnikiem gazowym i siatką,
–
cylindry miarowe o pojemności 25 i 50cm
3
,
–
sączek ze szkła spiekanego,
–
nadmanganian potasu przygotowany jak w poprzednim ćwiczeniu,
–
szczawian sodu o stężeniu ok. 0,1 mol/ dm
3
,
–
kwas siarkowy, roztwór o stężeniu 1mol/dm
3
, wolny od substancji redukujących.
Ćwiczenie 4
Oznacz zawartość alkoholu etylowego w pitnym soku owocowym.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) posłużyć się zestawem do destylacji alkoholu,
2) odmierzyć pipetą do kolby destylacyjnej 10cm
3
badanej próbki pitnego soku owocowego
oraz ok.125cm
3
wody destylowanej,
3) uruchomić przepływ wody w chłodnicy,
4) ogrzać zawartość kolby do wrzenia, zbierając destylat do kolby miarowej
o pojemności 100cm
3
, w ilości ok. 95cm
3
,
5) uzupełnić destylat wodą destylowaną do kreski i wymieszać,
6) użyć destylatu do oznaczania alkoholu metodą jodometryczną,
7) do kolby stożkowej o pojemności 100cm
3
odmierzyć pipetą - 10cm
3
roztworu K
2
Cr
2
O
7
o stężeniu ok. 0,1 mol/dm
3
oraz cylindrem 5cm
3
stężonego kwasu siarkowego po czym
wkroplić pipetą 10cm
3
destylatu,
8) ogrzać kolbę przykrytą szkiełkiem zegarkowym na siatce metalowej do łagodnego wrzenia
przez 10 minut,

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
32
9) przenieść całość ilościowo do kolby stożkowej o pojemności 500cm
3
przy użyciu ok. 300
cm
3
wody destylowanej,
10) dodać 1g krystalicznego jodku potasu, zamknąć korkiem szklanym i pozostawić na
2 minuty,
11) wydzielony jod miareczkować roztworem tiosiarczanu sodu, dodając pod koniec
miareczkowania 1 cm
3
wskaźnika skrobiowego, miareczkowanie prowadzić do momentu
przejścia barwy niebieskogranatowej w jasnozieloną,
12) wykonać próbę równoległą,
13) wykonać obliczenia według wzoru:
(
)
(
)
c
R
Cm
V
Cm
V
c
R
Cm
V
Cm
V
x
I
I
⋅
⋅
−
⋅
=
⋅
⋅
⋅
−
⋅
=
10
6
5
,
11
1000
100
6
5
,
11
2
2
2
1
gdzie: x – zawartość alkoholu etylowego w pitnym soku owocowym w g/100cm
3
,
11,5 – współczynnik wynikający z masy molowej alkoholu etylowego,
V
1
– objętość roztworu K
2
Cr
2
O
7
pobrana do oznaczenia w cm
3
,
Cm
1
- molowość roztworu K
2
Cr
2
O
7
,
V – objętość roztworu Na
2
S
2
O
3
zużyta na pośrednie odmiareczkowanie nadmiaru
dwuchromianu potasu w cm
3
,
Cm
2
- molowość roztworu Na
2
S
2
O
3
,
R – rozcieńczenie (stosunek łącznej objętości destylatu do objętości pobranej, w tym
przypadku R=10),
c– objętość pitnego soku owocowego pobrana do destylacji w cm
3
(10cm
3
).
Wyposażenie stanowiska pracy:
–
zestaw do destylacji alkoholu,
–
cylindry miarowe o pojemności 10 i 250cm
3
,
–
kolba miarowa o pojemności 100cm
3
,
–
pipety jednomiarowe o pojemności 10cm
3
,
–
kolby stożkowe o pojemności 100 i 500cm
3,
–
biureta o pojemności 25cm
3
–
trójnóg, siatka, palnik gazowy,
–
dwuchromian potasu o stężeniu ok. 0,1 mol/dm
3
, ściśle mianowany,
–
kwas siarkowy stężony,
–
jodek potasu krystaliczny,
–
tiosiarczan sodu o stężeniu 0,1 mol/dm
3
, ściśle mianowany,
–
wskaźnik skrobiowy.
4.4.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) zdefiniować pojęcie analizy redoksymetrycznej?
2) przygotować i mianować roztwory KMnO
4
?
3) przygotować zestaw do sączenia pod zredukowanym ciśnieniem?
4) przygotować podstawowe odczynniki do oznaczeń jodometrycznych?

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
33
5. SPRAWDZIAN OSIĄGNIĘĆ
INSTRUKCJA DLA UCZNIA
1. Przeczytaj uważnie instrukcję.
2. Podpisz imieniem i nazwiskiem kartę odpowiedzi.
3. Zapoznaj się z zestawem zadań testowych.
4. Udzielaj odpowiedzi tylko na załączonej karcie odpowiedzi.
5. Zaznacz prawidłową odpowiedź X (w przypadku pomyłki należy błędną odpowiedź
zaznaczyć kółkiem, a następnie ponownie zakreślić odpowiedź prawidłową),
6. Pracuj samodzielnie, bo tylko wtedy będziesz miał satysfakcję z wykonanego zadania.
7. Kiedy udzielenie odpowiedzi będzie Ci sprawiało trudność, wtedy odłóż jego rozwiązanie
na później i wróć do niego, gdy zostanie Ci wolny czas. Trudności mogą przysporzyć Ci
pytania: 15-20, gdyż są one na poziomie trudniejszym niż pozostałe.
8. Na rozwiązanie testu masz 45 min.
Powodzenia!

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
34
ZESTAW ZADAŃ TESTOWYCH
1. Do miareczkowania roztworów używana jest:
a) pipeta.
b) biureta.
c) kolba miarowa.
d) cylinder miarowy.
2. Naczynia miarowe zanieczyszczone alkaliami myje się:
a) zasadą sodową.
b) mieszaniną chromową.
c) kwasem solnym.
d) roztworami detergentów.
3. Roztwory trujące i żrące zasysa się do pipet:
a) ustami.
b) pompką wodną.
c) biuretą.
d) można stosować wszystkie wymienione sposoby.
4. Końcowy punkt miareczkowania określa się wizualnie korzystając z:
a) odczynników chemicznych.
b) barwnych wskaźników.
c) substancji wzorcowych.
d) substancji podstawowych.
5. Naczynia miarowe skalowane są w temperaturze:
a) 10°C.
b) 20°C.
c) 30°C.
d) 40°C.
6. Alkalimetria polega na oznaczaniu:
a) zasad za pomocą mianowanych roztworów kwasów.
b) kwasów za pomocą mianowanych roztworów zasad.
c) kwasów za pomocą roztworów stężonych.
d) zasad za pomocą związków trudno rozpuszczalnych.
7. Błędów w odczytach spowodowanych paralaksą można uniknąć jeśli oczy obserwatora
znajdują się na:
a) menisku dolnym cieczy bezbarwnych.
b) menisku górnym cieczy barwionych.
c) poziomie menisku cieczy.
d) wszystkie odpowiedzi są prawidłowe.
8. Jeżeli podczas miareczkowania roztworu zasada zrównoważy zawarte w nim kwasy to
taki punkt nosi nazwę punktu:
a) równowagowego nasycenia.
b) Miareczkowania.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
35
c) paralaksy.
d) gramorównoważnikowego.
9. Fenoloftaleina jest wskaźnikiem używanym przy miareczkowaniu:
a) słabych kwasów.
b) słabych zasad.
c) mocnych kwasów.
d) mocnych zasad.
10. Miareczkując mocny kwas siarkowy mianowanym roztworem NaOH można stosować
jako wskaźnik:
a) oranż metylowy.
b) fenoloftaleinę.
c) oranż i fenoloftaleinę.
d) dwufenyloaminę.
11. Podstawowym odczynnikiem w argentometrii jest:
a) dwuchromian potasu.
b) azotan srebra.
c) tiosiarczan sodu.
d) tlenek wapnia.
12. W praktyce argentometrycznej oznacza się głównie:
a) bromki, siarczany, chlorki.
b) tlenki, chlorki, jodki.
c) chlorki, bromki, jodki.
d) chromiany, węglany, bromki.
13. Do oznaczania zawartości chlorków wykorzystuje się metody:
a) Mohra i Volharda.
b) Lane-Eynona.
c) Luffa-Schoorla.
d) Ballinga.
14. Kolby miarowe to naczynia o kształcie:
a) rurki z doszlifowanym kurkiem.
b) rurki zwężonej u dołu.
c) cylindra z podziałką.
d) gruszkowatym z wąską, długą szyjką.
15. Stężenie molowe wyraża się liczbą:
a) gramów substancji rozpuszczonej w 100g roztworu.
b) gramorównoważników substancji rozpuszczonej w 1dm
3
roztworu.
c) moli substancji rozpuszczonej w 1dm
3
roztworu.
d) mg substancji rozpuszczonej w 1dm
3
roztworu.
16. Kompleksonami o największym znaczeniu są kwasy:
a) galakturonowy.
b) wersenowy.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
36
c) palmitynowy.
d) aminopolikarboksylowy.
17. Do wskaźników jodometrycznych zalicza się:
a) skrobię.
b) chromian srebra.
c) czerń eriochromową.
d) wersenian dwusodowy.
18. Podstawowe odczynniki stosowane w oznaczeniach jodometrycznych to roztwory:
a) nadmanganianu potasu.
b) jodu i tiosiarczanu sodu.
c) dwuchromianu potasu.
d) szczawianu sodu.
19. Roztwory jodu przechowuje się w:
a) butelkach z ciemnego szkła z doszlifowanym korkiem.
b) bezbarwnych słojach z doszlifowanym korkiem.
c) butelkach ze szkła brązowego.
d) butelkach ze szkła zielonego.
20. Oznaczenia kompleksometryczne są stosowane do oznaczania:
a) niektórych pierwiastków, np. żelaza.
b) twardości wody.
c) chlorków.
d) alkoholu etylowego.
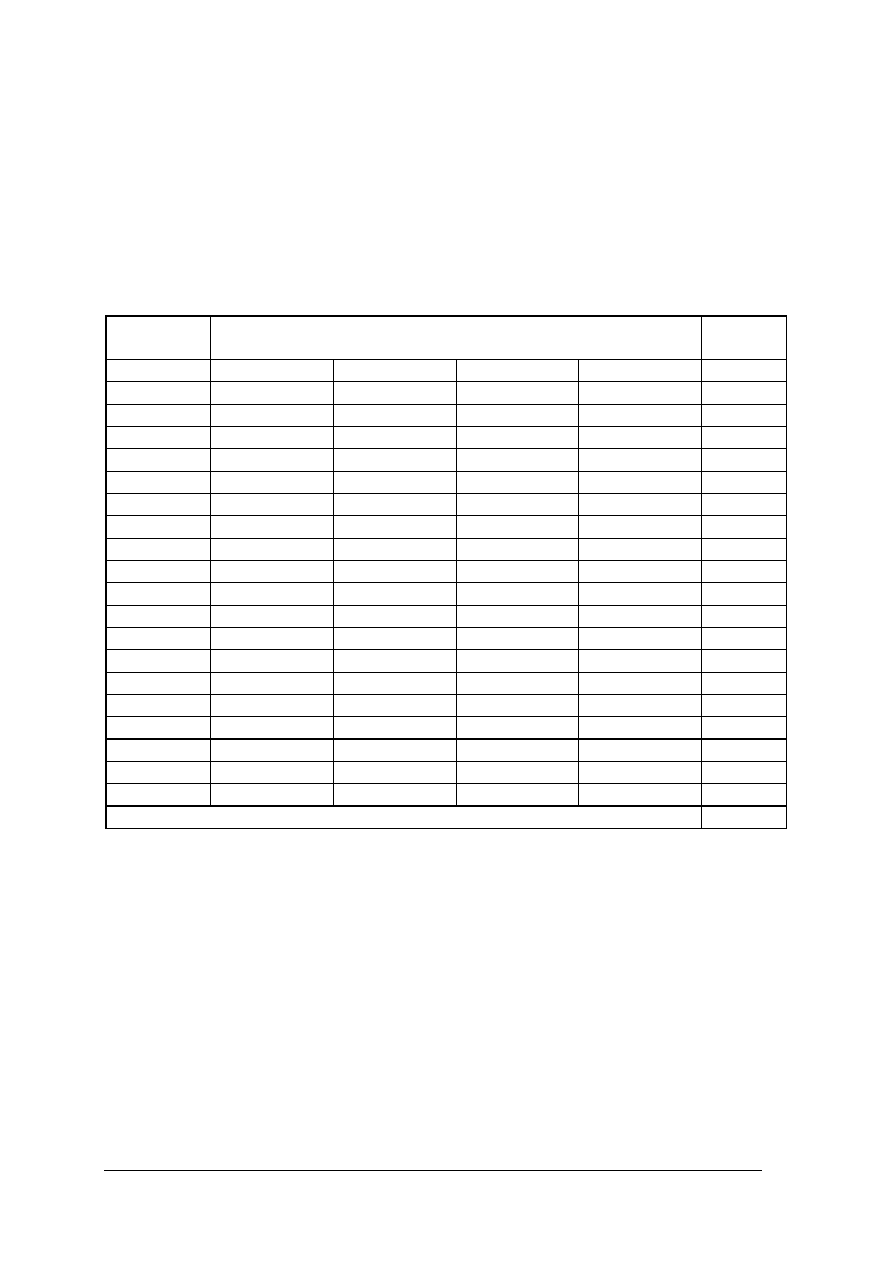
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
37
KARTA ODPOWIEDZI
Imię i nazwisko..........................................................................................
Wykonywanie objętościowej analizy żywności
Zakreśl poprawną odpowiedź wpisz brakujące części zdania lub wykonaj rysunek.
Nr
zadania
Odpowiedź
Punkty
1.
a
b
c
d
2.
a
b
c
d
3.
a
b
c
d
4.
a
b
c
d
5.
a
b
c
d
6.
a
b
c
d
7.
a
b
c
d
8.
a
b
c
d
9.
a
b
c
d
10.
a
b
c
d
11.
a
b
c
d
12.
a
b
c
d
13.
a
b
c
d
14.
a
b
c
d
15.
a
b
c
d
16.
a
b
c
d
17.
a
b
c
d
18.
a
b
c
d
19.
a
b
c
d
20.
a
b
c
d
Razem:

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
38
6. LITERATURA
1. Budsławski J., Drabant Z.: Metody analizy żywności. WNT, Warszawa 1999
2. Cygański A.: Chemiczne metody analizy ilościowej. WNT, Warszawa 1997
3. Drzazga B.: Analiza techniczna w przemyśle spożywczym. WSiP, Warszawa1992
4. Minczewski J., Marczenko Z.: Chemia analityczna. Analiza ilościowa. PWN, Warszawa
1978
5. ModzelewskiM., Soliński J.: Pracownia chemiczna technika laboratoryjna, WSiP 1996
6. Rubel S.: Pracownia chemiczna. Analiza ilościowa. WSiP, Warszawa 2001
Wyszukiwarka
Podobne podstrony:
32 Wykonywanie wagowej analizy żywności
34 Wykonywanie instrumentalnej analizy żywności
32 Wykonywanie wagowej analizy żywności
32 Wykonywanie wagowej analizy żywności
34 Wykonywanie instrumentalnej analizy żywności
FIZYKOCHEMIA, teoria do 33, Wykonywane są dwa rodzaje analiz wody:
Metody reologiczne w analizie żywności
Zagadnienia na kolokwium OEBHP, (Sylwia) studia semestr 3, Analiza żywności, Bhp i ergonomia
Oznaczenie zawartości sacharydów, Technologia żywnosci i Żywienie człowieka, 4 SEMESTR, Analiza żywn
Analiza żywności ćw 4 kwasowość, Tż, Analiza żywności II, Sprawozdania
Analiza żywności egzamin 13
dr Szczapa, Analiza żywności, Karotenoidy
Polarymetryczne oznaczanie zawartości skrobi, Tż, Analiza żywności II, Sprawozdania
TiAZ- produkcje, studia, bio, 3rok, 5sem, technologia i analiza żywności, wykład
Kalend.-Ćwiczeń-z-Now.-Met.-Anal.-Żywn.-13-14, Nowoczesne metody analizy żywności
sprawko tran, Nowoczesne metody analizy żywności
Oznaczanie cukrow prostych metoda Antronowa, Tż, Analiza żywności II, Sprawozdania
OZNACZANIE ZAWARTOCI POLISACHARYDW1, 2 rok, analiza, Analiza żywności, analiza cd, sprawka
więcej podobnych podstron