
Leczenie systemowe nowotworów
Terapie ukierunkowane
molekularnie
Aby można rozpocząć leczenie
konieczne jest uzyskanie:
ROZPOZNANIA
HISTOPATOLOGICZNEGO

Rozpoznanie histopatologiczne
Metody uzyskania materiału:
BAC
BACC
pobranie wycinków z guza
pobranie węzła chłonnego
materiał pooperacyjny
badanie szpiku kostnego

Rozpoznanie choroby
nowotworowej
WYNIK BADANIA CYTOLOGICZNEGO
Zmiana łagodna
Cellulae suspectae
Rak
– carcinoma
Rzadko mięsak , chłoniak

Współdziałanie
Leczenie onkologiczne jest procesem
złożonym w którym zwykle biorą udział
lekarze:
histopatolodzy
chirurdzy
onkolodzy kliniczni
radioterapeuci

LECZENIE ONKOLOGICZNE
Kontrola miejscowa
procesu
nowotworowego:
CHIRURGIA
RADIOTERAPIA
Leczenie
systemowe:
CHEMIOTERAPIA
HORMONOTERAPI
A
TERAPIA
BIOLOGICZNA

CHIRURGIA
Jest najstarszą metodą leczenia
nowotworów.
Już w starożytności stosowano wypalanie,
przyżeganie, a następnie wycinanie jako
metodę leczenia.

Rodzaje zabiegów chirurgicznych
Operacje diagnostyczne: biopsja
chirurgiczna węzłów chłonnych lub guza
nowotworowego
Operacje radykalne
Operacje oszczędzające (bez konieczności
usuwania całego narządu)
Operacje paliatywne
Inne zabiegi: endoskopowe, laserowe,
elektro-resekcja, elektrokoagulacja,
krioterapia,

ROZPOZNANIE HISTOPATOLOGICZNE
Jest kluczem do :
określenia rokowania
ustalenia dalszej terapii
Np:
Rodzaj materiału pooperacyjnego: sutek prawy,
Wynik badania hist.-pat.:
Carcinoma ductale infiltrans II stopień wg Blooma
Znaleziono 13 (5+2+6) węzłów chłonnych sine signis meta
ER 50%
PR 30%
HER2 3+

LECZENIE SYSTEMOWE
CHEMIOTERAPIA
leczenie cytostatykami czyli związkami
niszczącymi komórki
HORMONOTERAPIA
tylko w leczeniu nowotworów hormono-
zależnych (rak piersi, trzonu macicy,
gruczołu krokowego)
TERAPIA UKIERUNKOWANA
MOLEKULARNIE

Prekursorem leczenia systemowego był Tomas
Beatson. Zauważył, ze samice królików przestają
produkować mleko po usunięciu jajników.
Zainteresowała go zależność funkcji jednego narządu od
innego, znajdującego się w zupełnie innym miejscu
organizmu. Następnie odkrył, że usunięcie jajników
powoduje remisję u pacjentek z zaawansowanym rakiem
piersi.
Historia chemioterapii rozpoczyna się po II wojnie
światowej. W 1946 u chorych na chłoniaki
zastosowano związek alkilujący chlormetynę-
pochodną stosowanego w czasie I wojny światowej
gazu musztardowego, który u ofiar uszkadzał m.in.
układ krwiotwórczy.
Trochę historii...

Cytostatyki hamują podziały komórkowe i powodują rozmaite
uszkodzenia subletalne (np. poprzez uszkadzanie DNA lub powstawanie
wolnych rodników tlenowych), które wprowadzają komórkę w proces
apoptozy.

Rodzaje chemioterapii
Radykalna -
celem jest całkowite wyleczenie:
•
Wstępna (neoadiuwantowa) – stosowana u
pacjentów z miejscowo zaawansowanym
nowotworem, mająca umożliwić leczenie
radykalne
•
Uzupełniająca (adiuwantowa) – podawana
celem zniszczenia mikroprzerzutów po
radykalnym zabiegu operacyjnym
Paliatywna -
niekiedy przedłużająca życie,
poprawiająca komfort życia

Skuteczność leczenia nowotworów
cytostatykami
Nowotwory w których można
uzyskać wyleczenie:
ostre białaczki (ALL, AML)
kosmówczak
chłoniaki o wysokim stopniu
złośliwości
ziarnica złośliwa
nowotwory jądra
guz Wilmsa

Skuteczność leczenia cytostatykami
W zaawansowanej chorobie
nowotworowej można przedłużyć
życie:
szpiczak mnogi
chłoniaki o niskim stopniu
złośliwości
białaczki przewlekłe (CLL, CML)
drobnokomórkowy rak płuca
rak piersi
rak jajnika
niektóre mięsaki

Skuteczność leczenia cytostatykami cd.
W niektórych nowotworach
skuteczność jest dyskusyjna i
wymaga potwierdzenia
randomizowanymi badaniami
klinicznymi (np. rak żołądka,
czerniak złośliwy)

Zasady chemioterapii
podawanie kilku leków
jednocześnie
podawanie leków w ściśle
określonych, maksymalnych
dawkach
zachowanie określonego czasu
między cyklami chemioterapii (nie
wydłużanie przerw)

Powikłania po chemioterapii
Powikłania hematologiczne – uszkodzenie
szpiku kostnego
Nudności i wymioty, działanie mukotoksyczne,
uszkodzenie przewodu pokarmowego
Uszkodzenie skóry, łysienie
Uszkodzenie mięśnia sercowego
Działanie nefrotoksyczne, hepatotoksyczne,
pulmonotoksyczne

Powikłania chemioterapii cd.
Zaburzenie czynności narządów
płciowych, uszkodzenie gonad
Uszkodzenie naczyń krwionośnych
Uszkodzenie narządu wzroku
Reakcje nadwrażliwości

Łysienie czyli alopecja
W skórze głowy ok. 90% komórek cebulek
włosowych ulega bardzo szybkim procesom
podziałowym, zaledwie 10% pozostaje w fazie
spoczynkowej. Wypadanie lub przerzedzenie
włosów w trakcie chemioterapii, zjawisko
całkowicie odwracalne, jeśli wystąpi może
dotyczyć wszystkich okolic owłosionych – także
brwi i rzęs.
Leki najbardziej toksyczne dla cebulek
włosaowych to doksorubicyna, cyklofosfamid,
ifosfamid, preparaty platyny...

Paznokcie
Zaburzenia troficzne i grzybica paznokci,
szkodzenia płytki paznokciowej
łamliwość, pękanie odwarstwienia, zmiany ropne
pod płytką paznokciową, „schodzenie paznokci”.
Szczególnie po cyklofosfamidzie, doksorubicynie,
fluorouracylu, docetakselu, kapecytabinie.
Leczenie przewiduje odpowiednią pielęgnację oraz
terapię przeciwgrzybiczą (lakiery do paznokci,
maści, leki doustne).

Uszkodzenia skóry
Odczyny skórne po ekspozycji na działanie
promieni słonecznych (szczególnie metotreksat,
winblastyna, fluorouracyl), zaburzenia troficzne,
podrażnienie, ściemnienie skóry.
Pigmentacja skóry jak w chorobie Addisona
(doksorubicyna, busulfan, fluorouracyl,
karmustyna)
Smugowate przebarwienia na skórze tułowia
przypominające ślady drapania (bleomycyna)

Uszkodzenia skóry cd.
Alergiczne odczyny skórne, pokrzywka –
u 1/3 chorych leczonych asparaginazą,
bleomycyną, taksoidami
Świąd, zmiany grudkowo-plamiste,
odbarwienie skóry, nadmierne
rogowacenie po taksoidach

Układ krążenia i serce
Dożylne podanie cytostatyków wybitnie uszkadza
naczynia
krwionośne, zapalenie żył jest zjawiskiem
niemal stale
towarzyszącym chemioterapii
Choroba nowotworowa wybitnie uspasabia do
powikłań
zakrzepowo- zatorowych (kliniczne objawy u 15%
pacjentów)
Niektóre leki stosowane w onkologii wykazują działanie
kardiotoksyczne
(antracykliny,
trastuzumab,
cyklofosfamid, 5-fluorouracyl, amsakryna, cytozyna,
arabinozyna,
winkrystyna,
cisplatyna,
duże dawki
metotreksatu)

Powikłania hematologiczne
Spadek poziomu białych krwinek
(leukopenia) i neutrofili (neutropenia)
objawy: gorączka neutropeniczna,
osłabienie, infekcje bakteryjne i
grzybicze
leczenie: antybiotyki, czynniki wzrostu
dla neutrofili, w ciężkich przypadkach
hospitalizacja

Powikłania hematologiczne cd.
Spadek poziomu płytek krwi
(trombocytopenia)
Objawy: krwawienie z dziąseł, z nosa,
liczne siniaki, skaza krwotoczna, krwotok
Jeśli występują objawy skazy krwotocznej
– hospitalizacja, przetaczanie koncentratu
płytkowego

Powikłania po chemioterapii
NADIR
-
Spadek parametrów hematologicznych,
-
Rozwój powikłań śluzówkowych,
-
Infekcje
-
zwykle między 8 a 12 dniem po
chemioterapii

Terapie celowane w onkologii
–
„magic bullet”?
Mają działać swoiście na komórki nowotworowe,
a dokładnie ingerować w szlak molekularny, który
odpowiada za potencjał nowotworowy klonu
komórkowego. Dzięki temu możliwe będzie
unikniecie powikłań charakterystycznych dla
chemioterapii.

Czy mamy „lekarstwo na raka”?
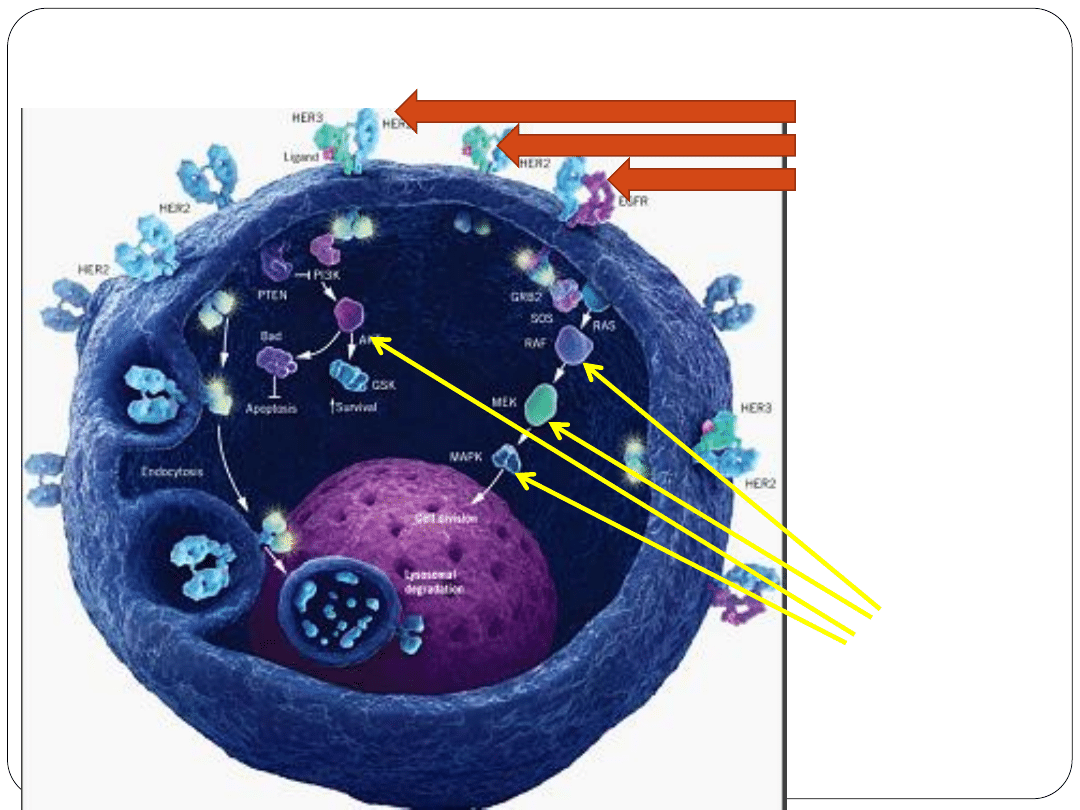
Komórka nowotworowa z ekspresja receptorów HER2
http://www.biooncology.com/bioonc/images/her-main-lg.jpg
Przeciwciała
monoklonalne
Inhibitory
kinaz

Terapie „celowane” w onkologii -
przykłady
Przeciwciała monoklonalne (trastuzumab,
rituksymab, cetuksymab, bawacyzumab)
Drobnocząsteczkowe inhibitory kinaz (imatynib,
gefitynib, erlotynib)
Inhibitor proteasomu 20S (bortezomib)
Inhibitory PARP

Przeciwciała monoklonalne
Skierowane są przeciw specyficznym antygenom obecnym
na komórce nowotworowej
Aktywują cytotoksyczność komórkową zależną od
przeciwciał lub dopełniacza
Nasilają apoptozę
Blokują receptor dla czynnika wzrostu
Niszczą komórkę prze związaną toksynę lub pierwiastek
radioaktywny
-momab
– białko mysie
-ksymab
– białko chimeryczne (50-90% białka
ludzkiego)
-zumab
– białko humanizowane (95% białka ludzkiego)
-mumab
– białko ludzkie

Drobnocząsteczkowe inhibitory
kinaz
Wiążą i blokują białka enzymatyczne (kinazy)
odpowiedzialne za przekazywanie sygnału
wewnątrzkomórkowego na zasadzie fosforylacji
odpowiednich reszt aminokwasowych (tyrozynowych,
serynowych, treoninowych). Kinazy mogą być
fragmentem błonowego białka receptorowego (EGFR,
HER2) lub białka cytoplazmatycznego (RAF).
Przykłady:
Imatynib
Erlotynib
Lapatynib
Sorafenib

Terapia anty-EGFR
Receptory dla naskórkowego czynnika wzrostu (EGFR) występują
na powierzchni licznych komórek, także komórek nowotworowych.
Po połączeniu z ligandem (EGF, naskórkowy czynnik wzrostu)
ulegają aktywacji i dimeryzacji. Następnie domeny
wewnątrzkomórkowe EGFR ulegają wzajemnej fosforylacji dzięki
aktywności kinaz tyrozynowych, jaką wykazują ich fragmenty.
Ufosforylowane domeny mogą aktywować przekaźniki kolejnego
rzędu , co umożliwia przepływ sygnału do wnętrza komórki i
uruchamianie ekspresji genów odpowiedzialnych za wzrost,
przeżycie i migrację komórki.
Cetuksymab to przeciwciało anty-EGFR, po połączeniu z receptorem
uniemożliwia jego aktywację.
Erlotynib i gefitynib hamują aktywność kinazy tyrozynowej EGFR.
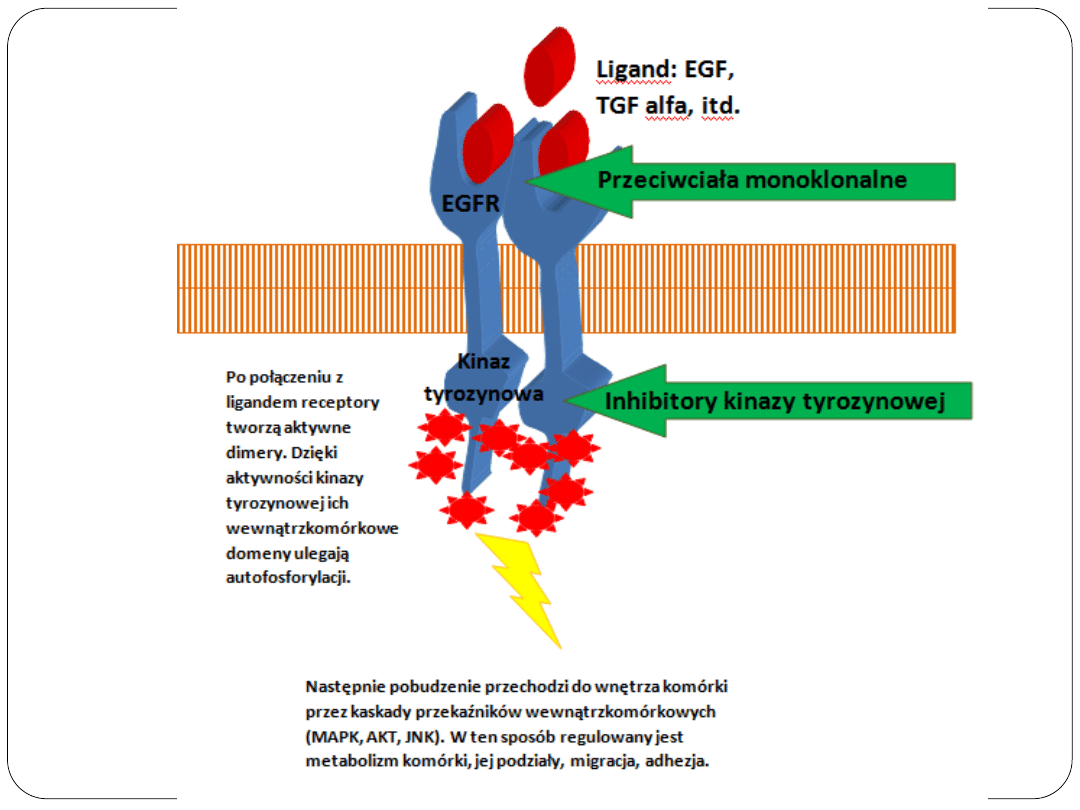
Terapie
anty-EGFR

Angiogeneza nowotworowa
Rozrastający się guz nowotworowy wymaga coraz lepszego
zaopatrzenia w tlen i substancje odżywcze. W nieukrwionej
początkowo obcej tkance dochodzi do niedotlenienia i wzmożonej
produkcji naczyniowego śródbłonkowego czynnika wzrostu (vascular
endothelial growth factor, VEGF). VEGF powoduje wzrost
sąsiadujących naczyń w kierunku guza nowotworowego , a
następnie wytworzenie jego patologicznych naczyń krwionośnych.
Umożliwia to odżywienie i dalszy wzrost guza.
Bewacizumab to przeciwciało monoklonalne anty- VEGF.
Uniemożliwia połączenie czynnika wzrostu z receptorami (VEGFR) w
komórkach naczyń wokół guza. Hamuje więc sygnał, który
powodowałby nowotworową angiogenezę.
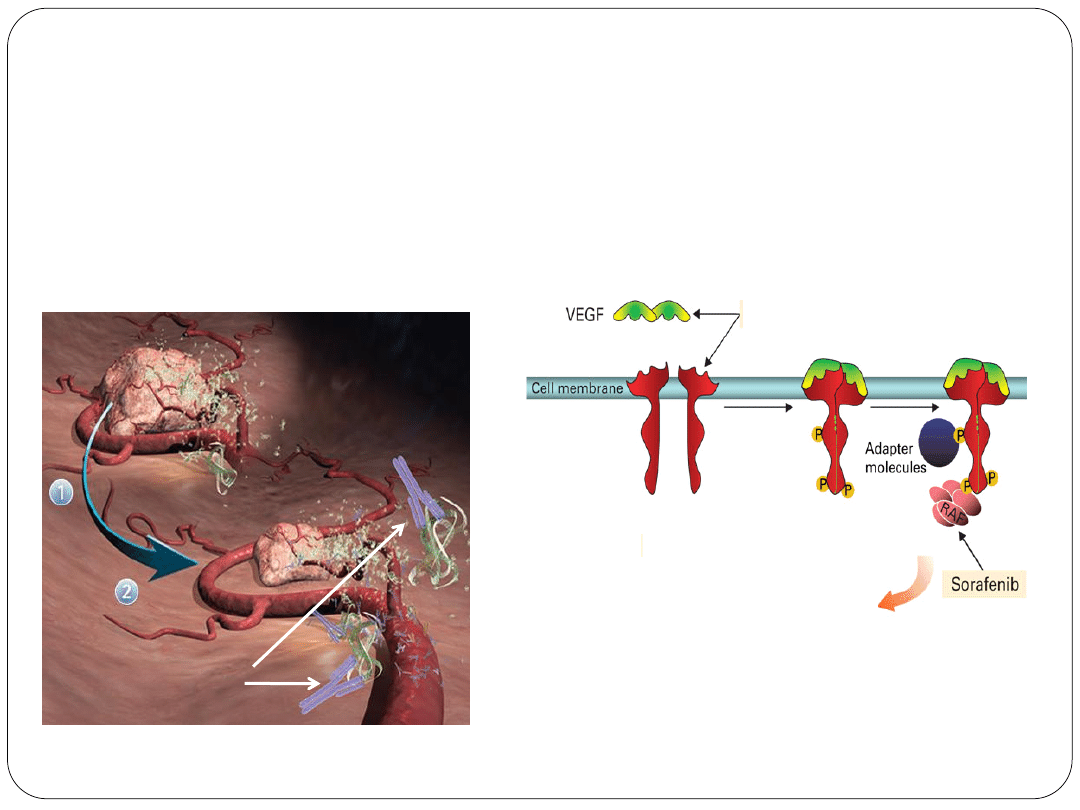
NSCLC
– leczenie
antyangiogenne
http://www.researchvegf.com/resear
chvegf/images/Anti-VEGF-MOA.jpg
http://home.ccr.cancer.gov/connections/a
rchives/2008/Vol2_No2/images/clinic/Figu
re1.jpg
VEGFR2
Proliferacja i migracja
komórek endotelium-
tworzenie nowych
naczyń
Bewacizumab
Bewacizumab

Terapia „celowana” ≠ „magic
bullet”
Skuteczność leczenia zależy jak istotny w
patogenezie nowotworu jest wybrany szlak
molekularny, który ma być hamowany
Skutki oboczne zależą od istotności
wybranego szlaku molekularnego w
zdrowych komórkach różnych tkanek

Badania nad nowymi lekami - onkologia
Faza przedkliniczna
Linie komórkowe
Modele zwierzęce guzów nowotworowych
Fazy badań klinicznych
I+ II -
wstępna ocena bezpieczeństwa substancji (wchłanianie,
metabolizm, wydalanie, toksyczność, interakcje), jej skuteczności w
danym wskazaniu i ustalenie dawek terapeutycznych (badania
prowadzone na ludziach chorych, u których wyczerpano wszystkie
dostępne metody leczenia)
III-
randomizowane badanie na dużej liczbie pacjentów porównujące
skuteczność nowego leku z dotychczasowym standardem, pozytywny
wynik uzasadnia rejestrację nowego leku
IV-
dotyczy leków zarejestrowanych, dodatkowa weryfikacja wcześniej
uzyskanych wyników
Co bierzemy pod uwagę oceniając
skuteczność leków „onkologicznych”?
Odpowiedź „bezpośrednia”: CR (całkowiata remisja), PR
(częściowa remisja), ORR (odpowiedź obiektywna
=CR+PR), SD (stabilizacja), CB (korzyść kliniczna =
ORR+SD), PD (progresja)
Punkty końcowe: DFS (czas przeżycia wolny od choroby),
PFS (czas wolny od progresji),
OS (przeżycie całkowite)
Czy lek przedłuża życie pacjenta?
(OS)
Czy poprawia/pogarsza komfort
życia?
( CR, PR
– ustąpienie dolegliwości związanych z chorobą,
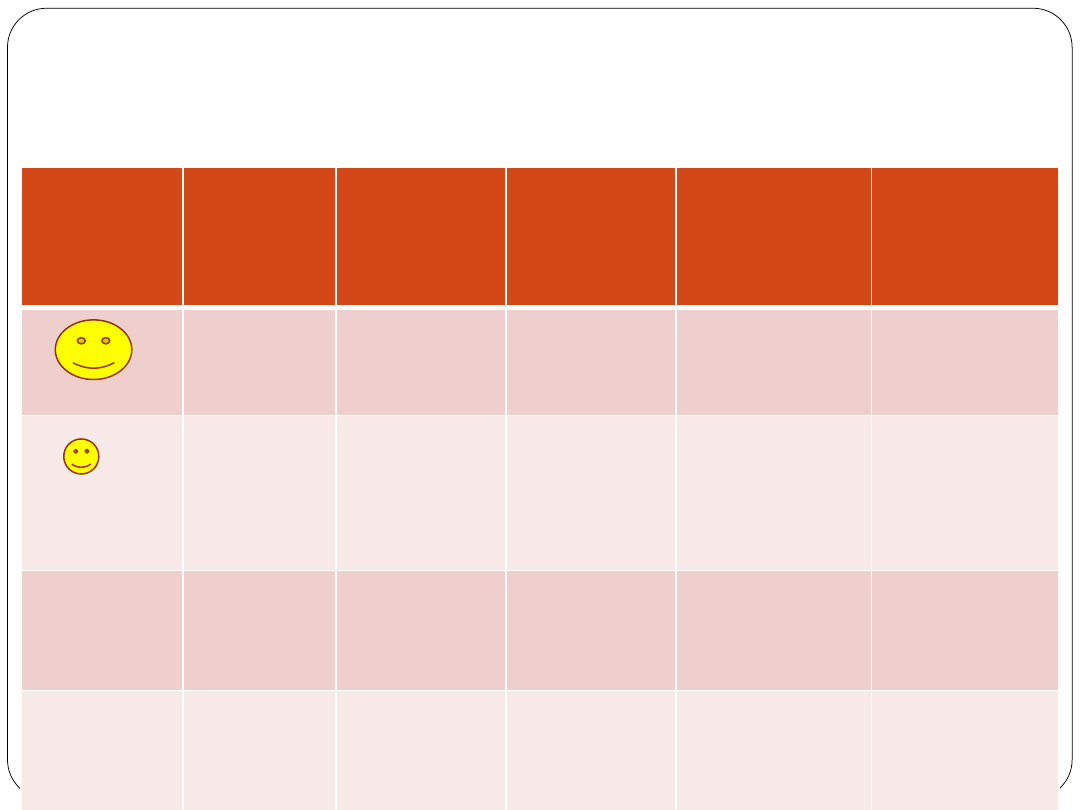
Czy to rzeczywiście działa
(przeciwciała monoklonalne)?
Nazwa
leku
Jednostk
a
chorobow
a
Charakter
leczenia
Konstrukcj
a badania
Odpowiedź
obiektywna
Punkty
końcowe
Rituksimab
DLBCL
Radykalne
ChT v.
ChT+R
CR 37 v. 52%
Przeżycie 2-
letnie 57 v.
70%
Trastuzum
ab
Rak piersi
IV
Paliatywne
(Slamon
2001)
ChT v.
ChT+Trast.
ORR 32 v.
50%
TTP 4.6 v.
7.4 mies.
OS 20.3 v.
25.1 mies.
Cetuksima
b
Rak jelita
grubego
IV
Paliatywne
(Jonker
2007)
Placebo
v.
Cetuksimab
PR 8%
SD 10.9 v.
31.4%
OS 4.6 v. 6.1
mies.
Bewacizum
ab
Rak nerki
IV
Paliatywne
(Rini 2010)
INF
α v.
INF
α+B
PFS 5 v. 8
mies.
OS 17.4
v.18.3 mies.
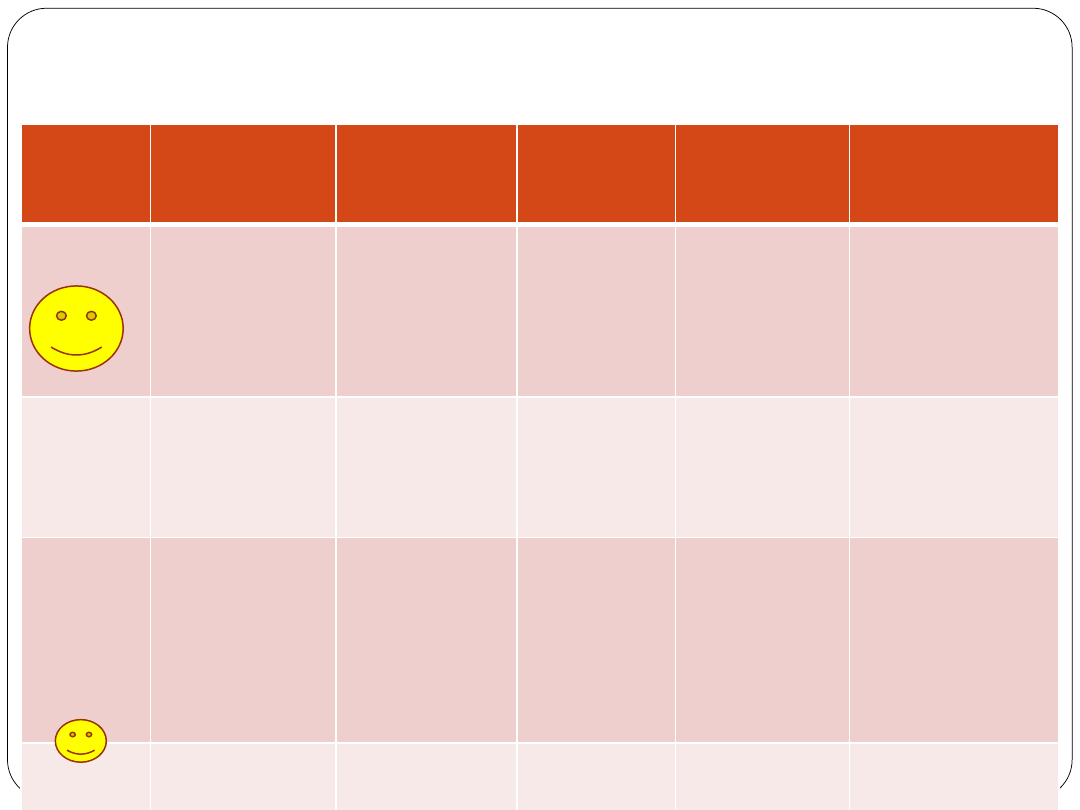
Czy to rzeczywiście działa (inhibitory
kinaz)?
Nazwa
leku
Jednostka
chorobowa
Charakter
leczenia
Konstrukc
ja badania
Odpowiedź
obiektywna
Punkty
końcowe
Imatynib
GIST (postać
zaawansowa
na)
Paliatywny
Bez leczenia
mediana
przeżycia 9-
20 mies.
400 mg v.
800mg
(Blanke
2008)
CR 5%v.3%
PR
40%v.42%
SD 25%
v.22%
PFS 18 v.20
mies.
OS 55 v. 51
mies.
Erlotynib
Rak płuca IV
Paliatywne
E v.
Placebo
(Shepherd
2005)
ORR 8,9%
OS 6.7 v. 4.7
mies.
PFS 2.2 v. 1.8
mies.
Lapatyni
b
Rak piersi IV
Paliatywne
ChT v.
ChT+L
(Geyer
2008)
PR 14 v.
23%
SD 29 v.
38%
PD 23 v.
13%
TTP 4.3 v.6.2
mies.
OS 15.3 v.15.6
mies.
Sunityni
b
Rak nerki IV
Paliatywne
INF
α v.
Sunitynib
ORR 12 v.
47%
PFS 5 v.11
mies.
OS 22 v.26

Co może wpłynąć na zwiększenie
skuteczności leków
ukierunkowanych molekularnie?
Dokładne sprecyzowanie grupy pacjentów, która
może odnieść korzyść, tzn. znalezienie
czynników
predykcyjnych
, np.:
Trastuzumab dla pacjentek HER2+
Rituksimab dla pacjentów CD20+
Imatynib dla pacjentów CD 117+
Erlotynib dla pacjentów z rakiem gruczołowym,
niepalących

Technikę otrzymywania przeciwciał monoklonalnych wynaleziono w
latach 80-
tych XX wieku. Opierała się ona na podstawowej wiedzy o
tym, że w układzie immunologicznm funkcjonują limfocyty B i T
potrafiące rozpoznać każde obce białko jako antygen, przeciw któremu
kierują naturalne przeciwciała. Klasyczna metoda produkcji przeciwciał
monoklonalnych polega na tym, że wstrzykuje się myszy antygen, aby
pobudzić jej układ immunologiczny do produkcji przeciwciał, a następnie
izoluje się z krwi myszy limfocyty B zaszczepione tym antygenem.
Jednocześnie pobiera się komórki ze szpiku człowieka chorego na
nowotwór i łączy je z limfocytami mysimi. Dochodzi wówczas do
stworzenia dużej liczby tzw.hybryd rozpoznających nowotworowy
antygen. Niestety, mysie przeciwciała w krótkim czasie rozpoznawane
są jako obcy antygen, przeciw którym organizm człowieka wytwarza
reakcję immunologiczną niszcząc je. Za pomocą inżynierii genetycznej
udało się zastąpić coraz większe fragmenty mysich przeciwciał
fragmentami cząsteczek przeciwciał ludzkich i tak powstały stosowane
dziś- humanizowane przeciwciała monoklonalne, dobrze tolerowane
przez układ immunologiczny człowieka.”
Iwona Głogowska

Terapie ukierunkowane molekularnie
– skutki uboczne
Cetuksymab -
nadwrażliwość podczas wlewu
(duszność, gorączka, dreszcze, obrzęki, spadki
ciśnienia), krostkowa wysypka na twarzy i tułowiu
(leczenie
– antybiotyki), zmęczenie, śródmiąższowe
zapalenie płuc.
Trastuzumab-
kardiomiopatia, nadwrażliwość podczas
wlewu
Bewacizumab -
nadciśnienie, białkomocz, osłabienie,
ból brzucha, zapalenie błon śluzowych, złuszczające
zapalenie skóry, trudności w gojeniu ran, krwawienie
(z guza!, szczególnie w rakach płaskonabłonkowych
płuca), powikłania zakrzepowo-zatorowe,
nadwrażliwość przy podaniu (duszność, gorączka,

Terapie ukierunkowane molekularnie
– skutki uboczne
Erlotynib
– krostkowa wysypka (podać antybiotyk),
śródmiąższowe zapalenie płuc, zapalenie spojówek,
biegunka.
Imatinib-
nudności, wymioty, skurcze mięśni, obrzęki
wokół oczu, wysypka, biegunka, obrzęki kończyn
dolnych, bóle mięśni, bóle brzucha, zmęczenie,
objawy zatrzymania płynów.
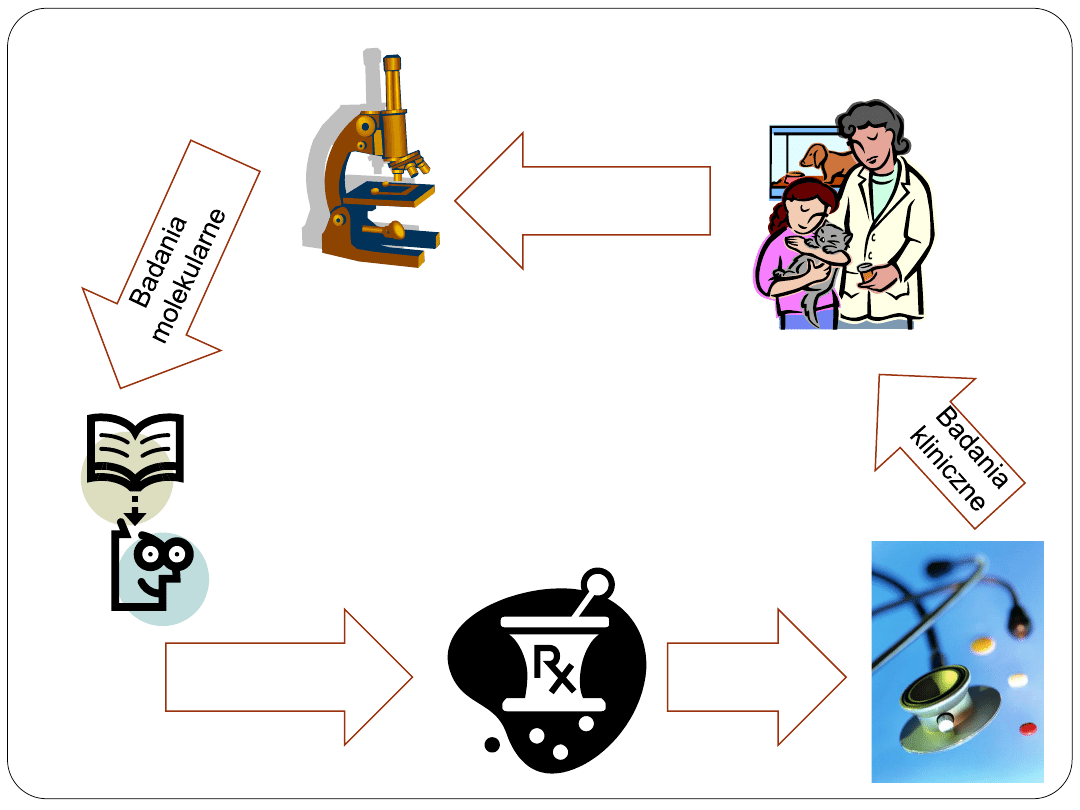
Badania translacyjne
Obserwacje
kliniczne
Nowe
koncepcje
Nowe leki

Korzyść z
leczenia
(Przedłużenie życia)
Obniżony
komfort życia
(powikłania, pobyt w szpitalu)
Cena
Co należy brać pod uwagę?
Wyszukiwarka
Podobne podstrony:
Leczenie uzupełniające nowotworów narządu rodnego chemioterapia, radioterapia
Regulacja białka supresorowego nowotworów p53. Biologia molekularna. Seminarium 1, biologia- studia
Problemy pielęgnacyjne pacjentów po leczeniu chirurgicznym nowotworów jelita grubego, Pielęgniarstwo
Leczenie bólu nowotworowego
Leczenie uzupeniajce nowotworow narzadu rodnego
test Leczenie systemowe, testy
Leczenie systemowe, MEDYCYNA, onkologia
Leczenie systemowe, leczenie raka piersi i płuca
Podstawy diagnostyki i leczenia chorób nowotworowych krwi
Leczenie systemowe
Badania kontrolne po leczeniu onkologicznym Nowotwory każdy nowotwór opracowany osobno
leczenie bolow nowotworowych
Leczenie chirurgiczne nowotworów, Zdrowie, medycyna itp, Onkologia
niewydolność nerek leczenie, anestezjologia i intensywna terapia
Leczenie systemowe
23 Leczenie bólów nowotworowych
więcej podobnych podstron