Metody instrumentalne w analizie ilościowej
Miareczkowanie potencjometryczne kwas-zasada
- Jaka jest zasada działania pH-metru? Co to są ogniwa elektrochemiczne? Jaka jest definicja
elektrody?
- Jakie typy elektrod wykorzystywane są w potencjometrii?
- Jakie znamy typy krzywych miareczkowania alkacymetrycznego? Co to jest punkt równoważności
molowej (PRM) i jak go można wyznaczać w oznaczeniach alkacymetrycznych?
Ogniwo wodorowo - kalomelowe: Pt/H
2
,H
+
// Cl
–
, KCl
(s)
, Hg
2
Cl
2
,Hg/Pt
Reakcja na elektrodzie prawej: Hg
2
Cl
2
+ 2 e = 2 Hg + 2 Cl
-
Reakcja na elektrodzie lewej: H
2
= 2 H
+
+ 2 e
Reakcja w ogniwie: Hg
2
Cl
2
+ H
2
= 2 Hg + 2 Cl
-
+ 2 H
+
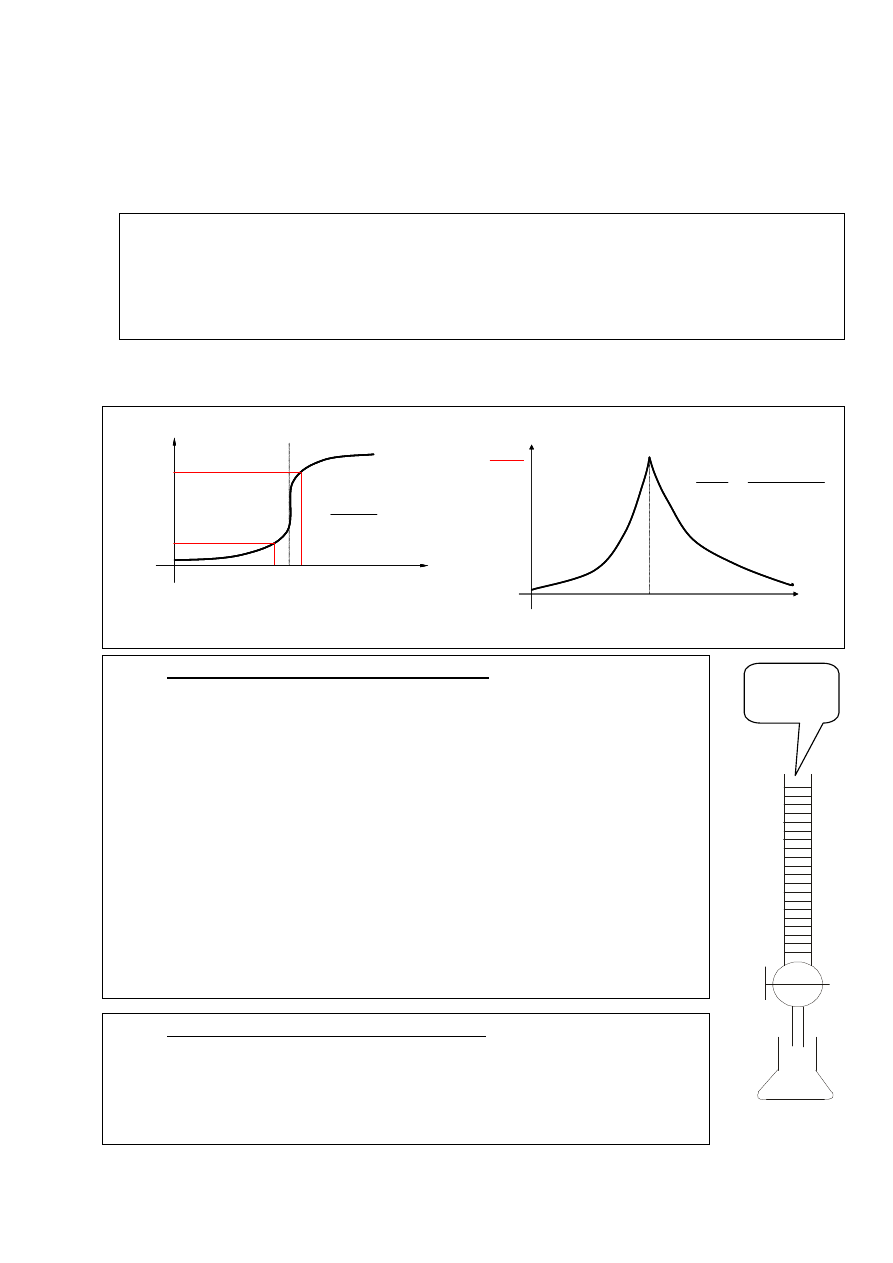
Wyznaczanie alkacymetrycznego PRM metodą potencjometryczną:
E
n+1
E
PRM
max
)
(
V
z
d
E
d
V
z
E
n
V
n+1
V
n
E
n+1
E
PRM
max
)
(
V
z
d
E
d
V
z
E
n
V
n+1
V
n
z
V
E
z
V
E
PRM
V
z
V
V
E
E
n
n
n
n
z
V
E
1
1
Δ
Δ
I. Miareczkowanie mocnego kwasu mocną zasadą:
1. Badany roztwór HCl rozcieńczyć w kolbie miarowej wodą destylowaną do kreski miarowej
2. Roztwór HCl pobrać pipetą i przenieść do kolby stożkowej i wrzucić mieszadełko
magnetyczne
3. Umieścić w kolbie stożkowej elektrodę zespoloną, podłączoną do pH-metru.
4. Włączyć mieszadło magnetyczne na 2 minuty, wyłączyć i odczytać wartość początkową
pH roztworu
5. Wykonać 1 miareczkowanie dodając roztwór NaOH i odczytując wartość pH
po każdym dodanym 1 cm
3
roztworu
6. Wykonać 2 i 3 miareczkowanie, dodając pierwszą porcję roztworu NaOH o objętości
o 1- 2 cm
3
mniejszej od oszacowanej w 1 miareczkowaniu wartości PRM
i dalej dodając porcjami o objętości 0,2 cm
3
.
7. Wyniki pomiarów zestawić w tabeli 1.
II. Miareczkowanie słabego kwasu mocną zasadą:
1. Badany roztwór CH
3
COOH rozcieńczyć w kolbie miarowej wodą destylowaną do kreski
miarowej.
2. Dalszy tok postępowania jak w punkcie I.
3.Wyniki pomiarów zestawić w tabeli 2.
Roztwór kwasu
Roztwór
NaOH
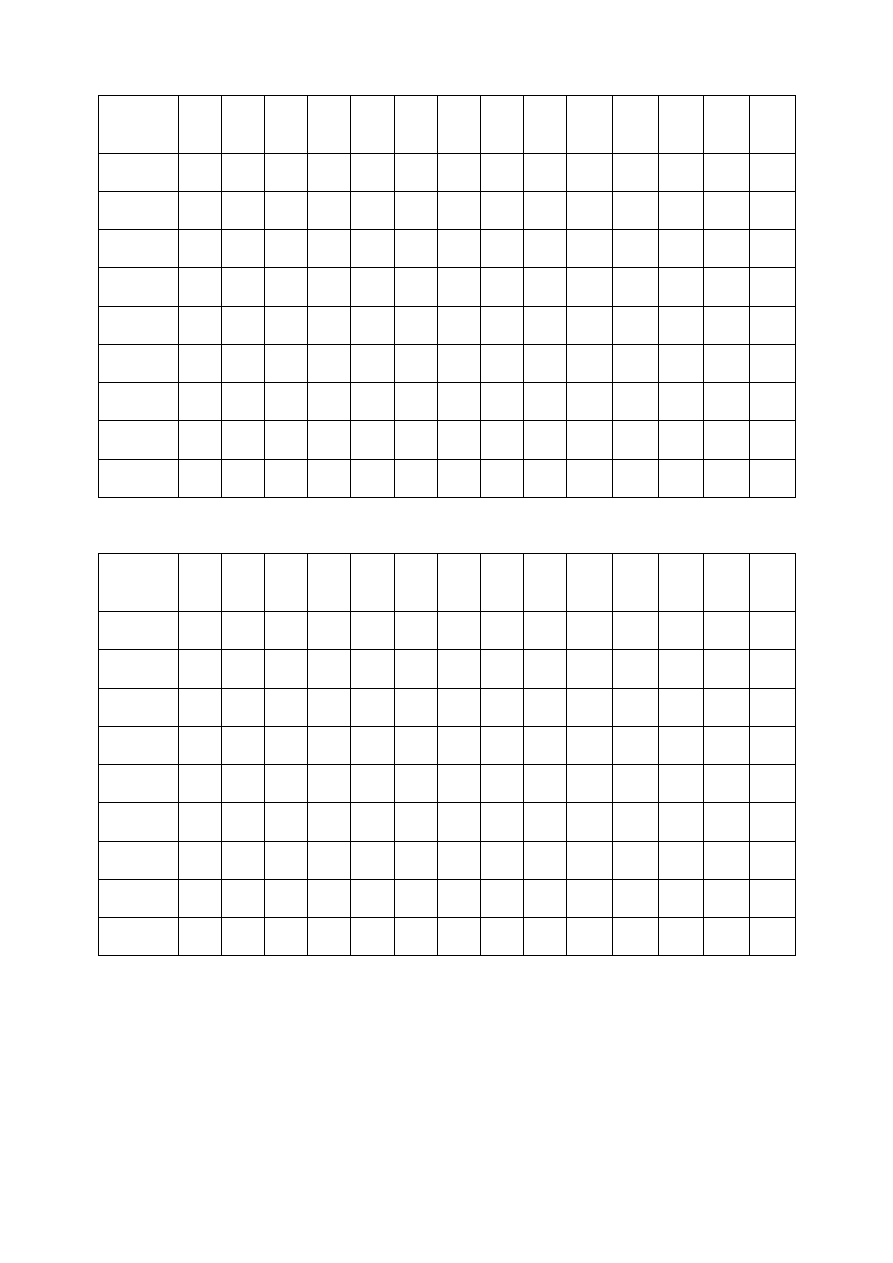
Tabela 1. Miareczkowanie mocnego kwasu mocną zasadą:
Nr
pomiaru
1
2
3
4
5
6
7
8
9
10
11
12
13
14
V
z
[cm
3
]
pH
ΔpH/ΔV
z
V
z
[cm
3
]
pH
ΔpH/ΔV
z
V
z
[cm
3
]
pH
ΔpH/ΔV
z
Tabela 2. Miareczkowanie słabego kwasu mocną zasadą:
Nr
pomiaru
1
2
3
4
5
6
7
8
9
10
11
12
13
14
V
z
[cm
3
]
pH
ΔpH/ΔV
z
V
z
[cm
3
]
pH
ΔpH/ΔV
z
V
z
[cm
3
]
pH
ΔpH/ΔV
z
Otrzymany wynik: c
HCl
= ……………………..……………………………………………....,
Masa HCl w badanym roztworze: m
HCl
= ……………….…………..………………….……..
Otrzymany wynik: c
CH3COOH
= …………………………………………………….…..……..,
Masa CH
3
COOH w badanym roztworze: m
CH3COOH
= …………………..………………
Wyszukiwarka
Podobne podstrony:
analiza ilosciowa 2 id 60539 Nieznany
analiza ilosciowa 4 id 60540 Nieznany (2)
analiza ilosciowa 9 id 60543 Nieznany (2)
analiza ilosciowa 7 id 60542 Nieznany (2)
analiza ilosciowa 2 id 60539 Nieznany
Elementy analizy ilosciowej id Nieznany
analiza notatki 3 id 559208 Nieznany (2)
Analiza struktury id 61534 Nieznany (2)
Analiza czynnikowa id 59935 Nieznany (2)
Darfur analiza kryzysu id 13186 Nieznany
Analiza Finansowa 3 id 60193 Nieznany (2)
Analiza finansowhga id 60398 Nieznany (2)
IMW W02 analiza stanow id 21233 Nieznany
Analiza krancowa id 60743 Nieznany (2)
analiza skupien id 61367 Nieznany
Analiza termiczna id 61671 Nieznany (2)
Analiza biochemiczna id 59863 Nieznany
analiza wzory id 61812 Nieznany (2)
więcej podobnych podstron