
Wyk
Wyk
ł
ł
ad 7
ad 7
Podstawy chemii organicznej
Hybrydyzacja sp
3,
sp
2
, sp
Budowa metanu, etanu, etenu i etynu
Nomenklatura alkanów
Konformacja alkanów
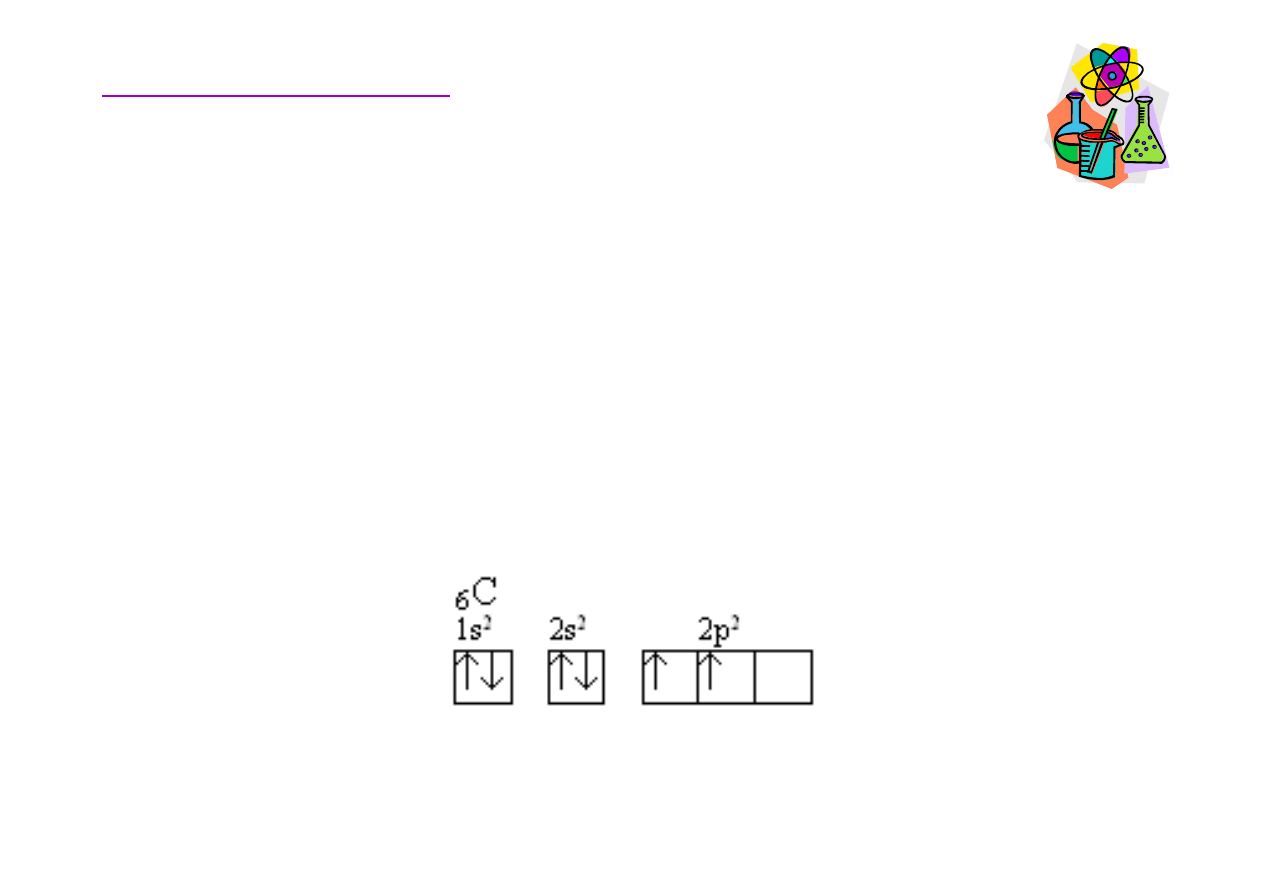
W
ę
giel
Atom w
ę
gla posiada cztery elektrony walencyjne, dwa na
orbitalu 2s i po jednym na orbitalach 2p
x
i 2p
y
, orbital 2p
z
jest pusty. Taka konfiguracja elektronowa wskazuje,
ż
e do
tworzenia wi
ą
za
ń
dost
ę
pne s
ą
tylko 2 elektrony.
Podstawy chemii organicznej
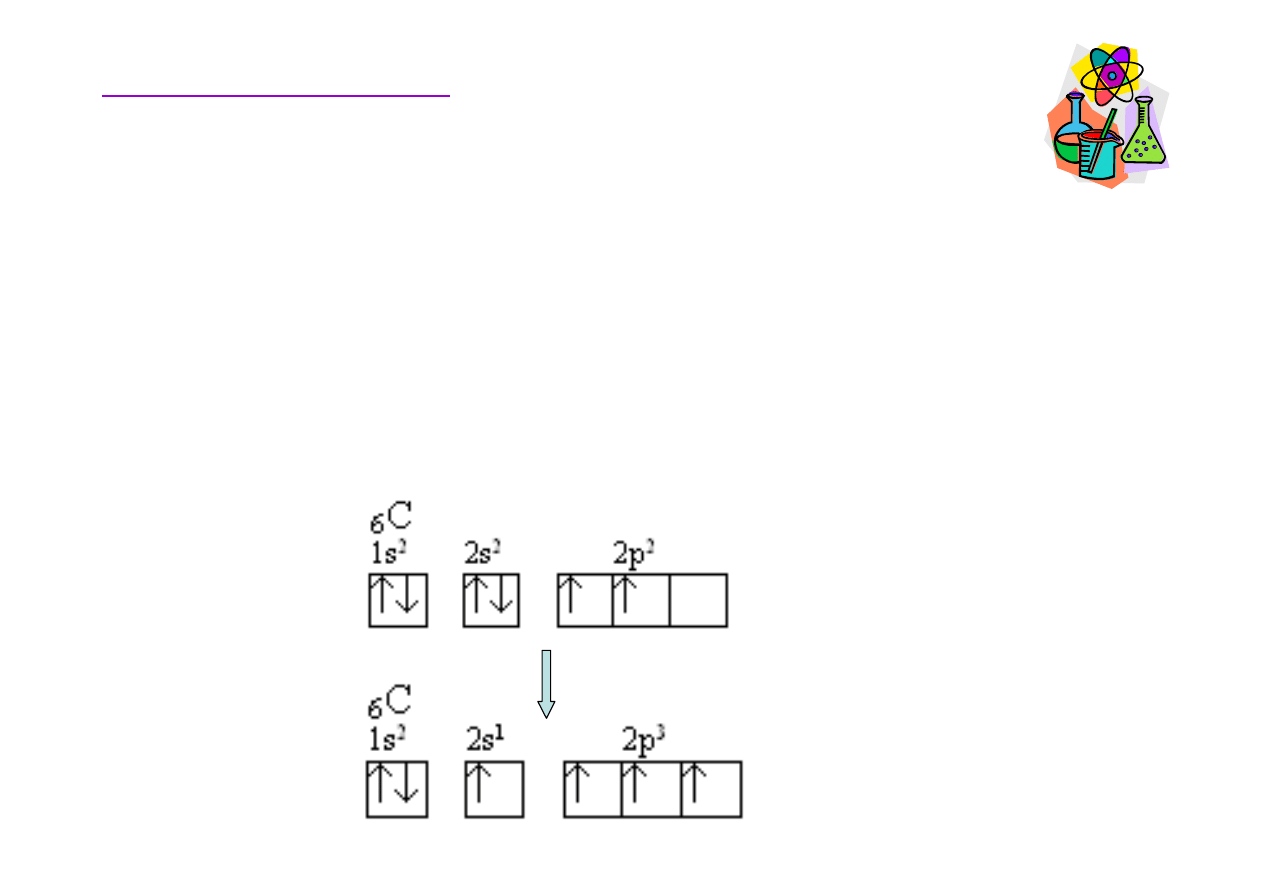
W
ę
giel
Jeden z elektronów z orbitalu 2s podczas tworzenia
wi
ą
zania jest przenoszony na pusty orbital 2p
z
(promocja
elektronu – wzbudzenie go na wy
ż
szy poziom
energetyczny), co powoduje,
ż
e w
ę
giel zyskuje cztery
niesparowane elektrony i mo
ż
e utworzy
ć
cztery wi
ą
zania.
Podstawy chemii organicznej
Konfiguracja elektronowa w
stanie podstawowym
Konfiguracja elektronowa w
stanie wzbudzonym
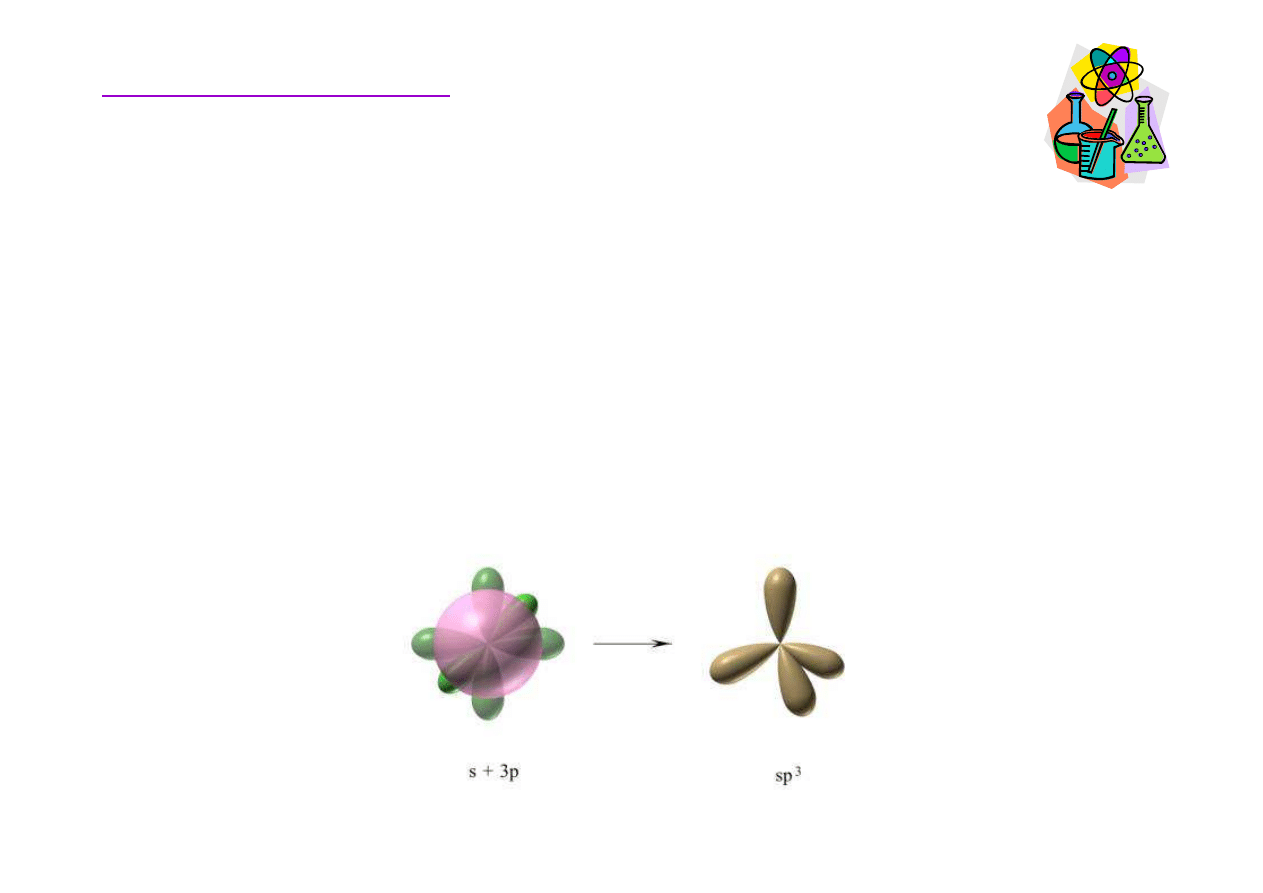
W
ę
giel - hybrydyzacja orbitali
W stanie wzbudzonym orbital 2s i trzy orbitale 2p (2p
x
, 2p
y
, 2p
z
)
nakładaj
ą
si
ę
na siebie (hybrydyzuj
ą
). W efekcie powstaj
ą
cztery równocenne energetycznie orbitale zhybrydyzowane
sp
3
. Proces ten ma miejsce tylko podczas tworzenia wi
ą
za
ń
i
jest nazywany hybrydyzacj
ą
orbitali.
Podstawy chemii organicznej
http://zasoby1.open.agh.edu.pl/dydaktyka/chemia/a_e_chemia/1_3_budowa_materii/01_04_03_2b.html
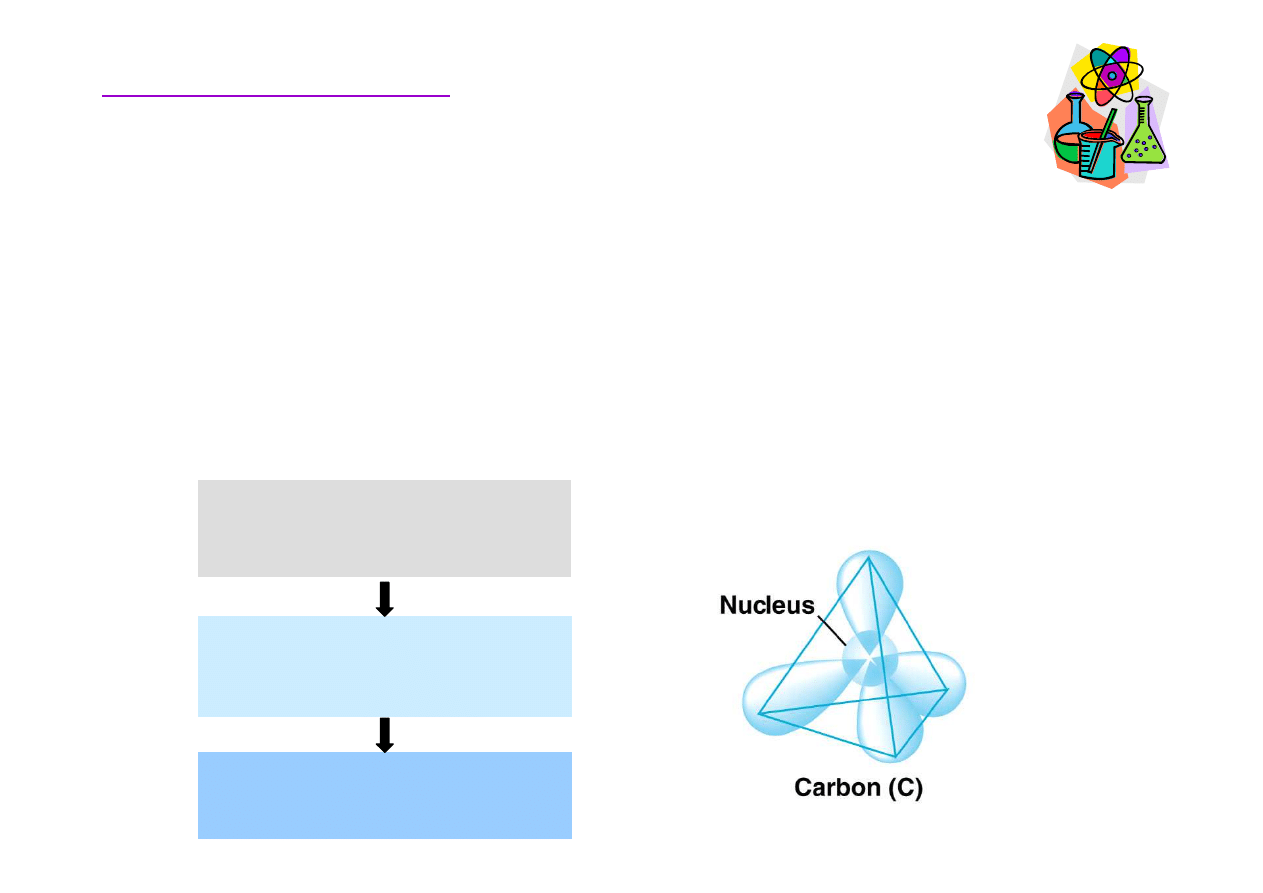
W
ę
giel - hybrydyzacja orbitali
Hybrydyzacja
→
nakładanie si
ę
(mieszanie) orbitali
atomowych podczas tworzenia si
ę
wi
ą
za
ń
, w wyniku czego
powstaj
ą
orbitale zhybrydyzowane (ró
ż
ni
ą
ce si
ę
kształtem i
energi
ą
od wyj
ś
ciowych orbitali atomowych).
Podstawy chemii organicznej
2p
z
2p
y
2p
x
2s
1s
↑
↑
↑↓
↑↓
C
sp
3
sp
3
sp
3
sp
3
1s
↑
↑
↑
↑
↑↓
C*
2p
z
2p
y
2p
x
2s
1s
↑
↑
↑
↑
↑↓
C*
http://iws.collin.edu/biopage/faculty/mcculloch/1406/outlines/chapter%204/Ma2-6.JPG
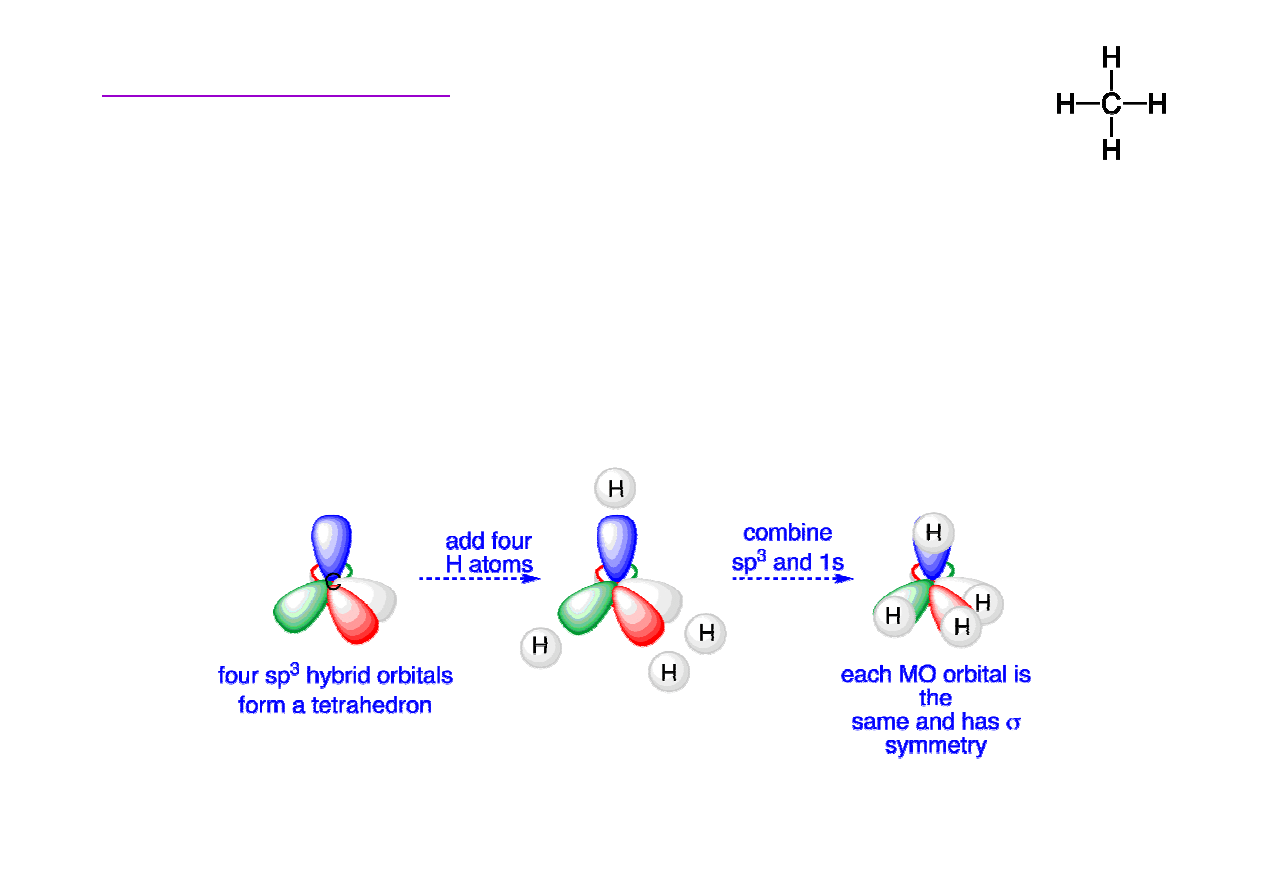
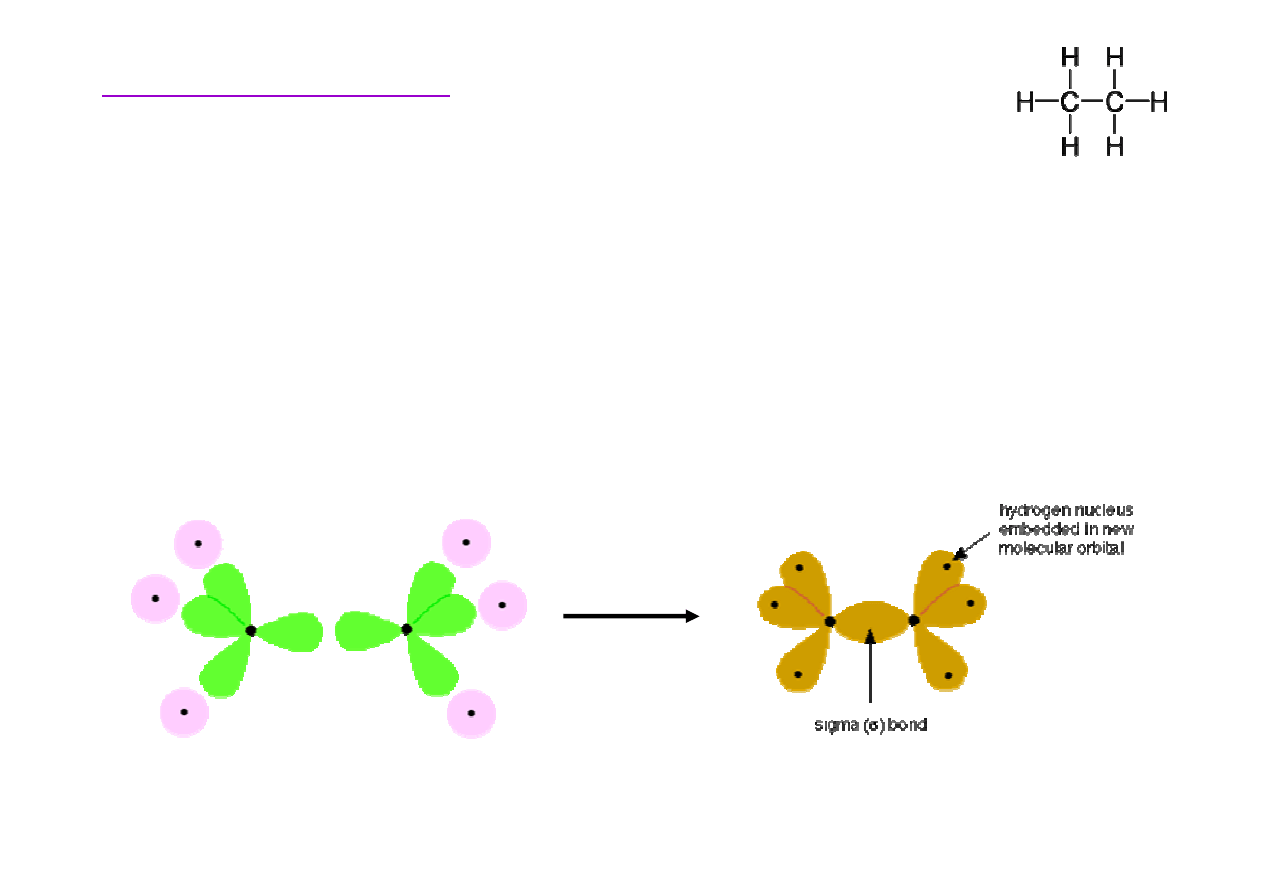
Metan – wi
ą
zania
σ
W cz
ą
steczce CH
4
, ka
ż
dy z czterech orbitali
shybrydyzowanych sp
3
nakłada si
ę
z orbitalem 1s
wodoru, w wyniku czego powstaj
ą
cztery identyczne
wi
ą
zania
σ
(o tej samej sile i długo
ś
ci).
Podstawy chemii organicznej
http://www.chemtube3d.com/orbitalshybrid.html
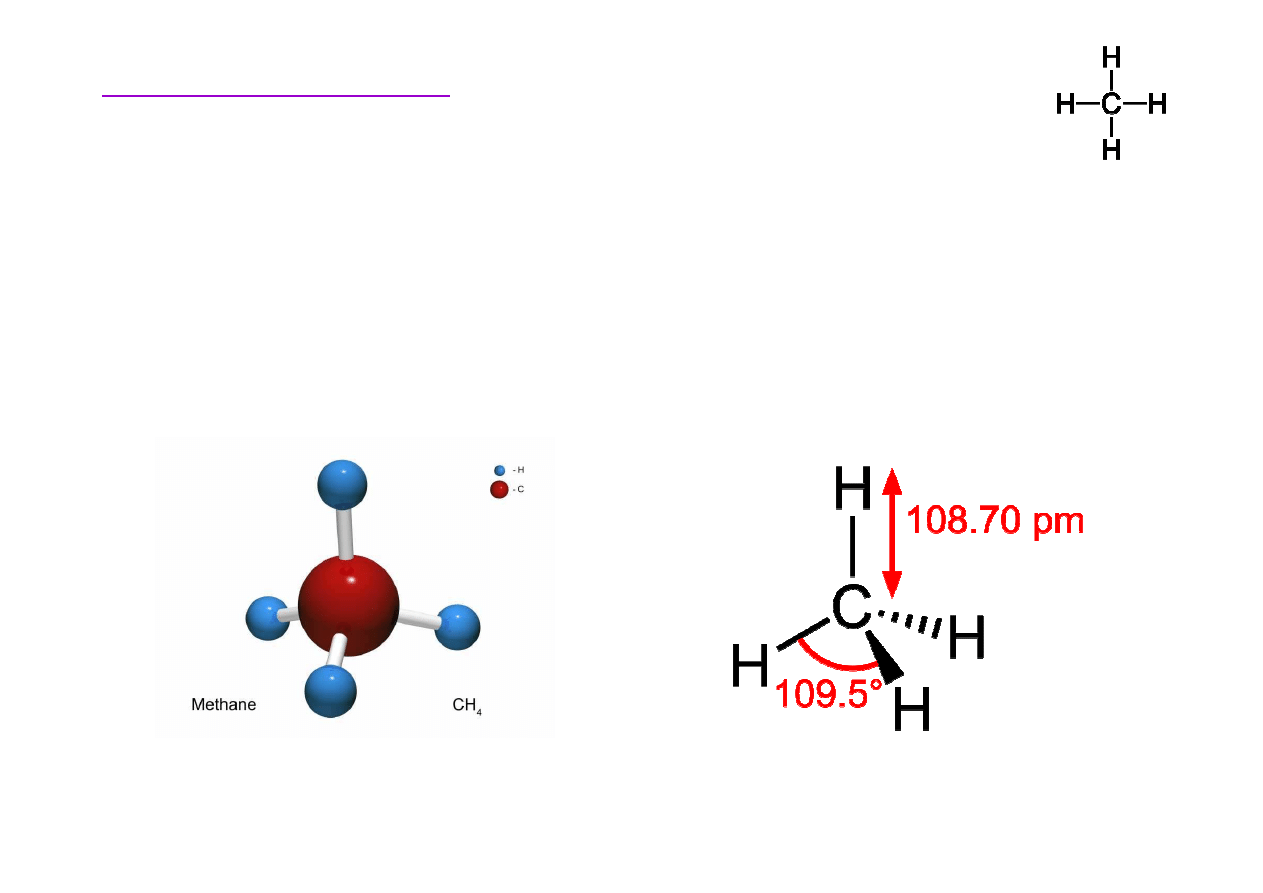
Metan
Metan – najprostszy zwi
ą
zek organiczny, cz
ą
steczka ma
kształt tetraedru (czworo
ś
cianu foremnego), z czterema
równocennymi wi
ą
zaniami C-H (k
ą
ty pomi
ę
dzy
wi
ą
zaniami wynosz
ą
109°28 ').
Podstawy chemii organicznej
http://www.earthtimes.org/pollution/scientists-
doubt-microbes-consumed-deepwater-horizon-
methane-plume/928/
http://en.wikipedia.org/wiki/File:Methane-2D-dimensions.svg
Wi
ą
zania w
ę
giel-wodór
Wszystkie wi
ą
zania w
ę
giel-wodór s
ą
wi
ą
zaniami
σ
, w
alkanach powstaj
ą
poprzez nakładanie si
ę
orbitali sp
3
w
ę
gla i orbitali s wodoru. Wi
ą
zania C-H s
ą
silne i trwałe.
Podstawy chemii organicznej
σ
s–hybrid
http://en.wikipedia.org/wiki/Sigma_bond
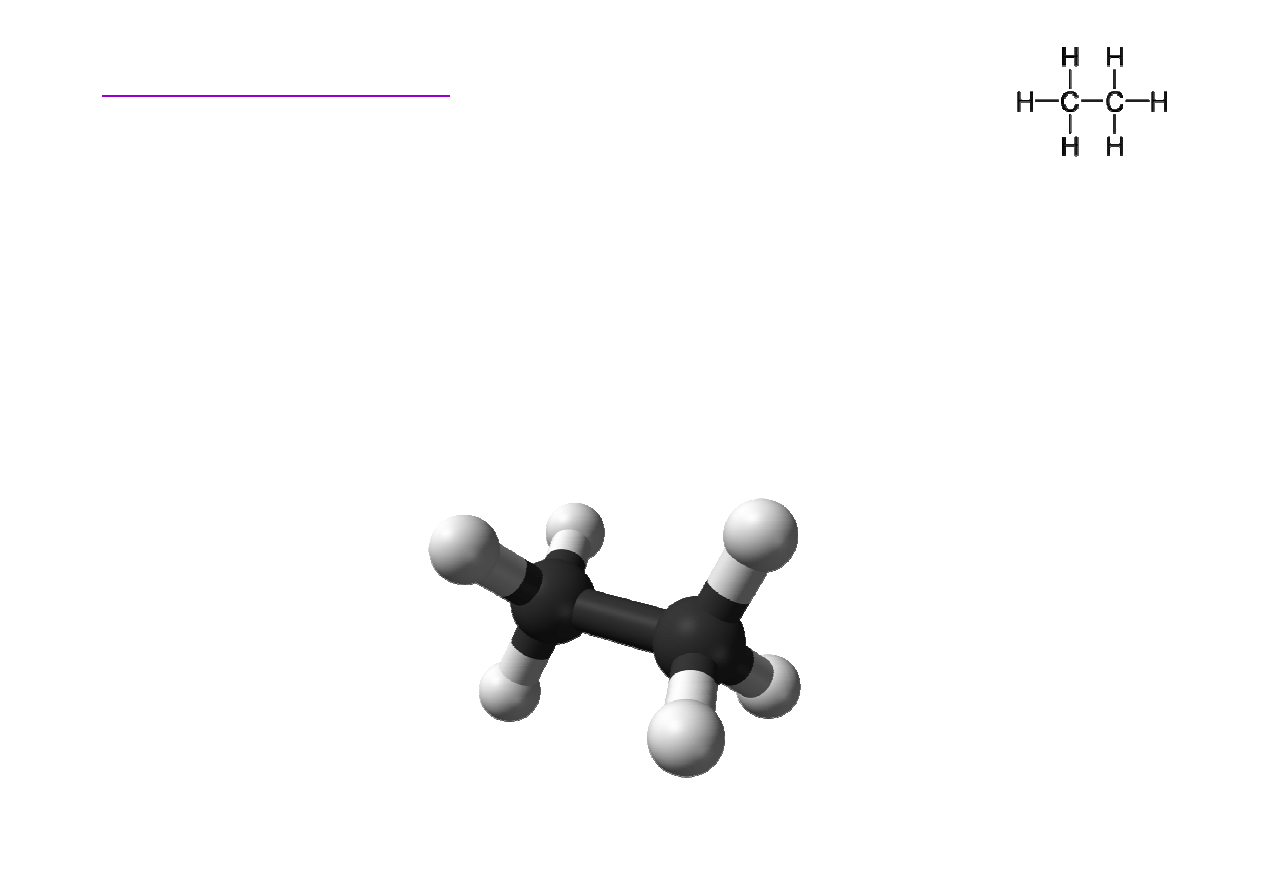
Struktura etanu
Wi
ą
zania tworzone przez atomy w
ę
gla w cz
ą
steczce etanu
(C
2
H
6
), jak równie
ż
w innych alkanach ka
ż
dy z atomów
mo
ż
e utworzy
ć
cztery wi
ą
zania skierowane ku naro
ż
om
tetraedru.
Podstawy chemii organicznej
http://en.wikipedia.org/wiki/Ethane
Struktura etanu
Wi
ą
zanie w
ę
giel-w
ę
giel w etanie to wi
ą
zanie
σ
stworzone
przez dwa nakładaj
ą
ce si
ę
orbitale sp
3
. Tak
ż
e wi
ą
zania
w
ę
giel-wodór to wi
ą
zania
σ
(orbital sp
3
w
ę
gla i orbital s
wodoru).
Podstawy chemii organicznej
http://www.chemguide.co.uk/basicorg/bonding/methane.html
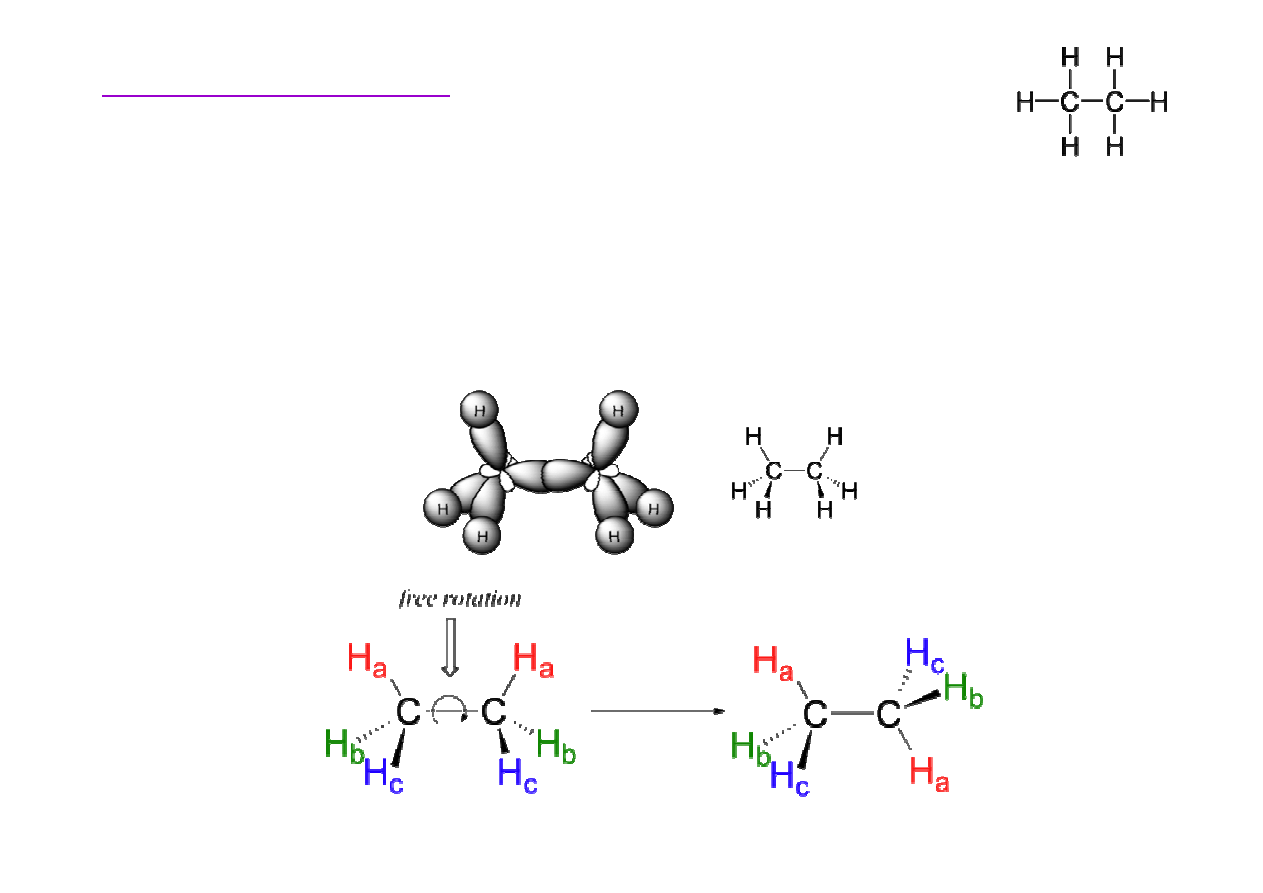
Struktura etanu
Wi
ą
zanie
σ
(powstałe dzi
ę
ki współosiowemu nakładaniu
si
ę
orbitali atomowych ) ł
ą
cz
ą
ce dwa atomy umo
ż
liwia
swobodny obrót.
Podstawy chemii organicznej
http://chemwiki.ucdavis.edu/Organic_Chemistry/Organic_Chemistry_With_a_Biological_Emphasis/Chapter__1%3A_
Budowa etenu
Dwa atomy w
ę
gla mog
ą
dzieli
ć
dwie pary elektronów
→
podwójne wi
ą
zanie w
ę
giel-w
ę
giel.
Alkeny – w
ę
glowodory, których cz
ą
steczki zawieraj
ą
wi
ą
zanie podwójne w
ę
giel – w
ę
giel.
Eten (inaczej etylen) – najprostszy alken.
Podstawy chemii organicznej
https://sites.google.com/site/ed350201003/Task
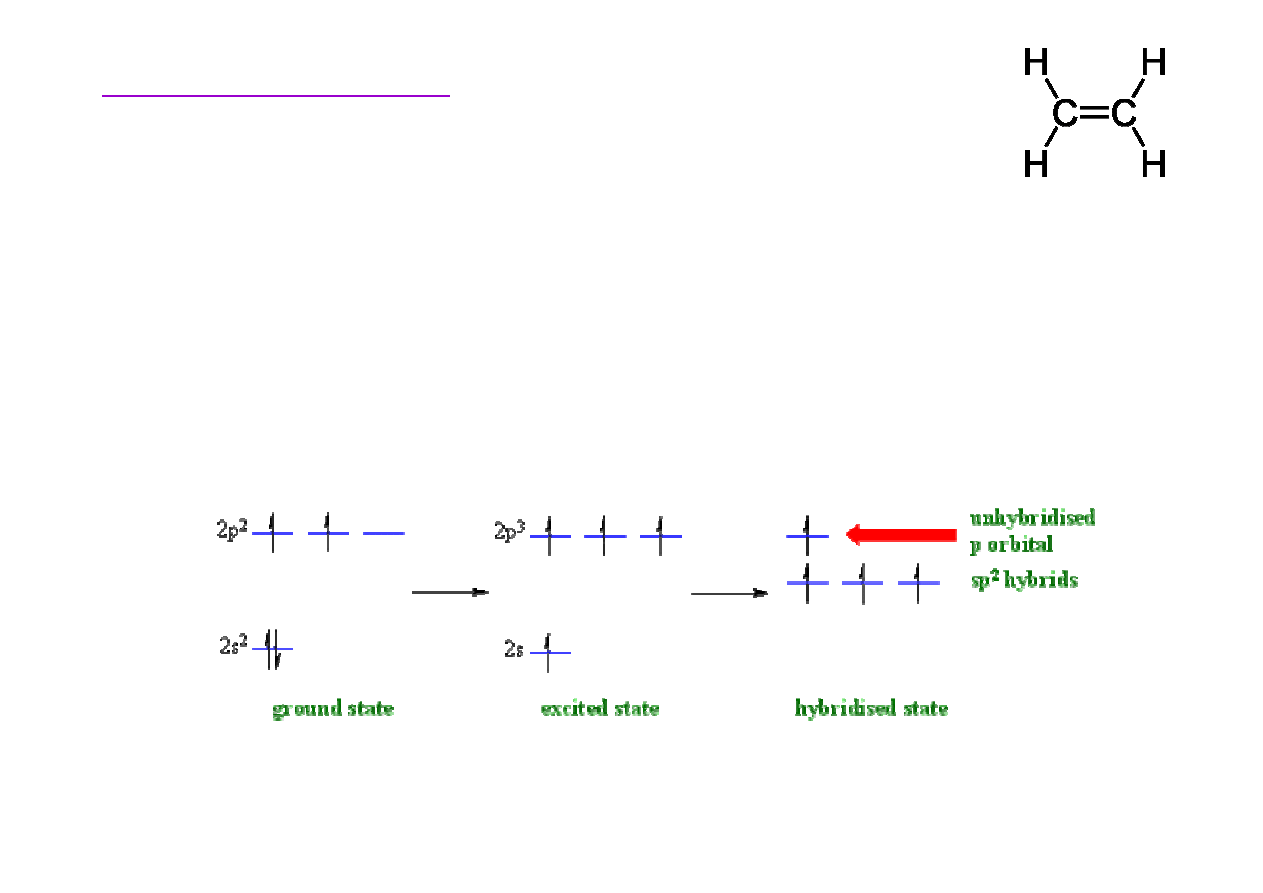
Budowa etenu
sp
2
orbitals – orbital 1s miesza si
ę
(hybrydyzuje) z dwoma
orbitalami 2p co prowadzi do powstania trzech orbitali sp
2
.
Jeden orbital 2p nie podlega hybrydyzacji.
Podstawy chemii organicznej
http://www.mhhe.com/physsci/chemistry/carey5e/Ch02/ch2-3-2.html
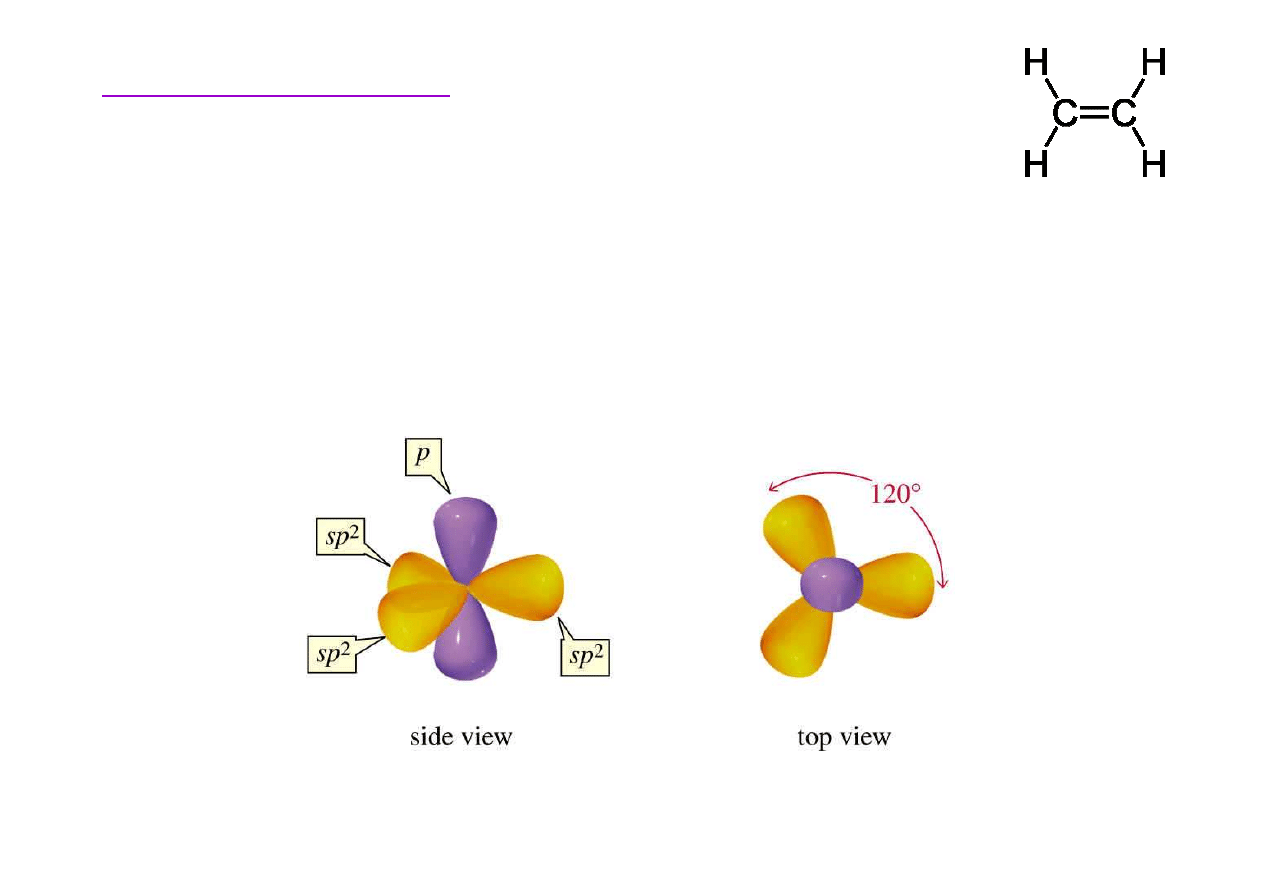
Budowa etenu
Trzy orbitale sp
2
orbitals s
ą
skierowane do wierzchołków
trójk
ą
ta równobocznego (k
ą
t pomi
ę
dzy nimi wynosi 120°).
Podstawy chemii organicznej
http://personal.monm.edu/gebauer_peter/chem_230/Lect_pages/Bruice_jpgs&pgs/sp2_hybrids.html
Budowa etenu
Podstawy chemii organicznej
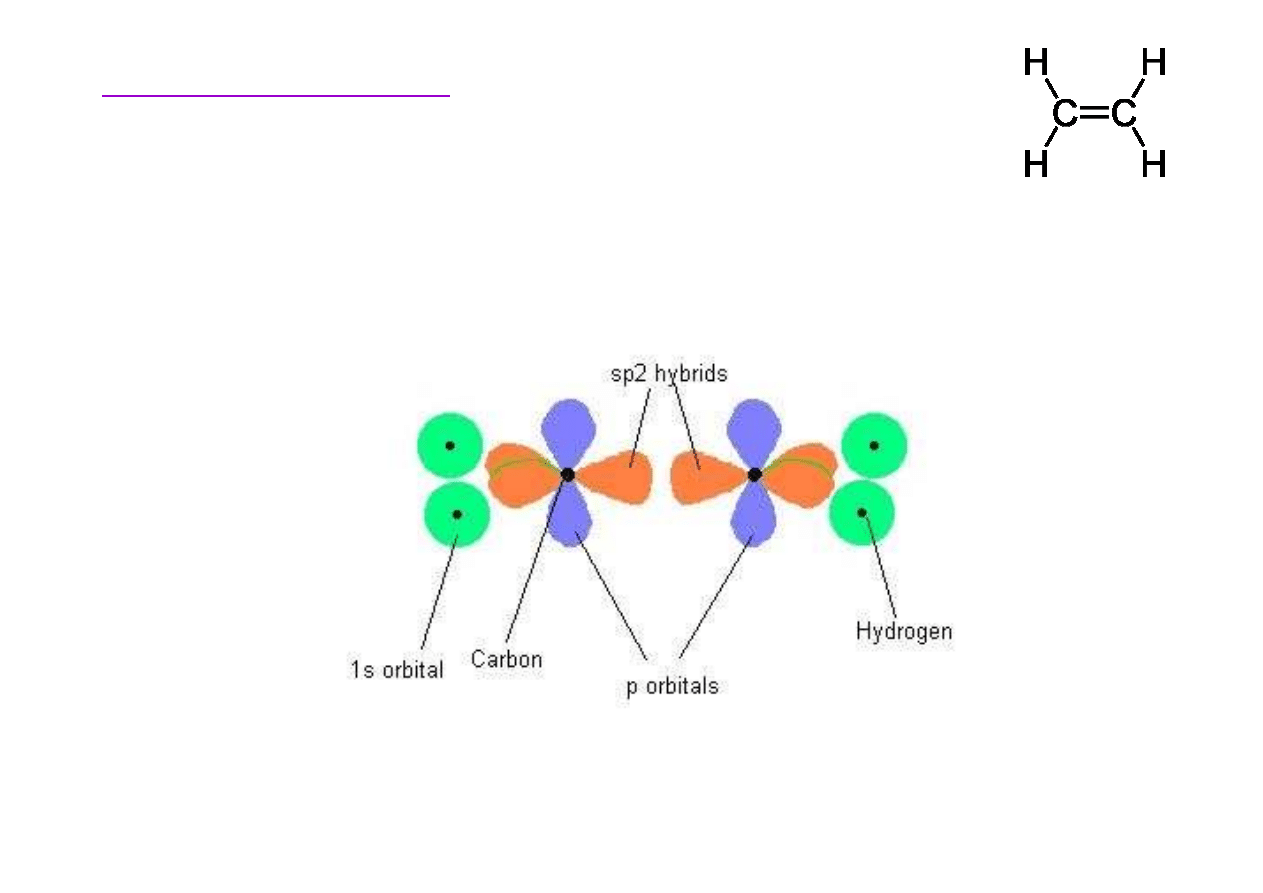
Budowa etenu
• 4 wi
ą
zania C-H powstaj
ą
poprzez oddziaływanie orbitali
sp
2
w
ę
gla z orbitalem 1s wodoru (
czerwone strzałki
)
• jedno wi
ą
zanie C-C powstaje przez oddziaływanie
orbitali sp
2
obu atomów w
ę
gla (
zielona strzałka
)
• Jedno wi
ą
zanie C-C powstaje przez oddziaływanie
orbitali p obu atomów w
ę
gla p (czarne strzałki)
Podstawy chemii organicznej
http://www.mhhe.com/physsci/chemistry/carey5e/Ch02/ch2-3-2.html
Budowa etenu
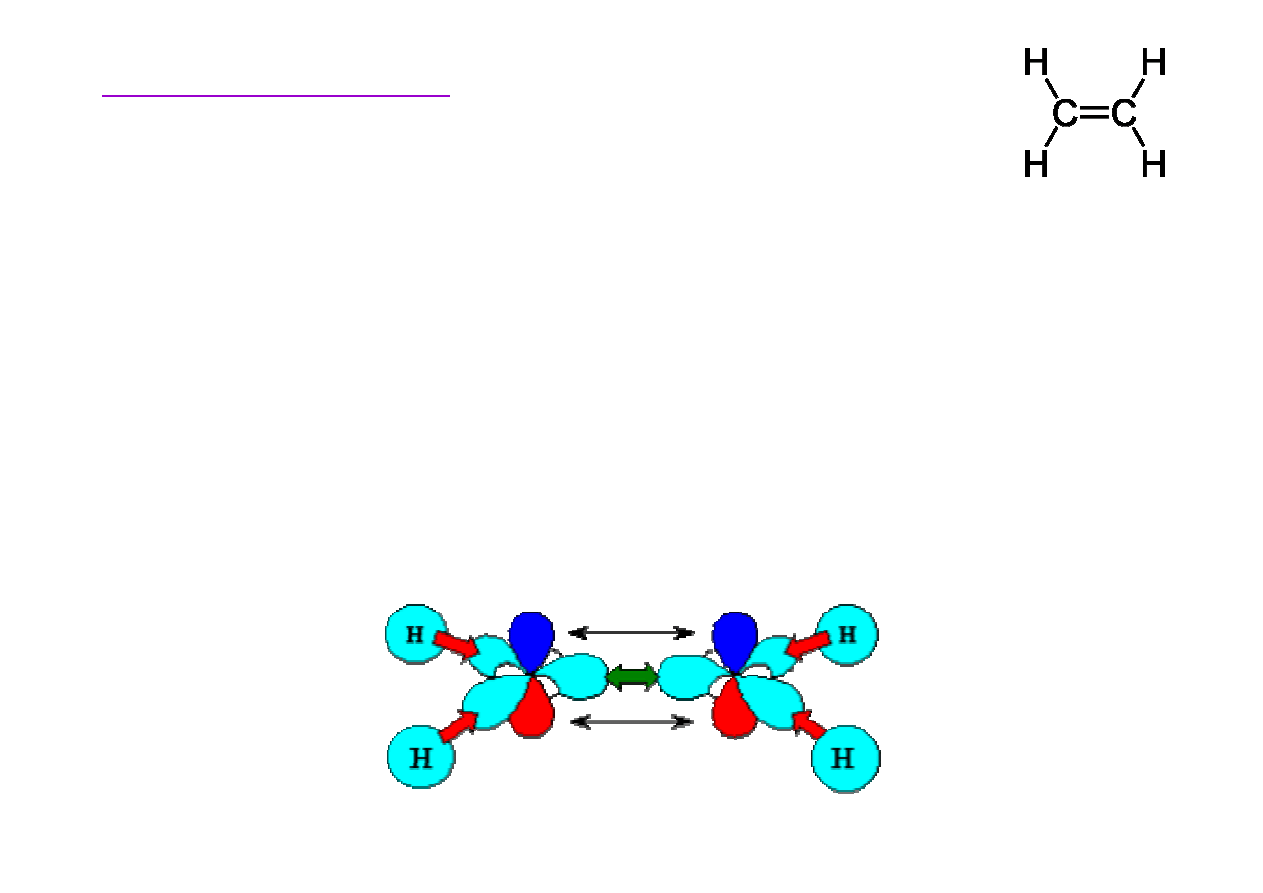
Podstawy chemii organicznej
Orbitale tworz
ą
ce wi
ą
zanie
π
http://wps.prenhall.com/wps/media/objects/340/348272/wade_ch06.html
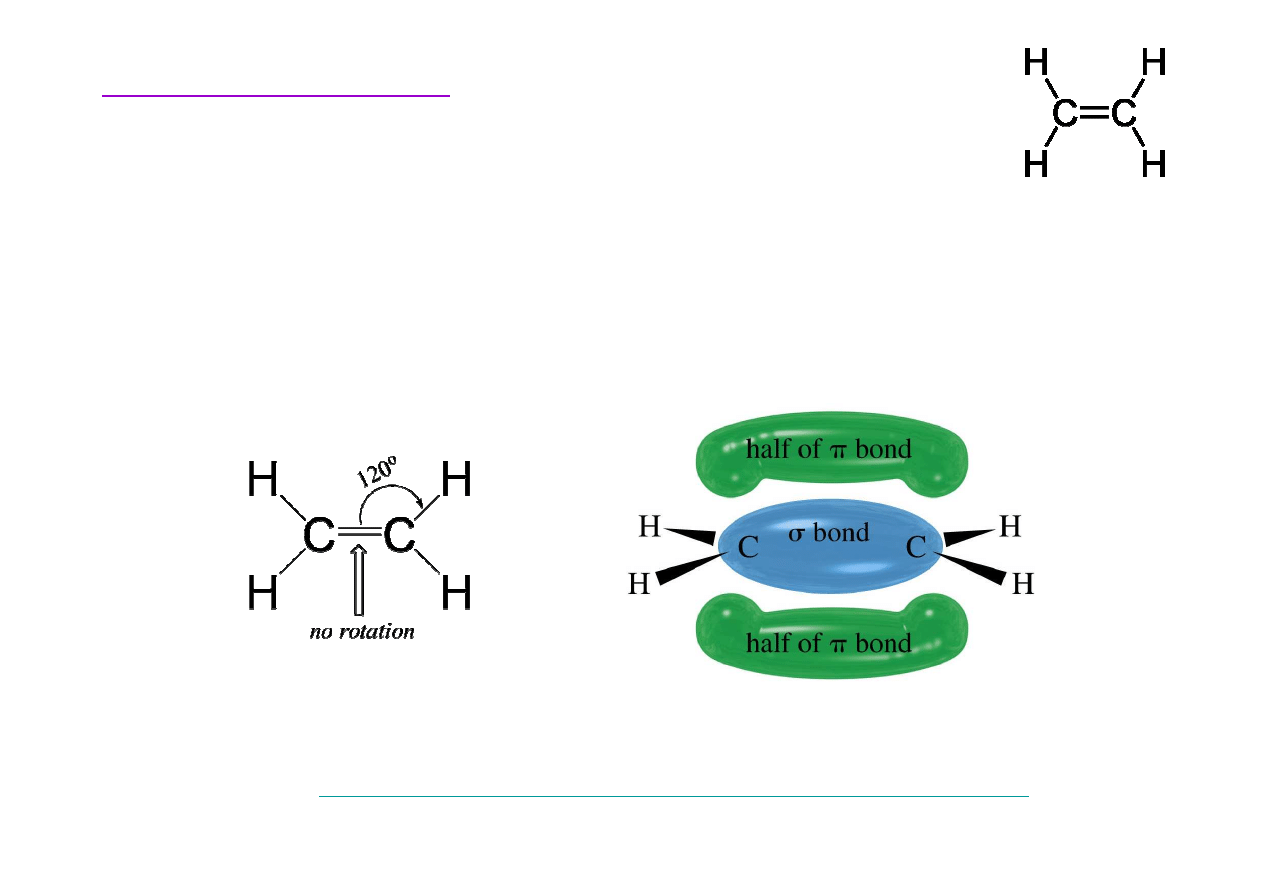
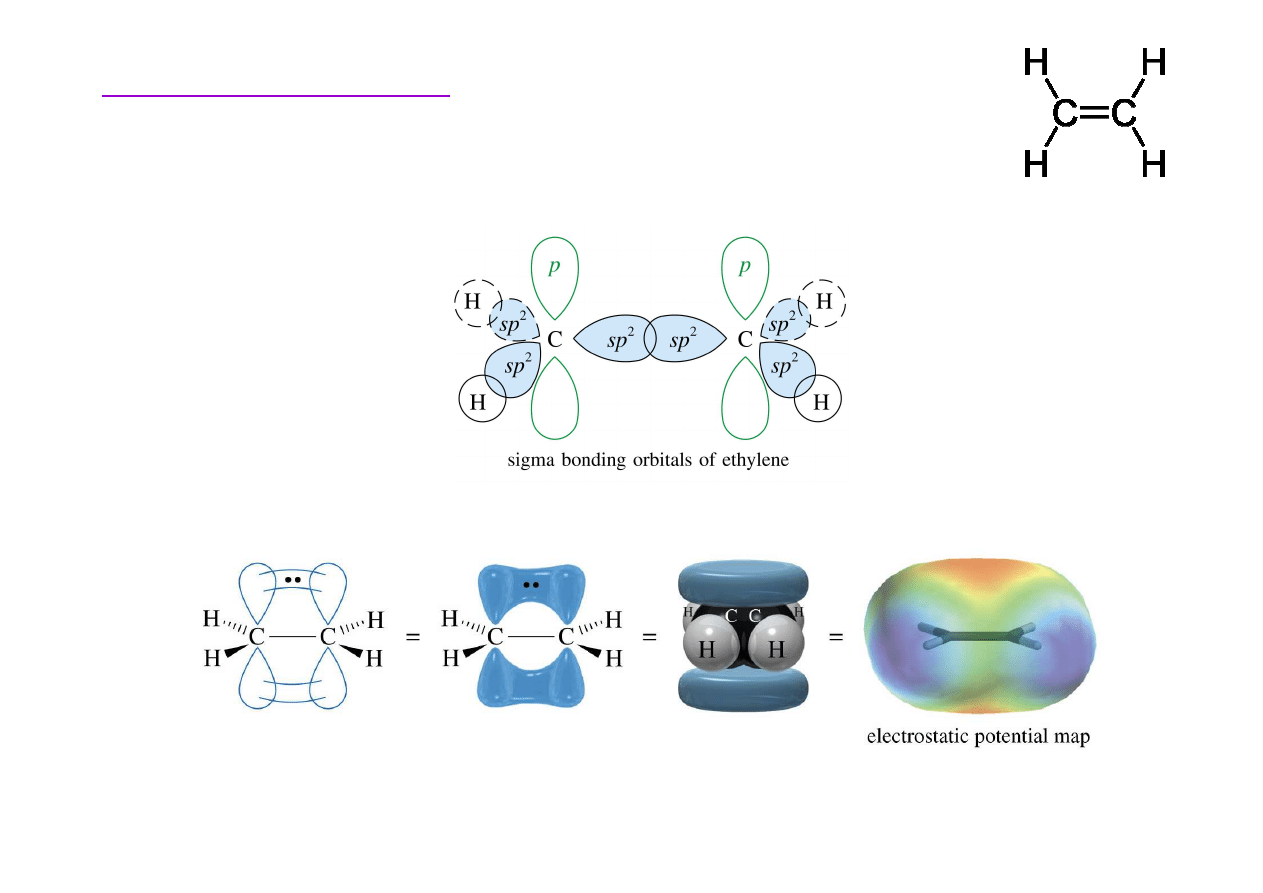
Budowa etenu
Istnieje du
ż
a bariera energetyczna zwi
ą
zana z rotacj
ą
(obrotem) podstawników po obu stronach wi
ą
zania
podwójnego. Eten jest płask
ą
cz
ą
steczk
ą
.
Podstawy chemii organicznej
http://chemwiki.ucdavis.edu/Organic_Chemistry/Organic_Chemistry_With_a_Biological_Emphasis/Chapter__1%3A_Chapter_1%3A_
Introduction_to_organic_structure_and_bonding_I/Section_1.5%3A_Valence_bond_theory%3A_sp,_sp2,_and_sp3_hybrid_orbitals
htt
p:/
/w
ps
.p
re
nh
all.
co
m/w
ps
/m
ed
ia
/o
bje
cts
/3
40
/3
48
27
2/w
ad
e_
ch
02
.h
tm
l
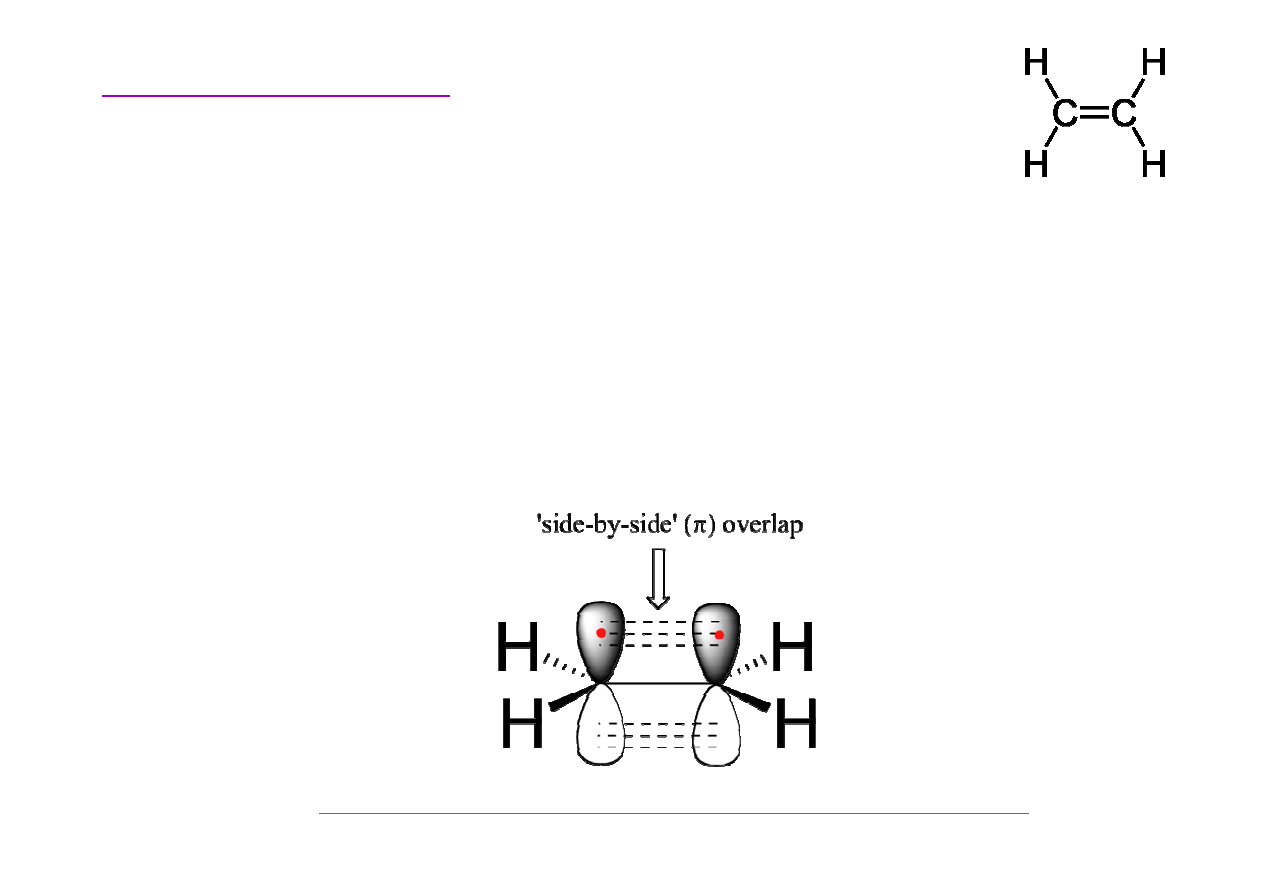
Budowa etenu
Wi
ą
zanie
π
nie podlega rotacji, poniewa
ż
powstaje poprzez
boczne nakładanie orbitali p. Obrót o 90°spowodował by
przesuni
ę
cie orbitali p dwóch s
ą
siaduj
ą
cych atomów w
ę
gla
do poło
ż
e
ń
, w których nie mog
ą
one ju
ż
si
ę
wzajemnie
nakłada
ć
.
Podstawy chemii organicznej
http://chemwiki.ucdavis.edu/Organic_Chemistry/Organic_Chemistry_With_a_Biological_Emphasis/Chapter__1%3A_Chapter_1%3A_
Introduction_to_organic_structure_and_bonding_I/Section_1.5%3A_Valence_bond_theory%3A_sp,_sp2,_and_sp3_hybrid_orbitals
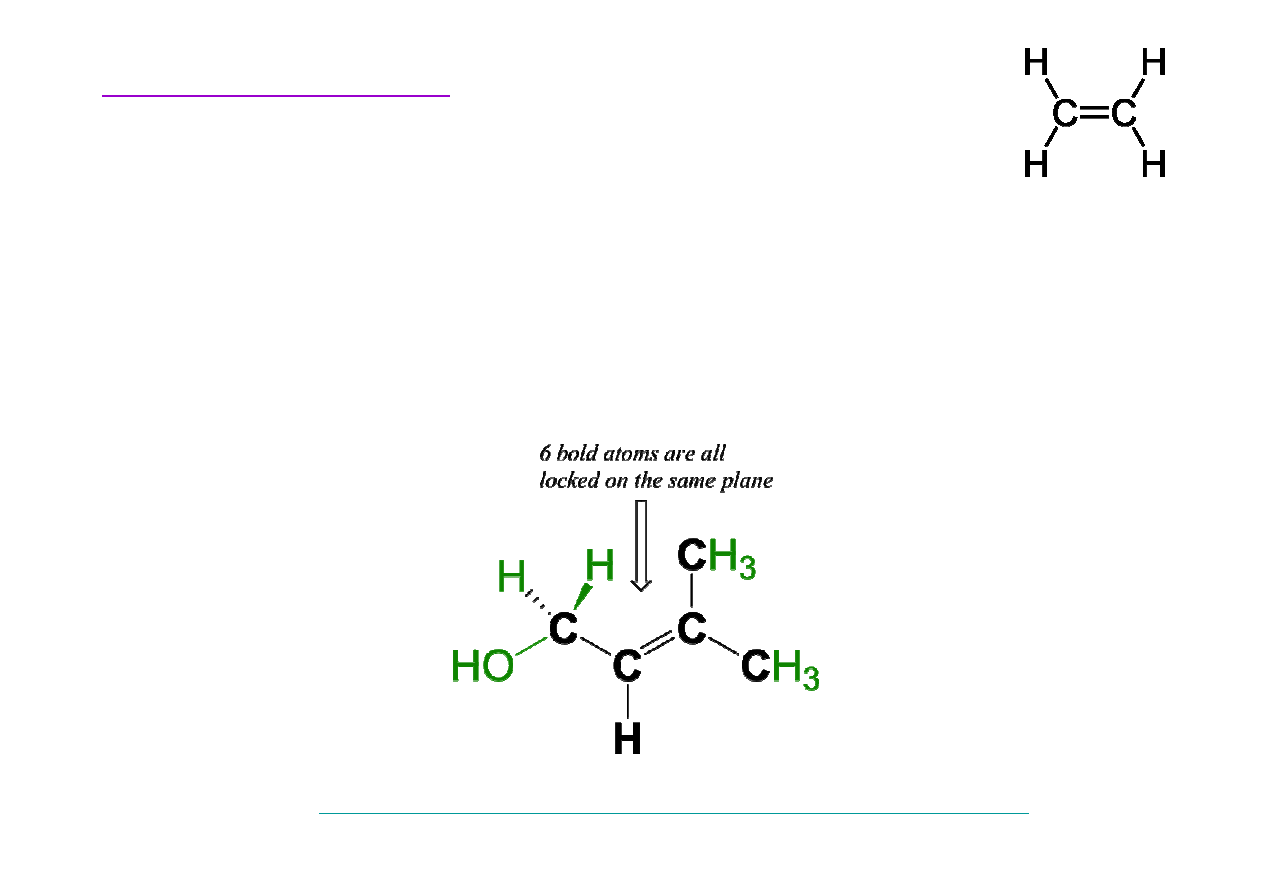
Budowa etenu
Obecno
ść
wi
ą
zania
π
w cz
ą
steczce powoduje,
ż
e sze
ść
atomów (dwa w
ę
gle wi
ą
zania i bezpo
ś
rednio zwi
ą
zane z
nimi atomy) znajduje si
ę
w tej samej płaszczy
ź
nie.
Podstawy chemii organicznej
http://chemwiki.ucdavis.edu/Organic_Chemistry/Organic_Chemistry_With_a_Biological_Emphasis/Chapter__1%3A_Chapter_1%3A_
Introduction_to_organic_structure_and_bonding_I/Section_1.5%3A_Valence_bond_theory%3A_sp,_sp2,_and_sp3_hybrid_orbitals
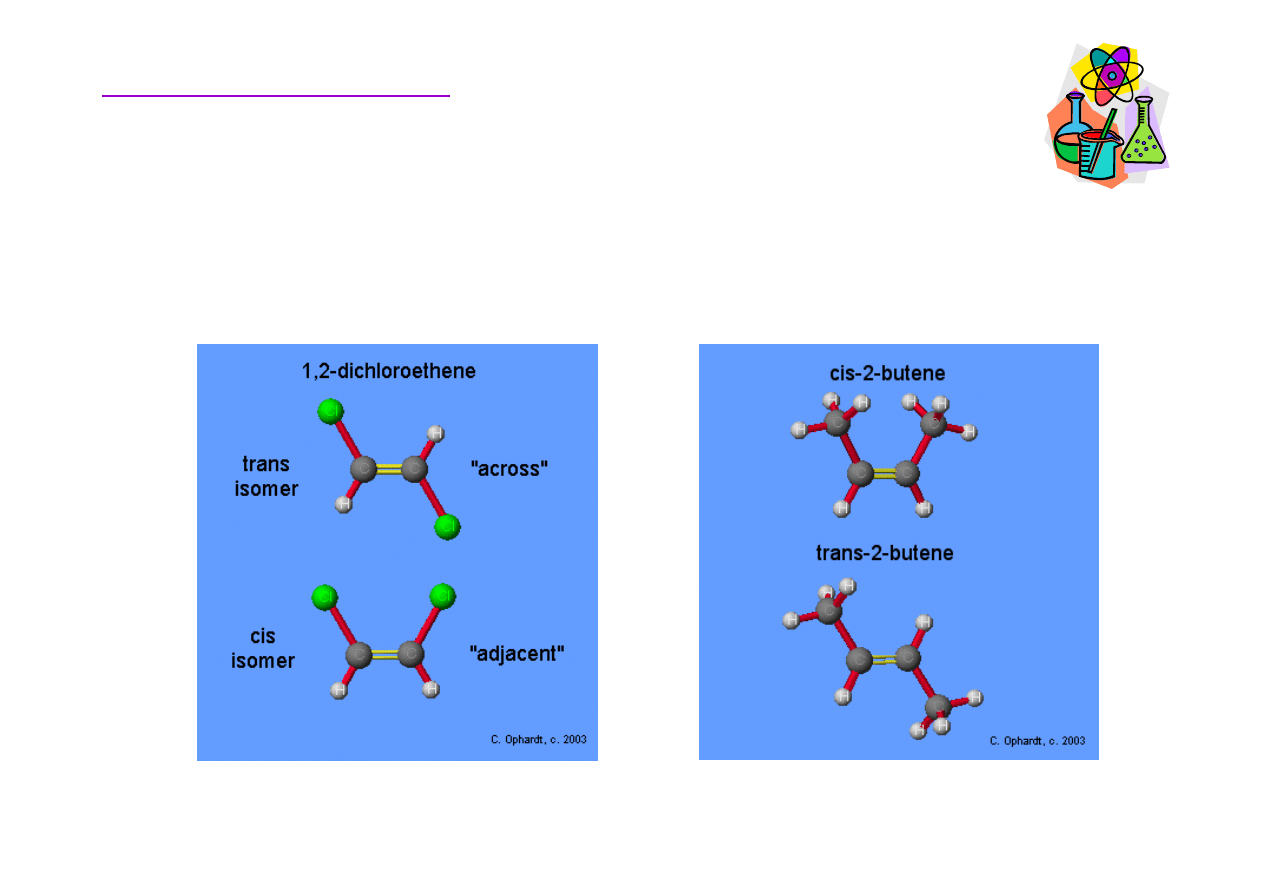
Izomeria cis-trans
• cis, łac. po tej samej stronie
• trans, łac. po drugiej stronie
Podstawy chemii organicznej
http://www.elmhurst.edu/~chm/vchembook/209cistrans.html
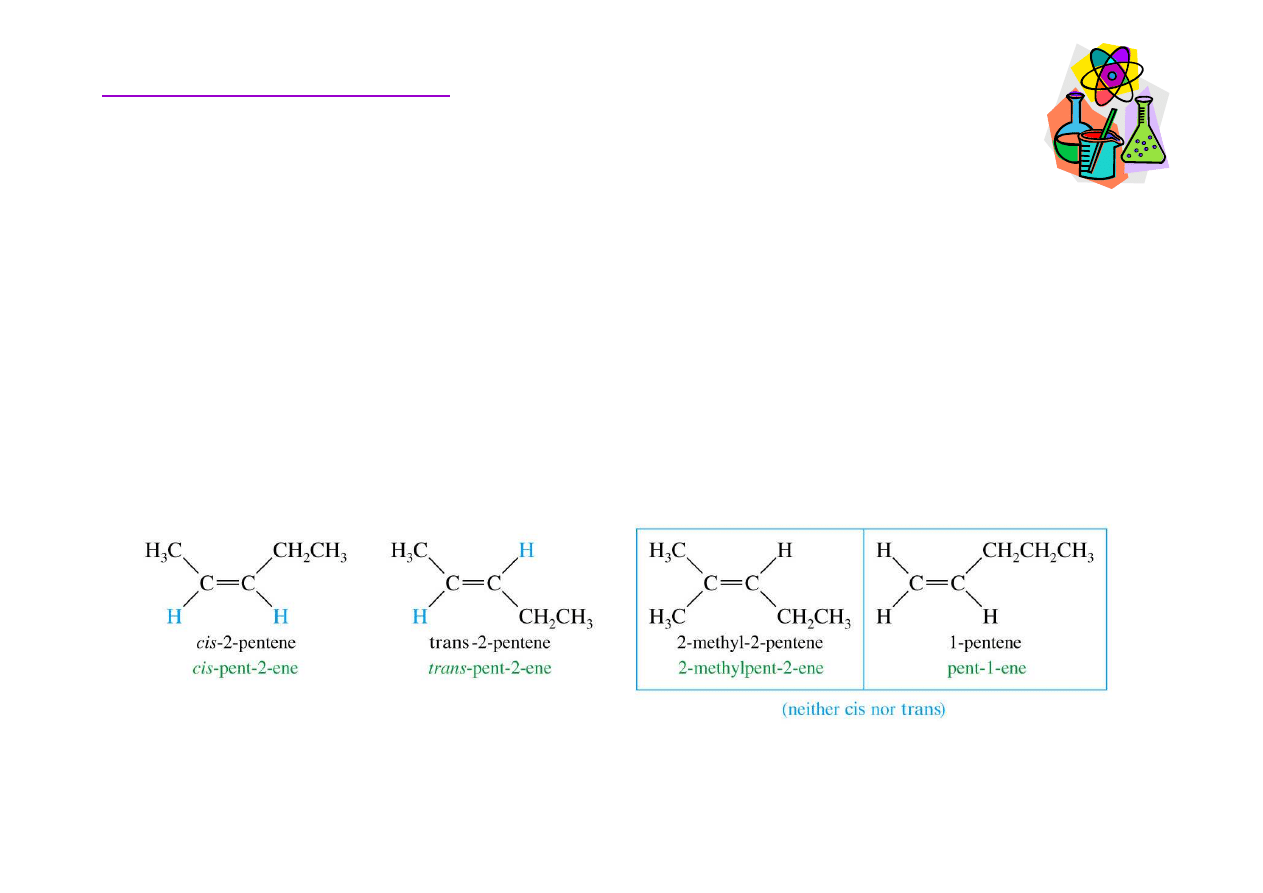
Izomeria cis-trans
Izomeria cis-trans mo
ż
e wyst
ą
pi
ć
tylko wówczas, gdy dwie
grupy poł
ą
czone z atomem w
ę
gla zarówno na jednym i
drugim ko
ń
cu podwójnego wi
ą
zania ró
ż
ni
ą
si
ę
od siebie.
Podstawy chemii organicznej
http://wps.prenhall.com/wps/media/objects/340/348272/wade_ch07.html
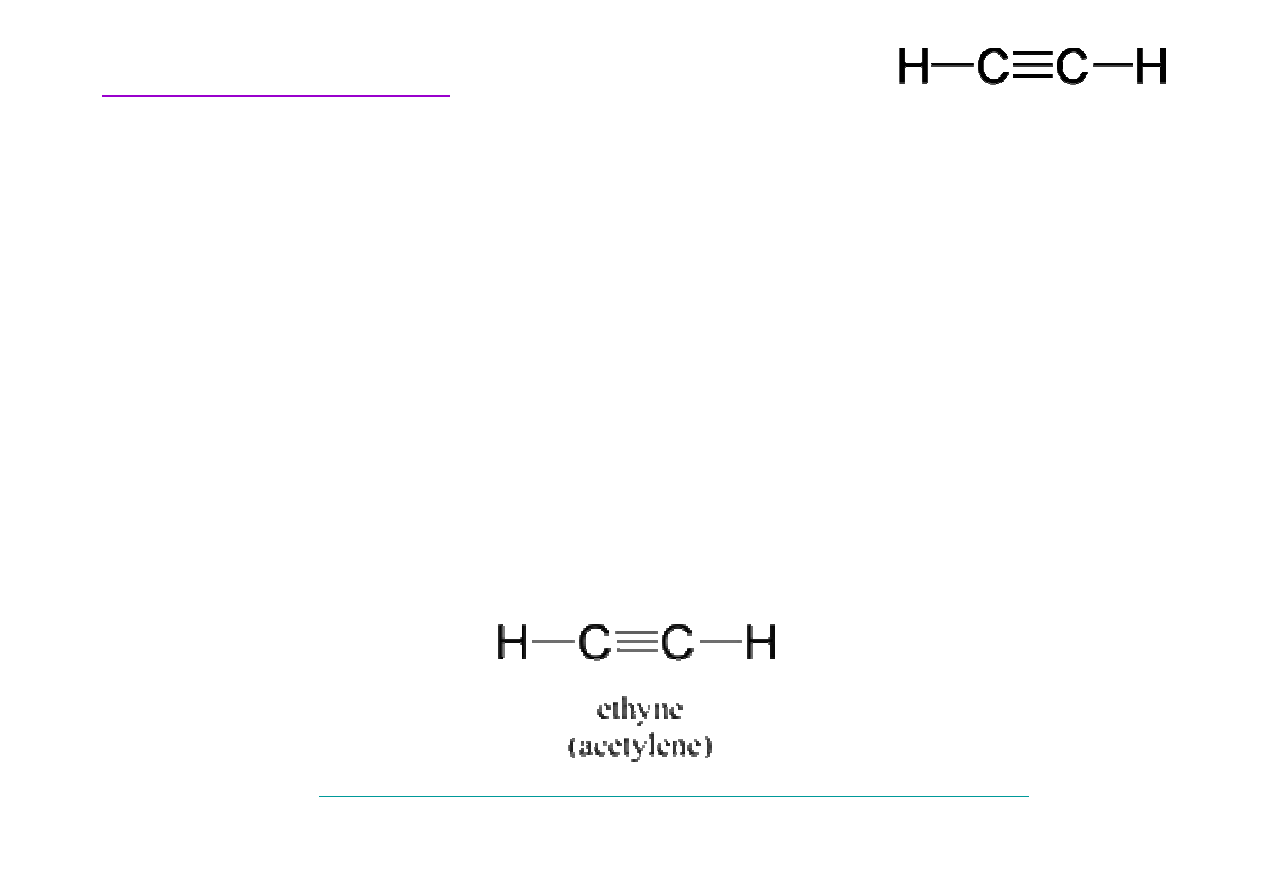
Budowa etynu (acetylenu)
Dwa atomy w
ę
gla mog
ą
dzieli
ć
trzy pary elektronów
→
potrójne wi
ą
zanie w
ę
giel-w
ę
giel.
Alkiny – w
ę
glowodory, których cz
ą
steczki zawieraj
ą
wi
ą
zanie potrójne w
ę
giel – w
ę
giel.
Etyn (inaczej acetylen) – najprostszy alkin.
Podstawy chemii organicznej
http://chemwiki.ucdavis.edu/Organic_Chemistry/Organic_Chemistry_With_a_Biological_Emphasis/Chapter__1%3A_Chapter_1%3A_
Introduction_to_organic_structure_and_bonding_I/Section_1.5%3A_Valence_bond_theory%3A_sp,_sp2,_and_sp3_hybrid_orbitals
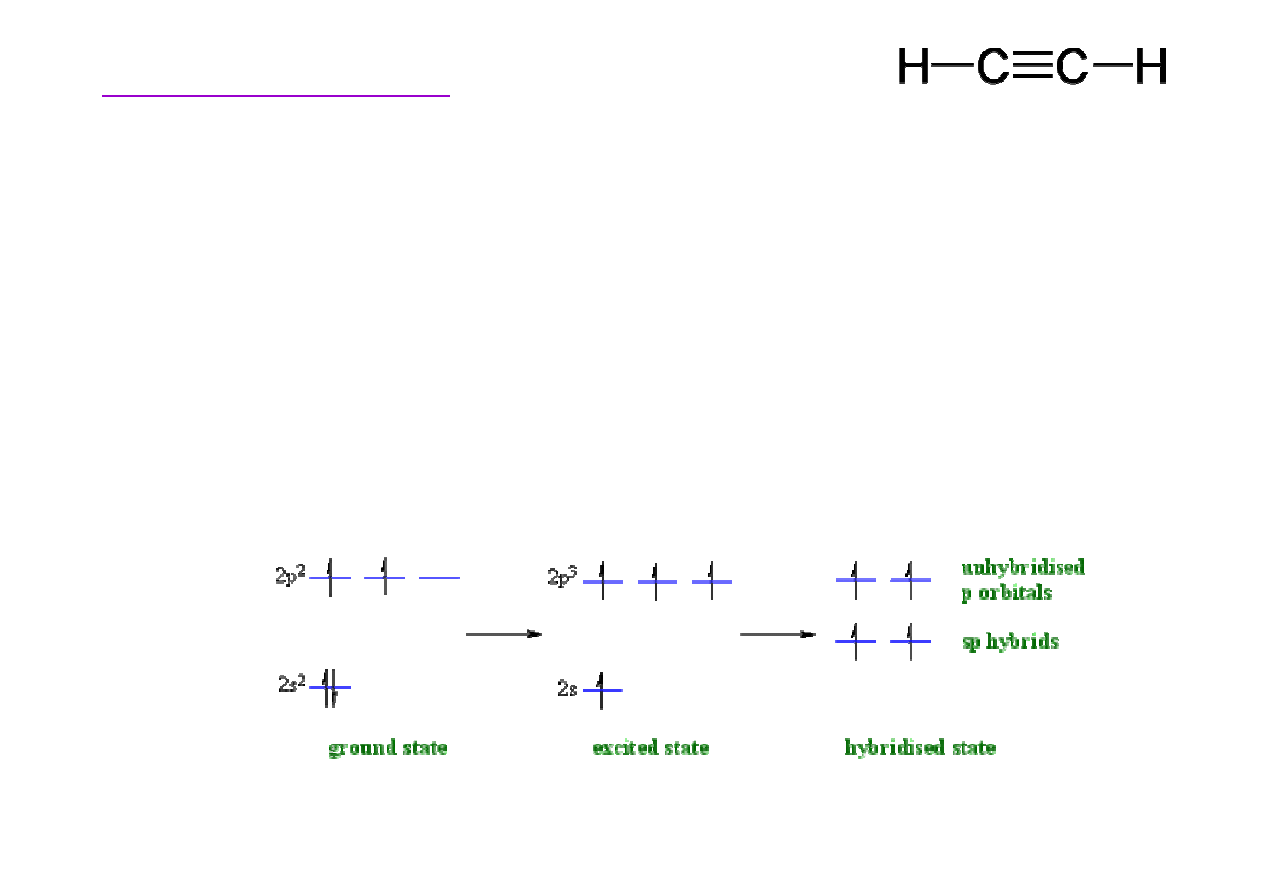
Budowa etynu (acetylenu)
orbitale sp – orbital 2s jest zmieszany (zhybrydyzowany) z
jednym orbitalem 2p co daje w sumie dwa orbitale sp.
Dwa orbitale 2p nie podlegaj
ą
hybrydyzacji.
Podstawy chemii organicznej
http://www.mhhe.com/physsci/chemistry/carey5e/Ch02/ch2-3-2.html
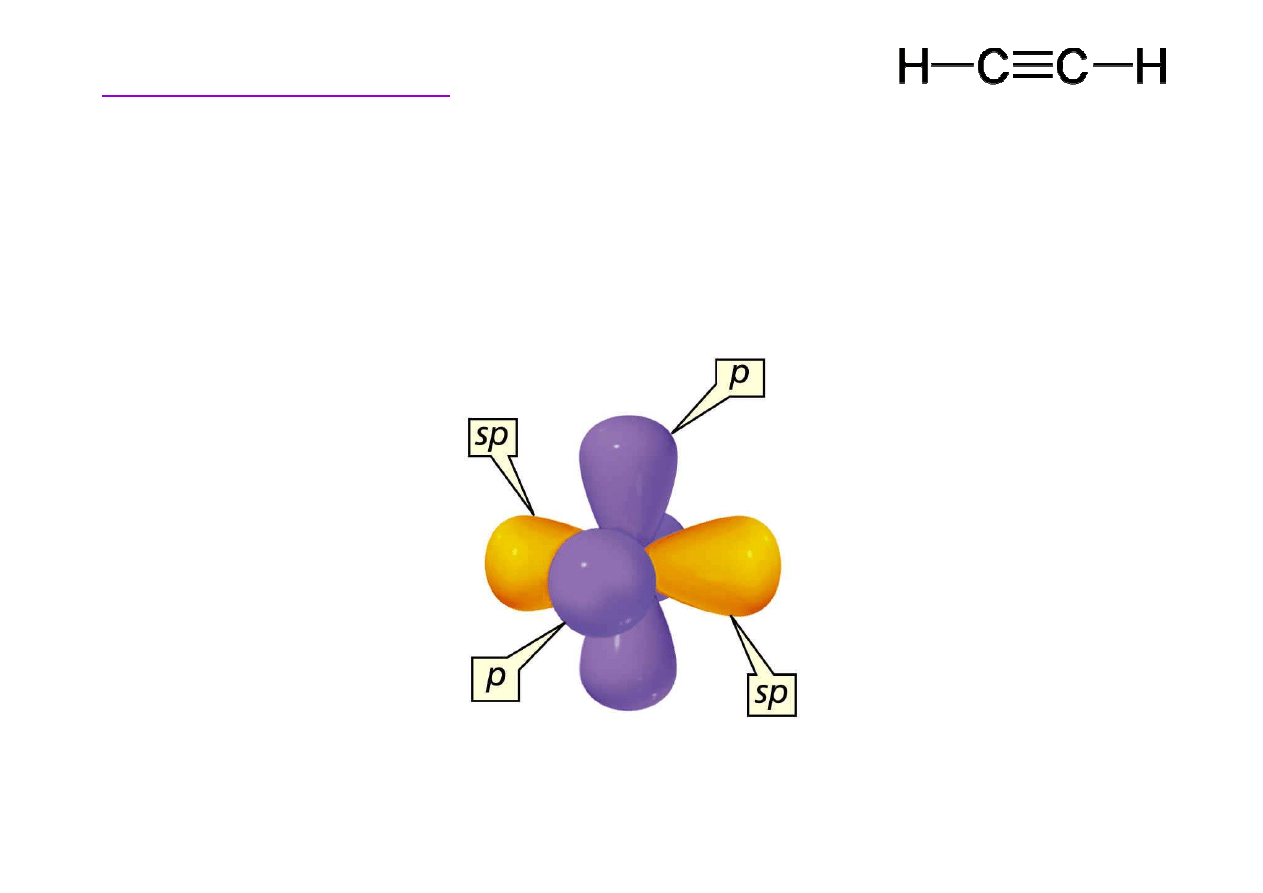
Budowa etynu (acetylenu)
Orbitale sp zachowuj
ą
wzgl
ę
dem siebie k
ą
t 180°
Podstawy chemii organicznej
http://personal.monm.edu/gebauer_peter/chem_230/Lect_pages/Bruice_jpgs&pgs/sp_hybrids.htm
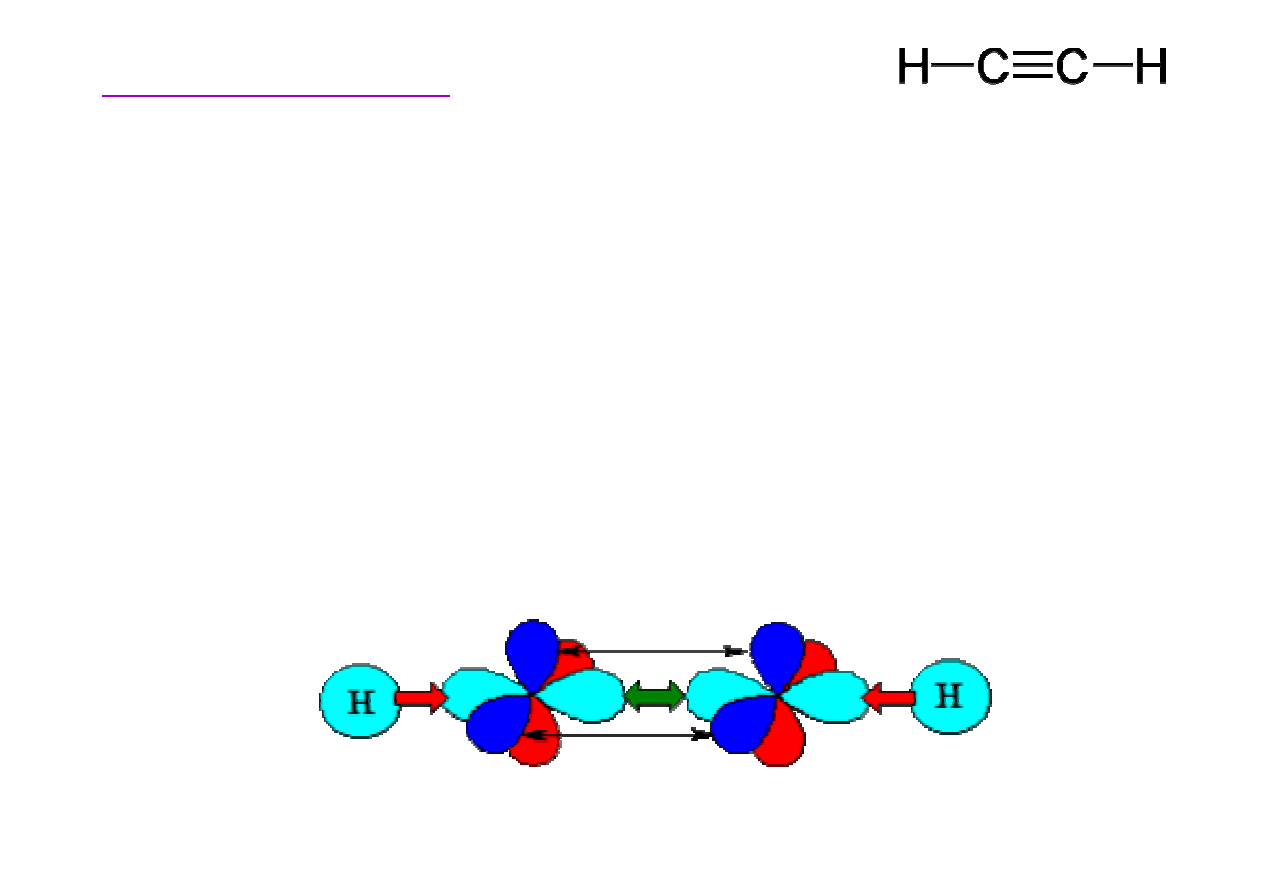
Budowa etynu (acetylenu)
• Obydwa atomy w
ę
gla s
ą
w stanie hybrydyzacji sp
• Dwa wi
ą
zania C-H powstaj
ą
poprzez nało
ż
enie orbitalu
sp w
ę
gla z orbitalem 1s wodoru (
czerwone strzałki
)
• wi
ą
zanie
σ
C-C powstaje poprzez nało
ż
enie orbitali sp
pochodz
ą
cych od obu atomów w
ę
gla (
zielone strzałki
)
• Dwa wi
ą
zania
π
C-C powstaj
ą
poprzez oddziaływanie
dwóch par orbitali p od obu atomów w
ę
gla (czarne
strzałki)
Podstawy chemii organicznej
http://www.mhhe.com/physsci/chemistry/carey5e/Ch02/ch2-3-2.html
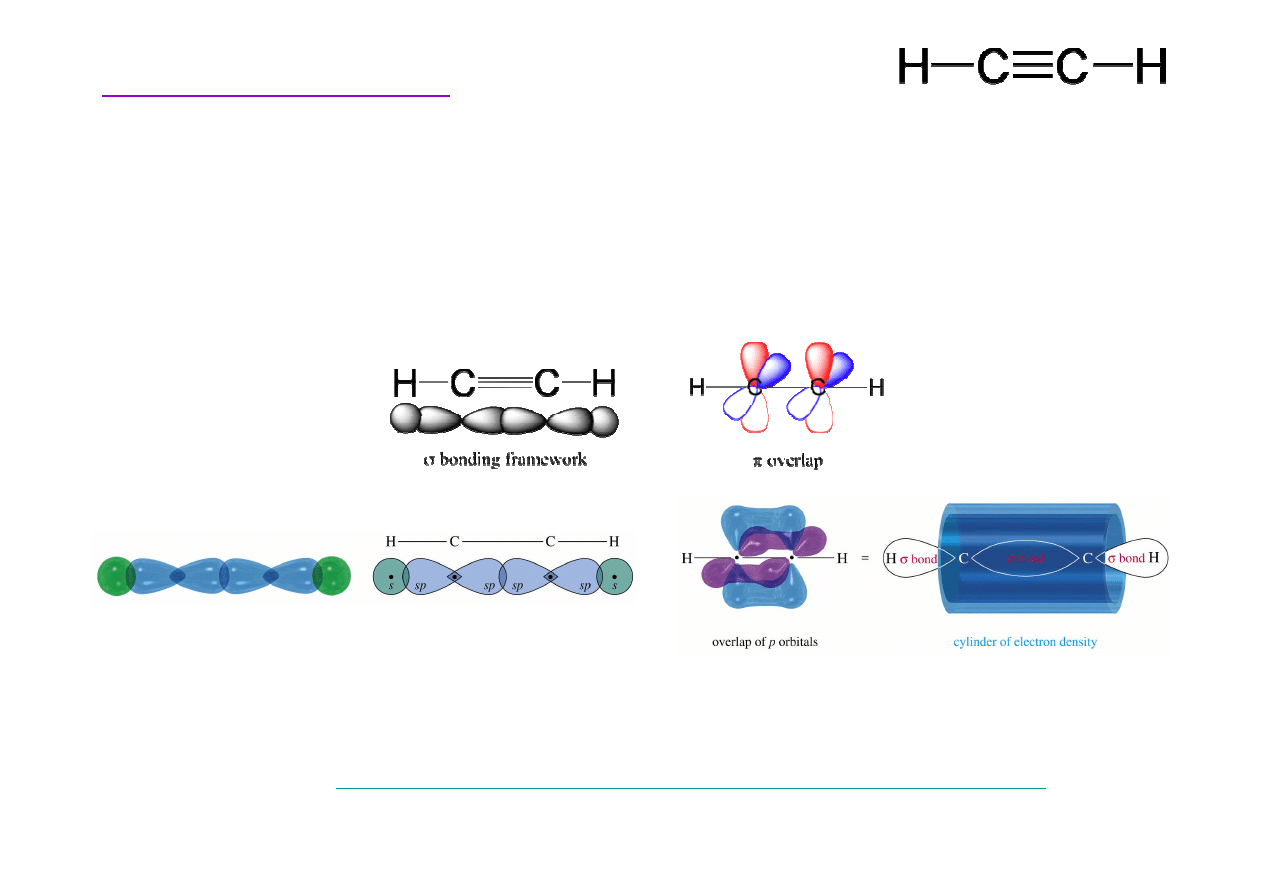
Budowa etynu (acetylenu)
Potrójne wi
ą
zanie w
ę
giel-w
ę
giel składa si
ę
z jednego
wi
ą
zania
σ
i dwóch wi
ą
za
ń π
.
Podstawy chemii organicznej
http://chemwiki.ucdavis.edu/Organic_Chemistry/Organic_Chemistry_With_a_Biological_Emphasis/Chapter__1%3A_Chapter_1%3A_
Introduction_to_organic_structure_and_bonding_I/Section_1.5%3A_Valence_bond_theory%3A_sp,_sp2,_and_sp3_hybrid_orbitals
http://wps.prenhall.com/wps/media/objects/340/348272/wade_ch09.html
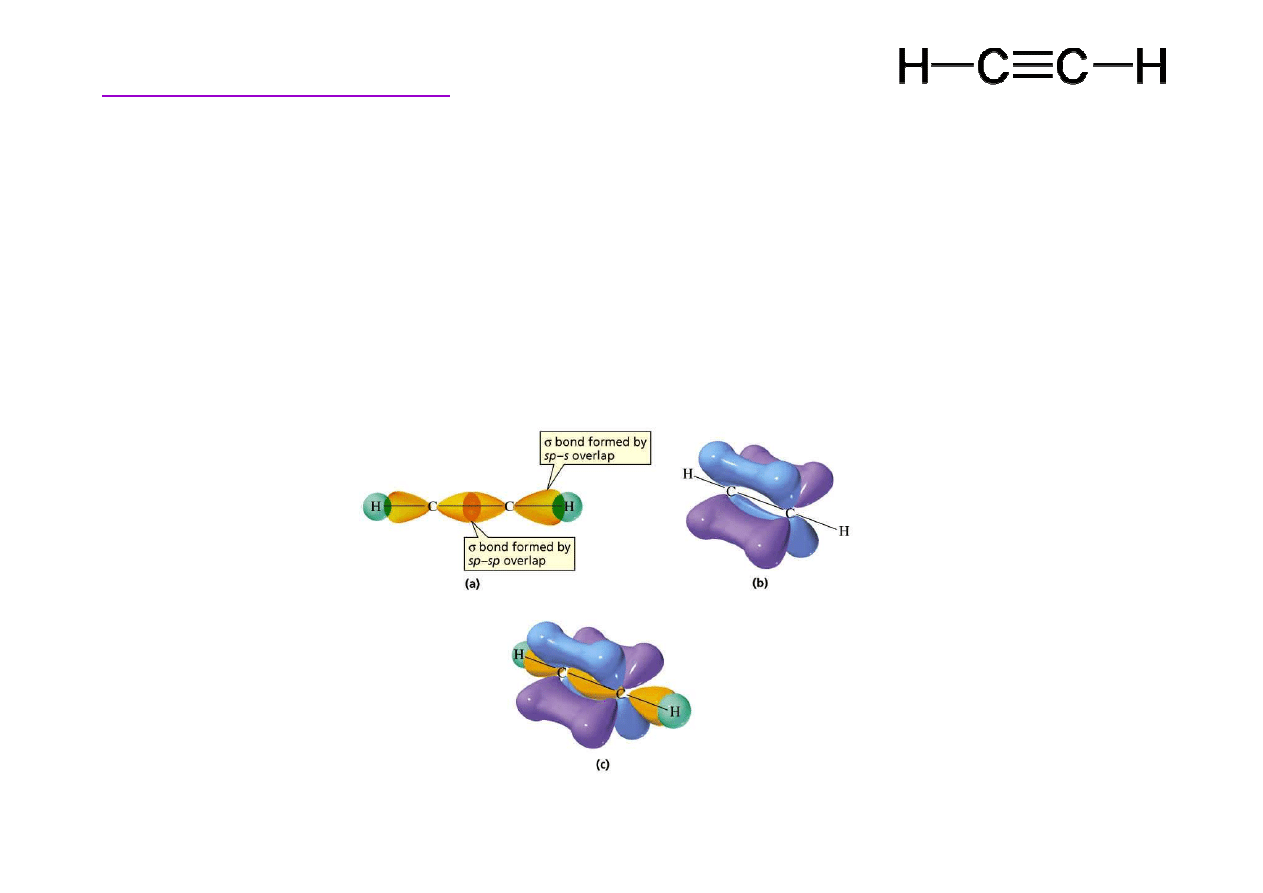
Budowa etynu (acetylenu)
Wi
ą
zanie potrójne przypomina rodzaj walca o symetrii
osiowej. Swobodny obrót wokół osi ł
ą
cz
ą
cej atomy C
≡≡≡≡
C jest
mo
ż
liwy.
Podstawy chemii organicznej
http://personal.monm.edu/gebauer_peter/CHEM_230/Lect_pages/Bruice_jpgs&pgs/ethyne_hybrids.htm
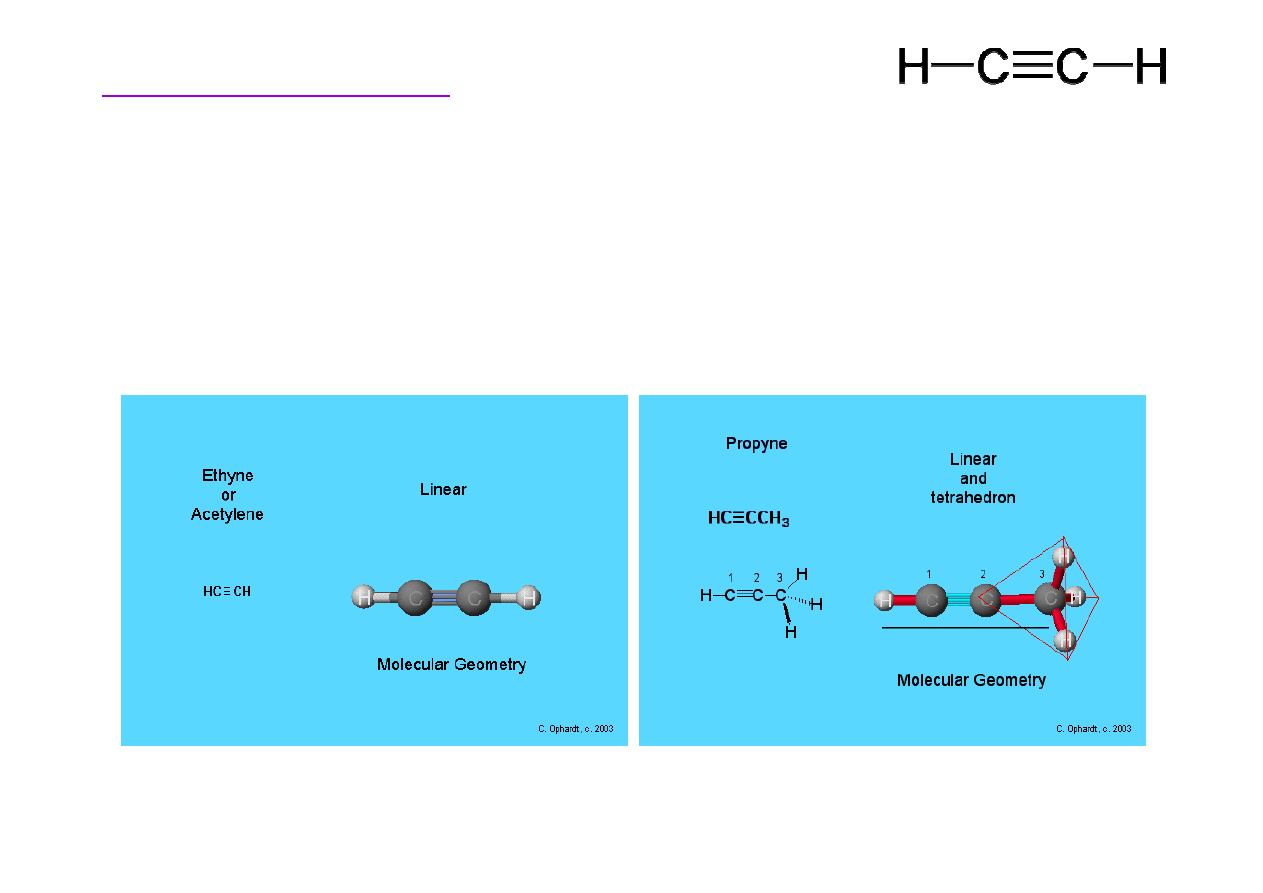
Budowa etynu (acetylenu)
Alkiny, zawieraj
ą
ce wi
ą
zanie potrójne, w miejscu
wyst
ę
powania tych wi
ą
za
ń
s
ą
liniowe.
Podstawy chemii organicznej
http://www.elmhurst.edu/~chm/vchembook/209alkynes.html
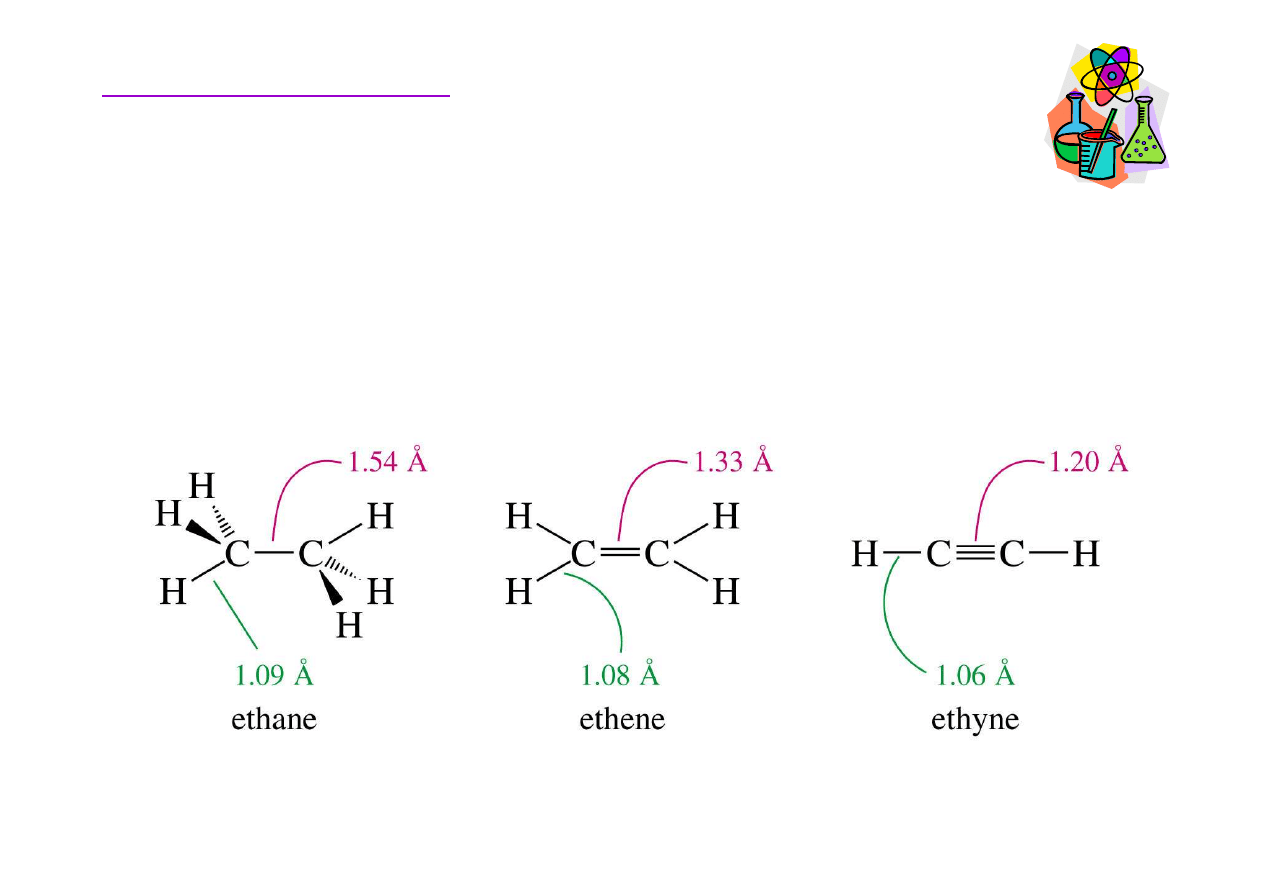
Długo
ść
wi
ą
za
ń
w etanie, etenie i etynie
Im wi
ę
kszy udział orbitali s w nakładaj
ą
cych si
ę
orbitalach
w
ę
gla tym krótsze wi
ą
zanie.
http://wps.prenhall.com/wps/media/objects/340/348272/wade_ch09.html
Podstawy chemii organicznej
Podstawy chemii organicznej
cztery orbitale
typu sp
3
109°28’
Cztery
orbitale
skierowane
ku
wierzchołkom
czworo
ś
cianu
foremnego
jeden orbital s
trzy orbitale p
sp
3
trzy orbitale
typu sp
2
120°
Orbitale
skierowane
ku
wierzchołkom
trójk
ą
ta
foremnego
jeden orbital s
dwa orbitale p
sp
2
dwa orbitale
typu sp
180°
liniowy
jeden orbital s
jeden orbital p
sp
Ilo
ść
zhybrydyzowa-
nych orbitali
K
ą
ty
mi
ę
dzy
wi
ą
zaniami
Układ
przestrzenny
Ilo
ść
orbitali
tworz
ą
cych
hybryd
ę
Typ
hybrydyzacji
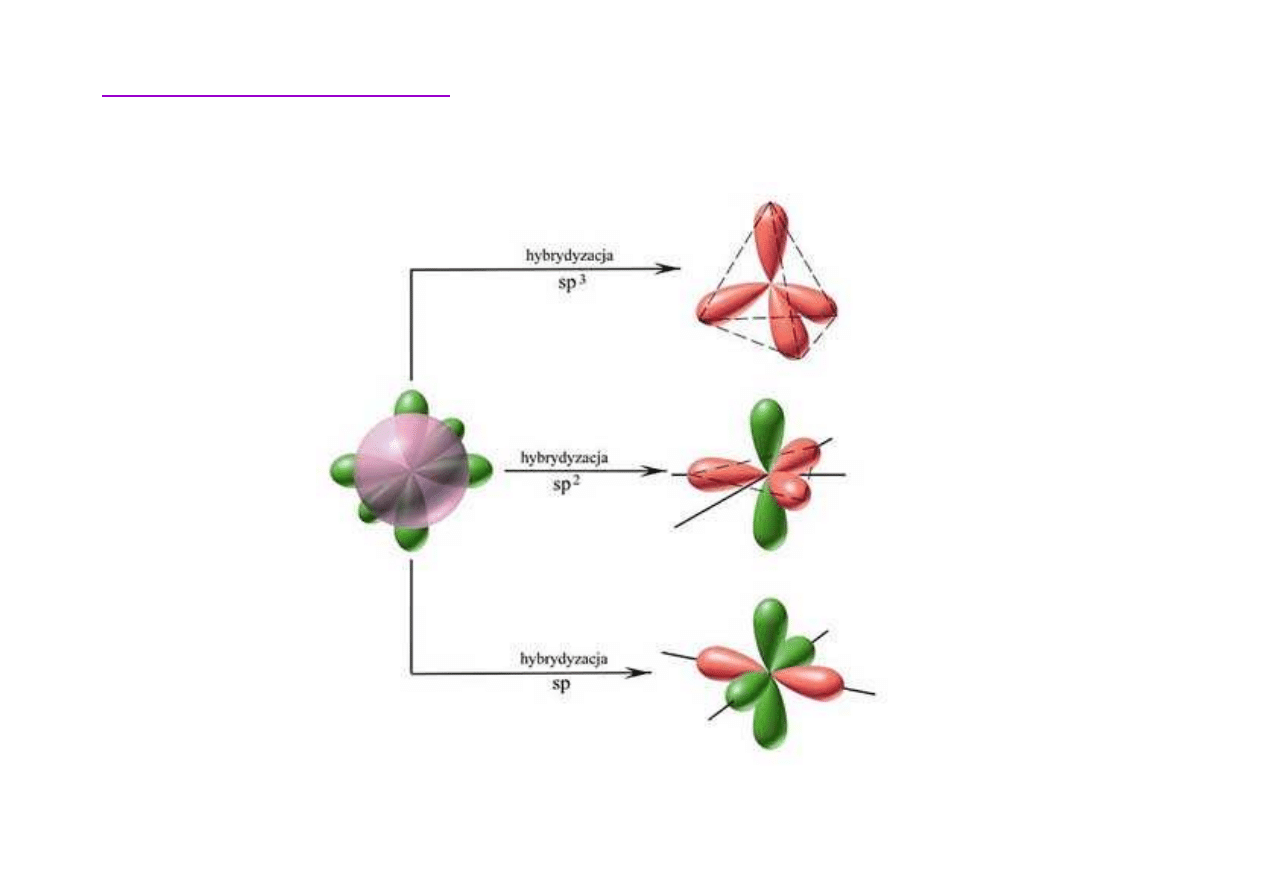
Hybrydyzacja orbitali w
ę
gla - podsumowanie
Podstawy chemii organicznej
http://zasoby1.open.agh.edu.pl/dydaktyka/chemia/a_e_chemia/1_3_budowa_materii/01_04_03_2b.html
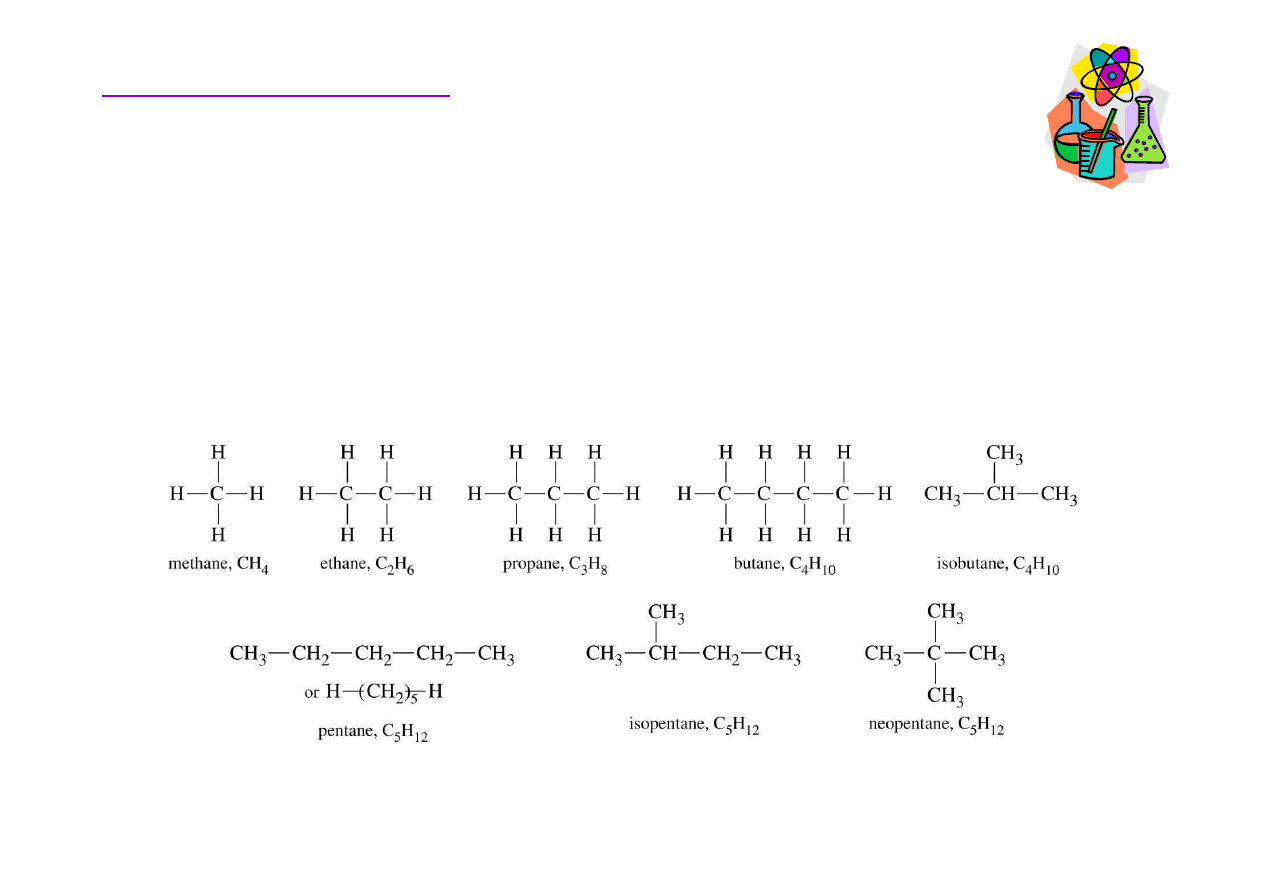
Alkany - nomenklatura
•
ogólny wzór alkanów C
n
H
2n+2
•
wszystkie izomery strukturalne s
ą
znane do nonanu C
9
H
20
,
•
dekan C
10
H
22
– 75 izomerów,
•
eikozan C
20
H
22
– 366 319 mo
ż
liwych izomerów
Podstawy chemii organicznej
http://wps.prenhall.com/wps/media/objects/340/348272/wade_ch03.html
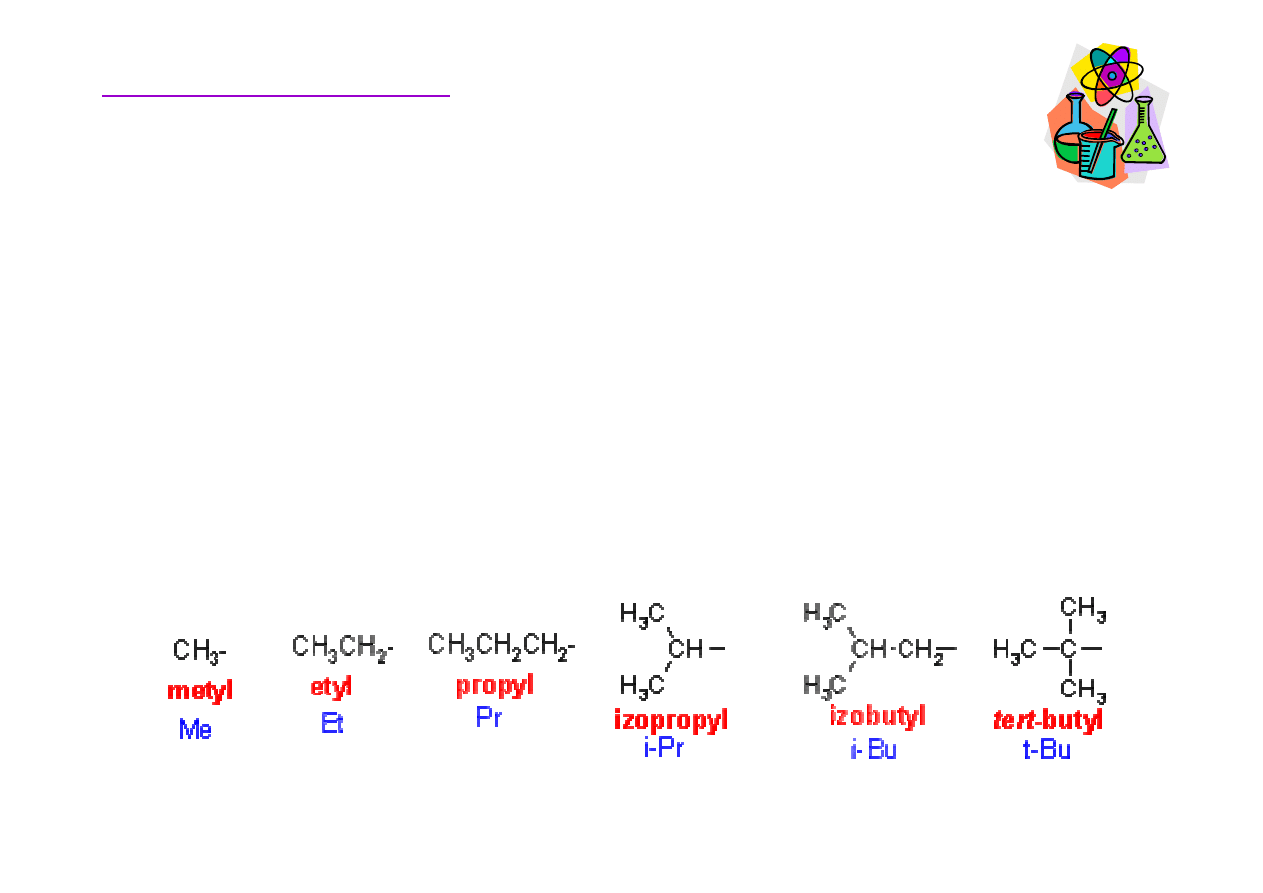
Grupy alkilowe
Grupy alkilowe tworzymy z odpowiednich alkanów przez
odj
ę
cie jednego wodoru. Grupy alkilowe nie s
ą
zwi
ą
zkami
trwałymi, stanowi
ą
cz
ęść
wi
ę
kszej cz
ą
steczki. Nazwa alkilu
powstaje w wyniku zast
ą
pienia zako
ń
czenia -an w nazwie
alkanu ko
ń
cówk
ą
-yl.
Podstawy chemii organicznej
http://www.chemorganiczna.com/organiczna/kurs/9-alkany.html?start=1
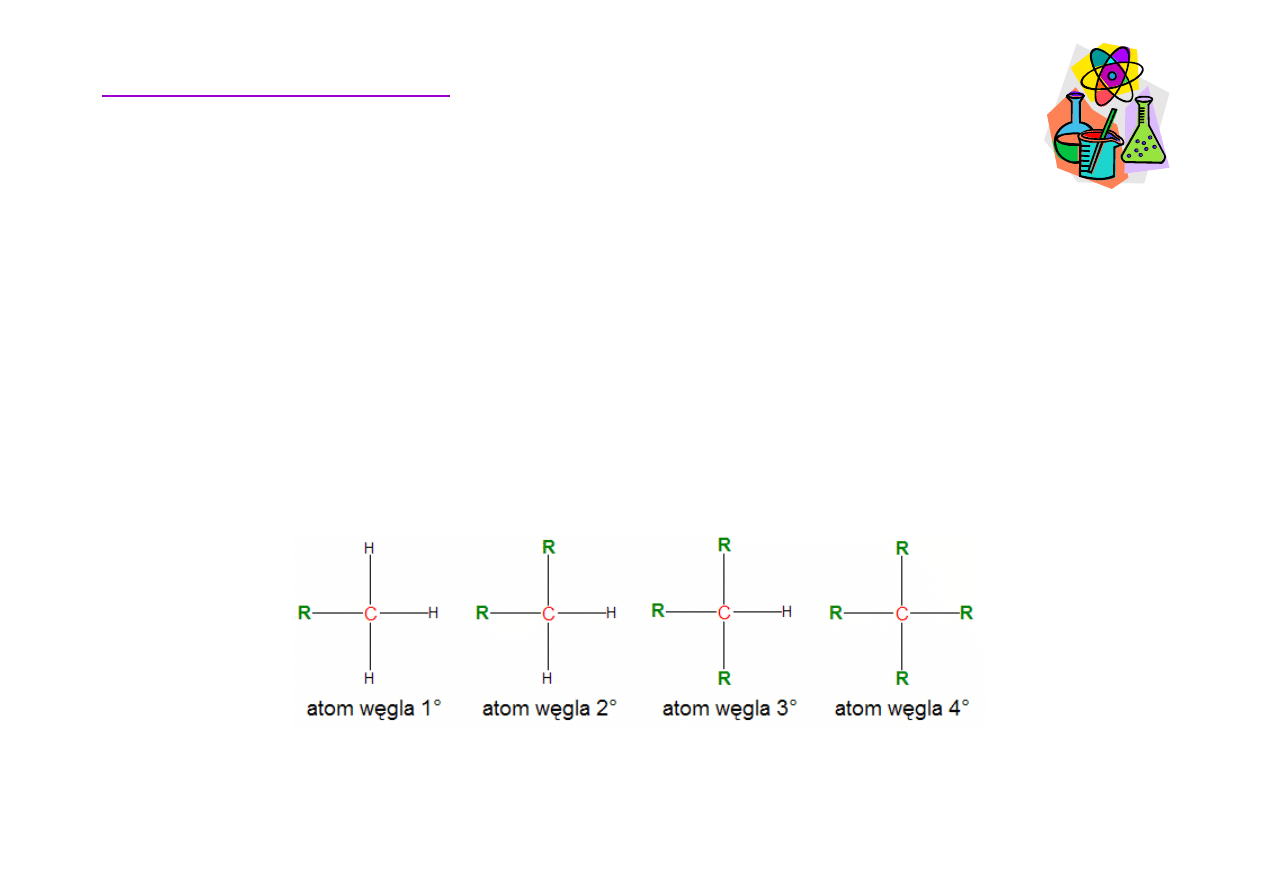
Rz
ę
dowo
ść
atomu w
ę
gla
•
liczba atomów w
ę
gla bezpo
ś
rednio poł
ą
czonych z rozpatrywanym
atomem w
ę
gla w cz
ą
steczce zwi
ą
zku organicznego.
•
reaktywno
ść
wi
ą
za
ń
, jakie tworzy w
ę
giel z atomami innych
pierwiastków w znacznym stopniu zale
ż
y od rz
ę
dowo
ś
ci atomu
w
ę
gla.
Podstawy chemii organicznej
http://pl.wikibooks.org/wiki/Chemia_organiczna/Alkany/Grupy_alkilowe._Rz%C4%99dowo%C5%9B%C4%87_atom%C3%B3w_w%C4%99gla
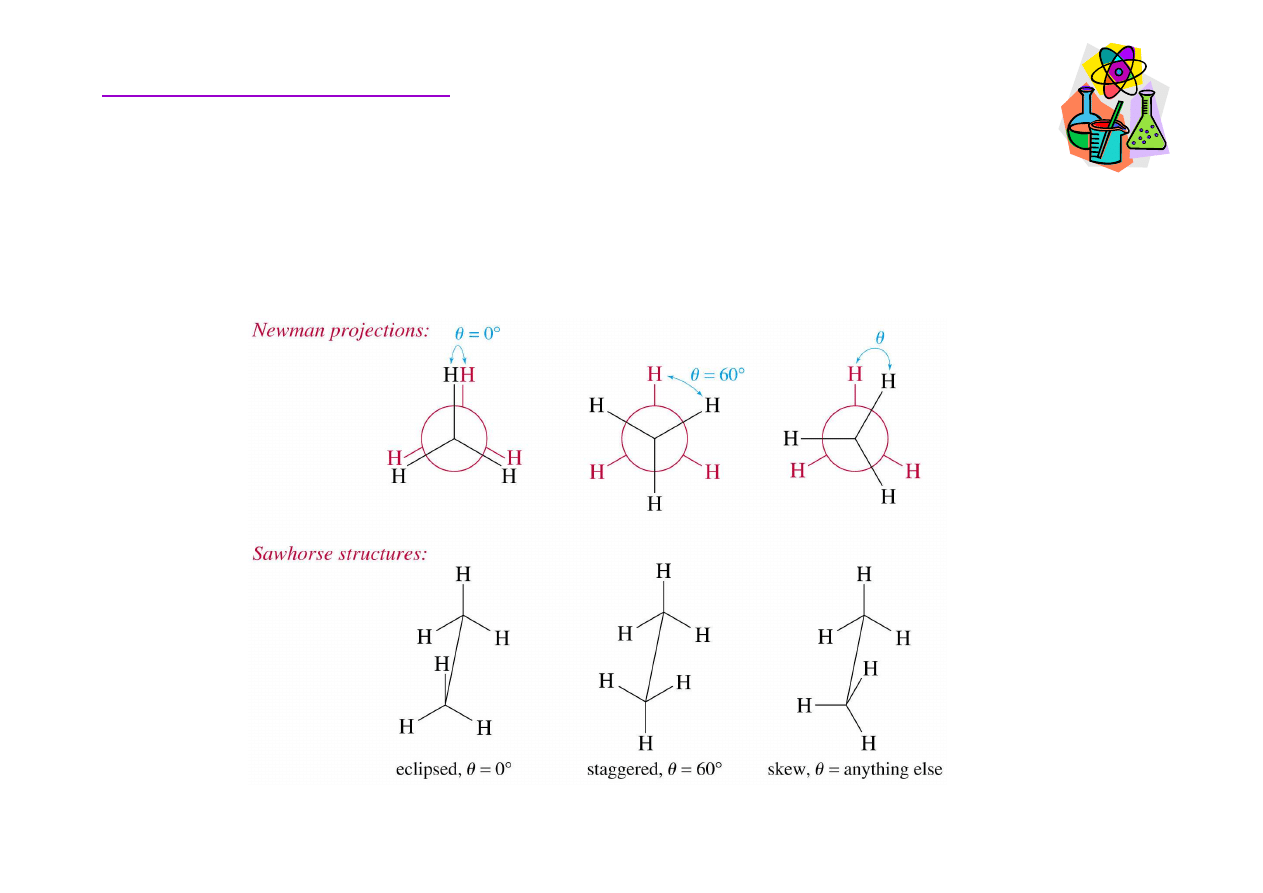
Konformacja alkanów
Konformacje - ró
ż
ne układy atomów w obr
ę
bie cz
ą
steczek,
powstaj
ą
ce w wyniku obrotów dokoła osi wi
ą
za
ń
.
Podstawy chemii organicznej
Konformacja
naprzemianległa
projekcja
Newmana
projekcja
konikowa
(koziołkowa)
Konformacja
naprzeciwległa
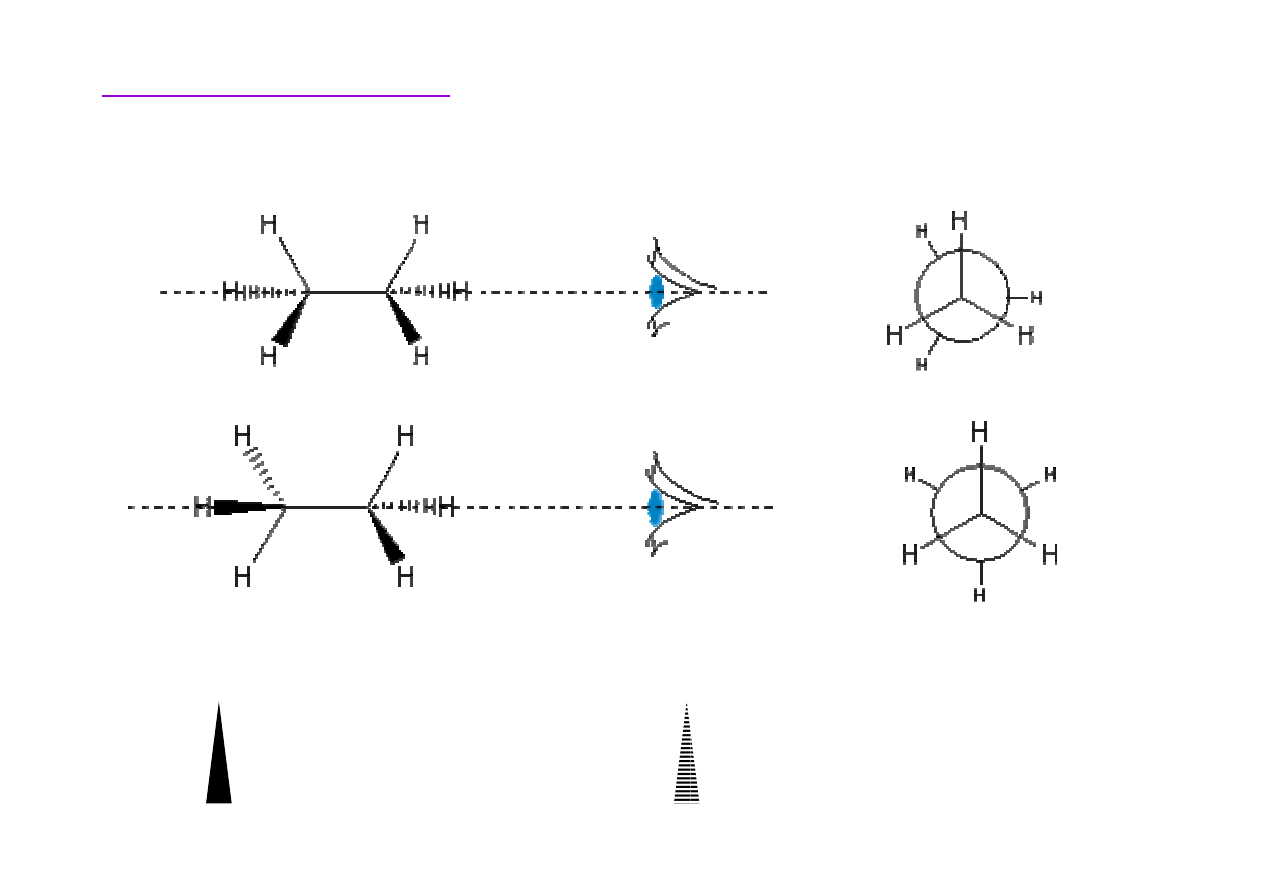
Konformacja alkanów
nad powierzchni
ą
kartki
http://www.chemmix.edu.pl/artnet/index.php?s1=02&s2=004&s3=006
pod powierzchni
ą
kartki
Podstawy chemii organicznej
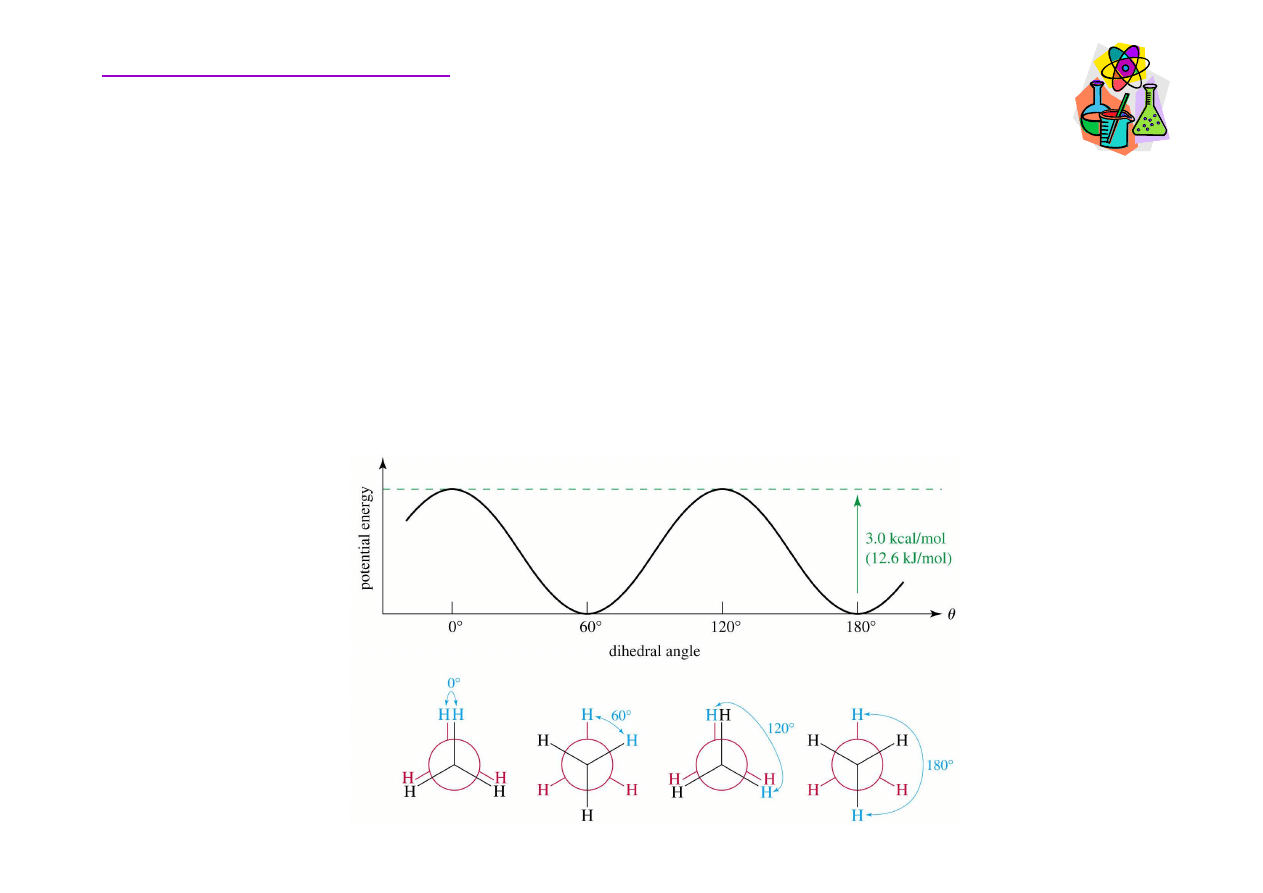
Konformacja alkanów
Poszczególne konformacje ró
ż
ni
ą
si
ę
energi
ą
, ró
ż
nica energii konformeru
naprzeciw- i naprzemianległego wynosi ok. 12 kJ/mol i stanowi barier
ę
swobodnej rotacji w cz
ą
steczce etanu. Energia ta nazywana jest
napr
ęż
eniem torsyjnym. Im napr
ęż
enie torsyjne jest wi
ę
ksze, tym
prawdopodobie
ń
stwo odchylenia od struktury najni
ż
ej energetycznej
jest mniejsze.
Podstawy chemii organicznej
http://wps.prenhall.com/wps/media/objects/340/348272/wade_ch03.html
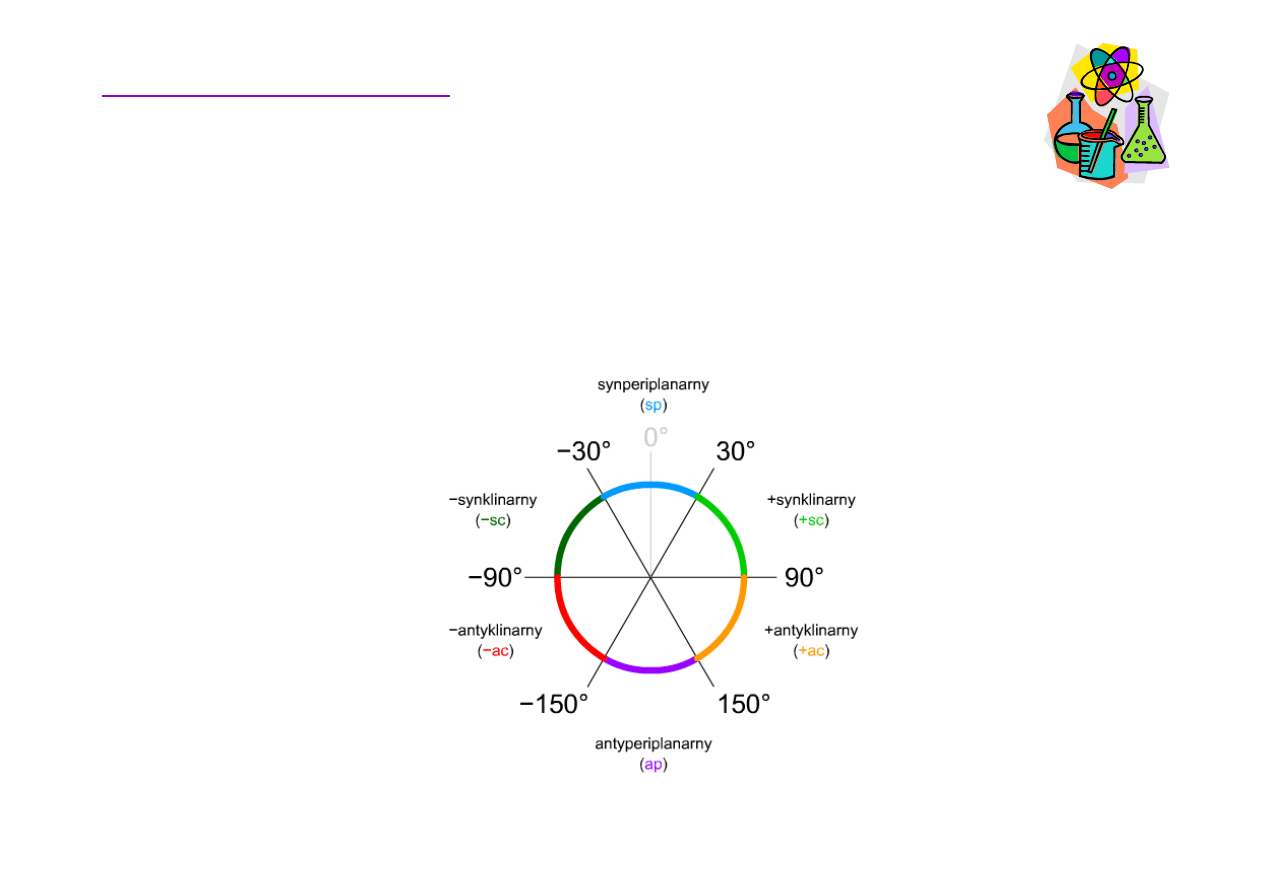
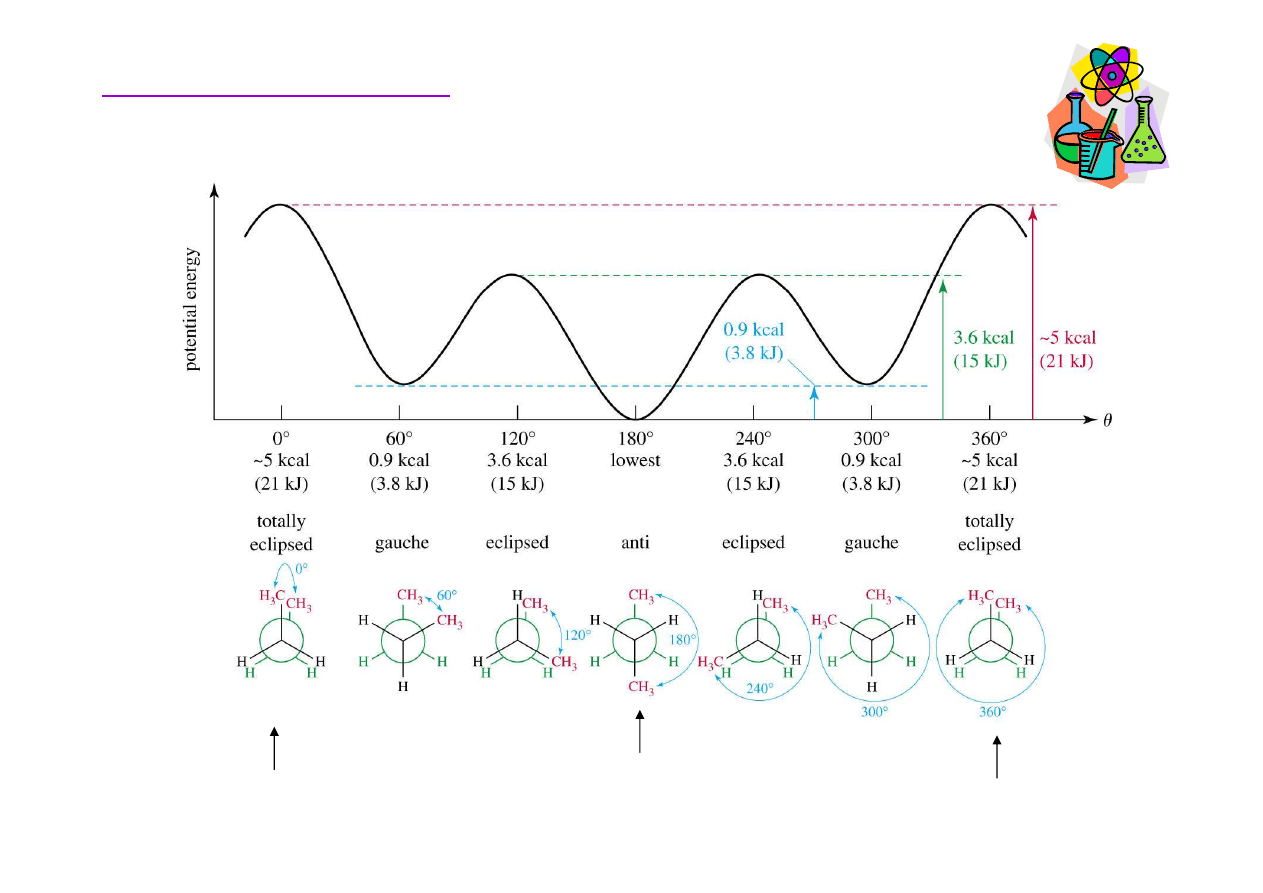
Konformacja alkanów
Konformery n-butanu maj
ą
swoje nazwy w zale
ż
no
ś
ci od k
ą
ta, jaki
zawarty jest pomi
ę
dzy grupami metylowymi. 180°to konformacja
antyperiplanarna, 60°synklinarna, 0°synperiplanarna .
http://www.chemmix.edu.pl/artnet/index.php?s1=02&s2=004&s3=006
Podstawy chemii organicznej
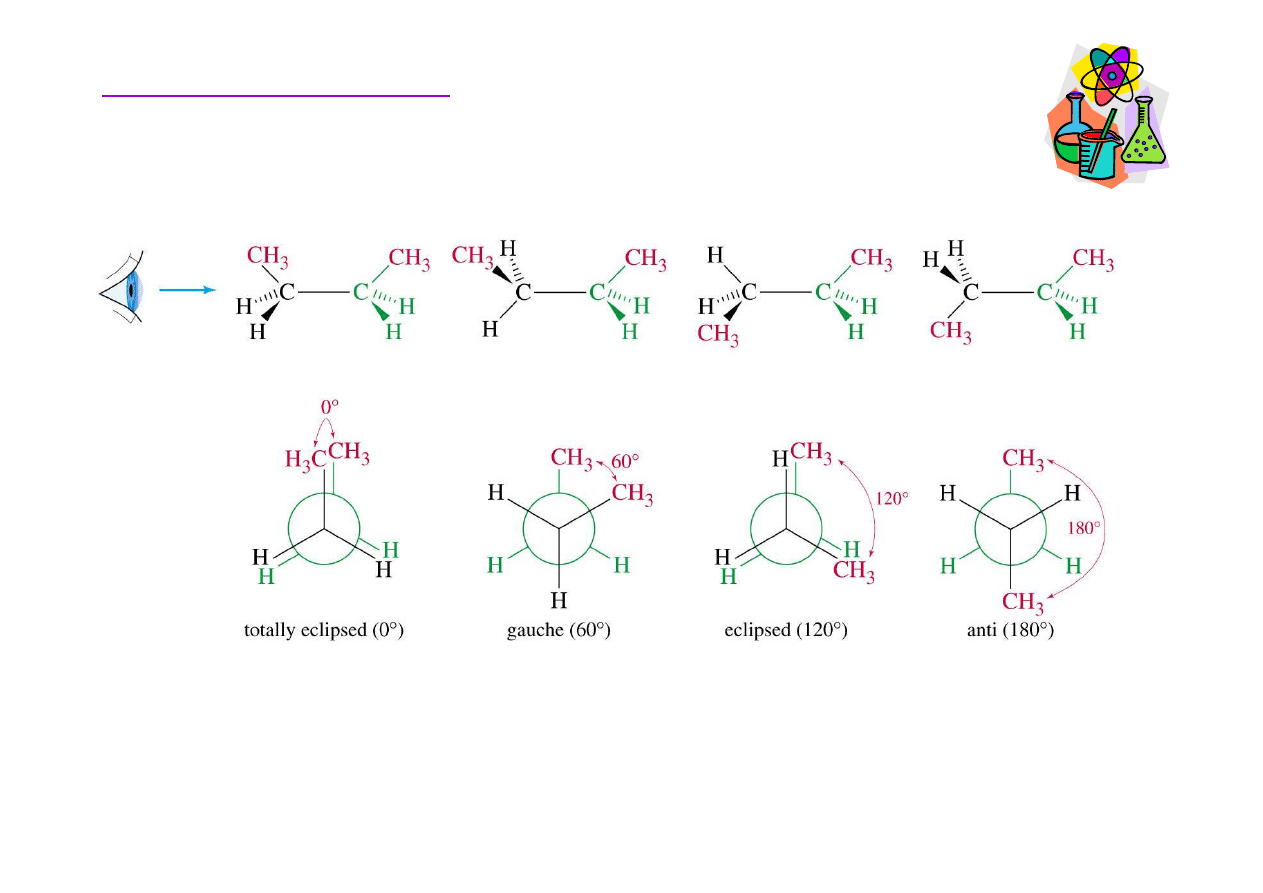
Konformacja alkanów
http://wps.prenhall.com/wps/media/objects/340/348272/wade_ch03.html
Podstawy chemii organicznej
synperiplanarna
~0.01%
synklinalna
~30%
antyklinalna
~0.6%
antyperiplanarna
~69%
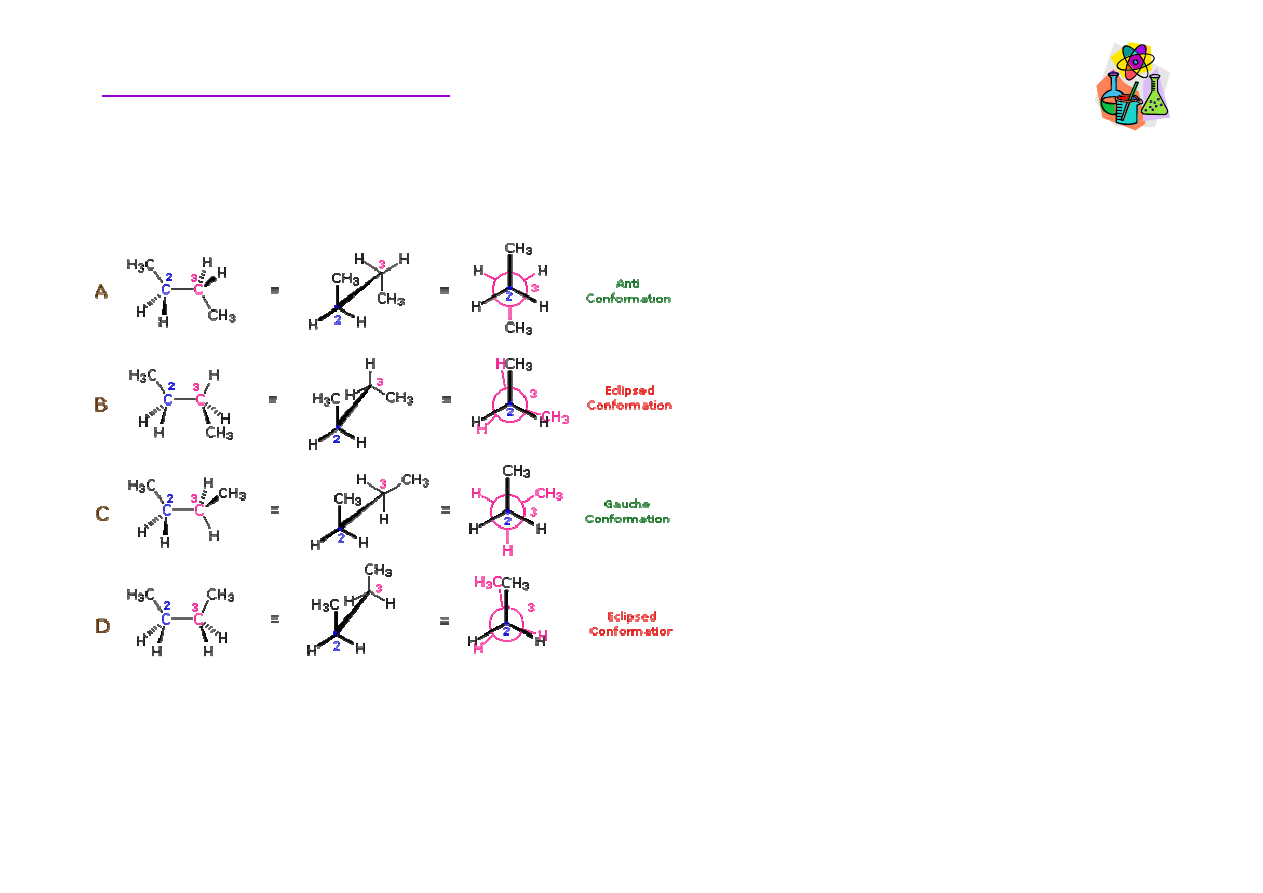
Konformacja alkanów
Stereoizomery - zwi
ą
zki o
tym samym wzorze i tych
samych wi
ą
zaniach
chemicznych, ró
ż
ni
ą
ce si
ę
budow
ą
przestrzenn
ą
.
Konformery
(stereoizomery
konformacyjne) -
przekształcaj
ą
si
ę
w siebie
na skutek obrotu jednej
cz
ęś
ci cz
ą
steczki wzgl
ę
dem
drugiej.
Podstawy chemii organicznej
http://www2.chemistry.msu.edu/faculty/reusch/VirtTxtJml/sterisom.htm
Konformacja alkanów
http://wps.prenhall.com/wps/media/objects/340/348272/wade_ch03.html
Podstawy chemii organicznej
antyperiplanarna
~69%
synperiplanarna
~0.01%
synperiplanarna
~0.01%
Konformacja alkanów
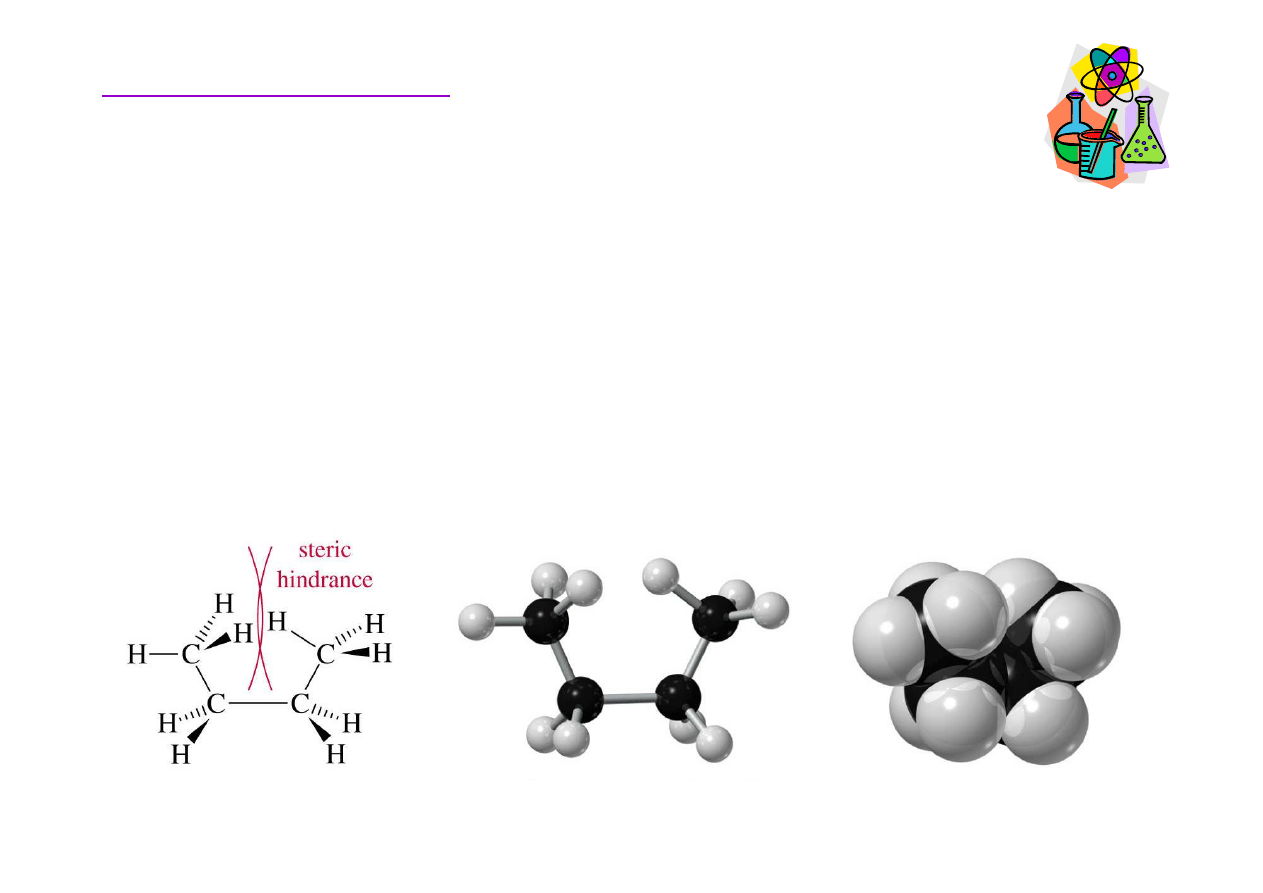
Konformacje naprzeciwległe (120°i 0°) s
ą
mniej trwałe od
naprzemianległych (180°i 60°). Oprócz napr
ęż
enia
torsyjnego wyst
ę
puje te
ż
inne - napr
ęż
enie steryczne.
Powstaje ono, kiedy grupy funkcyjne fizycznie sobie
przeszkadzaj
ą
zachodz
ą
c na siebie.
http://wps.prenhall.com/wps/media/objects/340/348272/wade_ch03.html
Podstawy chemii organicznej

Dzi
ę
kuj
ę
za uwag
ę
Wyszukiwarka
Podobne podstrony:
chemia 2014 odp
Arkusz CKU Chemia 2014
chemia 2014 kolos, lekarski, I rok, chemia, kolos - teoria
Chemia 3 2014
Zagadnienia chemia 2014, żcioż, III semestr, Chemia żywności
chemia 2 2014
Chemia 6 2014
chemia 2014
chemia 2014 odp
Arkusz CKU Chemia 2014
chemia 2014 operon probna rozszerzona odpowiedzi
chemia 2014 maj matura rozszerzona
Pytania z wejściówek, analityka medyczna UMP 2014, chemia fizyczna, ćwiczenia
arkusz 2 opm chemia z tutorem 12 06 2014 klasy przedmaturalne
WF-Zagadnienia Egz-22.05.2014, rok numero uno, chemia nieorganiczna
Rzeczy których nie ma u piegusa wykład chemia( 02 2014
Sprawozdanie 2 Badanie właściwości i analiza jakościowa anionów, Politechika Białostocka, budownictw
więcej podobnych podstron