ELEKTROCHEMIA
POLITECHNIKA WROCŁAWSKA
Wydział Chemiczny
CHEMIA NIEORGANICZNA – PODSTAWY
WYKŁAD

OGNIWA
GALWANICZNE
ELEKTROLIZA
Wykład 3 – Elektrochemia
ELEKTROCHEMIA –
badanie i wykorzystanie
samorzutnych reakcji
chemicznych umożliwiających
wytwarzanie
prądu elektrycznego
zastosowanie elektryczności do
przeprowadzania reakcji które
nie zachodzą samorzutnie.
Prąd elektryczny –
ruch elektronów –
reakcje „REDOKS”
oraz
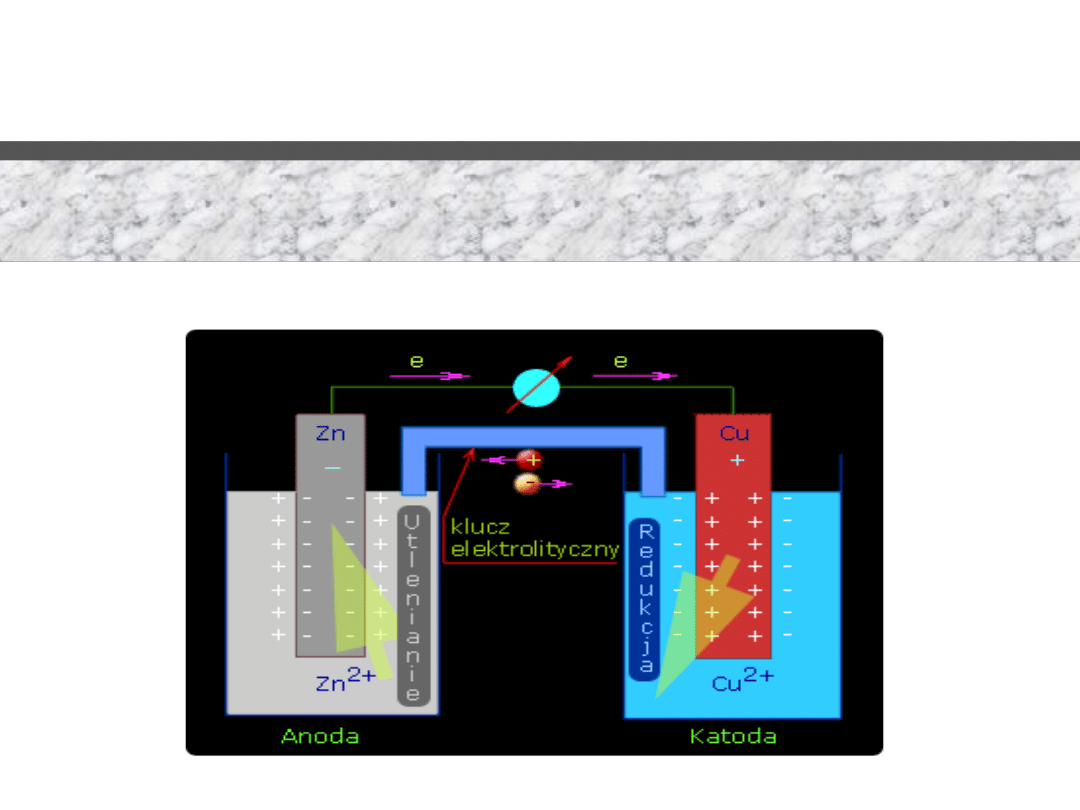
Wykład 3 – Elektrochemia
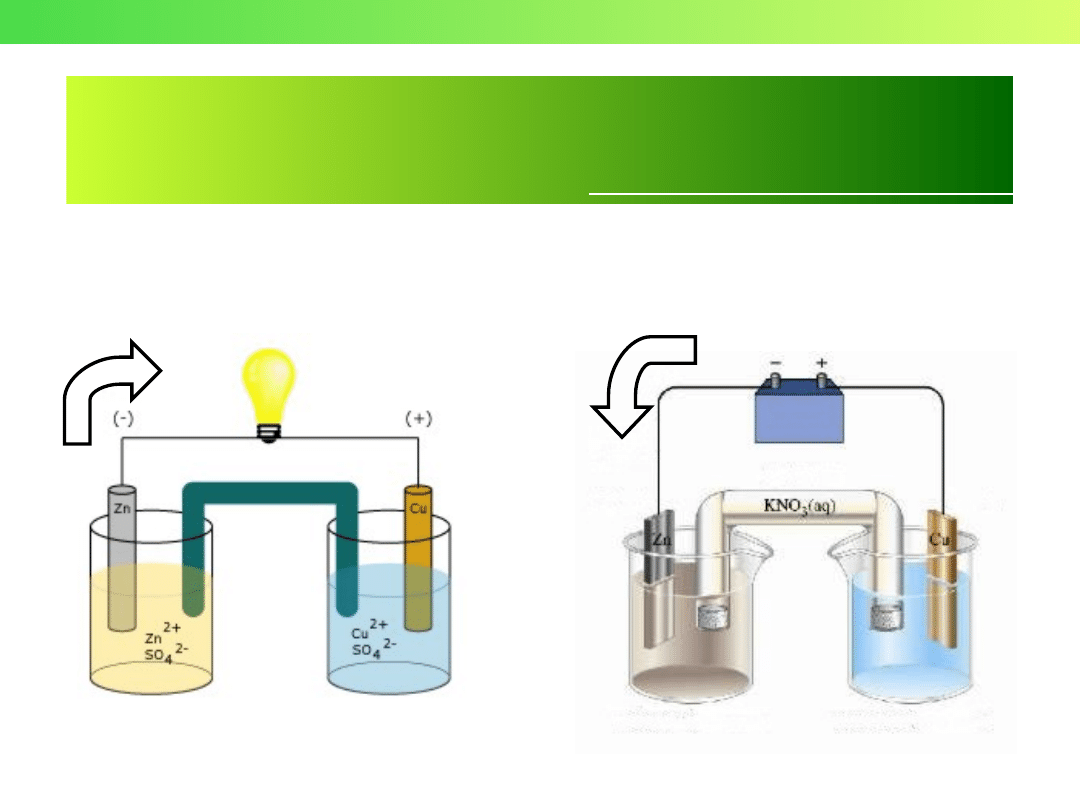
Cu
Zn
Zn + CuCl
2
= ZnCl
2
+
Cu
Zn + Cu
2+
+ 2Cl
–
= Zn
2+
+ 2Cl
–
+
Cu
- zapis cząsteczkowy
- zapis jonowy
Zn + Cu
2+
= Zn
2+
+
Cu
Reakcja "redoks"
2 e
-
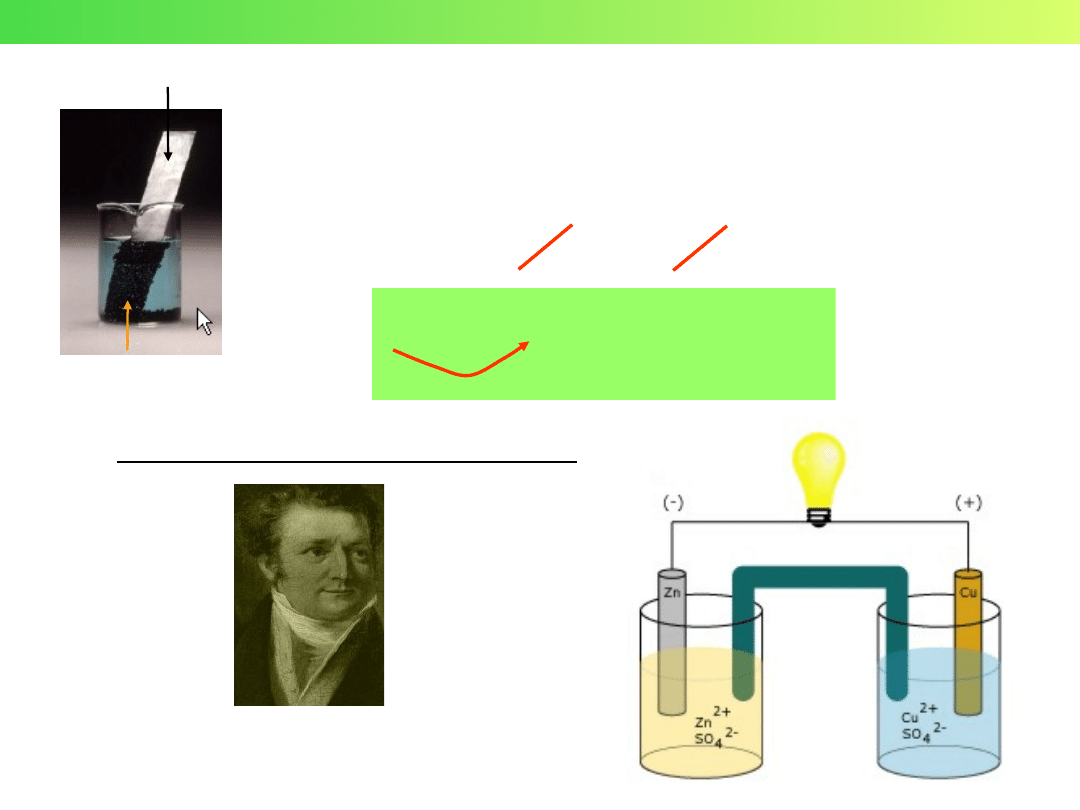
Ogniwo Daniella (1836 r.)
John Frederic Daniell
1790 - 1845

Wykład 3 – Elektrochemia
kK + lL = mM + nN
SEM – siła elektromotoryczna ogniwa - E
SEM –
napięcie [V] pomiędzy elektrodami ogniwa
będącego w stanie równowagi (bez przepływu
prądu)
Siła elektromotoryczna - Wzór Nernsta:
E
0
– standardowa siła elektromotoryczna
n
– liczba wymienianych elektronów
F
– stała Faradaya (~96500 C) -
ładunek 1 mola elektronów !
Walther Hermann Nernst
(1864-1941)
Reakcja chemiczna w ogniwie:
n
m
l
k
a
a
a
a
ln
nF
RT
E
E
N
M
L
K
0

Wykład 3 – Elektrochemia
Zn + Cu
2+
= Zn
2+
+ Cu
SEM – siła elektromotoryczna ogniwa - E
SEM –
napięcie [V] pomiędzy elektrodami ogniwa
będącego w stanie równowagi (bez przepływu
prądu)
Walther Hermann Nernst
(1864-1941)
Cu
Zn
Zn
Cu
0
2
2
a
a
a
a
ln
nF
RT
E
E
= 1
= 1
Reakcja chemiczna w ogniwie:
E
0
– standardowa siłą elektromotoryczna
n
– liczba wymienianych elektronów
Siła elektromotoryczna - Wzór Nernsta:
F
– stała Faradaya (~96500 C) -
ładunek 1 mola elektronów !
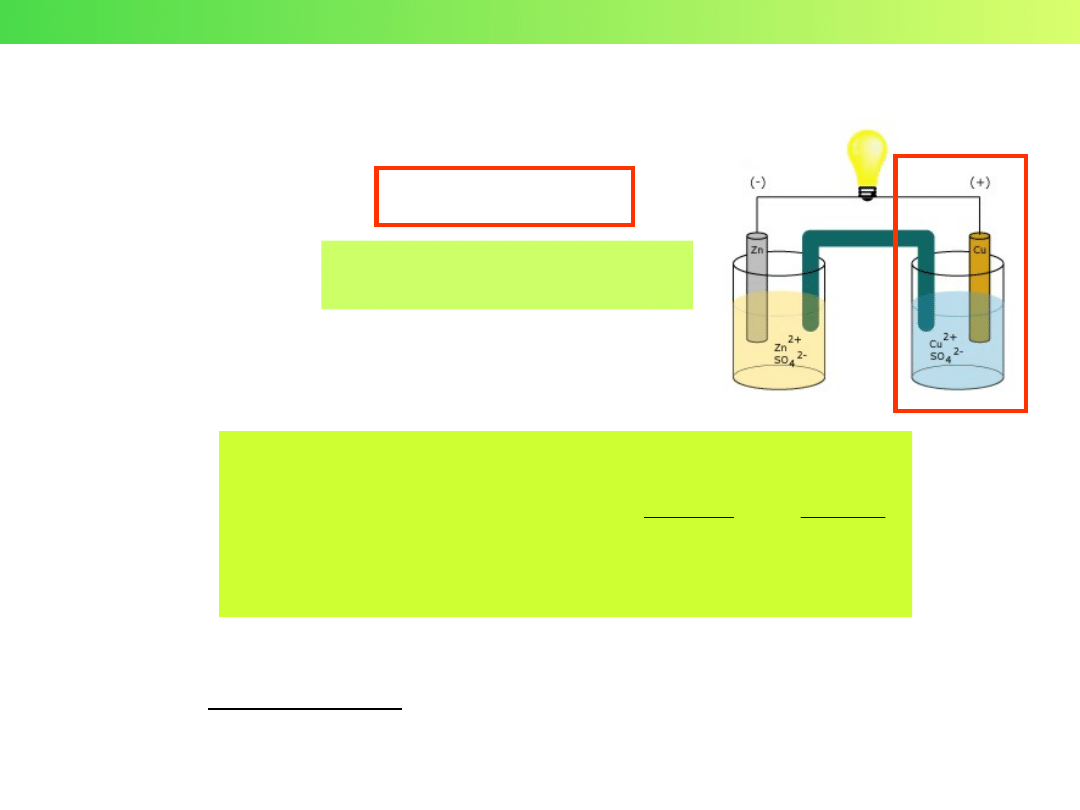
Wykład 3 – Elektrochemia
POTENCJAŁ PÓŁOGNIWA
Reakcja
w półogniwie:
Ox + ne = Re
Ox –
forma utleniona
Re –
forma zredukowana
Re
Ox
0
Ox/Re
Ox/Re
a
a
ln
nF
RT
E
E
Potencjał
półogniwa:
Cu
2+
+ 2e = Cu
Potencjał standardowy półogniwa
E
Ox/Re
mierzy się względem
standardowego półogniwa wodorowego, dla którego przyjmuje
się
E
0
= 0
0
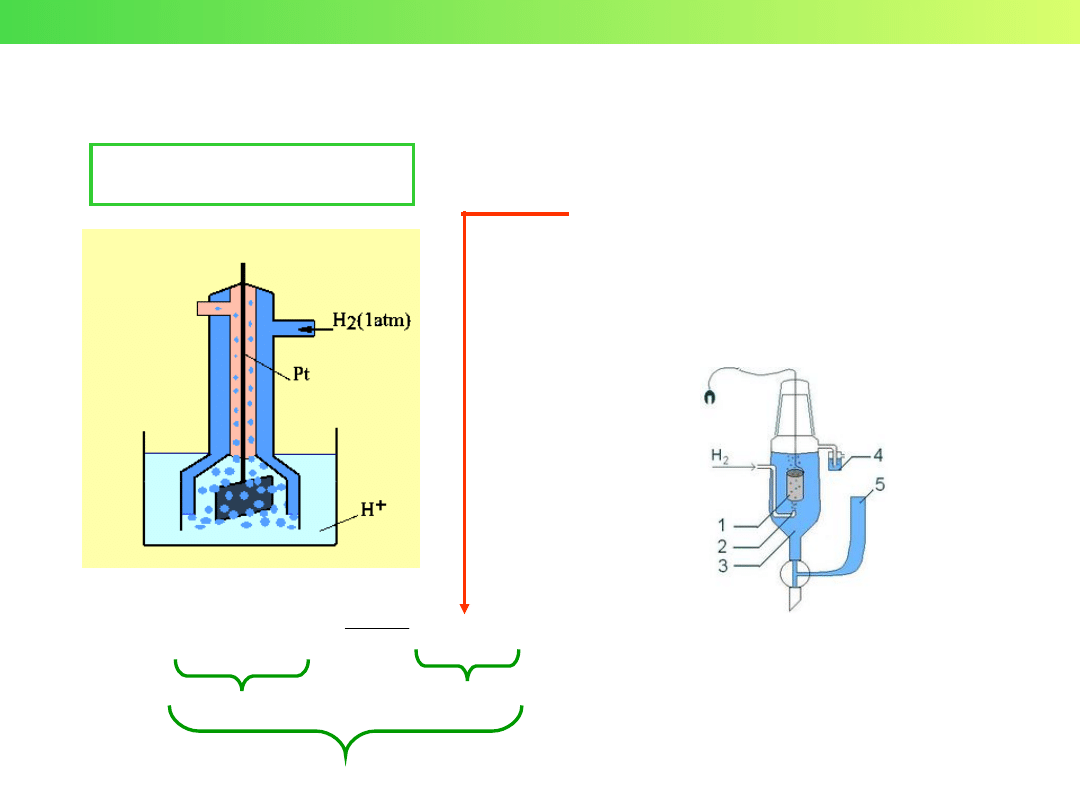
Wykład 3 – Elektrochemia
1) elektroda platynowa
2) pęcherzyki wodoru
3) roztwór kwasu
4) płuczka blokująca dostęp
tlenu
5) zbiornik z zapasem
elektrolitu
ELEKTRODA WODOROWA
Normalna elektroda wodorowa:
• elektrolit – 1,18 M HCl
• aktywność H
+
= 1
• ciśnienie H
2
- 101,325 kPa
• temperatura - 273,15 K = 0°C
2
0
2
H
H
/
2H
a
ln
F
RT
E
SEM
2
2H
+
+ 2e
−
= H
2
zał. = 0
0
0

Wykład 3 – Elektrochemia
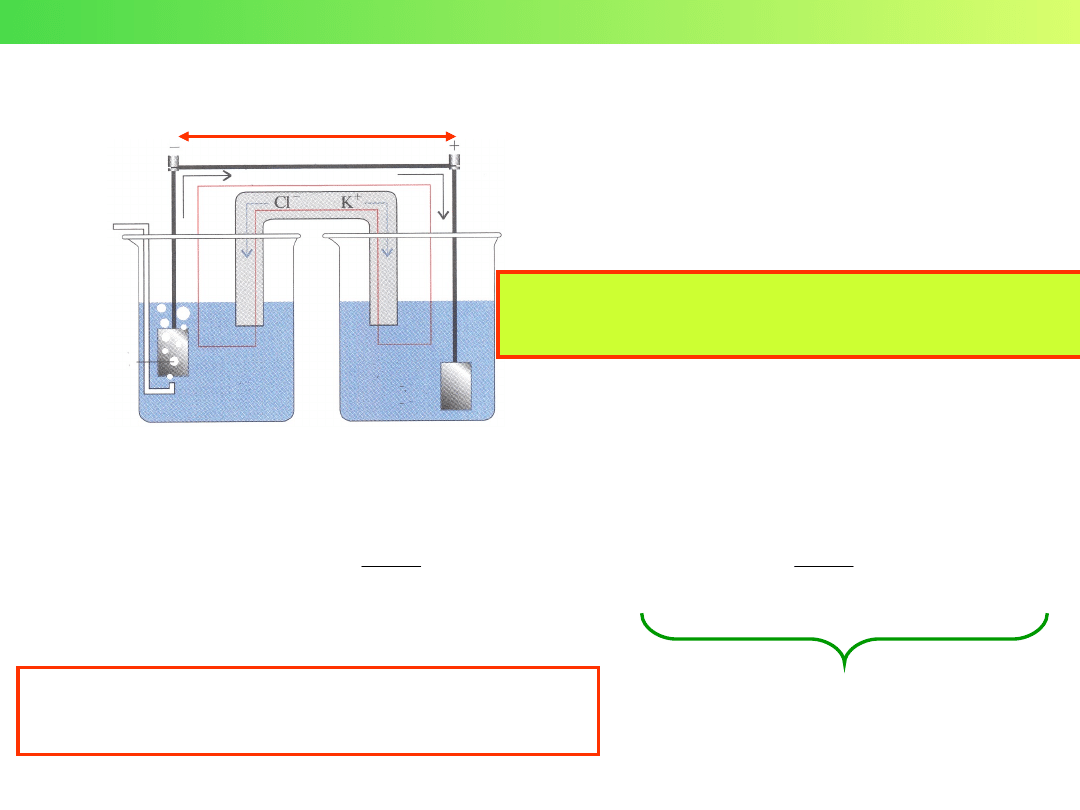
SCHEMAT OGNIWA ELEKTROCHEMICZNEGO
Konwencja Sztokholmska
Reakcja:
Zn + Cu
2+
= Zn
2+
+ Cu
Schemat
ogniwa:
Zn Zn
2+
Cu
2+
Cu
E
utl
E
red
Potencjały
półogniw:
reakcja
utleniania
reakcja
redukcji
Reakcje
połówkowe:
Półogniwo:
Lewe
Prawe
SEM = E
red
– E
utl
Siła
elektromotoryczna
ogniwa:
SEM = E
Prawe
– E
Lewe
Wykład 3 – Elektrochemia
Pomiar potencjałów półogniw
Attkins, rys. 18.11
H
2
Cu
Cu
2+
H
+
elektroda
wodorowa
elektroda
mierzona
SEM
2
H
0
H
/
2H
Cu
0
Cu
/
Cu
a
ln
F
2
RT
E
a
ln
F
2
RT
E
E
2
2
2
SEM = E
Prawe
– E
Lewe
0
Jeżeli
2
Cu
a
= 1 to
0
Cu
Cu
2
SEM
/
E
Wykład 3 – Elektrochemia
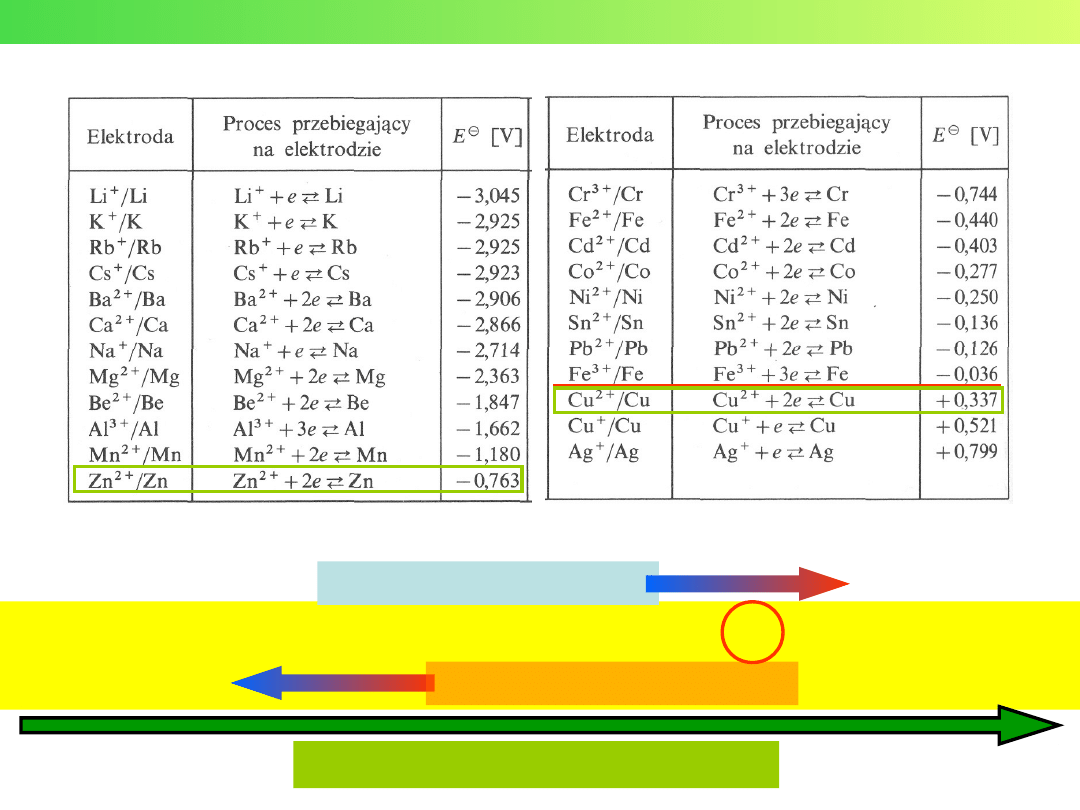
Potencjały półogniw
Li K Ca Na Al Zn Cr Fe Ni Sn Pb
H
Cu Ag
Hg Au
UTLENIACZE (jako jony)
REDUKTORY (jako metale)
Szereg elektrochemiczny
metali
Szereg napięciowy metali
0
Ox/Re
E

Wykład 3 – Elektrochemia
Elektrody (półogniwa) redoks
ELEKTRODA
REAKCJA
E
0
[V]

Wykład 3 – Elektrochemia
ELEKTRODA
REAKCJA
E
0
[V]

Wykład 3 – Elektrochemia
amoniakowa
NH3
amonowa
NH4+
azotanowa
NO3-
barowa (siarczano
wa)
Ba2+
(SO42-)
chlorkowa
Cl-
chlorowa
Cl2
cyjankowa
CN-
dwutlenku węgla
CO2
jodkowa
J-
miedziowa
Cu2+
ołowiowa
Pb2+
potasowa
K+
siarczkowa
S2-
sodowa
Na+
srebrowa
Ag+
twardości wody
Ca2+ /
Mg2+
wapniowa
Ca2+
Elektrody jonoselektywne
Wykład 3 – Elektrochemia
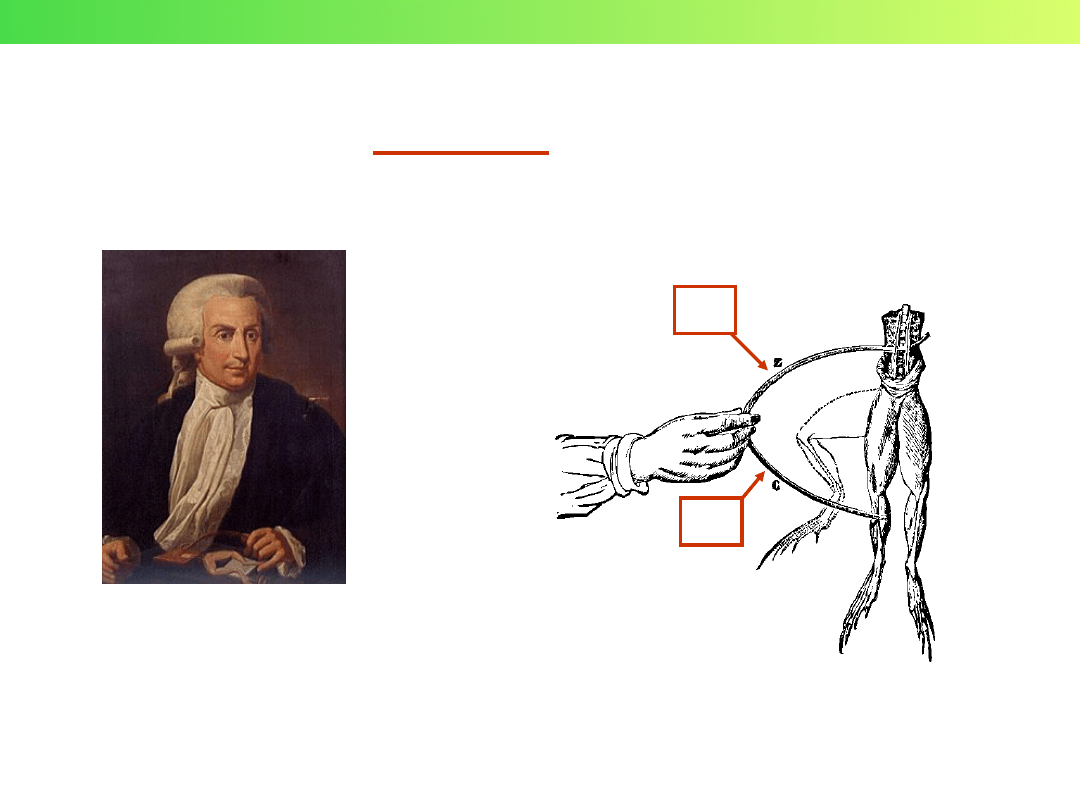
ZASTOSOWANIA OGNIW ELEKTROCHEMICZNYCH
(GALWANICZNYCH)
Luigi Galvani
1737 – 1798
Doświadczenie Galvaniego
Zn
Cu

Wykład 3 – Elektrochemia
Ogniwa „suche” - BATERIE
Ogniwo Leclanchégo (1866) – 1,5 V
Georges Leclanché
1839 - 1882
Ogniwo z końca XIX w.
Ogniwo srebrowe – 1,5 V
Wykład 3 – Elektrochemia
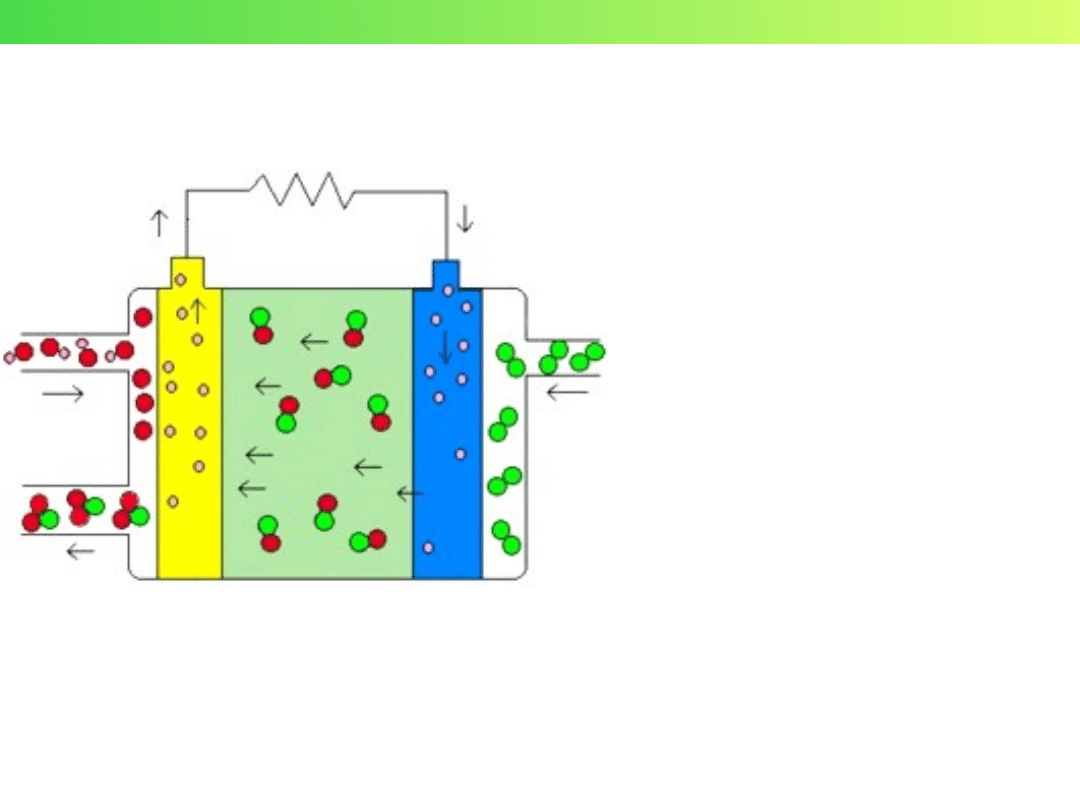
Ogniwa paliwowe
H
2
O
H
2
O
2
OH
–
e
–
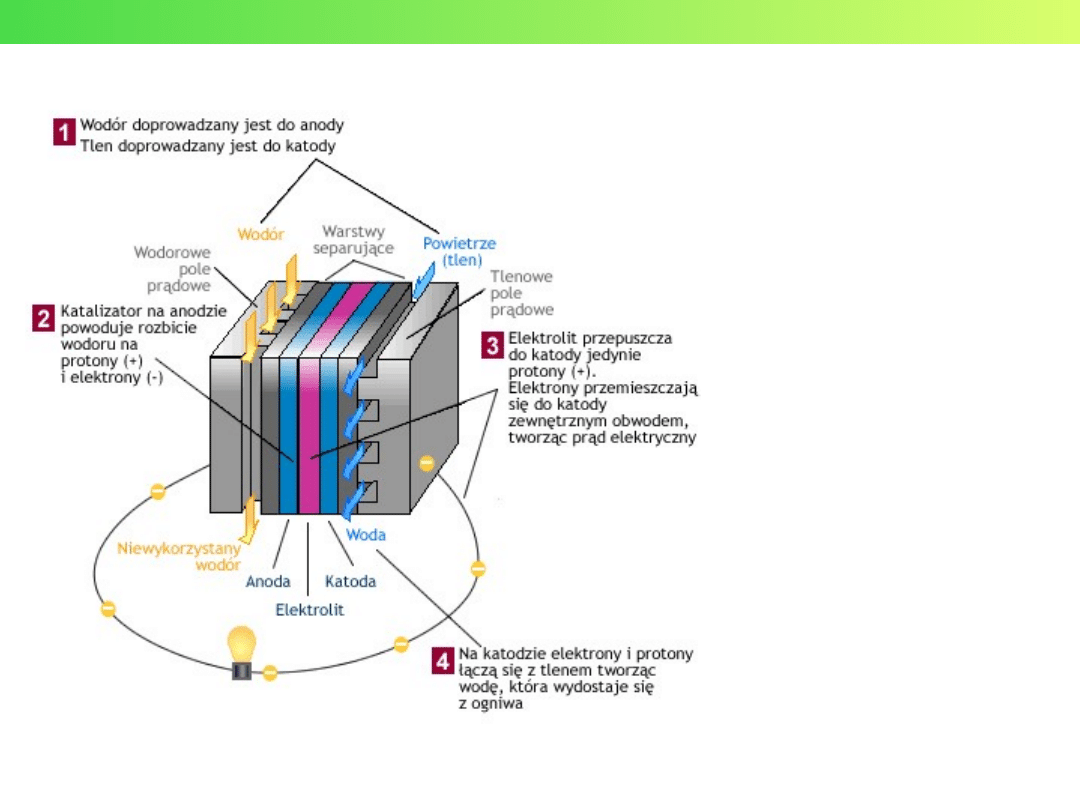
Wykład 3 – Elektrochemia
Ogniwa paliwowe
Ogniwo PEM
Proton Exchange Membrane
Polymer Electrolyte Membrane
Wykład 3 – Elektrochemia
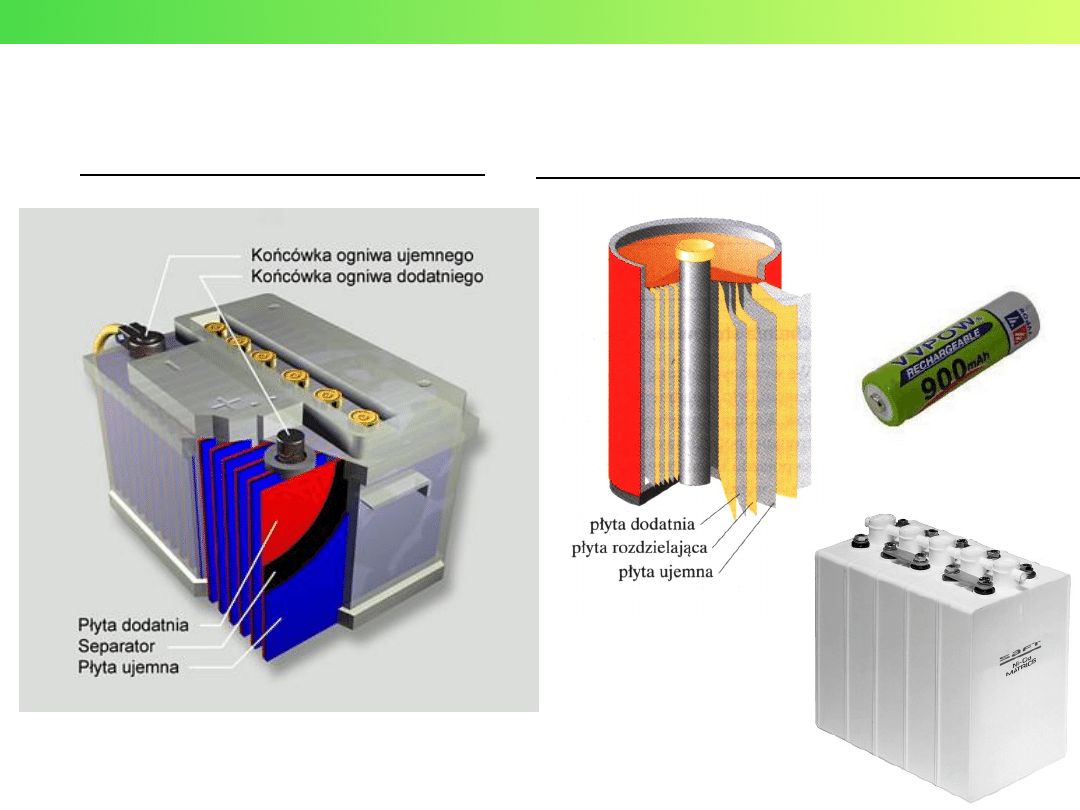
Ogniwa odwracalne - AKUMULATORY
Akumulator ołowiowy – 2 V
Akumulator niklowo-kadmowy – 1,2 V

Wykład 3 – Elektrochemia
Ogniwa – „zrób to sam”
Wykład 3 – Elektrochemia
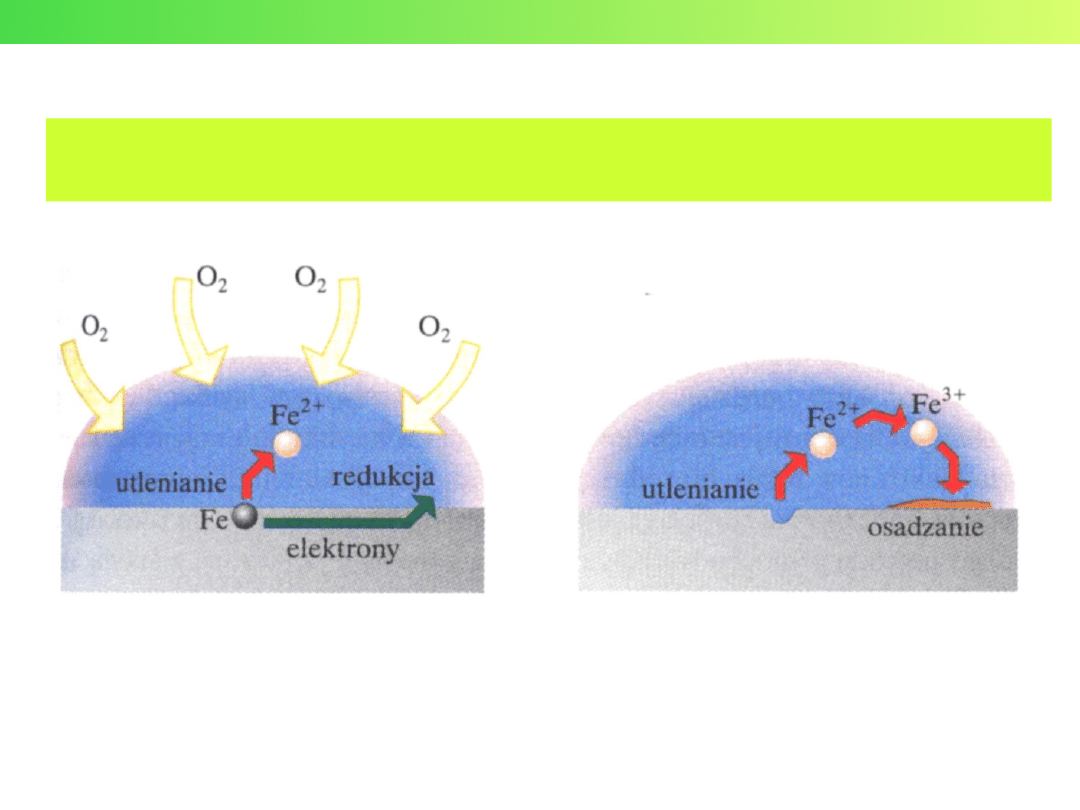
KOROZJA
Korozja – proces niszczenia materiałów wskutek chemicznego
lub elektrochemicznego oddziaływania środowiska
Półogniwa tlenowe
O
2
+ 2H
2
O + 4e
–
4OH
–
E
0
=+0,40 V
O
2
+ 4H
+
+ 4e
–
2H
2
O
E
0
=+1,23 V

Wykład 3 – Elektrochemia
Przykłady korozji metali
Korozja
żela
za
Korozja miedzi -
patyna
Malachit
Cu
2
(CO
3
)(OH)
2
ELEKTROLIZA
Wykład 3 – Elektrochemia
zastosowanie elektryczności
do przeprowadzania reakcji,
które nie zachodzą samorzutnie.
Elektrolizer
Ogniwo
e
–
e
–
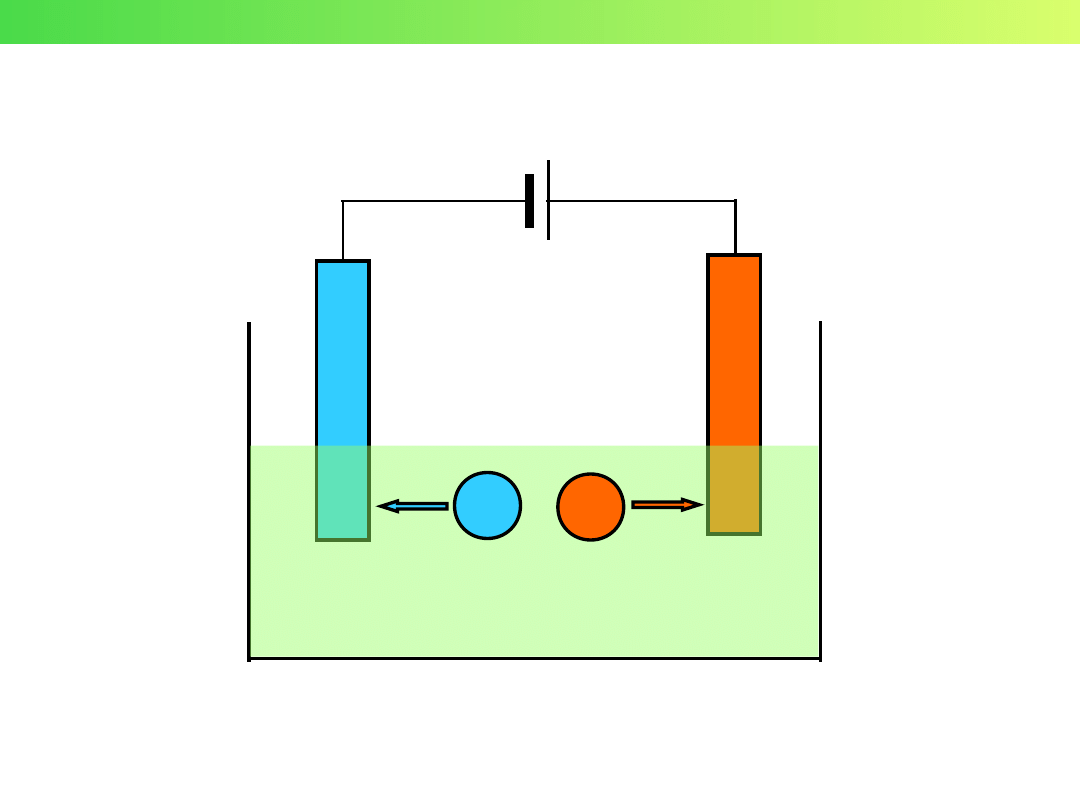
Wykład 3 – Elektrochemia
Schemat elektrolizera
K
+
A
–
– +
(–)
(+)
KATODA
ANODA
Redukcja
Utlenianie
- „utleniacz”
„reduktor” -
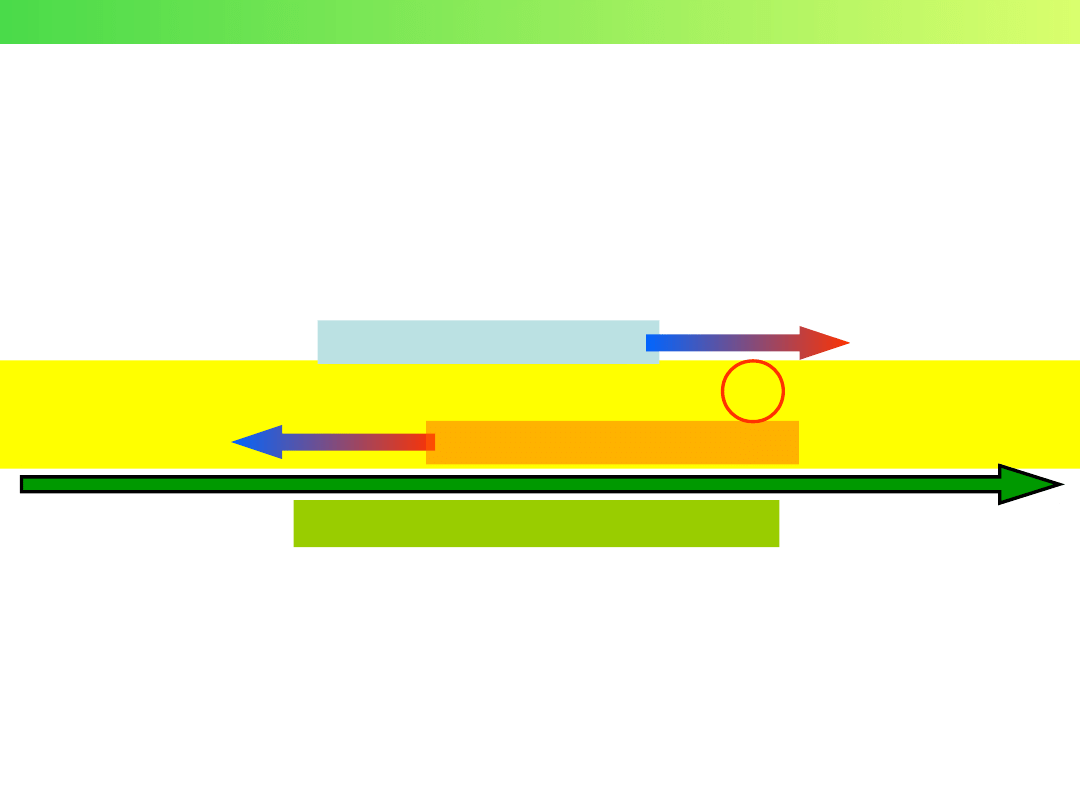
Wykład 3 – Elektrochemia
Li K Ca Na Al Zn Cr Fe Ni Sn Pb
H
Cu Ag
Hg Au
UTLENIACZE (jako jony)
REDUKTORY (jako metale)
Szereg elektrochemiczny
metali
Szereg napięciowy metali
0
Ox/Re
E
Wykład 3 – Elektrochemia
Przykłady procesów elektrolitycznych
1. Elektroliza stopionego NaCl
Na
+
+ e
–
= Na
2Cl
–
= Cl
2
+ 2e
–
KATODA
ANODA
ANODA
(grafit)
KATODA
(żelazo)
2. Elektrolityczne otrzymywanie Al
Al
3+
+ 3e
–
= Al
2O
2–
= O
2
+ 4e
–
KATODA
ANODA
ANODA
(grafit)
KATODA
(grafit)
Al
2
O
3
Na
3
AlF
6
Ciekły
glin
Wykład 3 – Elektrochemia
Przykłady procesów elektrolitycznych
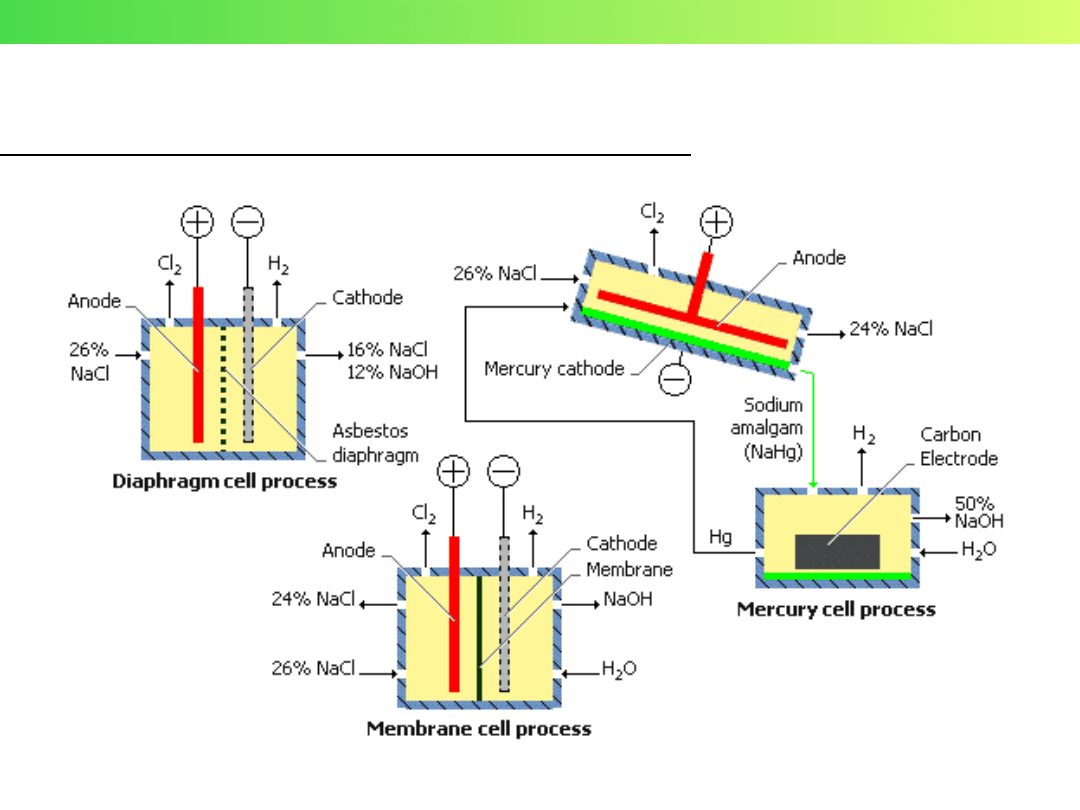
3. Elektroliza wodnego roztworu NaCl (solanki)
Wykład 3 – Elektrochemia
CaF
2
+ H
2
SO
4
→ 2 HF + CaSO
4
HF + KF → KHF
2
2 KHF
2
→ 2 KF + H
2
+ F
2
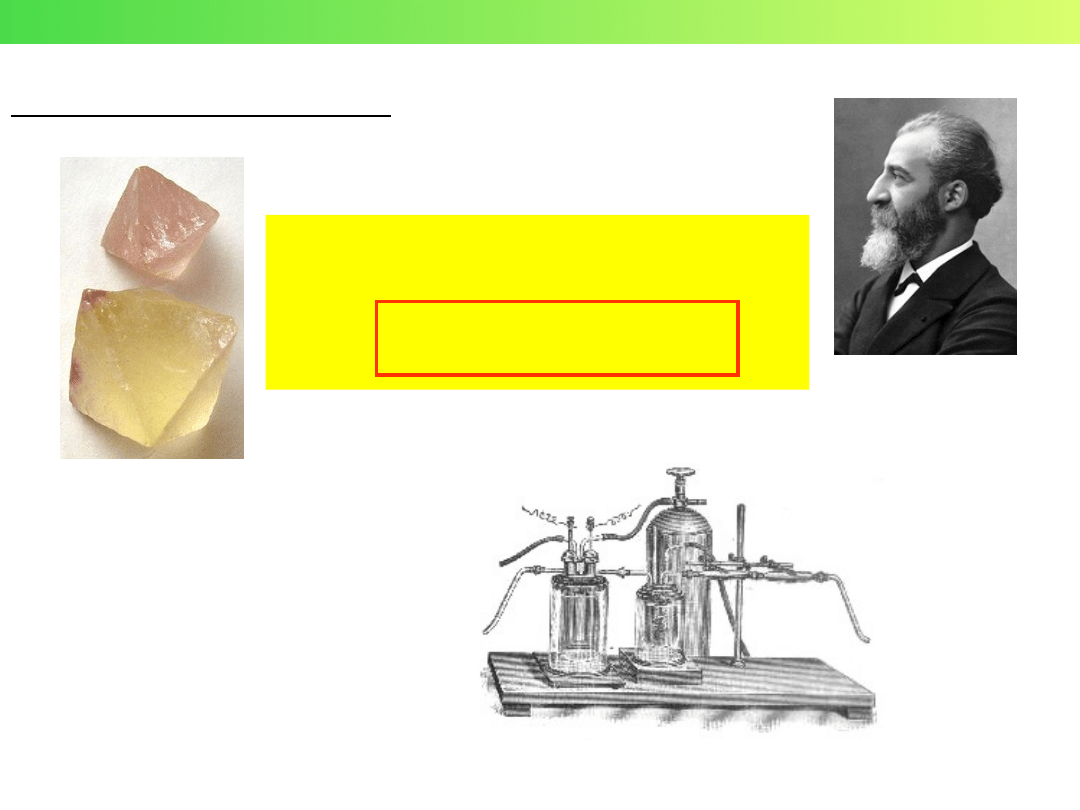
4. Otrzymywanie fluoru F
2
Fluoryt CaF
2
elektroliza (anoda)
Moissan (1886)
Henri Moissan
(1852 – 1907)
Nobel 1906

Q =
F m z
M
F - stała Faradaya (w
kulombach/mol)
z - ładunek jonu (bezwymiarowe)
M - masa molowa jonu (w
gram/mol).
Wykład 3 – Elektrochemia
Prawa elektrolizy
(Faraday 1834)
1. Masa substancji wydzielonej podczas
elektrolizy jest proporcjonalna do
ładunku Q,
który przepłynął przez elektrolit
2. Ładunek Q potrzebny do wydzielenia lub
roztworzenia masy m jest dany zależnością
Michael Faraday (1791 - 1867)
eksperymentator, samouk,
odkrywca m.in.: indukcji
elektromagnetycznej,
samoindukcji, silnika
elektrycznego, prądnicy,
diamagnetyzmu,
paramagnetyzmu, praw
elektrolizy benzenu, koloidalnego
złota.
Oryginalne próbki Faradaya: benzenu i koloidalnego złota
Stała Faradaya (F) –
ładunek 1 mola elektronów
1,602·10
–19
C x 6,022 ·10
23
= 96486 C/mol
Franklin x Avogadro = Faraday
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
Wyszukiwarka
Podobne podstrony:
zad5, Politechnika Poznańska, Mechatronika, Semestr 03, Elektrotechnika - ćwiczenia, Elektrotechnika
59 MT 03 Elektromagnes
03-6, Elektrotechnika-materiały do szkoły, Energoelektronika
zad2, Politechnika Poznańska, Mechatronika, Semestr 03, Elektrotechnika - ćwiczenia, Elektrotechnika
zad4, Politechnika Poznańska, Mechatronika, Semestr 03, Elektrotechnika - ćwiczenia, Elektrotechnika
Pytania sieci rozdz 03, Elektrotechnika, Downloads
formatka, Politechnika Poznańska, Mechatronika, Semestr 03, Elektrotechnika - laboratoria
03 Elektroterapia automatyczne defibrylatory zewnętrzne, defibrylacja, kardiowersja i elektrosty
wtk-03, Elektrotechnika, Telekomunikacja, wykład
79 Nw 03 Elektroniczna zapalniczka
15 03 Elektronarzedzia
Badanie liczników energii elektrycznej, Politechnika Poznańska, Mechatronika, Semestr 03, Elektrotec
59 MT 03 Elektromagnes
79 Nw 03 Elektroniczna zapalniczka
więcej podobnych podstron