
Elektrochemia
Szereg napięciowy metali
Rodzaje elektrod
Ogniwa w zastosowaniu
praktycznym
Dr inż. Katarzyna Kozłowska

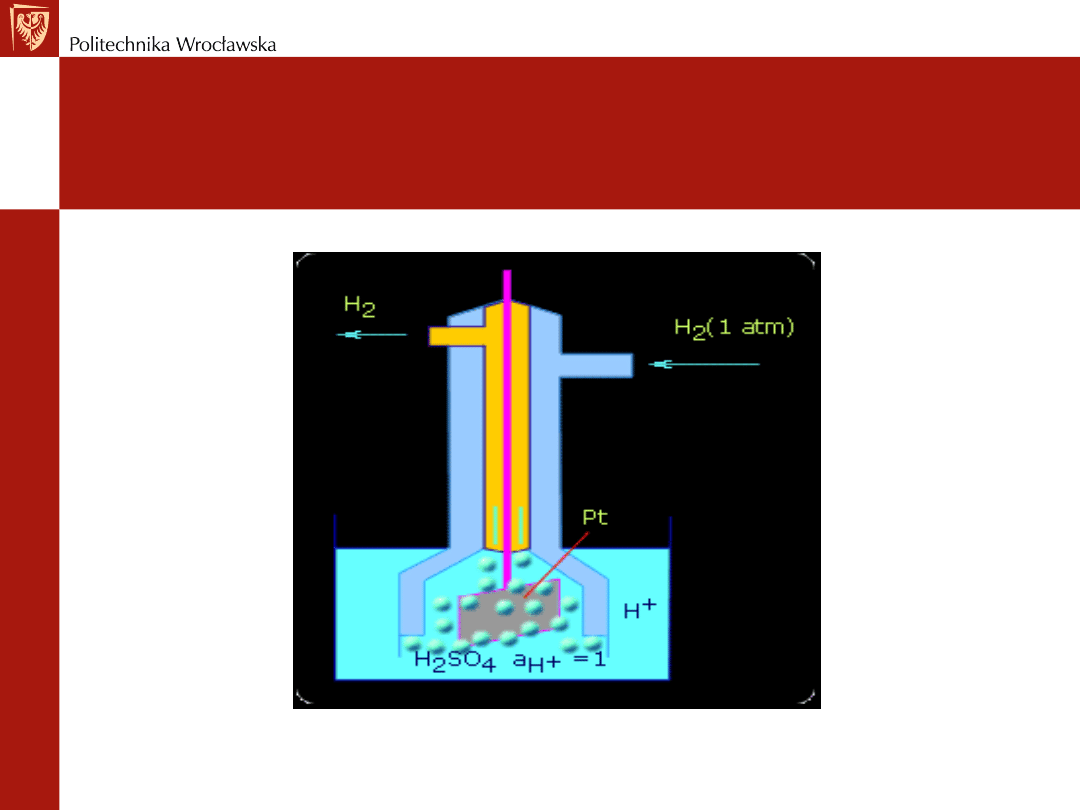
Standardowa elektroda wodorowa
Potencjał elektrody wodorowej przyjęto zero (0) - w każdej
temperaturze
Składa się z
płytki platynowej pokrytej warstewką czerni
platynowej
(absorbuje ona gazowy wodór)
opłukiwanej
wodorem gazowym pod ciśnieniem 1013 hPa
Płytka zanurzona jest w roztworze mocnego kwasu o
jednostkowej aktywności jonów wodorowych

Standardowa elektroda
wodorowa
Platyna
nie bierze bezpośredniego udziału w reakcji elektrodowej
pokryta czernią platynową z nasyconym wodorem zachowuje
się tak, jakby była elektrodą wykonaną z samego wodoru

Standardowa elektroda
wodorowa
Atomy wodoru podobnie jak metale przechodzą w postaci
jonów do roztworu
Jednocześnie jony wodorowe z roztworu ulegają na płytce
platynowej rozładowaniu
H
2
<=> 2H
+
+ 2e
Elektroda wodorowa

Elektroda wodorowa
Potencjał elektrodowy elektrody wodorowej przyjęto równy
zeru
Siła elektromotoryczna (SEM) ogniwa złożonego z normalnej
elektrody wodorowej i dowolnej innej elektrody daje –
bezpośrednio
potencjał zastosowanej elektrody
Elektroda wodorowa
Stosując elektrodę wodorową
Można wyznaczyć względne wartości potencjałów normalnych
Przez pomiar siły elektromotorycznej ogniwa zbudowanego z
normalnej elektrody wodorowej i badanej elektrody
zanurzonej w roztworze swych jonów o aktywności równej
jedności
Elektroda wodorowa
SEM takiego ogniwa jest różnicą potencjałów normalnych obu
elektrod
E
o
= E
o
H
2
– E
o
Me
Potencjał normalnej elektrody wodorowej równa się zeru
Zmierzona wartość SEM –to
Normalny względny potencjał danej elektrody

Szereg napięciowy metali
Szereg napięciowy metali
Reakcje elektrodowe uszeregowane według rosnących
wartości odpowiadających im potencjałów normalnych
Szereg napięciowy metali
Elektroda
Reakcja
elektrodowa
Potencjał
[V]
Li/Li
+
Li <=> Li
+
+ e
- 3,05
K/K
+
K <=> K
+
+ e
- 2,93
Ca/Ca
2+
Ca <=> Ca
2+
+
2e
- 2,84
Mg/Mg
2+
Mg <=> Mg
2+
+ 2e
- 2,37
Al/Al
3+
Al <=> Al
3+
+
3e
- 1,66
H
2
/H
+
H
2
<=> 2H
+
+
2e
- 0,00
z definicji
Ag/Ag
+
Ag
+
+ e <=>
Ag
+ 0,800
Au/Au
+
Au
+
+ e <=>
Au
+ 1,420

Szereg napięciowy metali
Wartość potencjału standardowego - to miara zdolności
utleniająco-redukujących pary utleniacz-reduktor
Znak i wartość potencjału standardowego –
określają zdolności redukujące cząstek
Dodatni znaku E
o
(Cu
2+
/Cu) +0,34 V -w ogniwie z elektrodą
wodorową miedź to- katoda - miejsce redukcji

Szereg napięciowy metali
Miedź jest redukowana przez gazowy wodór:
Cu
2+
+ H
2
(g) --> Cu(s) + 2H
+
Ujemny znak
E
o
(Zn
2+
/Zn) = - 0,76 V - w ogniwie z elektrodą
wodorową cynk –anoda –miejsce utleniania
Cynk redukuje jony wodorowe do gazowego wodoru:
Zn(s) + 2H
+
--> Zn
2+
+ H
2
(g)

Szereg napięciowy
Znając położenie pierwiastka w szeregu napięciowym
Określa się jego aktywność chemiczną
Pozwala to na przewidzenie kierunku
reakcji samorzutnych

Reakcje samorzutne
Ogniwo
(-)Me(s)|Me
z+
||
H
+
(aq)|H
2
(g)|Pt(+)
Wodór - wypierany z rozcieńczonych kwasów przez metale o
potencjałach standardowych niższych niż potencjał
standardowy elektrody wodorowej
Metale: K, Ca, Na, Zn
W czasie pracy:
o na lewym półogniwie będzie przebiegał proces utlenienia
metalu Me
o na prawym - proces redukcji kationów H
+
Wypadkowa reakcja
Me + zH
+
--> Me
z+
+ z/2 H
2
(g)

Reakcje samorzutne
Metale o dodatnich potencjałach standardowych
nie mogą redukować jonów wodorowych i wydzielać
gazowego wodoru z rozcieńczonego roztworu kwasu
Cu i metale szlachetne: Ag, Pt i Au
–
nie zostają utlenione przez jony wodorowe
Na podstawie potencjałów normalnych elektrod można
określić znaki elektrod i obliczyć wartość SEM ogniwa
SEM ogniwa zbudowanego z dwóch metali jest tym większa
im dalej od siebie są one położone w szeregu napięciowym

Rodzaje elektrod
Elektrody pierwszego rodzaju
Elektrody drugiego rodzaju
Elektrody pierwszego rodzaju
o Potencjał elektrodowy elektrod pierwszego rodzaju to wynik
wysyłania lub przyjmowania przez metal jonów dodatnich z
roztworu elektrolitu
o Odwracalne względem kationów
o Elektroda cynkowa, miedziana, węglowa ( odwracalna
względem jonów wodorowych)

Elektrody drugiego rodzaju
Składają się z metalu, jego trudno rozpuszczalnej soli oraz
elektrolitu zawierającego aniony wchodzące w skład trudno
rozpuszczalnej soli
Elektroda kalomelowa:
o składa się z naczyńka, w którym w charakterze kontaktu,
umieszczony jest drucik platynowy
o drucik zanurzony jest w rtęci znajdującej się na dnie
naczynia
o rtęć pokryta jest warstwą mieszaniny rtęci i chlorku
rtęciowego Hg
2
Cl
2
(kalomel)
o nad tą mieszaniną znajduje się roztwór chlorku potasu KCl
Schemat budowy elektrody kalomelowej
Hg, Hg
2
Cl
2
(s) || KCl
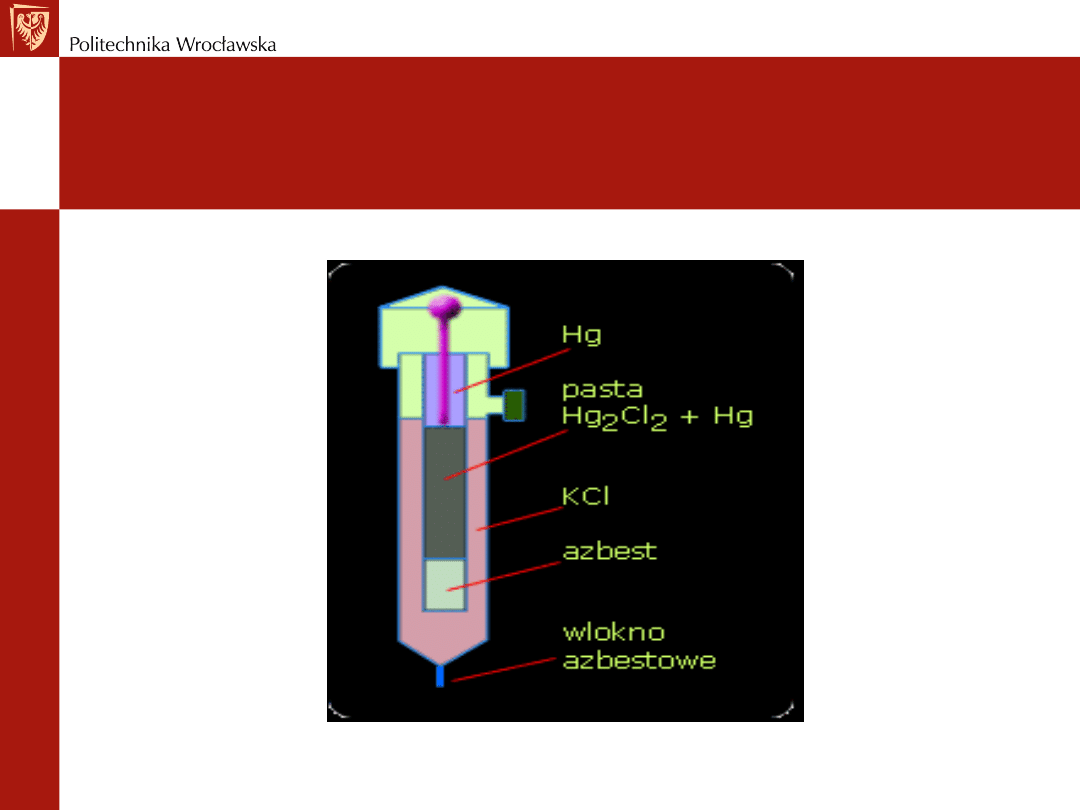
Schemat elektrody kalomelowej

Elektroda kalomelowa
Reakcją połówkową redukcji w przypadku kalomelu:
Hg
2
Cl
2
(s) + 2e --> 2Hg(c) + 2Cl
-
E
o
= +0,27V
O potencjale elektrody kalomelowej decyduje stężenie jonów
chlorkowych - wobec których elektroda jest odwracalna
Elektroda kalomelowa
Stężenie jonów chlorkowych w roztworze KCl
Którym elektroda jest wypełniona
Wpływa na stężenie jonów rtęciowych
Gdyż iloczyn rozpuszczalności kalomelu ma wartość stałą w
niezmiennej temperaturze

Elektroda kalomelowa
Im większe jest stężenie jonów chlorkowych
Tym mniejsze jest stężenie jonów rtęciowych
Tym mniejszy potencjał elektrody

Elektroda kalomelowa - użyta - jako
anoda
Gdy w ogniwie jest anodą
Podczas pracy ogniwa ulega utlenieniu
Przechodzi do roztworu w postaci jonów Hg
22+
- które z jonami
Cl- pochodzącymi od KCl tworzą trudno rozpuszczalny osad
Hg
2
Cl
2
(s)

Elektroda kalomelowa jako
katoda
Gdy w ogniwie jest katodą
Jony Hg
22+
pochodzące z kalomelu redukują się do metalicznej
rtęci
Wzrasta stężenie jonów chlorkowych

Elektrody
Elektrody drugiego rodzaju:
elektroda chlorosrebrowa
Ag , AgCl(s) ||Cl
-
elektroda siarczanowo-miedziowa
Cu , CuSO
4
|| SO
42-

Ogniwo Westona – wzorzec SEM
Ogniwo Westona:
o wykorzystuje się jako wzorzec siły elektromotorycznej w
pomiarach potencjometrycznych
o zbudowane jest z półogniwa drugiego rodzaju i z półogniwa
pierwszego rodzaju
o schemat ogniwa Westona
Hg | Hg
2
SO
4
(s) || CdSO
4
(8/3)H
2
O(roztwór nasycony) | Cd Hg
(amalgamat 12,5% Cd)
o Zachodzi tam reakcja
Cd(s) + Hg
2
SO
4
(s) <=> CdSO
4
(s) + 2Hg(c)
o Siła elektromotoryczna stała i wynosi 1,0883 V dla
temperatury 25
o
C

Elektrody oksydacyjno-redukcyjne
Zawierają obojętny chemicznie metal (platyna lub złoto)
zanurzony w roztworze substancji obecnej zarówno w formie
utlenionej (oks) jak i zredukowanej (red)
zgodnie z
równaniem:
oks + ne <=> red
Platyna zanurzona w roztworze jonów żelaza(III) Fe
3+
i
żelaza(II) Fe
2+
Pt | Fe
3+
, Fe
2+
Zachodzi tam reakcja
Fe
3+
+ e <=> Fe
2+

Elektrody oksydacyjno-redukcyjne
Potencjał elektrody platynowej w układzie oksydacyjno-
redukcyjnym
gdzie: a
oks
- aktywność formy utlenionej
a
red
- aktywność formy zredukowanej
E
o
- normalny potencjał oksydacyjno-redukcyjny

Ogniwa stężeniowe
Siła elektromotoryczna powstaje na skutek różnicy stężeń
(aktywności) roztworów przy elektrodach
Ogniwo zbudowane
z dwóch elektrod srebrowych
zanurzonych w roztworach azotanu srebra o różnych
stężeniach c
1
i c
2
(c
1
< c
2
)
(-) Ag | AgNO
3
( c
1
) || AgNO
3
( c
2
) |Ag (+)

Ogniwa stężeniowe
W czasie pracy ogniwa na anodzie zachodzi utlenianie
metalicznego srebra
Anoda:(-) Ag <=> Ag
+
+ e
Katoda:(+) Ag
+
+ e <=> Ag
Siła elektromotoryczna ogniwa stężeniowego

Ogniwa w zastosowaniu
praktycznym
Ogniwa:
o Pierwotne
- po wyczerpaniu nie nadają się do dalszego
użytkowania -
ogniwo Lecklanche'go
o Wtórne
- można regenerować przez ładowanie -
akumulatory

Ogniwa pierwotne
Ogniwa w wersji kwaśnej i zasadowej
Ogniwo w wersji kwaśnej - ogniwo Lecklanche'go składa
się:
z kubka cynkowego - jednocześnie biegun ujemny
wewnątrz kubka - elektrolit w postaci pasty złożonej z
chlorku amonowego, niewielkiej ilości chlorku cynkowego,
wody oraz ziemi okrzemkowej albo innego wypełniacza
w paście - pręt węglowy (grafitowy) otoczony woreczkiem
zawierającym drobno sproszkowany tlenek manganu(IV)
pręt węglowy zaopatrzony jest na końcu w przykrywkę
mosiężną dla lepszego kontaktu z prętem węglowym - w
ogniwie - biegun dodatni
tlenek manganu(IV) -pełni rolę depolaryzatora
schemat ogniwa:
Zn(s)|ZnCl
2
(aq),NH
4
Cl(aq)|MnO(OH)(s)|MnO
2
(s)|C, 1,5 V
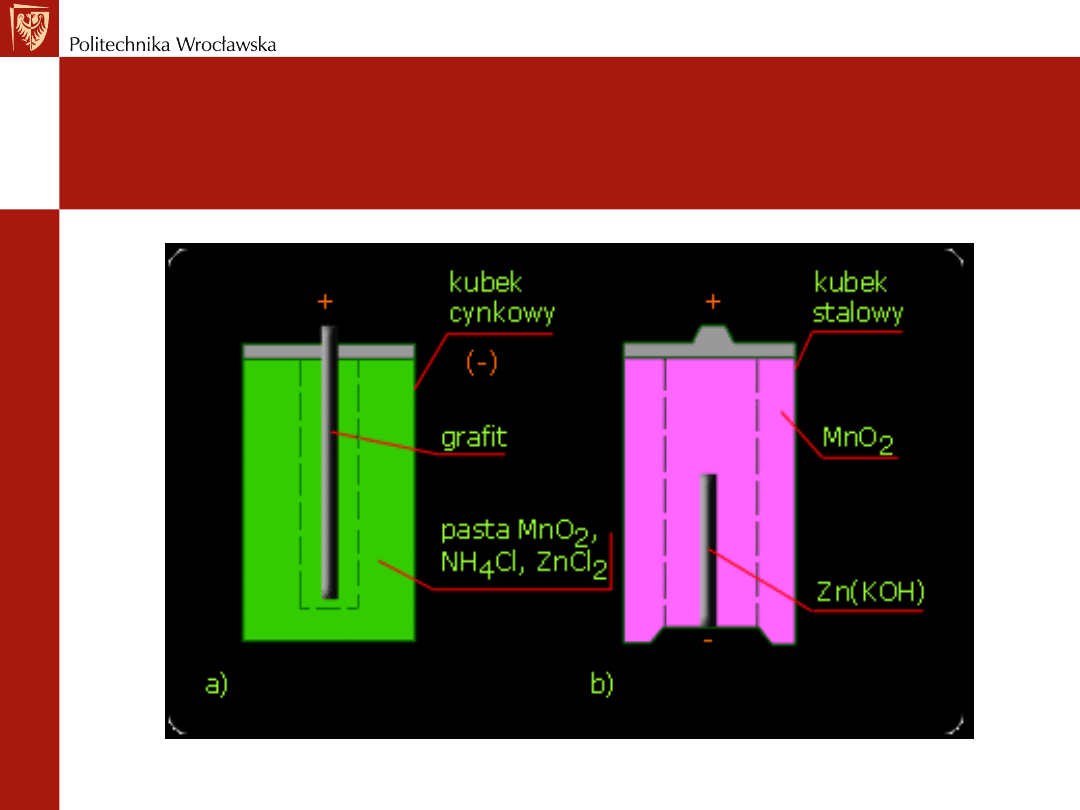
Ogniwo Lecklanche'go

Ogniwo Lecklanche'go – co się
dzieje podczas pracy
Na anodzie
Na katodzie
Zn --> Zn
2+
+
2e
MnO
2
(s) + H
2
O(c) + e
-
--> MnO(OH)(s) +
OH
-
(aq)
NH
4
(aq)+ + OH
-
(aq) --> 2NH
3
(g) + H
2
O(c)
ogólnie
2NH
4
(aq)+ + 2e
-
--> 2NH
3
(g) + H
2
(g)
Uwolniony wodór reaguje z MnO
2
H
2
+ 2MnO
2
--> Mn
2
O
3
+ H
2
O

Ogniwo Lecklanche'go – co się
dzieje podczas pracy
Mangan redukuje się z Mn
4+
do Mn
3+
Wytworzona woda dostarcza wilgoci koniecznej do umożliwienia
wędrówki jonów
Powstały amoniak jest związany przez jony cynku w jony
zespolone aminocynkowe
4NH
3
+ Zn
2+
--> [Zn(NH
3
)
4
]
2+
Różnica potencjałów ok. 1,4V
Napięcie w czasie pracy maleje do 0,8V
Wyższe napięcie - uzyskuje przez połączenie kilku ogniw
szeregowo w baterie

Ogniwo Lecklanche'go – co się
dzieje podczas pracy
Jeżeli ogniwo - pobiera się prąd z ogniwa suchego w sposób
ciągły
Dwie wtórne reakcje katodowe wiązania wodoru i amoniaku
- są dosyć wolne
Katoda polaryzuje się i napięcie maleje
Jeżeli następuje przerwa w pobieraniu prądu - reakcje
depolaryzatora MnO
2
oraz reakcja wiązania amoniaku zdąży
zajść i napięcie ogniwa wzrasta

Ogniwo w wersji alkalicznej
Roztwór – KOH
Pracują dłużej -gdyż nie następuje korozja cynku pod
wpływem NH
4
Cl – zamist NH
4
Cl - KOH
Sposób pobudzenia wyczerpanego częściowo ogniwa
suchego - krótkotrwałe ogrzanie
Podwyższenie temperatury przyspiesza reakcję depolaryzacji
- zwiększa szybkość dyfuzji jonów w elektrolicie

Ogniwa wtórne
Akumulator ołowiony
Szeroko stosowany
W samochodach, pociągach, laboratoriach jako źródło prądu
stałego
Podstawowy składnik – ołów
Elektrody - z płyt ołowianych - kratownic - z wyprasowanym w nie
tlenkiem ołowiu(II) (PbO)
Po umieszczeniu płyt w naczyniu - wprowadza się 20% roztwór
wodny kwasu siarkowego(VI) o gestości 1,15 g/cm
3
w
temperaturze 25
o
C
Stosowany jest także stężony kwas siarkowy (30%) zależnie od
typu akumulatora
Po zetknięciu się kwasu siarkowego(VI) z płytami zachodzi reakcja
PbO(s) + H
2
SO
4
(c) --> PbSO
4
(s) + H
2
O(c)
Na płytach osadza się siarczan ołowiu(II)
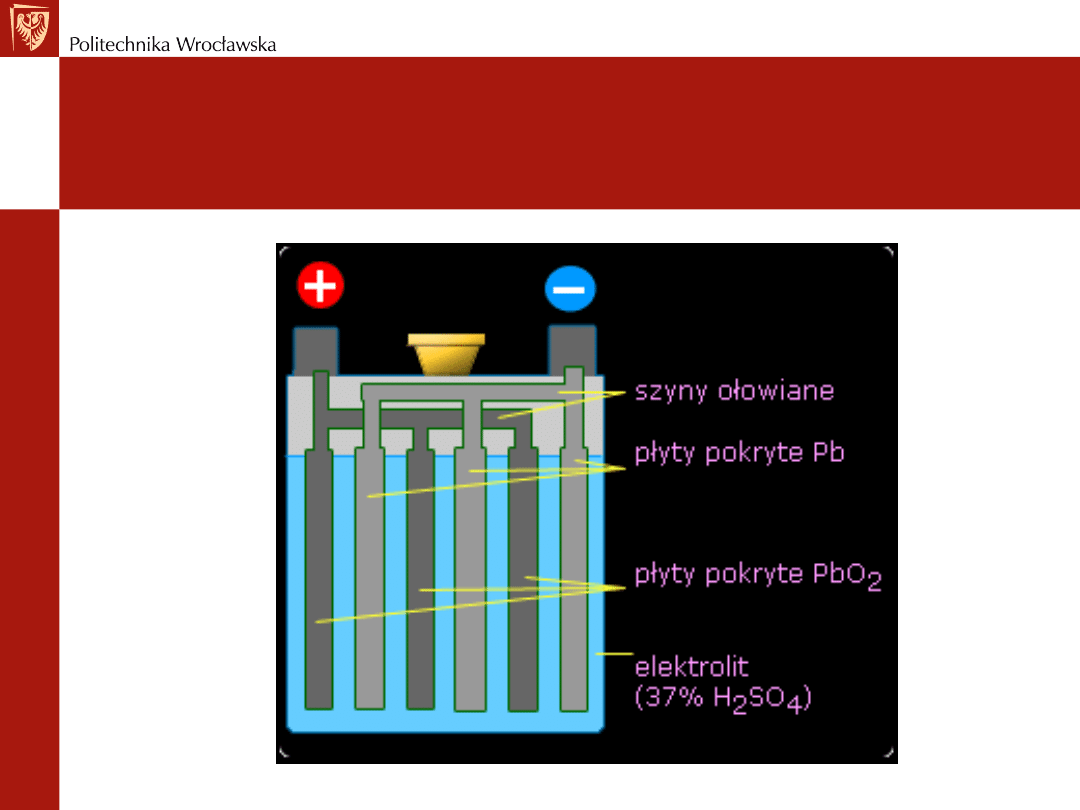
Schemat ogniwa akumulatora
ołowiowego

Akumulator ołowiowy
Ładowanie akumulatora powoduje zróżnicowanie elektrod
Ładowanie - to elektroliza kwasu siarkowego akumulatora
Na elektrodzie połączonej z
dodatnim biegunem
zewnętrznym źródła prądu biegnie proces łańcuchowy
SO
42-
+ PbSO
4
(s) --> Pb(SO
4
)
2
(c) + 2e
Siarczan ołowiu (IV) ulega odwracalnej hydrolizie
Pb(SO
4
)
2
(s) + 2H
2
O --> PbO
2
(s) + H
2
SO
4
(c)

Akumulator ołowiowy
Równolegle rozpuszczony siarczan ołowiu(IV) częściowo
dysocjuje na jony
Pb(SO
4
)
2
(c) <=> Pb
4+
+ 2SO
42-
W wyniku ładowania na elektrodzie ujemnej -powstaje ołów
Na elektrodzie dodatniej - tlenek ołowiu(IV)
Powstaje ogniwo o schemacie
Pb(s)|PbSO
4
(s)|H+(aq),HSO
-4
(aq)|PbO
2
(s)|PbSO
4
(s)|Pb(s), 2 V

Akumulator ołowiowy
Osadzone na elektrodach ołowianych substancje - są
gąbczaste
W ogniwach - stosowanych jako źródła prądu -dąży się do
utworzenia dużej powierzchni czynnych elektrochemicznych
reagentów -
Podnosi to szybkość procesów elektrodowych
Dodatnia elektroda akumulatora ołowianego -elektroda
redoksy - ołów metaliczny spełnia rolę wymiennika
elektronów
Elektroda ujemna - pierwszego rodzaju

Akumulator ołowiowy
Podczas pracy akumulatora -procesy elektrodowe:
o na elektrodzie ujemnej (anoda)
Pb(s) + HSO
4-
--> PbSO
4
(s) + H
+
+ 2e-
o na elektrodzie dodatniej (katoda)
o PbO
2
(s) + 3H
+
+ HSO
4-
+ 2e- --> PbSO
4
(s) + 2H
2
O
Sumaryczny proces w ogniwie
2PbSO
4
(s) + 2H
2
O <=> PbO
2
(s) + Pb(s) + 2H
2
SO
4
o Podczas ładowania akumulatora reakcja biegnie na prawo
o Podczas pracy - na lewo

Akumulator ołowiowy
SEM akumulatora ołowianego - 2,2V
W niewielkim stopniu zależy od temperatury
Dla uzyskania większej wartości napięć zasilających - pojedyncze
ogniwa łączy się szeregowo w baterię akumulatorów
W czasie pracy akumulatora nie można dopuścić aby siła
elektromotoryczna na pojedynczym ogniwie spadła poniżej
1,8V - na elektrodach zachodzą wtedy procesy
nieodwracalne - tworzy się PbS (siarczek ołowiu(II)) -
akumulator ulega zasiarczeniu
Wrażliwy - na wstrząsy, co wpływa na odpadanie porowatej masy
płyt – wynik - to samorozładowanie się akumulatora -
konsekwencja – zasiarczenie
Wymaga ciągłej konserwacji
Mała pojemność
Nadaje się do użycia tylko przy procesach krótkotrwałych -
podczas uruchamiania samochodu

Akumulator niklowo-żelazowy
(Edisona)
Mniej wrażliwy na wstrząsy
Nie wymaga konserwacji
Elektrolit to 21%(wagowo) roztwór KOH z małym dodatkiem
soli litu
Jony litu - adsorbują się na fazach stałych i działają
katalitycznie
Ujemną elektrodą - elektroda żelazna
Dodatnia elektroda - elektroda niklowa
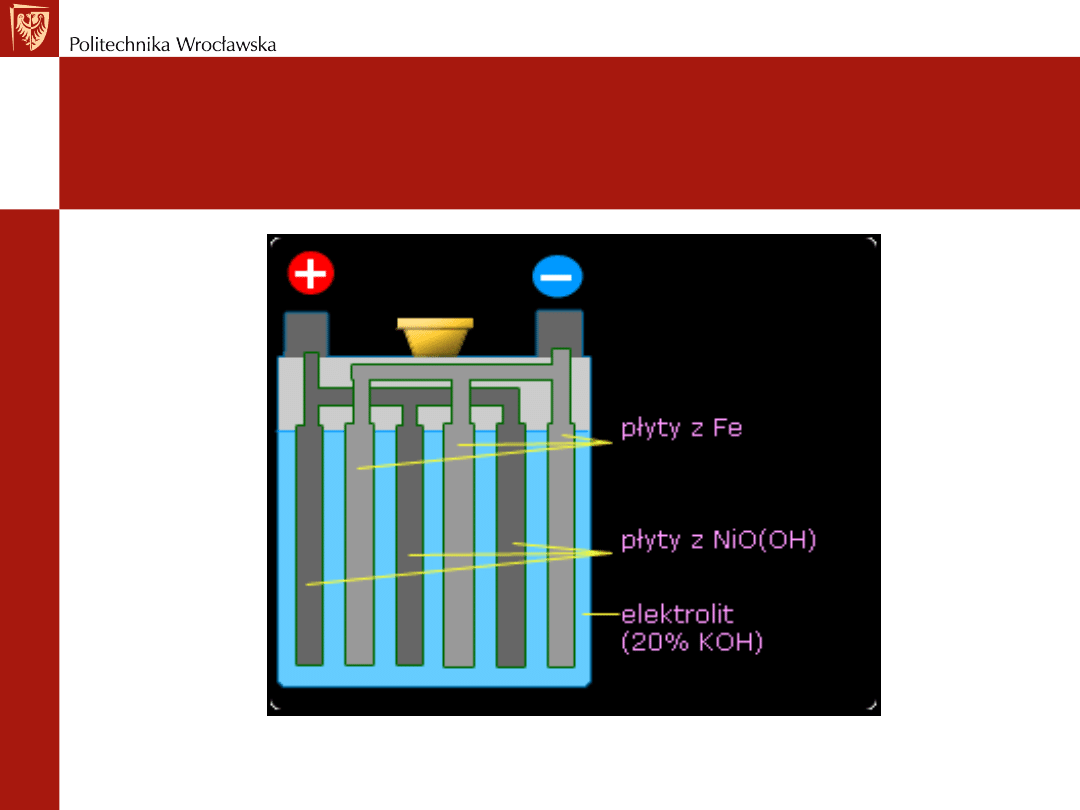
Ogniwo akumulatora niklowo-
żelazowego

Akumulator niklowo-żelazowy
Elektroda niklowa – to mieszanina tlenków: NiO
2
, Ni
2
O
3
lub
Ni
3
O
4
Może pracować do całkowitej utraty napięcia - wytwarzając
duże natężenia prądu
SEM wynosi 1,4 - 1,2 V
Stosowany - w radiostacjach - ze względu na dużą pojemność
Przewaga nad ogniwem ołowianym - jony OH- wytworzone na
katodzie są zużywane na anodzie - nie ma zmiany stężenia
elektrolitu podczas pracy akumulatora

Akumulator srebrowo-cynkowy
Opracowany w 1941 roku
Schemat ogniwa
(-)Zn(s)|KOH(30-40%)|Ag
2
O(s)|Ag(+)
Procesy elektrodowe podczas pracy
(-)Zn(s) + 4OH
-
--> [Zn(OH)
4
]
2-
+ 2e
-
(+)Ag
2
O(s) + H
2
O + 2e
-
--> 2Ag(s) + 2OH
-
Proces sumaryczny
Zn(s) + Ag
2
O(s) + 2KOH --> 2Ag(s) + K
2
[Zn(OH)
4
]
SEM wynosi 1,86V
Duża stabilność parametrów podczas rozładowania – dlatego
często stosuje się w sektorze militarnym, technice kosmicznej,
do zasilania mikroelektroniki użytkowej

Ogniwa paliwowe
Każdą reakcję redoks można rozdzielić na reakcje połówkowe i
wykorzystać do utworzenia ogniwa galwanicznego
Utlenianie metanu CH
4
:
CH
4
(g) + 2O
2
(g) --> CO
2
(g) + 2H
2
O
Reakcje połówkowe -w kwaśnym roztworze
anoda: CH
4
(g) + 10H
2
O --> CO
2
(g) + 8H
3
O
+
+ 8e
katoda: 2O
2
(g) + 4H
3
O
+
+ 4e
-
-> 4OH
-

Ogniwa paliwowe
W praktyce
Reakcja ta przebiega lepiej w środowisku zasadowym
Produkt reakcji CO
2
(g) występuje jako jon węglanowy CO
32-
Reakcje połówkowe w środowisku zasadowym
anoda: CH
4
(g) + 10OH
-
--> CO
32-
+ 7H
2
O + 8e
katoda: O
2
(g) + 2H
2
O + 4e
-
-> 4OH
-
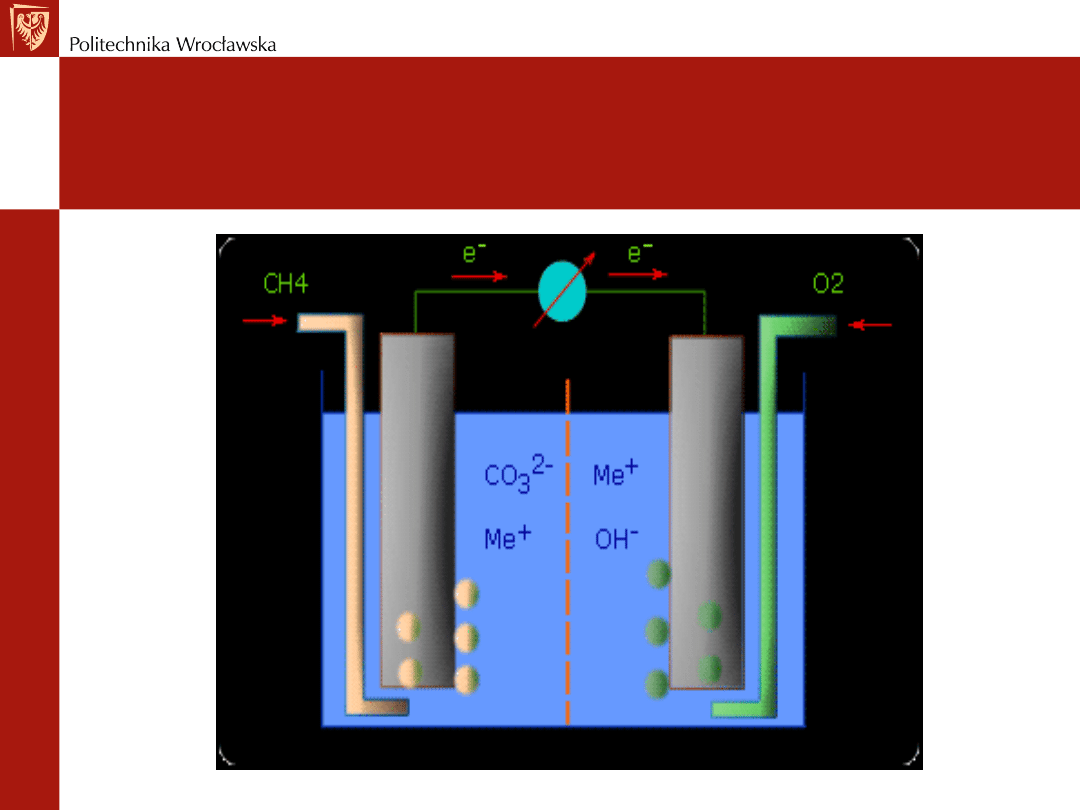
Schemat ogniwa paliwowego

Ogniwa paliwowe
Tutaj - dwoma reagentami są gazy - muszą być
wprowadzone do ogniwa z zewnątrz
Aby zapewnić kontakt elektryczny z reagującymi gazami
przewodzącymi - lecz obojętnymi - elektrody są zawieszone
w strumieniu pęcherzyków gazów
Porowata przegroda - reagujące gazy nie powinny się
mieszać

Jedyne działające ogniowo
paliwowe
Ogniwo, w którym wykorzystano reakcję
2H
2
(g) + O
2
(g) --> 2H
2
O
Elektrolit - wodny roztwór KOH
H
2
(g) i O
2
(g) - reagują powoli w zwykłej temperaturze -
zastosowano katalizatory - przyspieszają reakcje elektrodowe
Katalizator dla reakcji anodowej
- rozdrobniona platyna lub
pallad
Katalizator dla reakcji katodowej
- tlenek kobaltowy CoO,
platyna lub srebro
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
Wyszukiwarka
Podobne podstrony:
Dobra ściąga z elektrostatyki prąd napięcie, Testy
instrukcja bhp eksploatacji instalacji elektrycznych niskiego napiecia
Cw 2 ?danie sprzetu elektroizl (proby napieciowe)
Elektronika- Stabilizator napiecia stałego o działaniu nieciągłym, Laboratorium układów elektroniczn
Elektronika- Stabilizator napiecia stałego o działaniu nieciągłym, Laboratorium układów elektroniczn
Elektronika- Stabilizator napięcia stałego o działaniu nieciągłym..DOC, Wydz. E i A Grupa
Szereg napięciowy metali, Energetyka, I rok, chemia
dobra sciaga z elektrostatyki prad napiecie itd FLJW4HLO6EVGLPDTKKIFHKTERUAQAKSUQ6YWB4Y
Pomiary wielkosci elektrycznych Pomiar napiec oscyloskopem id 3
więcej podobnych podstron