
Powietrze jako
mieszanina
gazów
Tlen i Azot
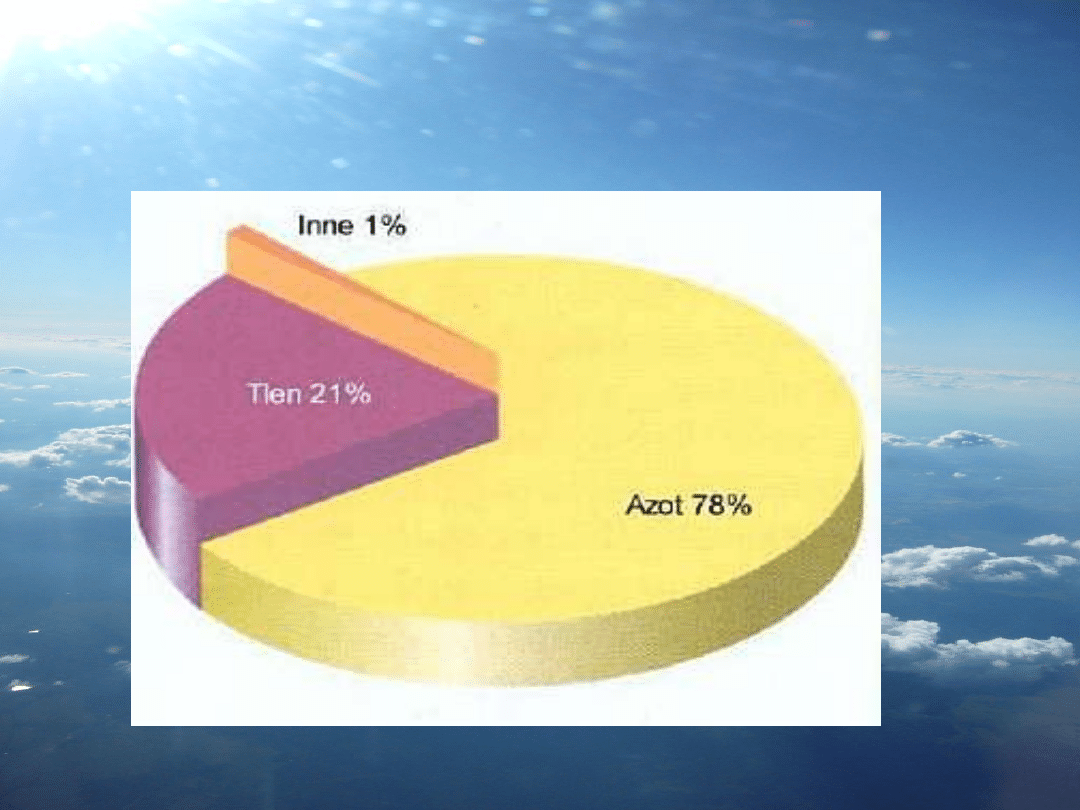
Skład powietrza

Tlen
• Symbol- O
• Znajduje się w grupie tlenowców
• Masa atomowa- 15,55u
• Znajduje się w 16 grupie i 2 okresie
• Ma 6 elektronów walencyjnych
• Znajduje się w bloku p
• Konfiguracja na powłokach- K
2
L
6
• Konfiguracja na pod powłokach-[He]2s²2p
4

Właściwości fizyczne
• Stan skupienia gazowy
• Gęstość 1,31
• Temperatura topnienia [oC]: -218
• Temperatura wrzenia [oC]: -183
• Barwa: bezbarwny
• Zapach: bezwonny
• Twardość: zerowa

Właściwości chemiczne
• W stanie wolnym występuje w postaci
dwuatomowych cząsteczek O
2
• Tlen łączy się z większością
pierwiastków z wytworzeniem tlenków.
[np. tlenek węgla (II)CO, tlenek
magnezu MgO]
• Jest niezbędny do życia większości
organizmów, gdyż bierze udział między
innymi w procesach oddychania.

Związki tlenu
Tlen wchodzi w skład wielu związków
chemicznych o dużym znaczeniu
przemysłowym: tlenków (w szczególności
wody oraz dwutlenku węgla), nadtlenków
(w szczególności nadtlenku wodoru
H
2
O
2
), kwasów tlenowych, zasad. Jest też
składnikiem większości związków
organicznych o znaczeniu biologicznym
np.: białka, tłuszcze.

Przykładowe reakcje tlenu
Woda
2H
2
+O
2
2H
2
O
Dwutlenek węgla
C+O
2
CO
2

Zastosowanie
Tlen jest używany do spalania
węglowodorów, tworzenia tlenków.
Spalanie węglowodorów:
-całkowite:
– CH
4
+ 2O
2
→ CO
2
+ 2H
2
O
-półspalanie (przy niedostatecznym
dostępnie tlenu):
– 2CH
4
+ 3O
2
→ 2CO + 4H
2
O
– CH
4
+ O
2
→ C + 2H
2
O

Azot
• Symbol- N
• Znajduje się w grupie azotowców
• Masa atomowa- 14.01u
• Znajduje się w 15 grupie i 2 okresie
• Ma 5 elektronów walencyjnych
• Znajduje się w bloku p
• Konfiguracja na powłokach- K
2
L
5
• Konfiguracja na pod powłokach-
[He]2s²2p
3

Właściwości fizyczne
• Stan skupienia gazowy
• Gęstość 1,2506 kg/m³
• Temperatura topnienia -210,01 °C
• Temperatura wrzenia -195,8°C
• Barwa: bezbarwny
• Zapach: bezwonny
• Twardość: zerowa

Właściwości chemiczne
• Spotykany w przyrodzie w stanie wolnym
• Azot jest składnikiem aminokwasów i białek.
• Krąży w środowisku w tzw. cyklu azotowym.
• W normalnych warunkach jest bierny
chemicznie, w podwyższonej temperaturze
wchodzi w reakcje z niektórymi metalami
(dając azotki, np. AlN, Mg3N2 Li3N),
wodorem (amoniak), węglikiem
wapniowym, borem (BN), krzemem (Si3N4).

Zastosowanie azotu
• Ciekły azot – jest jednym z najczęściej
stosowanych środków chłodzących, do
uzyskiwania temperatur poniżej – 100°C,
gdyż stosunkowo łatwo można go otrzymać
przez skraplanie powietrza. Gazowy azot
jest masowo stosowany do napełniania
balonów i jako najtańsza z dostępnych
atmosfera ochronna w wielu procesach
przemysłowych. Z jego związków produkuje
się nawozy sztuczne, konserwanty.

Przykładowe reakcje
• Azot o wysokiej czystości można uzyskać poprzez
termiczny rozkład azotan (III) amonu:
NH
4
NO
2
→ N
2
↑ + 2H
2
O
• W laboratorium można bardzo łatwo otrzymać azot
w wyniku łagodnego ogrzewania mieszaniny
chlorku amonu (salmiaku) i azotynu sodu:
NH
4
Cl + NaNO
2
→ N
2
↑ + NaCl + H
2
O
• Kwas azotowy(V) można otrzymać, łącząc tlenek
kwasowy z wodą:
N
2
O
5
+ H
2
O → 2HNO
3
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
Wyszukiwarka
Podobne podstrony:
Powietrze jest mieszaniną gazów
zadania4 lepkosc mieszanin gazow i cieczy pod niskim i umiarkowanym cisnieniem, Technologia chemiczn
meteorologia, opracowanie meteorologiczne, Termika powietrza jako czynnik ekologiczny w leśnictwie
02 statek powietrzny jako obiekt eksploatacji
3 Mieszanie gazów
Przemiany termodynamiczne powietrza wilgotnego, entalpia powietrza wilgotnego, mieszanie strumieni p
Karta pom Pomiar predkosci dzwieku w powietrzu jako funkcji temp
Podstawowe charakterystyki temperatury powietrza, Księgozbiór, Studia, Mechanika Płynów i Dynamika G
Oczyszczanie Gazow Odlotowych, Ochrona Środowiska studia, 4 rok (2009-2010), Semestr VII (Rok 4), Oc
WENTYL, Powietrze atmosferyczne jest roztworem różnych gazów chemicznie obojętnych względem siebie,
Porosty jako uniwersalne wskazniki stanu powietrza2
Adsorpcyjne oczyszczanie gazów z zanieczyszczeń związkami organicznymi, ochrona środowiska, ochrona
Folie jako opóźniacze pary wodnej i powietrza
Demontaż montaż Mikrosilniki rozdziału i mieszania Czujnik jakości powietrza w kabinie
Fitoremediacja rośliny jako narzędzia w oczyszczeniu powietrza w terenach zurbanizowanych (2)
więcej podobnych podstron