Podstawowe procesy oczyszczania gazów z
zanieczysz. gazowych
-Procesy fizyczne:
- absorpcja
- adsorpcja
- kondensacja
Procesy chemiczne:
- procesy spalania: -- bezpośredniego
-- termicznego
- utlenianie (spalanie) katalityczne
- redukcja katalityczna
- rozkład katalityczny

ABSORPCJA
Polega na pochłanianiu zanieczyszczeń gazowych
przez ciecz (absorbent); fizyczne rozpuszczenie
lub w połączeniu z reakcją chemiczną.
Absorbenty
: woda, roztwory soli, kwasów, zasad o
właściwościach utleniających lub redukujących.
Proces absorpcji w roztworach jest połączony
zwykle z reakcją chemiczną.
Zasadnicze etapy absorpcji
:
- dyfuzyjne przenoszenie cząsteczek gazu do
powierzchni cieczy
- rozpuszczenie w warstwie granicznej na
powierzchni cieczy
- przenoszenie składnika zaabsorbowanego w
głąb cieczy.
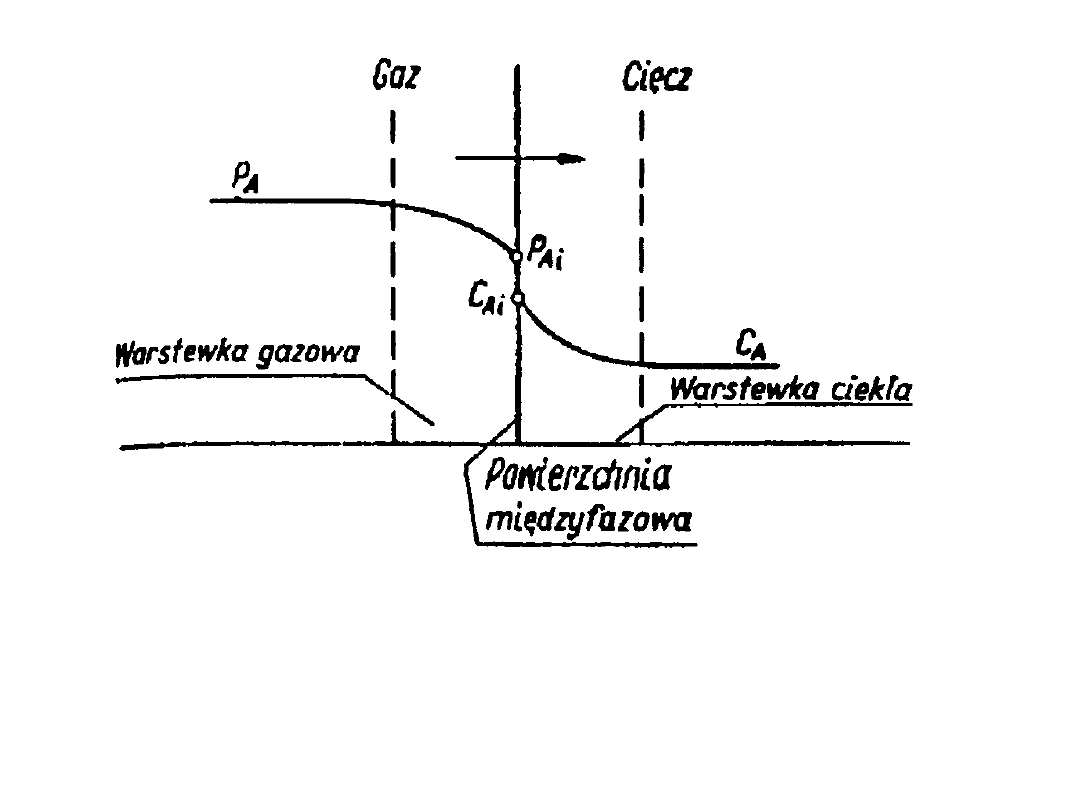
Profil stężenia podczas przenikania masy
(absorpcji)
P
A
- stężenie składnika A w gazie, C
A
- stężenie
składnika A w cieczy

Absorpcja stosowana jest, gdy
- stężenie zanieczyszczenia wynosi kilka
%;
- w przypadku gazów rozcieńczonych, gdy
są łatwo rozpuszczalne w absorbencie.
W procesie absorpcji dąży się do uzyskania
stanu równowagi gaz-ciecz.
Absorpcję prowadzi się w skruberach zw.
absorberami jedno- lub wielostopniowymi.
Absorpcja może być też prowadzona w
układach trójfazowych: gaz - ciało stałe -
ciecz.
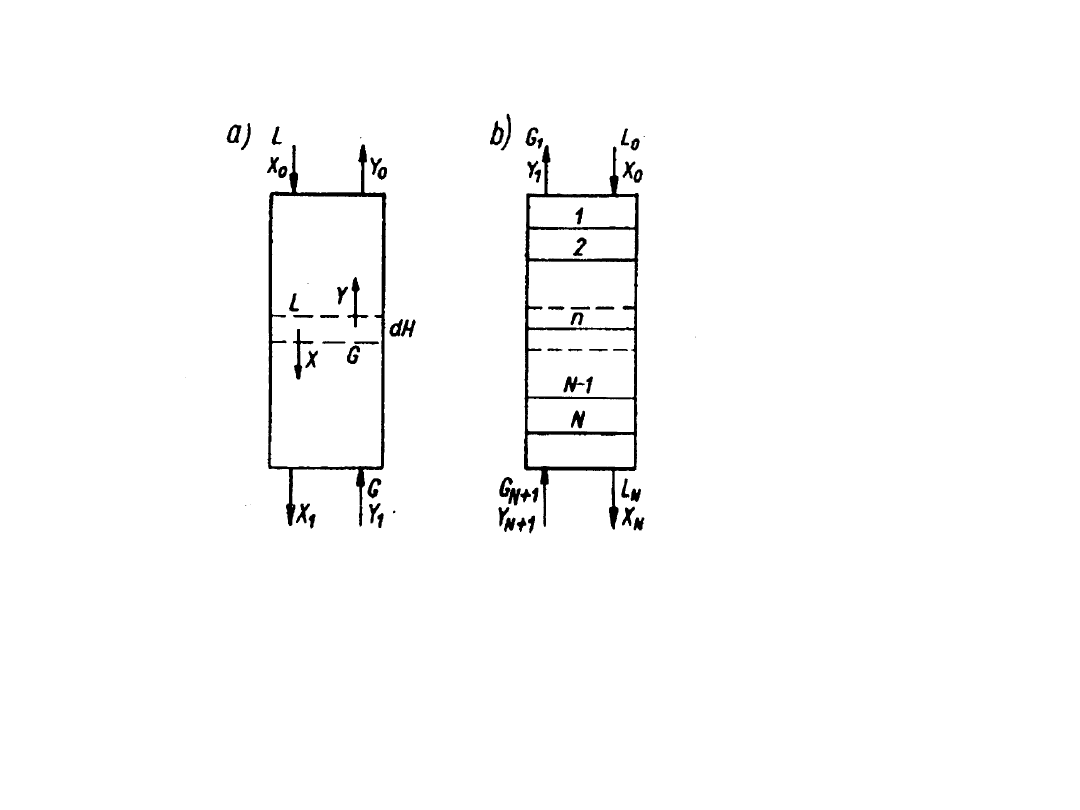
Proces absorpcji ciągły: a) jednostopniowy, b)
wielostopniowy

Wymagania d/ absorpcji
:
- mały wydatek energii
- długi czas kontaktu gazu i cieczy
- duża burzliwość przepływu
- duża powierzchnia kontaktu faz
- duża szybkość odnawiania powierzchni
kontaktu.

Projektowanie cyklu absorpcyjnego
1 – dobór rozpuszczalnika (absorbentu)
2 – określenie danych równowagi
3 – określenie parametrów przebiegu procesu
(bilans materiałowy i energetyczny)
4 – wybór konstrukcji skrubera (materiał
konstrukcyjny dobiera się zależnie od rodzaju
zaniecz., stosowanej cieczy, temperatury,
powstających produktów oczyszczania
5 – określenie wymiarów kolumny
6 – dobór elementów wyposażenia wnętrza i
urz. pomocniczych, np. dysze zraszające,
rurociągi.

ADSORPCJA
Polega na wydzieleniu i zatrzymaniu
składników płynu na powierzchni zewnętrznej
i wewnętrznej (w porach)
ciała stałego
–
adsorbentu (sorbentu).
Zatrzymanie cząsteczek na powierzcni
zachodzi w wyniku działania sił fiz. i chem.
bliskiego zasięgu.
Proces adsorpcji jest egzotermiczny.
Proces odwrotny (desorpcja
) wymaga
doprowadzenia ciepła.
Adsorpcji sprzyja:
- duża powierzchnia adsorbentu
- niska temperatura.

Etapy procesu adsorpcyjnego oczyszczania
gazu:
1 – przeniesienie dyfuzyjne składnika gazowego
do pow. zewn. adsorbentu
2 – dyfuzja w porach do powierzchni
wewnętrznej
3 – adsorpcja do powierzchni wewnętrznej
4 – regeneracja adsorbentu (desorpcja) – gdy
zaadsorbowana masa substancji zbliżona jest
do równowagowej.

Rodzaje stosowanych adsorbentów
1 –
węgiel aktywny
(porowate cząstki o
gęstości pozornej 0,6 g/cm
3
i d
śr
ok. 250 μm;
przy sferycznych cząstach, powierzchnia
właściwa: 1000-1300 m
2
/g)
Efektywny sorbent cząsteczek organicznych z
gazów wilgotnych.
2 –
tlenki metali
(półmetali):
a) adsorbenty krzemowe
: sylikażel
(SiO
2
*nH
2
O) (do adsorpcji pary wodnej)

b) sita molekularne
(zeolity) (gr. zeo –
gotować, lithos –
kamień) – krystaliczne
uwodnione glinokrzemiany, które
zawierają w
swojej strukturze słabo związane cząsteczki
wody. Porowata konstrukcja zeolitów – wymiary
kanalików: 0,3-4 nm
Zastosowanie: - usuwanie NH
3
i pary wodnej z
gazów
obojętnych przy
średnicy porów 0,003 μm
- usuwanie CO
2
, SO
2
, H
2
S, C
2
H
2
przy
średnicy porów 0,004 μm
c) tlenek glinu
3 – sorbenty impregnowane
: reagentem
chemicznym, katalizatorem (zw. Cr, Mo, W), np.
impregnowanie węgla aktywnego:
Węgiel aktywny impregnowany:
KI KOH K
2
CO
3
KMnO
4
H
2
SO
4
S sole
Usuwanie:
Br
H
2
S
+
+
+
+
Kwaśne
gazy
+
+
Amoniak
+
Hg
+
+
+
Olefiny
+

SPALANIE
– w przypadku małych stężeń
zanieczyszczeń (< 0,3 % obj.) w gazie i gdy
odzysk ich jest ekonomicznie nieuzasadniony
a ich toksyczność jest duża;
np. węglowodory, H
2
S, CO, pary
rozpuszczalników, organiczne aerozolowe
cząstki stałe.
KONDENSACJA
– odpowiednia do usuwania
węglowodorów i ich pochodnych o wysokich
temp. wrzenia i odpowiednio dużym stężeniu
(usuwanie: pary rozpuszczalników, np.
styrenu).
Kondensacja jest związana z przenikaniem
ciepła od oczyszczanego gazu do czynnika
chłodzącego:
efekt – obniżenie temp. gazu a następnie
kondensacja odpowiednich jego składników.
Czynniki chłodzące: woda, strumień
powietrza
.
KONDENSACJA
– technika separacji, w której
najbardziej lotny składnik mieszaniny gazowej
jest wydzielany na skutek zwiększenia prężności
i przejścia do stanu nasycenia oraz zmiany stanu
fazowego na ciekły (skroplenie).
Urządzenia:
kondensatory
- przeponowe
- bezprzeponowe (skrubery
natryskowe, półkowe).

Sposoby ograniczenia E
SO2
1.Odsiarczanie węgla przed
skierowaniem go do spalania (tzw.
metody pierwotne)
2.Odsiarczanie w procesie spalania (tzw.
metody bezpośrednie, inaczej „u
źródła”)
3.Odsiarczanie gazów opuszczających
miejsce powstawania (tzw. metody
wtórne).
Ad. 1
Metody fizyczne – flotacja, separacja
magnetyczna.
Metody chemiczne i biologiczne (droższe
lecz b. skuteczne).

Ad. 2
- Wprowadzenie do strefy spalania kamienia
wapiennego (CaCO
3
) lub dolomitu
(CaCO
3
*MgCO
3
)
Temp. reakcji 800-1200
0
C
CaCO
3
→ CaO + CO
2
+ 178 kJ/mol
CaO + SO
2
→ CaSO
3
CaO + SO
2
+ ½ O
2
→ CaSO
4
– 500 kJ/mol
Sposób mało skuteczny: η = 20 – 40 %
- Iniekcja drobno zmielonego sorbentu do
strefy ponad warstwę paliwa w paleniskach
rusztowych lub ponad palnik w palnikach
olejowych;
η = 40 – 60 % przy Ca/S ≥ 2/1

- Spalanie węgla z dodatkiem kamienia
wapiennego (dolomitu) w złożu
fluidalnym.
Niska t = 850-950
0
C korzystna dla
wiązania siarki przez cząstki sorbentu.
η = 60 – 80 % przy Ca/S = 2/1 i
odpowiednio wysokim złożu.
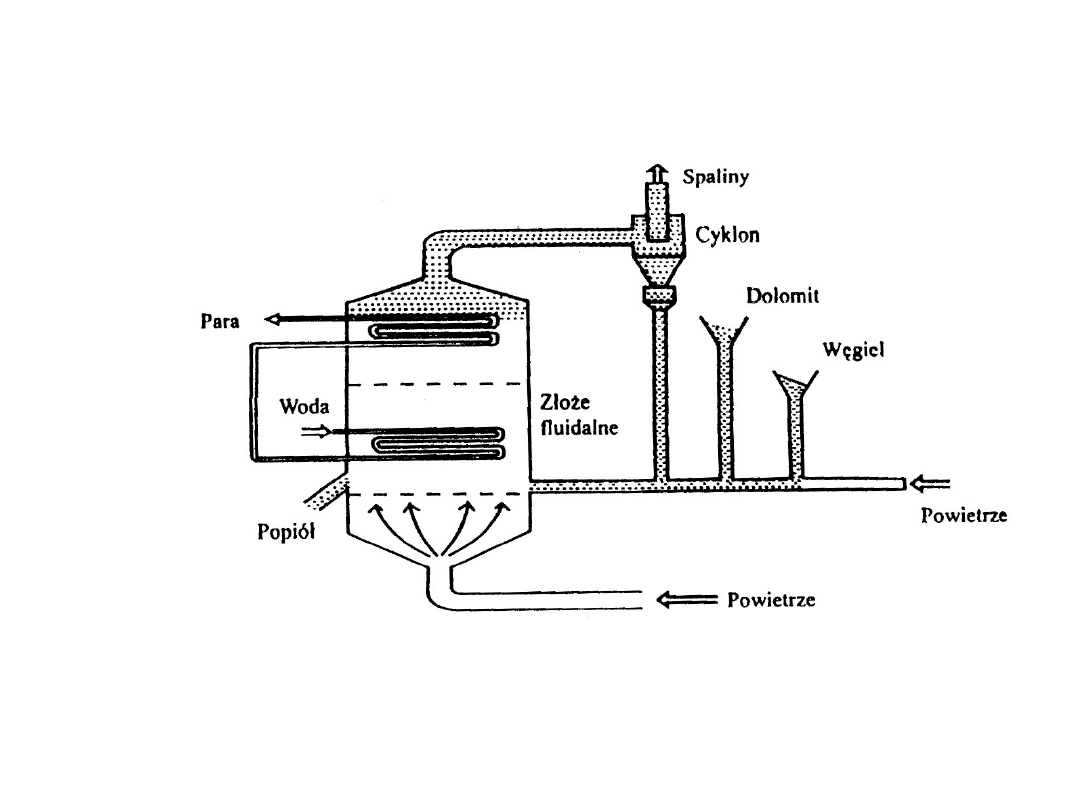
Schemat kotła fluidalnego z
atmosferycznym złożem
stacjonarnym

Ad. 3
Odsiarczanie gazów przemysłowych (odlotowych)
-
mokre i suche
(to rozróżnienie może odnosić
się do stanu produktu końcowego, bądź też
stosowania lub nie cieczy, roztworu)
-
regeneracyjne
(metody te związane są z
odzyskiem siarki w postaci produktów
handlowych; SO
2
reaguje chemicznie z
absorbentem, który jest następnie regenerowany
i zawracany do procesu absorpcji)
-
nie regeneracyjne
(polegają na wytwarzaniu
odpadów siarkowych; preferowane, bo produkty
handlowe siarki są słabo zbywalne).

Metody mokre
– na absorpcji SO
2
w zawiesinach wodnych lub
roztworach związków nieorganicznych,
np. alkalicznych:
CaO
CaCO
3
Ca(OH)
2
K
2
CO
3
Na
2
CO
3
MgO
Na
2
SO
3
NH
3

Mokra metoda wapienna
Czynnikiem wiążącym SO
2
jest CaCO
3
, CaO, Ca(OH)
2
.
Produkt końcowy reakcji: gips.
Ca(OH)
2
+SO
2
+ H
2
O = CaSO
3
+ 2 H
2
O
Ca(OH)
2
+SO
2
+ H
2
O + ½ O
2
= CaSO
4
• 2 H
2
O
CaCO
3
+ 2 H
2
O + SO
2
+ ½ O
2
= CaSO
4
• 2 H
2
O + CO
2
Zalety:
wysoka efektywność odsiarczania: η > 80 %
dodatkowe odpylanie spalin
prosty układ konstrukcyjny i niskie koszty.
Wady:
konieczność podgrzewania oczyszczonych spalin przed ↑ do atm.
potrzeba zagospodarowania lub składowania produktów
końcowych
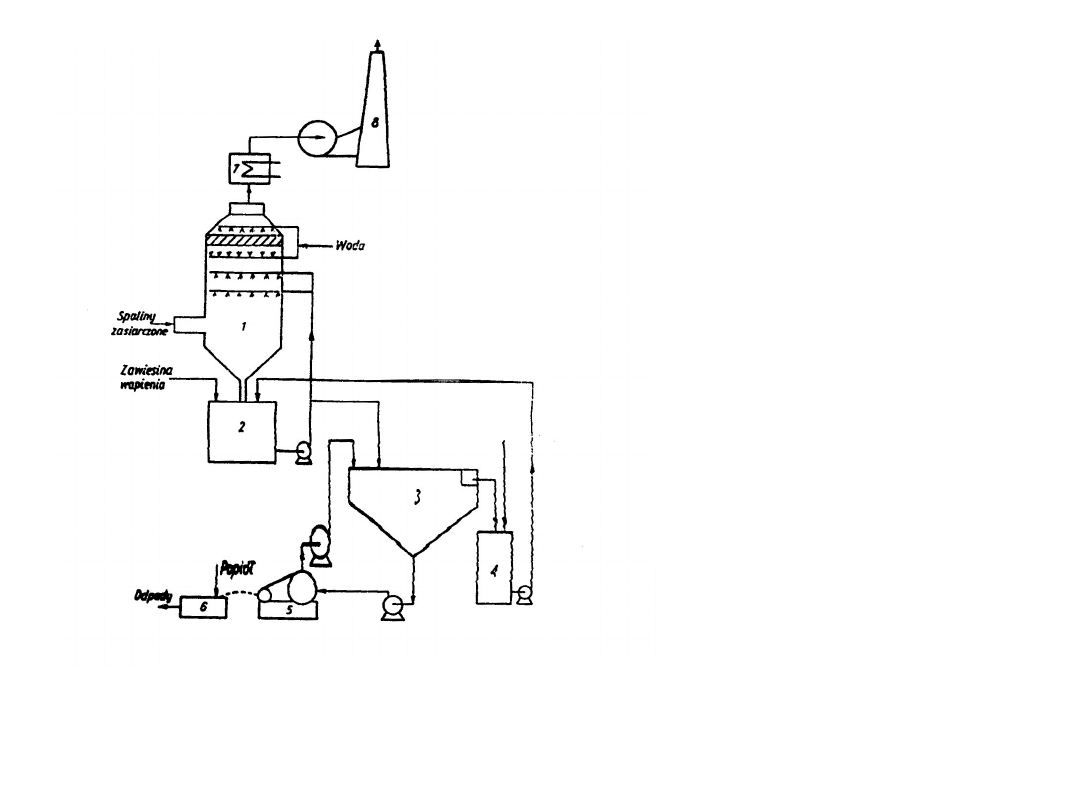
Schemat instalacji odsiarczania gazów
metodą wapienną
Absorber wieżowy: d
= 17 m, H = 38 m, m
= 320 t.
Zużycie k_wapiennego
przy 1,5 % S w węglu:
9,2 t/h,
Przy η = 90%
powstaje
16 t gipsu/h.

Metody suche
oparte są na:
- adsorpcji na sorbentach stałych (tlenkach
metali lub węglu aktywnym)
- absorpcji z reakcją chemiczną i jednoczesnym
suszeniem produktów odsiarczania
1) Adsorpcja SO
2
na tlenkach metali połączona
jest z reakcją chemiczną
tlenki Mn, Fe, Cu, Co, Zn; dobrym sorbentem
jest MnO
x
i CuO osadzone na nośniku glinowym
CuO + ½ O
2
+ SO
2
= CuSO
4
Regeneracja (ok. 680K) adsorbentu w celu
odzyskania Cu i SO
2
za pomocą H
2
, CO, lekkich
C
x
H
y
, np.:
CuSO
4
+ 2H
2
= Cu + SO
2
+ 2 H
2
O

2) Sposoby realizacji metod suchych:
iniekcja sorbentu SO
2
do strumienia gazu
Sorbenty:
sodowe, np. NaHCO
3
, Na
2
CO
3
; droższe,
skuteczniejsze –
metoda efektywna w t = 130
– 180
0
C, η = 70 – 80 % przy Na/S = 2/1, czas
kontaktu: 1,75 s
2NaHCO
3
+ SO
2
= Na
2
SO
3
+ H
2
O + 2 CO
2
Na
2
CO
3
+ SO
2
= Na
2
SO
3
+ CO
2
wapniowe, np. CaO, Ca(OH)
2
; niska sprawność
przy
dużym nadmiarze Ca
na sucho w reaktorach ze stałą lub ruchomą (w
tym fluidalną) warstwą dużych ziaren sorbentu.
Sorbent może mieć postać granul
impregnowanych tlenkami metali, np. CuO.
3) Inne metody suche odsiarczania gazów:
usuwanie SO
2
i NO
x
ze spalin metodą
radiacyjną
metoda FOOG
metoda Bergbau-Forschung
katalityczne utlenianie SO
2
Spalanie katalityczne gazów – spalanie
bezdymne (dopalanie),
w obecności katalizatora.
Katalizator inicjuje reakcję spalania w niskich
t = ok. 320
0
C.
Budowa katalizatora:
nośnik
Warstwa przejściowa
Właściwa substancja
katalityczna:
- metale szlachetne: Pt, Pd,
Rh, Ru
- tlenki metali
przejściowych: V
2
O
5
, TiO
2
,
MoO
3
, CuO, Cr
2
O
3
- tlenki metali alkalicznych:
Na, K, Li i ziem
alkalicznych: Ca, Sr, Ba

Nośniki: - w postaci bloków monolitycznych
ceramicznych lub
metalicznych
- w postaci ziaren, siatek, tabletek.
do nośnika dodaje się: aktywatorów, np.
•
wolfram (W) , który rozszerza zakres temp.
efektywnego działania katalizatora,
•
Na
2
O, K
2
O, które przyspieszają utlenianie
SO
2
w t > 400
0
C.
Katalizatory: w postaci półek (półkowe)
w postaci bloków (blokowe), np. w
kształcie
sześcianu z kanałami
ustawionymi ║do
kierunku
przepływu spalin. Bloki zestawia się
w
moduły, które umieszcza się na półce.

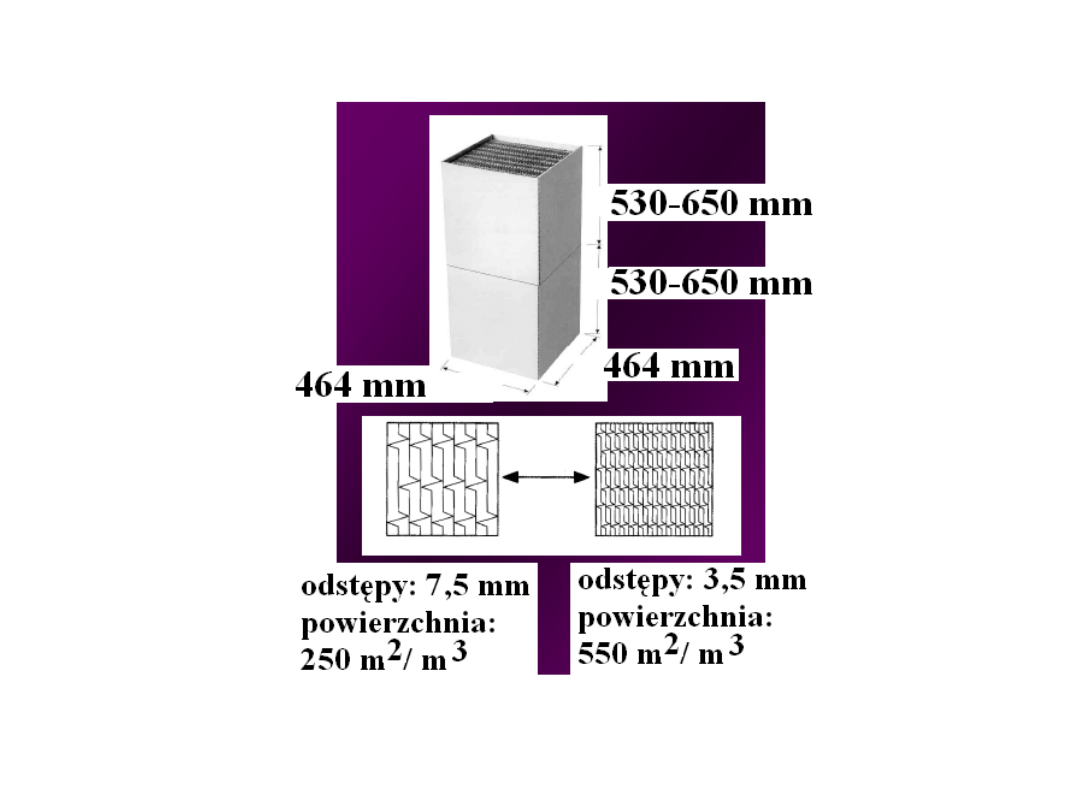

Do odsiarczania spalin stosowany jest
katalizator wanadowy
złożony z:
- nośnika monolitycznego SiO
2
(z
aktywatorami: Na
2
O, K
2
O i in.)
- właściwego kontaktu V
2
O
5
DESOX
SO
2
+ ½ O
2
= SO
3
SO
3
+ H
2
O = H
2
SO
4
Powstały SO
3
absorbuje się w 20 % H
2
SO
4
.
Produkt procesu: 76 % H
2
SO
4
, który można
skierować do koncentracji lub użyć do
produkcji gipsu.

Zalety:
wysoki stopień konwersji SO
2
; η ok.. 90 %
brak odpadów.
Wady:
konieczność prowadzenia reakcji w
podwyższonych temp. ok. 420
0
C
wysoki koszt katalizatora (11000-32000 $/t)
wymóg wstępnego odpylenia gazów
wysoki koszt inwestycyjny.
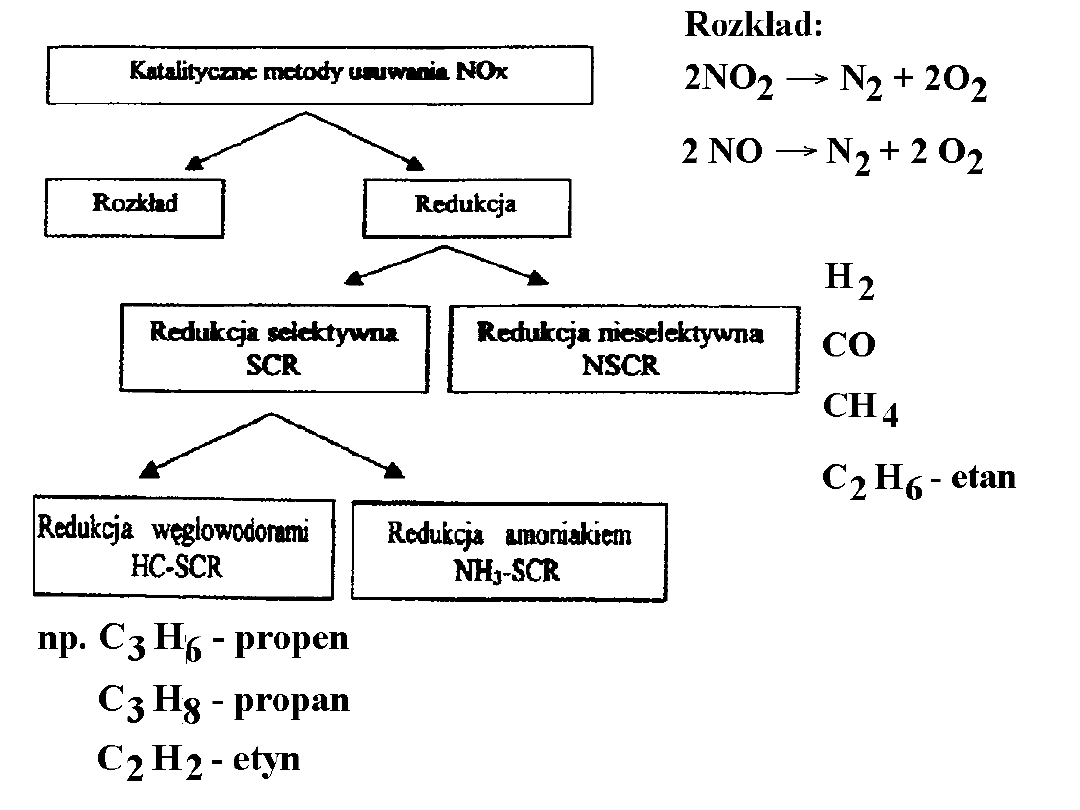

DENOX
2 NO + 4 NH
3
+ 2 O
2
= 3 N
2
+ 6 H
2
O
4 NO + 4 NH
3
+ O
2
= 4 N
2
+
6 H
2
O
NO + 2 NH
3
+ NO
2
= 2 N
2
+
3 H
2
O
Inne reakcje
redukcji
CO + NO = ½ N
2
+
CO
2
H
2
+ NO = ½ N
2
+
H
2
O
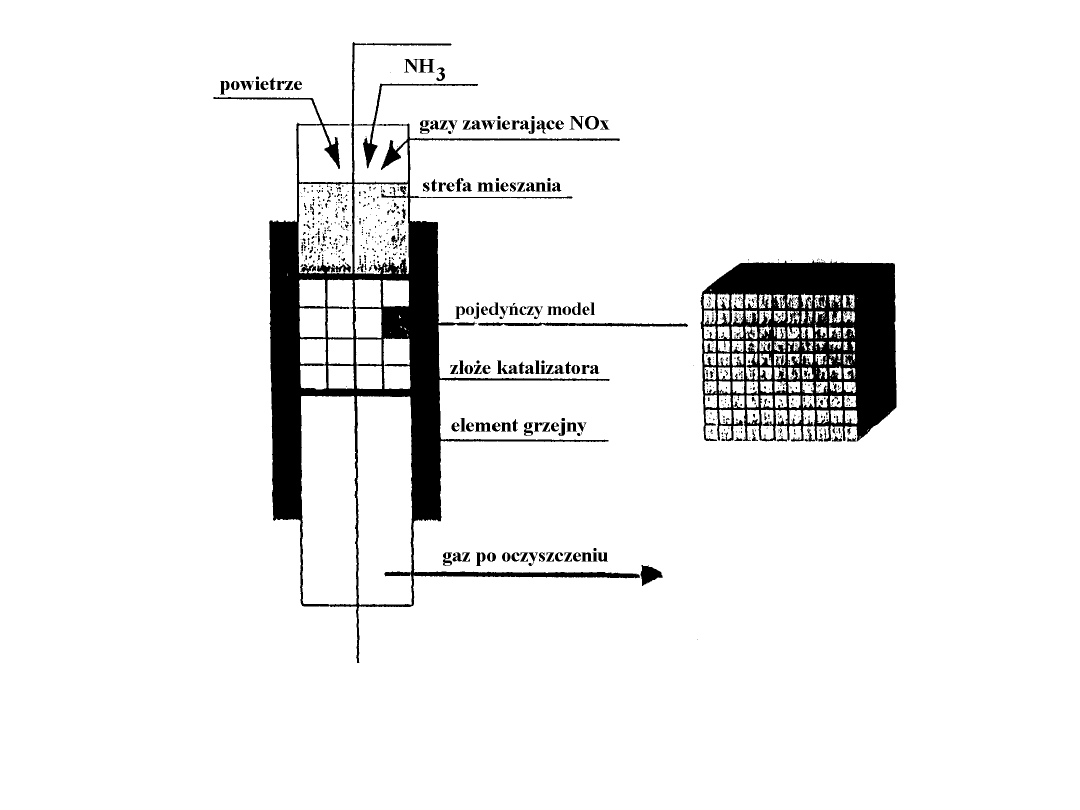
Schemat reaktora do selektywnej redukcji
katalitycznej NO
x
amoniakiem
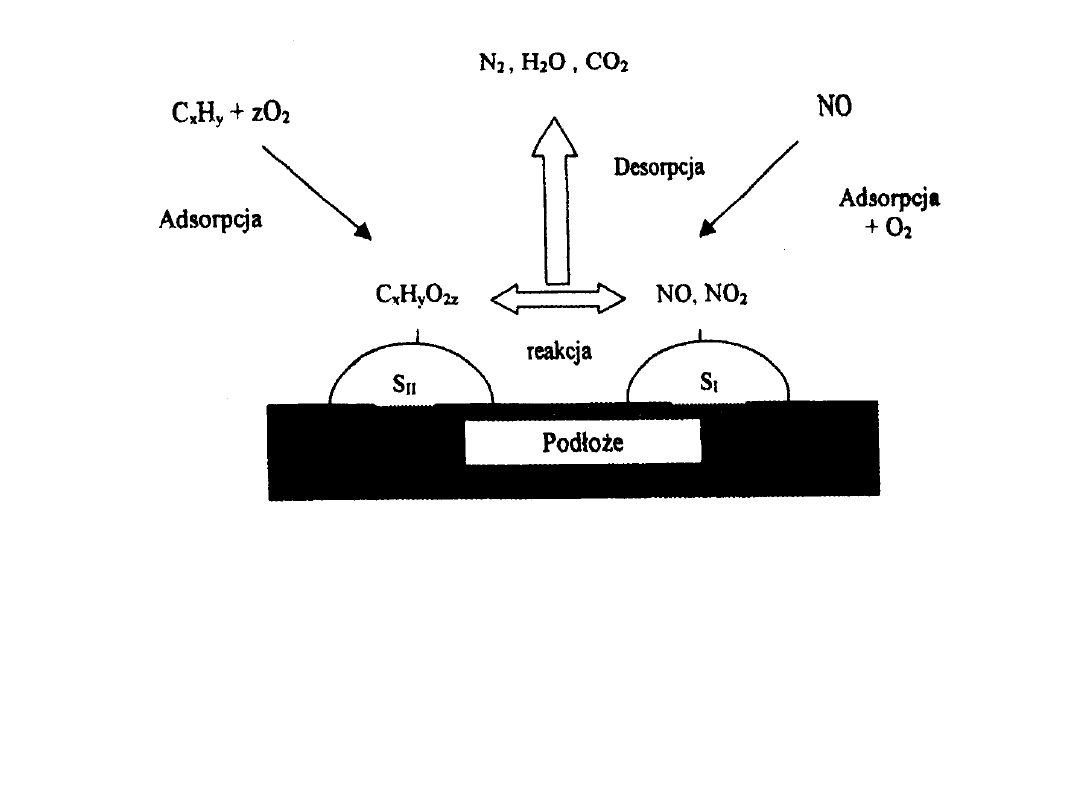
Graficzne przedstawienie mechanizmu
reakcji redukcji NO za pomocą
węglowodorów
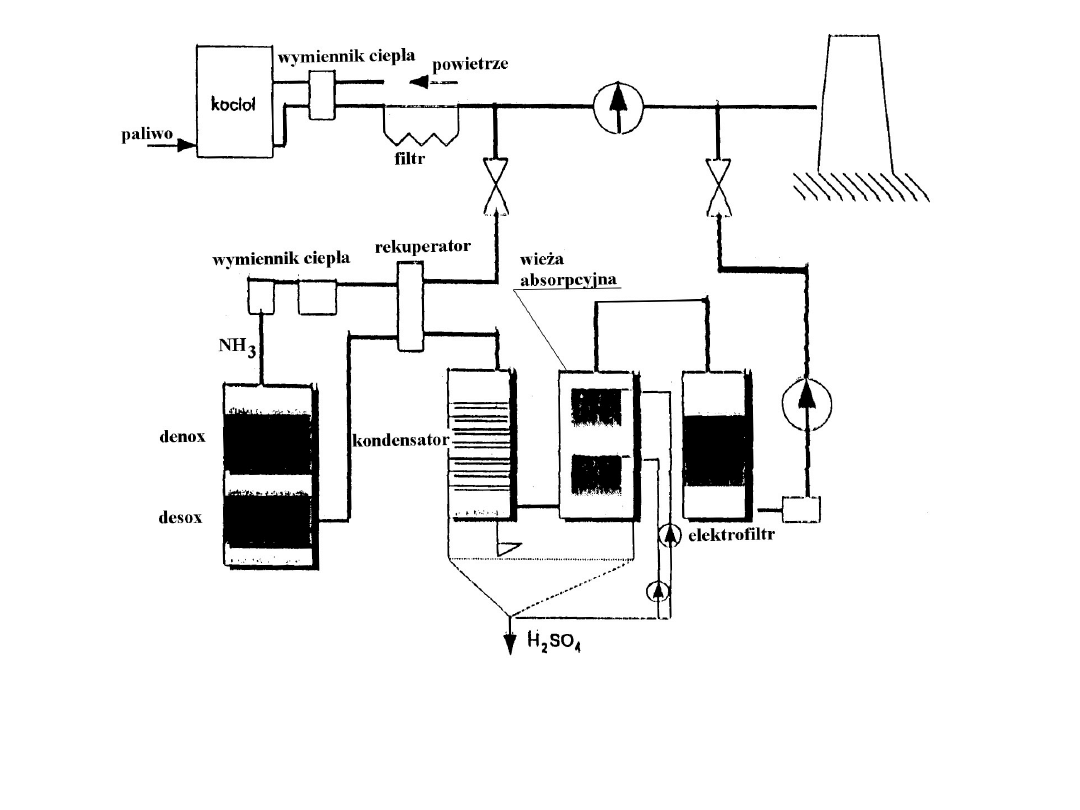
Schemat instalacji denosox
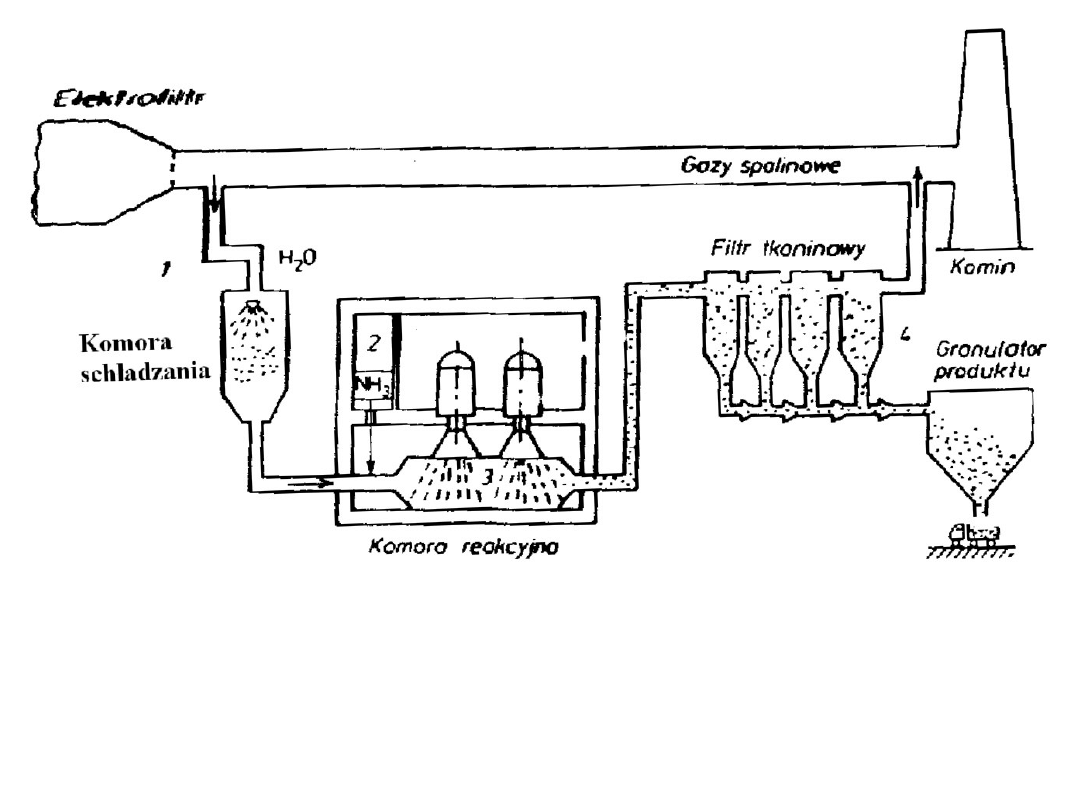
Schemat pilotowej instalacji odsiarczania
spalin metodą radiacyjną w elektrowni
Kawęczyn;
1 – kondycjonowanie spalin, 2 – układ
dozowania amoniaku, 3 –reaktor, 4 – filtracja i
odbiór produktu
Istota oczyszczania spalin z SO
2
i NO metodą
radiacyjną
utlenienie SO
2
i NO odpowiednio do SO
3
i NO
2
reakcja z para wodną i amoniakiem
produktów utlenienia – wytworzenie aerozolu
siarczanu i azotanu amonu:
(NH
4
)
2
SO
4
i NH
4
SO
3
wydzielenie produktów reakcji w tradycyjnym
odpylaczu i zużycie ich jako nawóz.
W metodzie radiacyjnej
η do 95 % dla SO
2
i do 70 % dla NO.
W instalacjach mokrych η do 95 % (98 %) dla
SO
2
.
W instalacjach SCR do 70 % (80 %) dla NO
x
W instalacjach SNCR do 50 % dla NO
x
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
Wyszukiwarka
Podobne podstrony:
Oczyszczanie gazow odlotowych cz 1
Projekt 2 - Spis treści, Inżynieria Środowiska, Oczyszczanie Gazów
BIOLOGICZNE OCZYSZCZANIE GAZOW Nieznany (2)
Oczyszczanie gazów Antczak Ściąga nr 2, Studia, Ochrona środowiska
Oczyszczanie Gazow Odlotowych, Ochrona Środowiska studia, 4 rok (2009-2010), Semestr VII (Rok 4), Oc
Wyklady z oczyszczalni, Studia Inżynieria Środowiska, Oczyszczanie ścieków
Oczyszczanie gazów ściąga
Oczyszczanie gazow odlotowych cz[1] 1 2009
PYTANIA Z WYKŁADU OCZYSZCZANIE WODY
Adsorpcyjne oczyszczanie gazów z zanieczyszczeń związkami organicznymi, ochrona środowiska, ochrona
Projekt 2 - Adsorpcja, Inżynieria Środowiska, Oczyszczanie Gazów
Projekt 1 - Spis treści, Inżynieria Środowiska, Oczyszczanie Gazów
Tabela, Polibuda, OŚ, Semestr VI, Technologie Oczyszczania Gazów
Oczyszczanie gazów Antczak Ściąga nr 3, Studia, Ochrona środowiska
Technologie oczyszczania gazów projekt
Oczyszczanie Gazów Odlotowych z NOx za pomocą plzamy nietermicznej z reakcjami heterogenicznymi
Projekt 1 - Charakterystyka wentylatora, Inżynieria Środowiska, Oczyszczanie Gazów
więcej podobnych podstron