
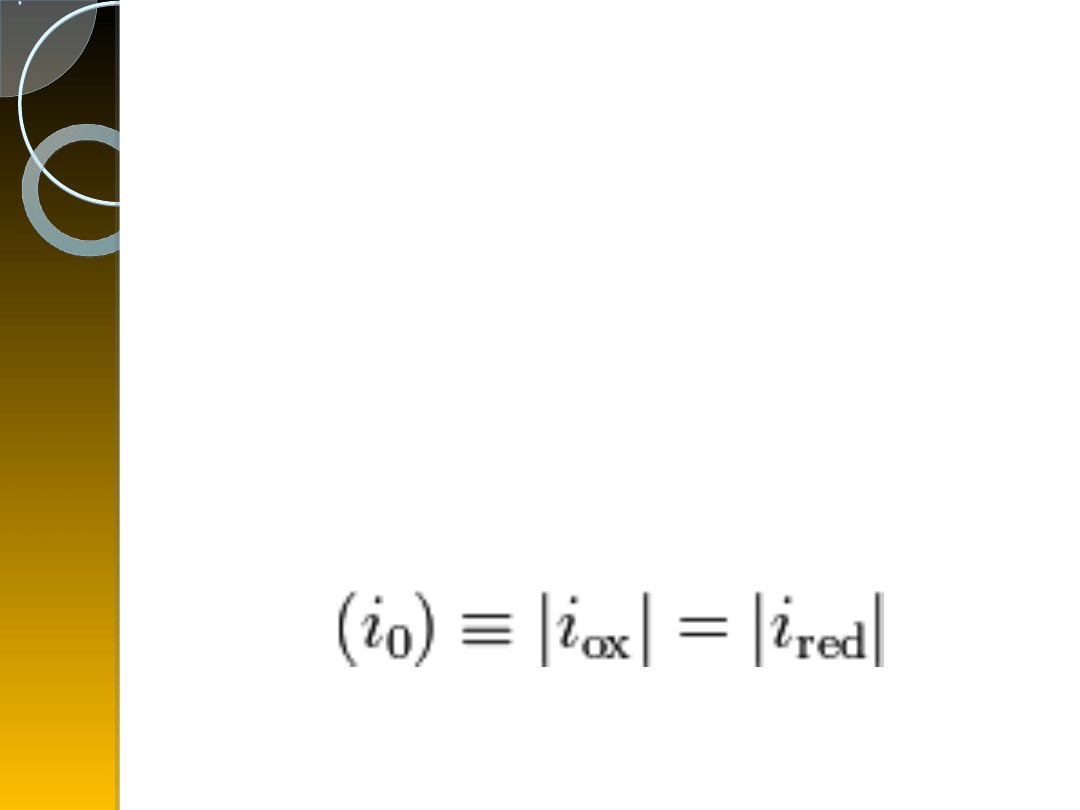
Zjawisko polaryzacji elektrod
Zjawisko polaryzacji elektrod
Polaryzacja elektrody - zjawisko
fizyczne związane ze zmianą
potencjału elektrody w stosunku do jej
potencjału równowagowego. Zmiana
ta wywołana jest przez przyłożenie
zewnętrznego źródła prądu.
Prąd wymiany:

Zjawisko polaryzacji
Zjawisko polaryzacji
elektrod
elektrod
Możliwe są dwa rodzaje polaryzacji
elektrody:
polaryzacja katodowa - gdy potencjał
elektrody spolaryzowanej jest mniejszy niż
jej potencjał równowagowy,
polaryzacja anodowa - gdy potencjał
elektrody spolaryzowanej jest większy niż jej
potencjał równowagowy,
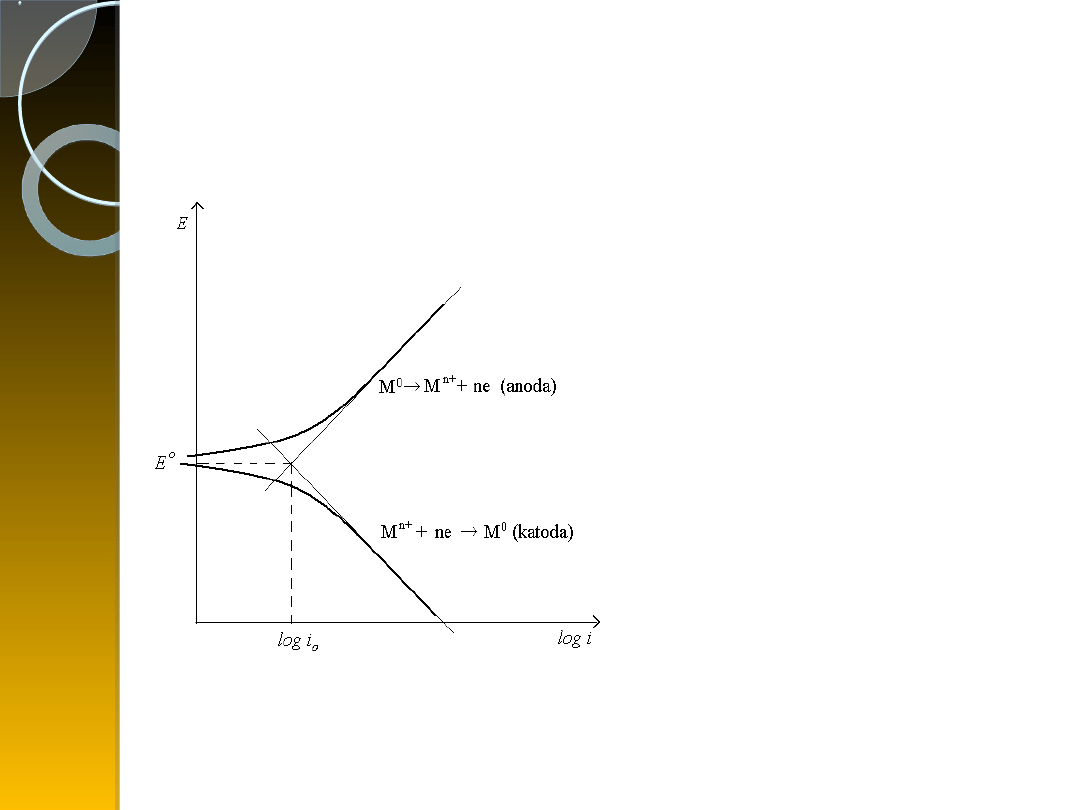
Krzywe polaryzacyjne elektrody I rodzaju w
Krzywe polaryzacyjne elektrody I rodzaju w
roztworze elektrolitu w stanie aktywnym
roztworze elektrolitu w stanie aktywnym
W
takim
układzie
zachodzą
następujące
procesy:
Proces anodowy:
przechodzenie metalu do
roztworu
M → M
n+
ne
Proces katodowy:
redukcja
jonów metalu i osadzanie
w postaci zredukowanej na
elektrodzie
M
n+
ne → M
lub katodowego
wydzielania wodoru po
redukcji jonu H
+
Wykres przedstawia krzywe polaryzacyjne
elektrody pierwszego rodzaju.

Zachodzące w układzie procesy można
również przedstawić w formie jednego
sumarycznego równania reakcji.
M
n+
ne ⇄ M
Odpowiadają im wartości prądów zgodne z
równaniami Tafela dla procesów:
anodowego:
a
= a b log i
a
katodowego:
k
= a b log i
c

Wyprowadzenie równania
Wyprowadzenie równania
Tafela
Tafela
Reakcja elektrodowa zwykle przebiega w potencjale
innym niż potencjał równowagowym. Charakteryzuje
ją wówczas wartość nadpotencjału reakcji:
Uwzględniając stężenia form Ox i Red wraz z
potencjałem E
0
odnosimy nadpotencjał do
potencjału równowagowego reakcji poprzez
gęstość prądu:
0
Re
0
0
ln
d
ox
c
c
zF
RT
E
E
ox
red
c
RT
E
E
zF
c
RT
E
E
zF
zFk
j
)
(
exp
(
)
1
(
exp
0
0
0

Podstawowe równanie kinetyki
elektrodowej, zwane równaniem
Volmera- Butlera opisane jest
zależnością :
zF
RT
zF
RT
j
j
exp
)
1
(
exp
0
gdzie z kolei
:
d
Ox
c
c
zFk
j
Re
1
0
0
a)
Jeśli nadpotencjał ma niewielką wartość w stosunku
do RT/zF to równanie przyjmuje postać :
RT
zF
j
j
o
Wartość prądu wymiany jest miarą odchylenia
potencjału elektrody od wartości równowagowej
podczas przepływu prądu z zewnętrznego źródła.
Im powolniejsza jest reakcja przejścia, tym większe
jest to odchylenie.
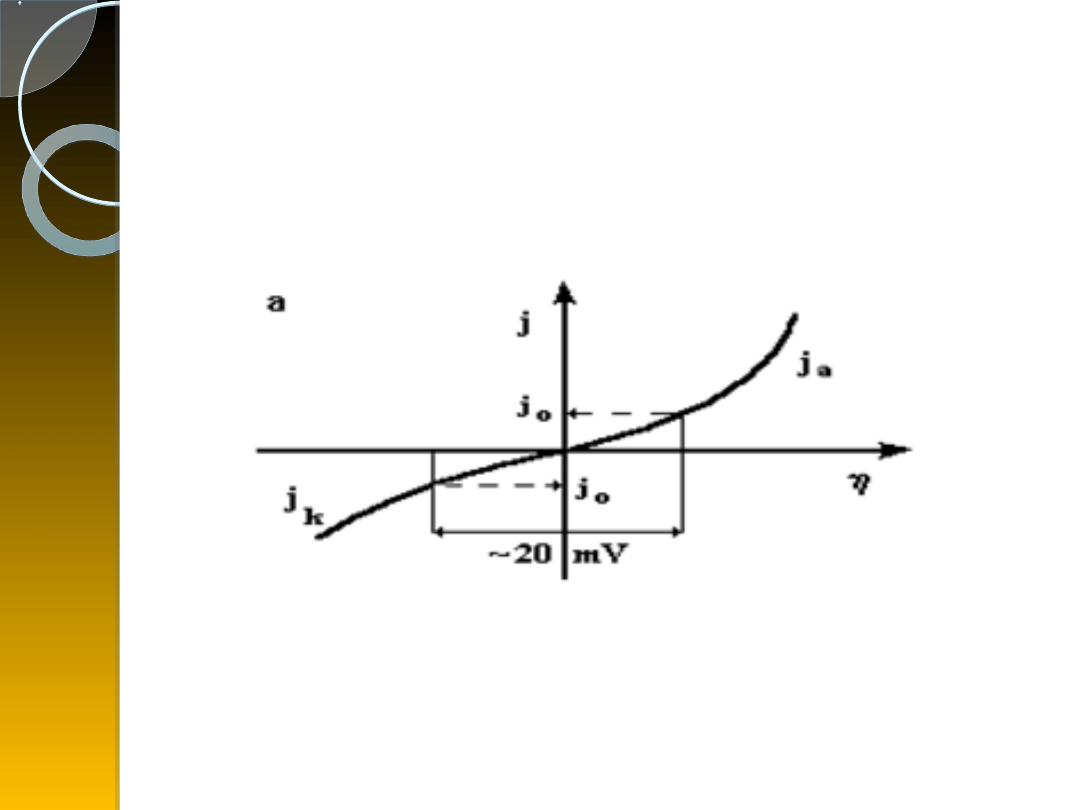
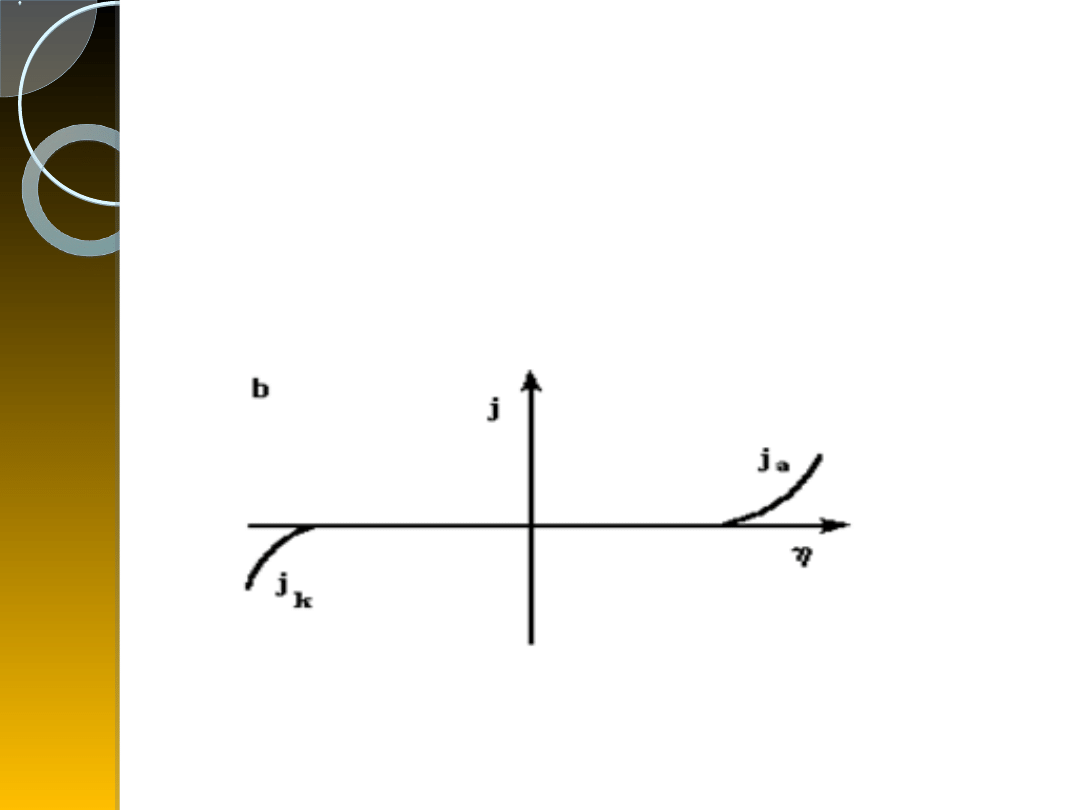
a) krzywa polaryzacji elektrody
dla <<(RT/zF)
b) Jeśli potencjał katodowy lub anodowy ma
dużą wartość w porównaniu z RT/αzF,
wówczas jeden z członów równania:
zF
RT
zF
RT
j
j
exp
)
1
(
exp
0
Jest na tyle mały, że można go pominąć i
otrzymujemy:
RT
zF
j
j
k
exp
0
RT
zF
j
j
a
)
1
(
exp
0
b) krzywa polaryzacji elektrody
dla
(RT/zF)

Po zlogarytmowaniu i przekształceniu otrzymujemy
równanie Tafela dla procesów katodowych i
anodowych:
j
zF
RT
j
zF
RT
lg
303
,
2
lg
303
,
2
0
j
zF
RT
j
zF
RT
lg
)
1
(
303
,
2
lg
)
1
(
303
,
2
0
Lub prościej je zapisując :
j
b
a
lg
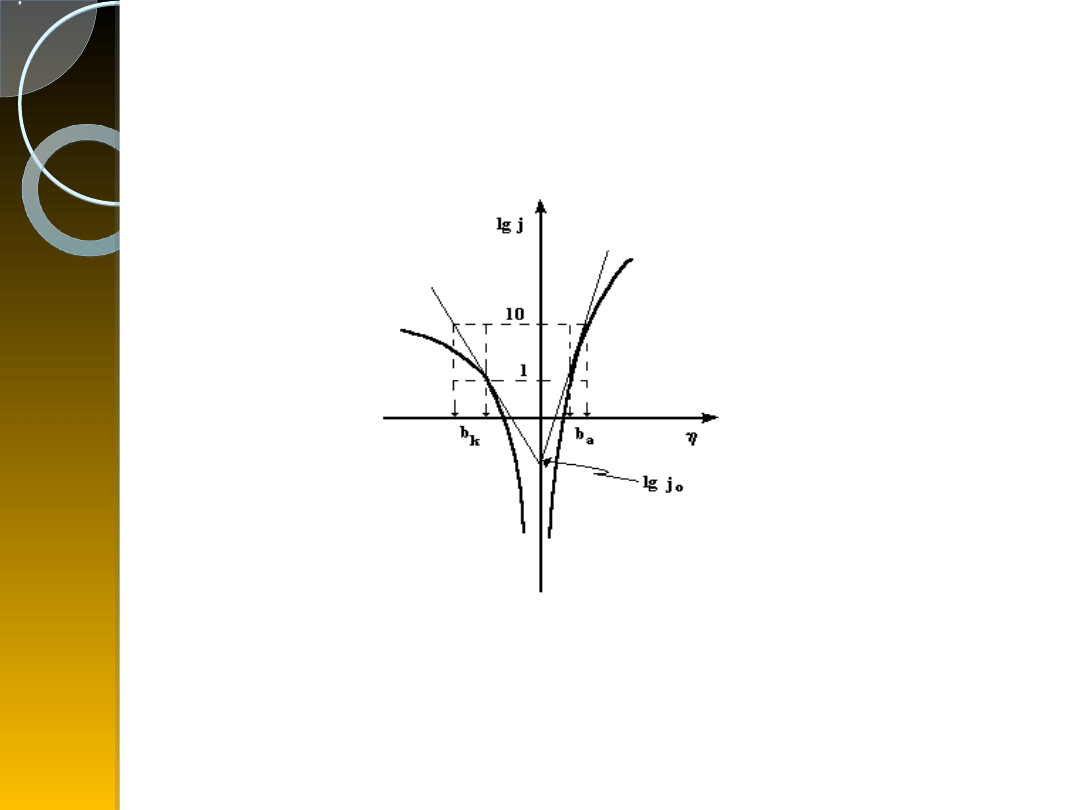
Zależności Tafela ilustruje wykres
półlogarytmiczny, w którym albo znajdujemy
odcinki prostoliniowe, albo prowadzimy styczne
( jest to mniej dokładne):
Z którego wyznacza się wartość prądu
wymiany j
0
oraz współczynniki Tafela b
a
i b
k
charakteryzujące odwracalność reakcji i
liczby elektronów przenoszonych w
procesach anodowych i katodowych

Równanie Tafela ponadto opisuje w swoisty
sposób istnienie bariery potencjału
wynikającej z teorii absolutnej szybkości
reakcji chemicznych. Pokazuje wyraźnie, że
na kinetykę procesów elektrodowych obok
parametrów reakcji chemicznych
( temperatura, ciśnienie) wpływa również
potencjał elektrody.
Procesy elektrodowe nieodwracalne,
Procesy elektrodowe nieodwracalne,
odwracalne i
odwracalne i
quasi-odwracalne
quasi-odwracalne
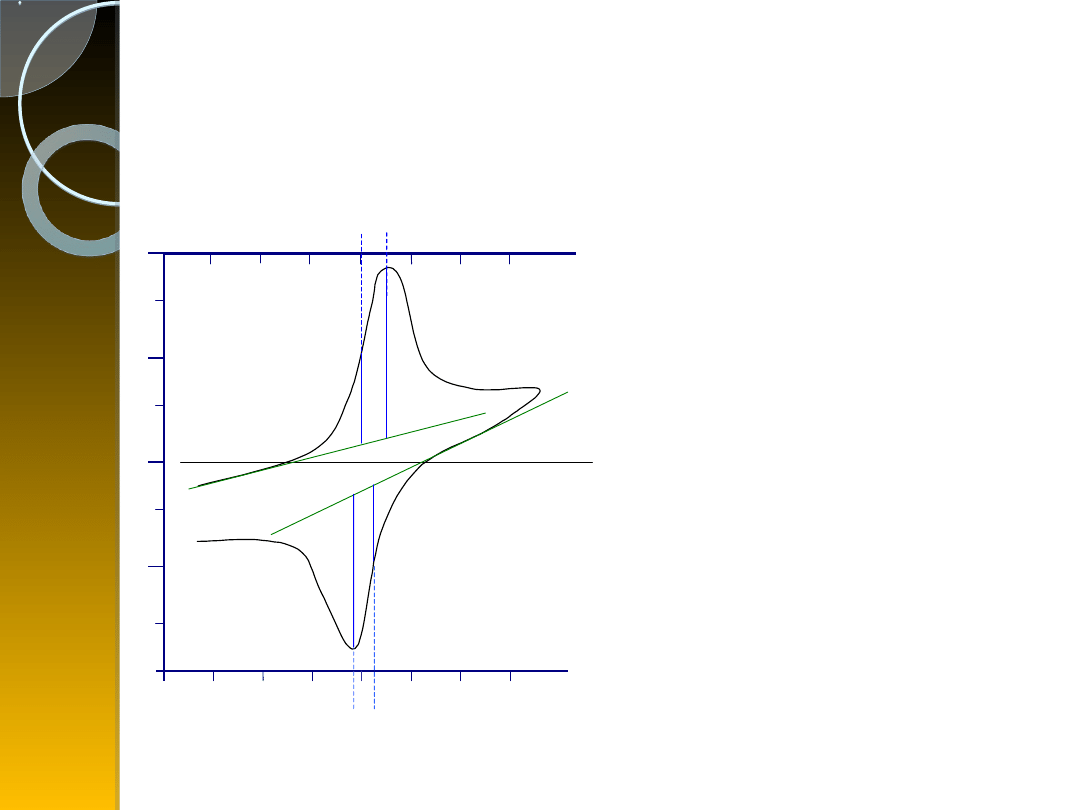
Cykliczna krzywa
chronowoltamperometrycza
procesu utlenienia i
redukcji z zaznaczonym
sposobem odczytywania
parametrów.
Epa, Epc – anodowy i
katodowy potencjał piku,
Epa/2, Epc/2 – anodowy i
katodowy potencjał połowy
piku,
Ia, Ic – anodowy i katodowy
prąd piku,
Ia/2, Ic/2 – anodowy i
katodowy prąd połowy piku.
Epa
Ia
Epa/2
Ic
Epc
Epc/2
Ic/2
Ia/2
I
E

Różnica potencjałów pików określa czy proces
jest odwracalny, nieodwracalny czy quasi‑
odwracalny.
Dla reakcji jednoelektronowej (n=1) różnica
powinna wynosić 0.058V dla procesu
odwracalnego,
od 0.060V do 0.1V dla procesu quasi-
odwracalnego
powyżej 0.1V dla procesu nieodwracalnego.
E
E
n
p a
p c
,
,
,
0 058

Elektroda idealnie polaryzowalna
Elektroda idealnie polaryzowalna
Elektrody, które przyjmują potencjał
przyłożony z zewnątrz, nie wykazując
przy tym przepływu prądu stałego,
wskazującego na zachodzenie procesu
elektrochemicznego.
Przykładem tej elektrody jest KER
( kapiąca elektroda rtęciowa)

Elektroda doskonale
Elektroda doskonale
odwracalna
odwracalna
Elektrody takie nieznacznie zmieniają
swój potencjał pod wpływem
zewnętrznego napięcia. Dołączenie do
zewnętrznego źródła napięcia
powoduje przepływ prądu, który
przeciwdziała gromadzeniu się
ładunku na powierzchni elektrody.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
Wyszukiwarka
Podobne podstrony:
polaryzacja elektrod nieorganiczna2 (1)
polaryzacja elektrod nieorganiczna2 (1)
POLARYMETR, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, 10 Badanie zj
lisowski,dielektryki i magnetyki,polaryzowalność elektronowa
35 Fale elektromagnetyczne i ich polaryzacja
Kolokwium I nieorganiczna- elektrochemia, Studia - Chemia kosmetyczna UŁ, II rok, III semestr, CHEMI
Kompleksy i elektrochemia notatka, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Chemia końcowy z
Badanie zjawiska dyfrakcji i polaryzacji światła, Elektrotechnika AGH, Semestr II letni 2012-2013, F
Elektronika- Układy polaryzacji i stabilizacji punktu pracy tranzystorów1.DOC, LABORATORIUM Z ELEKTR
,podstawy chemii nieorganicznej L,Równowagi w roztworach elektrolitów
,podstawy chemii nieorganicznej L,stała dysocjacji słabego elektrolitu
Elektroliza(1), Chemia, Chemia nieorganiczna
Nr ćwiczenia, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, 10 Badanie
Analiza stanu polaryzacji światła, FIZ 82, ˙wiat˙o jest poprzeczn˙ fal˙ elektromagnetyczn˙. Oko ludz
,podstawy chemii nieorganicznej L,Równowagi w roztworach elektrolitów
Potencjały równowagowe elektrod - siła elektromotoryczna ogniw. polaryzacja, Chemia fizyczna AGH la
elektrochemia, Studia - Chemia kosmetyczna UŁ, II rok, III semestr, CHEMIA NIEORGANICZNA laboratoriu
10. Dyfrakcja i Polaryzacja - Teoria, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - L
Potencjały równowagowe elektrod - siła elektromotoryczna ogniw polaryzacja, Chemia fizyczna AGH lab
więcej podobnych podstron