Chemia
Chemia
Prof. dr hab. Krystyna A. Skibniewska
Katedra Podstaw Bezpieczeństwa WNT
E-mail: kas@uwm.edu.pl

Plan wykładu VII
Plan wykładu VII
Elektrochemia: ogniwa,
elektroliza.
Korozja.
Twardość wody

Elektroliza
Elektroliza
-
reakcje chemiczne wywołane przepływem
prądu elektrycznego przez roztwór
elektrolitu. Elektrolit – kwas, zasada lub
sól.
I prawo Faraday’a m = kIt
m – masa substancji wydzielonej na elektrodzie [g],
k – stała charakterystyczna dla substancji wydzielanej
tzw. równoważnik elektrochemiczny [g/C],
I – natężenie prądu [A],
t – czas [s].
II prawo Faraday’a: masy substancji wydzielone przez
taki sam ładunek elektryczności są proporcjonalne
do ich mas równoważnikowych.

Elektroliza c.d.
Elektroliza c.d.
Wodorotlenków:
- metali mniej aktywnych od
wodoru,
- metali bardziej aktywnych od
wodoru,
Kwasów:
- beztlenowych,
- tlenowych,
Soli.

Ogniwa elektryczne
Ogniwa elektryczne
Działanie ogniwa to proces odwrotny do
elektrolizy.
Półogniwo – elektroda (metal) zanurzona
w roztworze swoich jonów.
Potencjał półogniwa (równanie Nernsta):
E = E
o
+ (RT/F
z
) ln a
R – stała gazowa (8,314 W
.
s/mol
.
K)
T – temperatura [K]
F – stała Faraday’a (96 485 C/mol)
z – wartościowość metalu
a – aktywność (stężenie) półogniwa.

Szereg napięciowy metali
Szereg napięciowy metali
Potencjały normalne w temp.
25
o
C
Pierwiastek
E
o
[V]
K/K
+
Ca/Ca
Al/Al
3+
Zn/Zn
2+
Fe/Fe
3+
Fe/Fe
2+
H
2
/2H
+
Cu/Cu
2+
Ag/Ag
+
Au/Au
3+
2F
-
/F
2
2Cl
-
/Cl
2
4OH
-
/O
2
+ H
2
O
- 2,92
- 2,76
- 1,71
- 0,76
- 0,41
- 0,05
0,00
+0,34
+0,80
+1,42
+2,87
+1,36
+0,40

Pasywacja
Pasywacja
Proces chemiczny lub elektrochemiczny powodujący
przejście metalu ze stanu aktywnego w stan pasywny.
Stan ten osiąga się poprzez wytwarzanie na powierzchni
metalu bardzo cienkiej, ale szczelnej i dobrze związanej
z podłożem warstewki tlenków, wodorotlenków lub soli.
Warstewka ta powoduje zmianę potencjału
elektrycznego metalu i zwiększa jego odporność na
korozję. Takie warstwy tworzą się na powierzchni
chromu, nikilu, molibdenu, tytanu, glinu, żelaza i
stopach tych metali, jak, np. na stalach Fe-Cr-Ni.
Pasywacja niektórych metali zachodzi samorzutnie
(samopasywacja) pod wpływem działania tlenu
zawartego w powietrzu (m.in. Al, Cr, Ni).
Zwykle pasywację przeprowadza się w kąpielach
utleniających -tzw. oksydowanie: elektrolityczne -
głównie w przypadku aluminium i jego stopów (tzw.
anodowanie), chemiczne - głównie stopów żelaza, tzw.
czernienie (np. elementy broni).
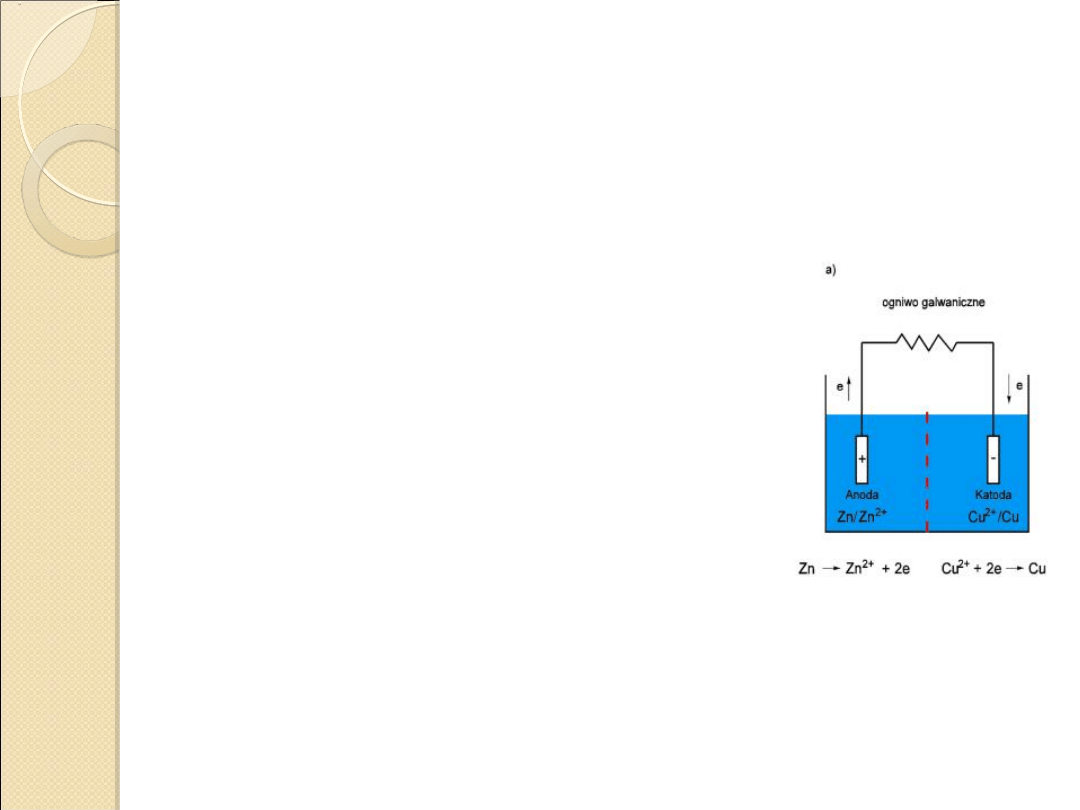
Ogniwo Daniella
Ogniwo Daniella
Skład: Zn w roztworze ZnSO
4
i Cu w
roztworze CuSO
4
.
Zn
o
⇆ Zn
2+
+ 2e
-
Cu
2+
+ 2e
-
⇆ Cu
o
Siła elektromotoryczna ogniwa SEM
to różnica potencjałów półogniw.

Ogniwo stężeniowe
Ogniwo stężeniowe
Połączone ze sobą dwa półogniwa –
metal w roztworze swojej soli o
różnym stężeniu. Wtedy:
SEM = (RT/F
z
) ln a
1
/a
2
Na skutek dążenia do wyrównania stężeń
w roztworze o mniejszym stężeniu
metal się rozpuszcza, a w drugim
osadza na elektrodzie.

Ogniwo stężeniowe typu
Ogniwo stężeniowe typu
oksydacyjnego
oksydacyjnego
Powstają przy nierównomiernym dopływie
tlenu do metalu. W środowisku wodnym
(np. wilgoć z powietrza czyli kropla wody
na metalu) zachodzą odmienne reakcje
na powierzchni wody i na styku z
metalem:
2 H
2
O + O
2
+ 4e
-
→ 4OH
-
Fe → Fe
2+
+ 2e
-
Takie zjawisko może zachodzić na części
elementu metalowego, lub pod
zanieczyszczeniem, które utrudnia
dostęp tlenu. Zanieczyszczenia jonowe
mogą przyspieszać proces korozji.

Korozja elektrolityczna
Korozja elektrolityczna
Wywoływana przez prąd stały tzw.
Prądy błądzące z uziemienia
urządzeń prądu stałego.
Ulegają jej znajdujące się w gruncie
elementy metalowe (infrastruktura
gazowa, wodociągowa, ciepłownicza
itp., również zbrojenie w żelbecie).
Miejsce wpływania prądu do
elementu staje się katodą, ujścia –
anodą i tu zachodzi korozja.

Zagadnienia na ćwiczenia
Zagadnienia na ćwiczenia
Reakcje charakterystyczne kationów:
Ca
2+
, Fe
3+
, Al
3+
, Na
+
, K
+
i anionów:
SO
42-
, CO
32-
, SiO
32-
, NO
3-
Analiza soli.
Twardość wody.
Document Outline
Wyszukiwarka
Podobne podstrony:
Sprawozdanie z ćw nr6 chemia bud, Studia budownictwo pierwszy rok, Chemia budowlana, sprawozdania
Sprawozdanie z ćw nr1 - chemia bud, Studia budownictwo pierwszy rok, Chemia budowlana, sprawka z che
Chemia bud 6
Sprawozdanie z ćw nr1 - chemia bud.kevcio, Studia budownictwo pierwszy rok, Chemia budowlana, sprawk
Chemia bud 5
chemia bud 2 2012 02 28
pytania chemia bud
chemia bud 1 2012 02 21
Chemia mat. bud, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki, Chemi
chemia org bud
Pytania jesień 2011, Politechnika Warszawska polibuda PW WIL, sem 2, Chemia budowlana, Chem bud
Pytania 2012, Politechnika Warszawska polibuda PW WIL, sem 2, Chemia budowlana, Chem bud
Pytania jesień 2010, Politechnika Warszawska polibuda PW WIL, sem 2, Chemia budowlana, Chem bud
chemia org bud
Chemia mat. bud, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki, Chemi
Dz bud 4
Chemia Bionie wyk1
Zao bud 1
więcej podobnych podstron