
CHEMIA MATERIAŁÓW II
Kompleksy alkenowe
W roku 1827, duński farmaceuta W.C. Zeise ogrzewał K
2
PtCl
4
w etanolu i
otrzymał nieoczekiwany związek, którego analiza elementarna wskazywała
na skład: KPtCl
3
C
2
H
4
. Zaszła reakcja odwodnienia etanolu a strukturę
samego związku ustalono o wiele później.
K
2
PtCl
4
+ EtOH
K
Pt
Cl Cl
Cl
+ H
2
O + KCl
Otrzymany został pierwszy związek metaloorganiczny, który był
kompleksem etylenu i platyny II. Wybór całkowicie przypadkowy był
niezwykle trafny. Regułą jest, że kompleksy olefinowe metali
szlachetnych są najbardziej odporne na działanie tlenu i wilgoci.
Obecnie znane są olefinowe kompleksy każdego metalu przejściowego i
stanowią jedna z najważniejszych klas związków koordynacyjnych.
Rozwój chemii metaloorganicznej olefin wiąże się ściśle z powstaniem w
minionym wieku przemysłu petrochemicznego, gdyż olefiny stały się
powszechnie dostępne.
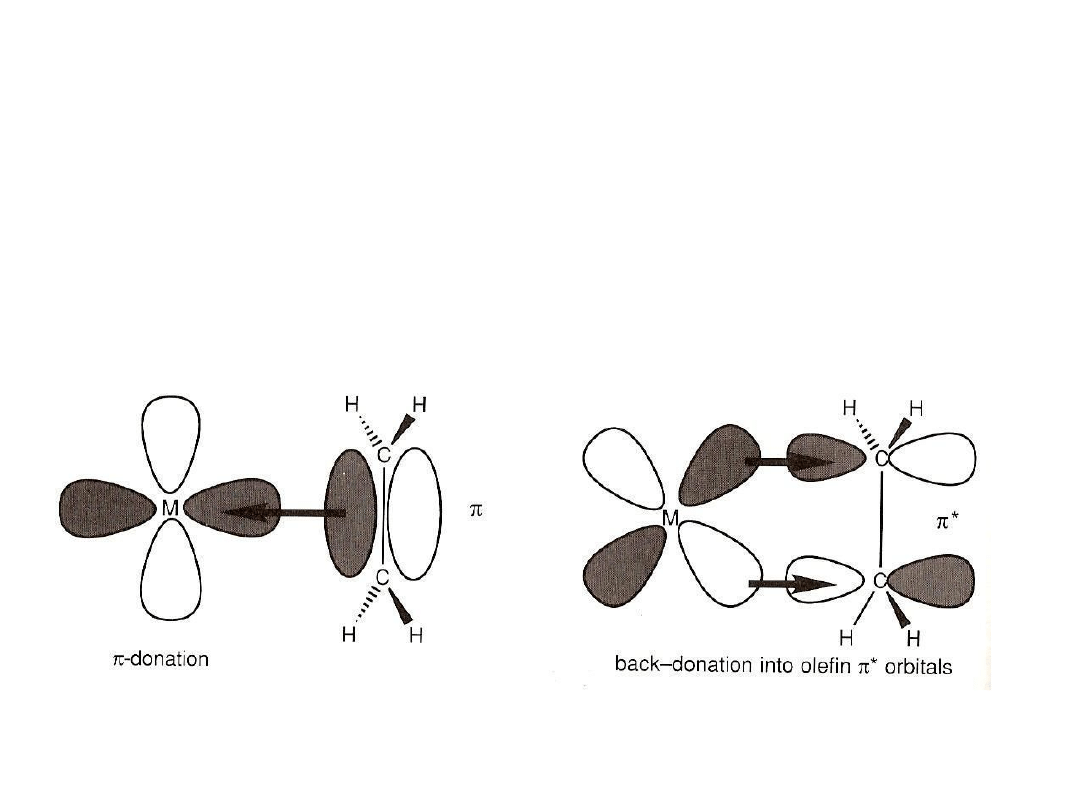
Wiązanie alkenów z metalami przejściowymi
Olefiny wiążą się z metalem przejściowym przez orbitale π, wiązaniem
donorowym do nie zapełnionego orbitalu d metalu. Olefiny są jednak
słabymi zasadami i wiązanie to jest stabilizowane wiązaniem zapełnionego
orbitalu d metalu z orbitalem π
*
olefiny, który posiada odpowiednią
symetrię aby zapewnić wzajemne oddziaływanie orbitali. Metal funkcjonuje
zatem zarówno jako kwas Lewisa (akceptor elektronów) i zasada Lewisa, w
odniesieniu do olefiny.
Koncepcja tego wiązania zastała zaproponowana przez Dewar’a, Chatt’a i
Duncanson’a.
Wiązanie alkenów z metalami przejściowymi
Analogicznie do wiązania z CO:
sprzężenie powrotne do orbitalu antywiążącego π
*
wiązania C=C
prowadzi do osłabienia (wydłużenia) wiązania C=C.
Sprzężenie powrotne z orbitalem π
*
ma dwie strukturalne
konsekwencje:
- wydłużenie wiązania C=C
- redukcję kątów wokół atomów węgla ze 120
o
C (sp
2
) do kątów
typowych dla sp
3

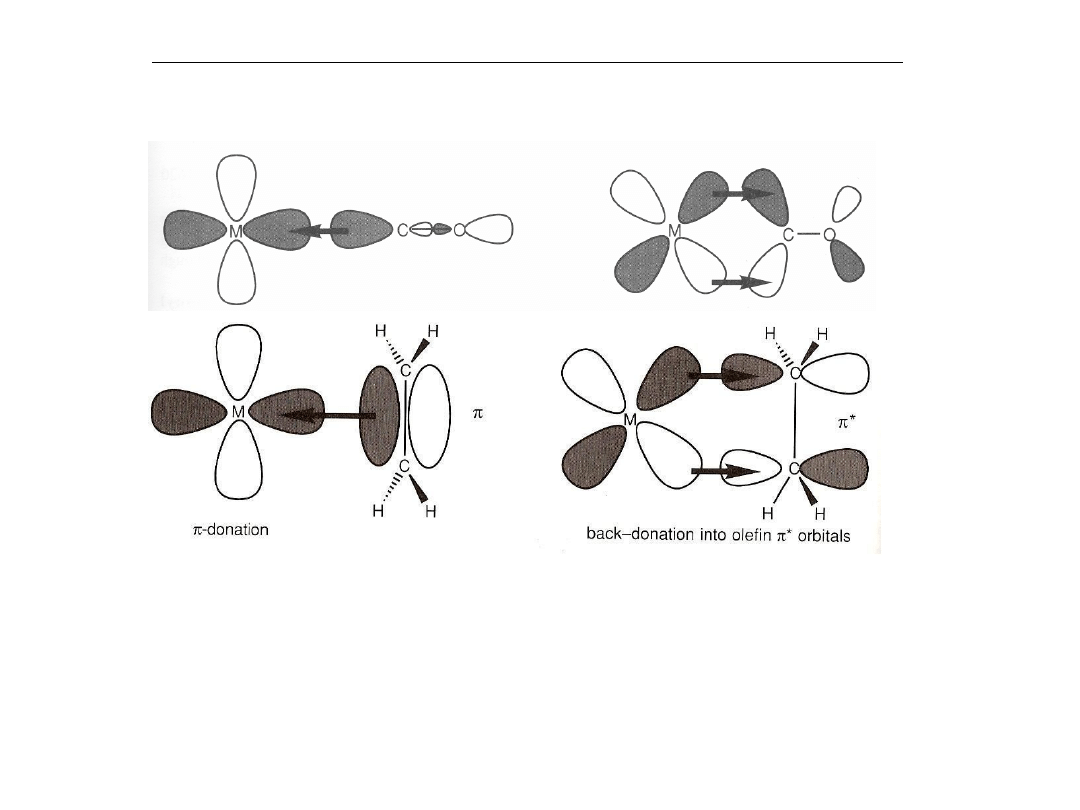
Wiązanie alkenów z metalami przejściowymi
Zakres wiaząnia powrotnego zależy od:
- energii zapełnionych orbitali metalu
M
-
efektów sterycznych
-
mocy elektrono-akceptorowej olefiny,
tj. obecności (lub) nie podstawników
elektrono-akceptorowych
Jeśli energia zapełnionych orbitali d
metalu przejściowego jest wysoka,
wiązanie powrotne jest silne i gęstość
elektronowa jest skoncentrowana na
alkenie. W krańcowych wypadkach
długość wiązania C=C przyjmuje
wartości zbliżone do typowych
pojedynczych wiązań C-C i utworzenia
dwóch indywidualnych wiązań σ.
Powstające kompleksy triad Ti i V
powinny być raczej określane jako
metalacyklopropan
.
M
M
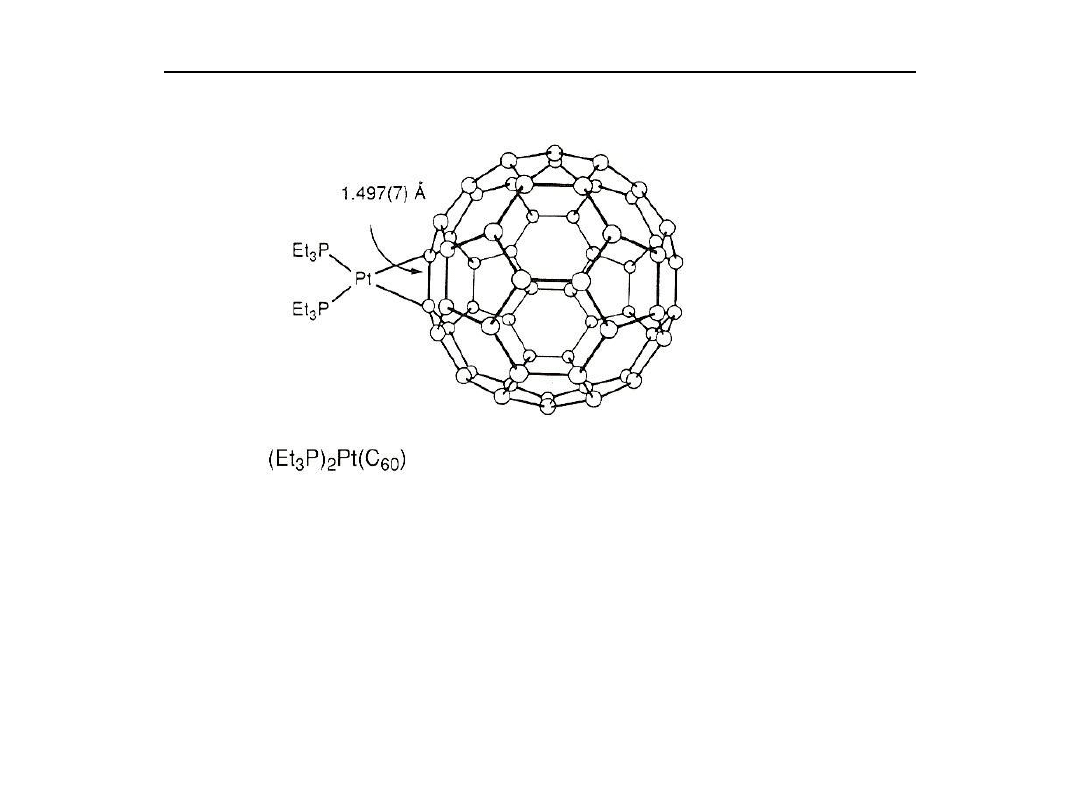
Wiązanie alkenów z metalami przejściowymi
Specjalnym przykładem kompleksów olefinowych są połączenia bukminster-
fullerenu C
60
Fullereny są sieciami węglowymi o kształcie piłki futbolowej, składające
się z pierścieni 6 i 5 członowych, co umożliwia sferyczną geometrię.
C
60
może związać do 6 jednostek PtL
2
.
W laboratoriach, fullereny, otrzymuje się odparowując w atmosferze helu
grafit, wiązką światła laserowego lub w elektrycznym łuku węglowym.

Fullereny
Budowa:
Cząsteczki tworzące kryształ są ogromnymi i pustymi wewnątrz, symetrycznymi
wielościanami składającymi się z kilkudziesięciu do kilkuset atomów węgla.
Najbardziej trwałe fullereny to: C32, C44, C50, C58, C60, C70, C240, C540, C960.
Najlepiej poznane są, jak dotąd, cząsteczki C60 i C70 . Cząsteczki te składają się z
12 pierścieni pięcioatomowych i odpowiednio 20 lub 25 pierścieni
sześcioatomowych. Mają one doskonale znane kształty piłek - futbolowej / C60 / i
do rugby / C70 / .
Fullereny mogą być wyekstrahowane z sadzy przy użyciu benzenu, czy
innych rozpuszczalników organicznych. C60 i inne fullereny mogą być od
siebie rozdzielone z wykorzystaniem chromatografii cieczowej. W ten
sposób zostały one po raz pierwszy otrzymane przez ich odkrywców , za
co przyznano im w 1996 roku Nagrodę Nobla z chemii. Byli to: R. Smalley,
R. Curl i, przyznający się do polskich korzeni H. Kroto /rodzina pochodzi z
okolic Krotoszyna /.
Właściwości i przewidywane zastosowanie:
Fullereny to miękkie żółte lub brązowe kryształki, które łatwo
i
są dobrze rozpuszczalne w rozpuszczalnikach organicznych. Nie
rozpuszczają się w wodzie. Wewnątrz cząsteczki fullerenu można
umieścić atomy metali (tzw. metalofullereny). Przewiduje się, iż fullereny
i ich metaliczne związki znajdą zastosowanie jako przewodniki,
półprzewodniki, nadprzewodniki (nadprzewodnictwo), smary, włókna
sztuczne, farmaceutyki -np. w leczeniu choroby Alzheimera.
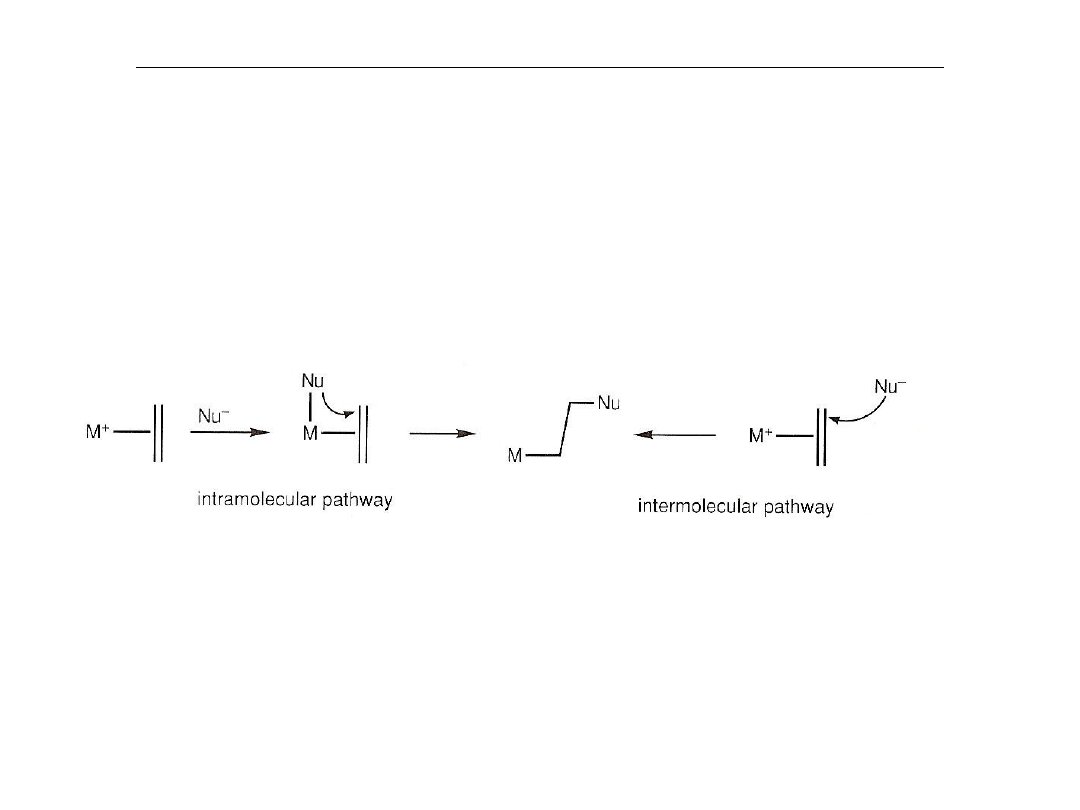
Reakcje kompleksów alkenowych z nukleofilami
Najważniejszym aspektem chemii kompleksów olefina-metal jest
podatność
skoordynowanej olefiny na atak nukleofilowy. Wolne olefiny nie reagują
łatwo z
nukleofilami, zaś skoordynowane ulegają reakcji w temperaturze
pokojowej, szczególnie, gdy kompleks ma ładunek dodatni.
Reakcja może przebiegać wewnątrz-cząsteczkowo lub
międzycząsteczkowo
Preferowany jest mechanizm wewnątrz-cząsteczkowy.
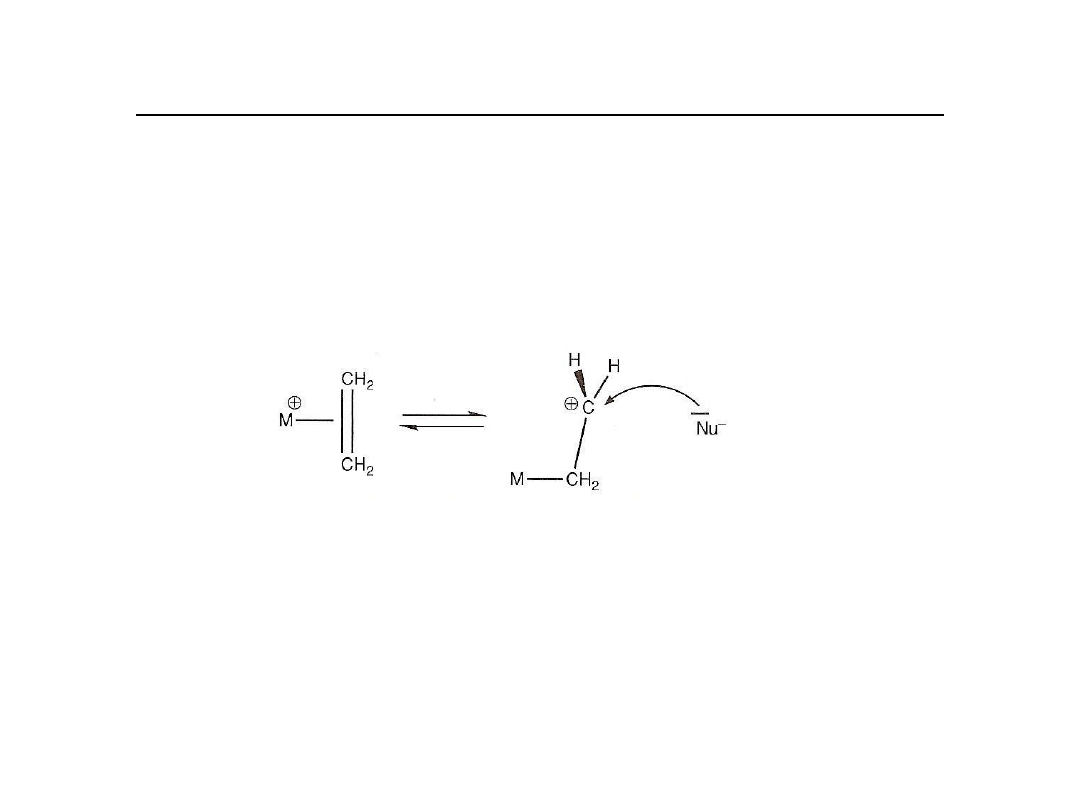
Reakcje kompleksów alkenowych z nukleofilami
Dlaczego olefina jest aktywowana?
Orbital π
*
jest częściowo zapełniony na skutek wiązania powrotnego z orbitalami d
metalu.
Oddziaływanie z nukleofilem powinno być utrudnione a nie ułatwione.
Jest oczywiste, że taka polaryzacja ułatwia atak cząstki posiadającej
wolną parę elektronową.
Brak reaktywności etylenu wynika z braku polarności.
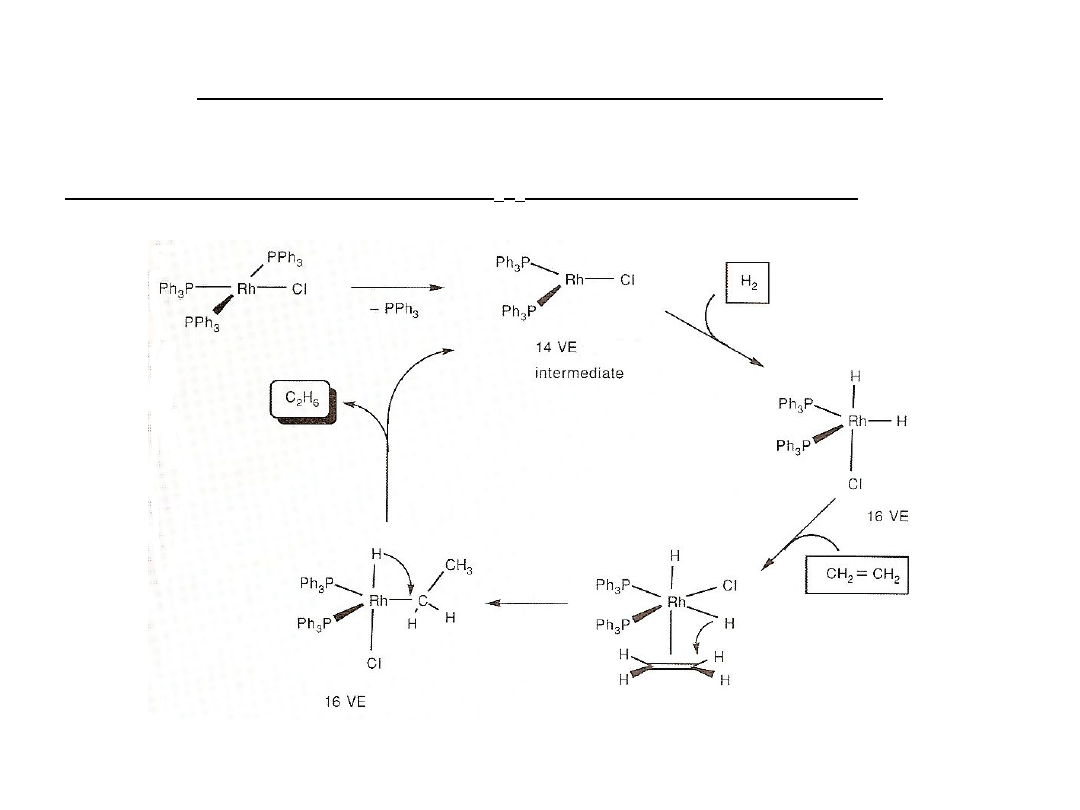
Reakcje z nukleofilami w katalizie
Uwodornienie olefin - RhCl(PPh
3
)
3
(katalizator Wilkinsona)
Aktywacja wodoru a potem transfer do skoordynowanego alkenu.
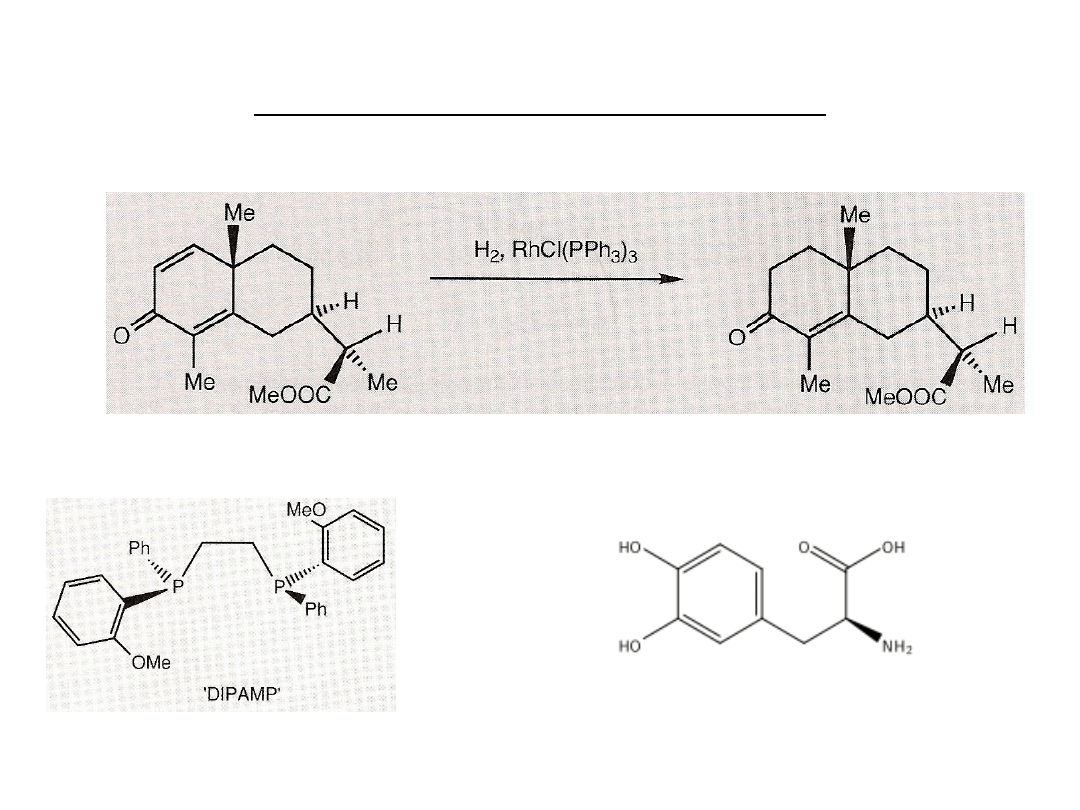
Reakcje z nukleofilami w katalizie
W odróżnieniu od katalizatorów heterogenicznych (Ni/C, Pd/C) homogeniczne kompleksy
rodu i rutenu są chemo- i regioselektywne.
Zastosowanie chiralnych ligandów fosfinowych (DIPAMP) umożliwia
przeprowadzenie asymetrycznego uwodornienia.
L-dopa (dihydroksyfenyloalanina) –
aminokwas stosowany jako lek w
chorobie Parkinsona
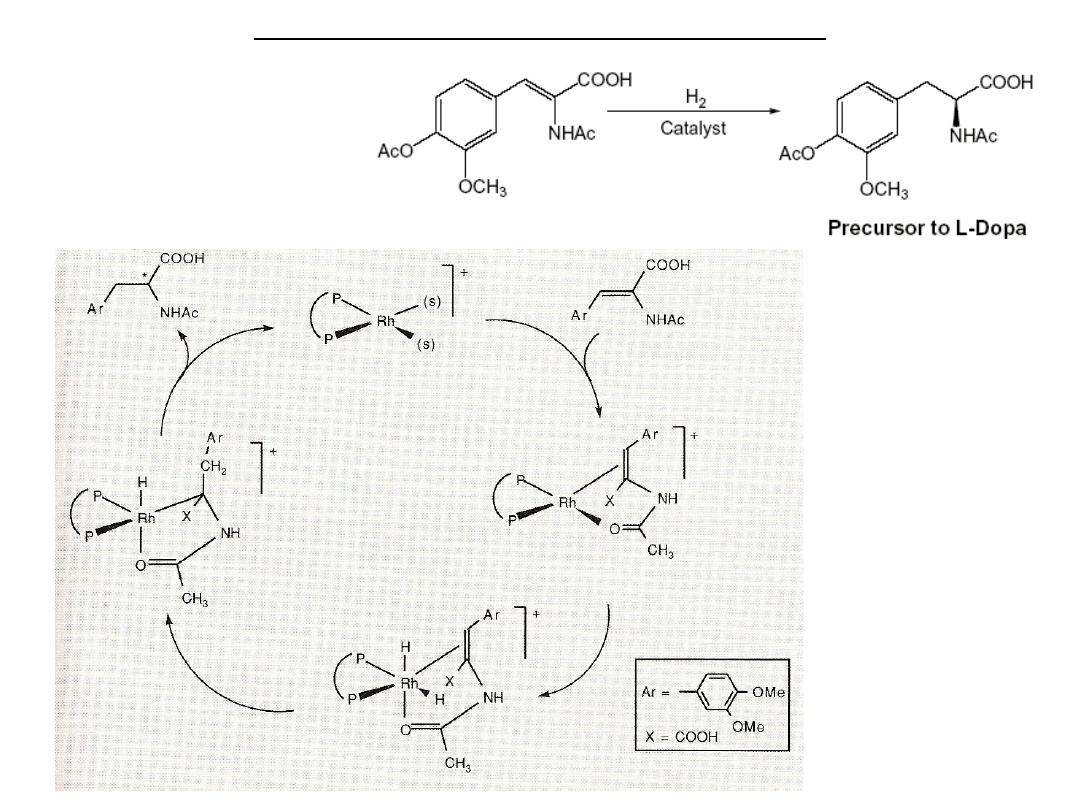
Reakcje z nukleofilami w katalizie
Asymetryczne
uwodornienie
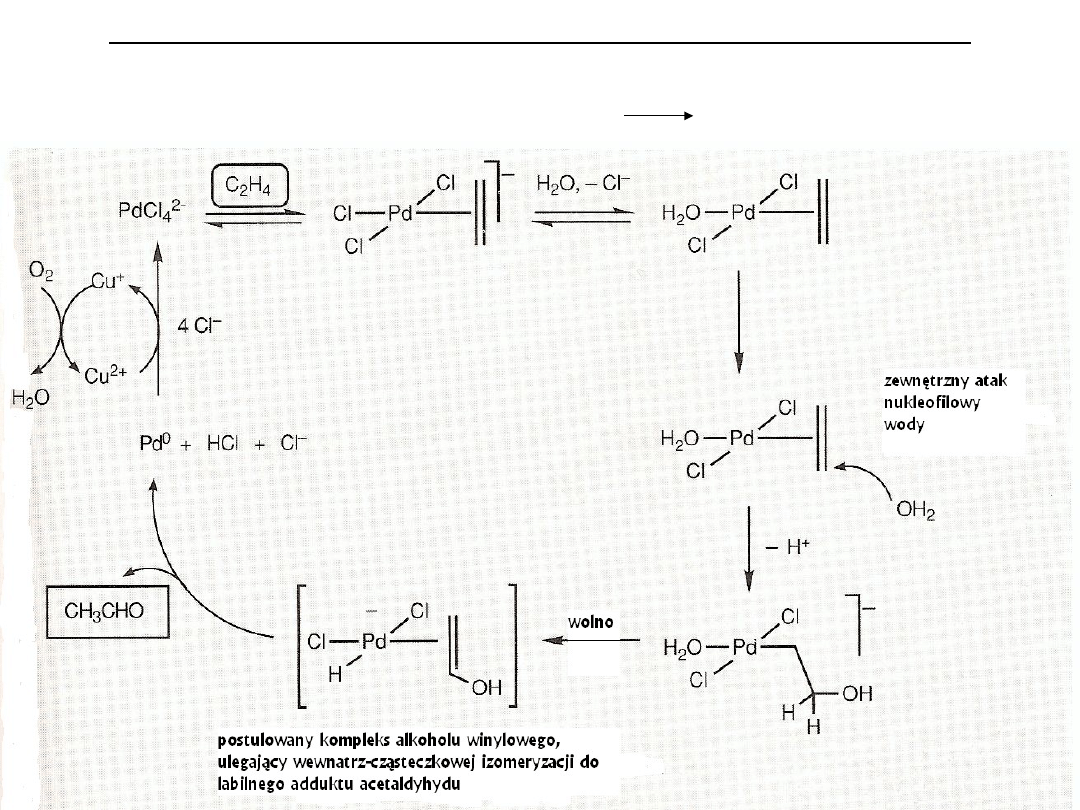
Reakcje z nukleofilami w katalizie. Proces Wackera
Proces syntezy aldehydu octowego, alternatywny do procesu Monsanto, stosowany od 50 lat w Wacker
Chemie. Sumarycznie jest to utlenianie etylenu – C
2
H
4
+ ½ O
2
CH
3
CHO
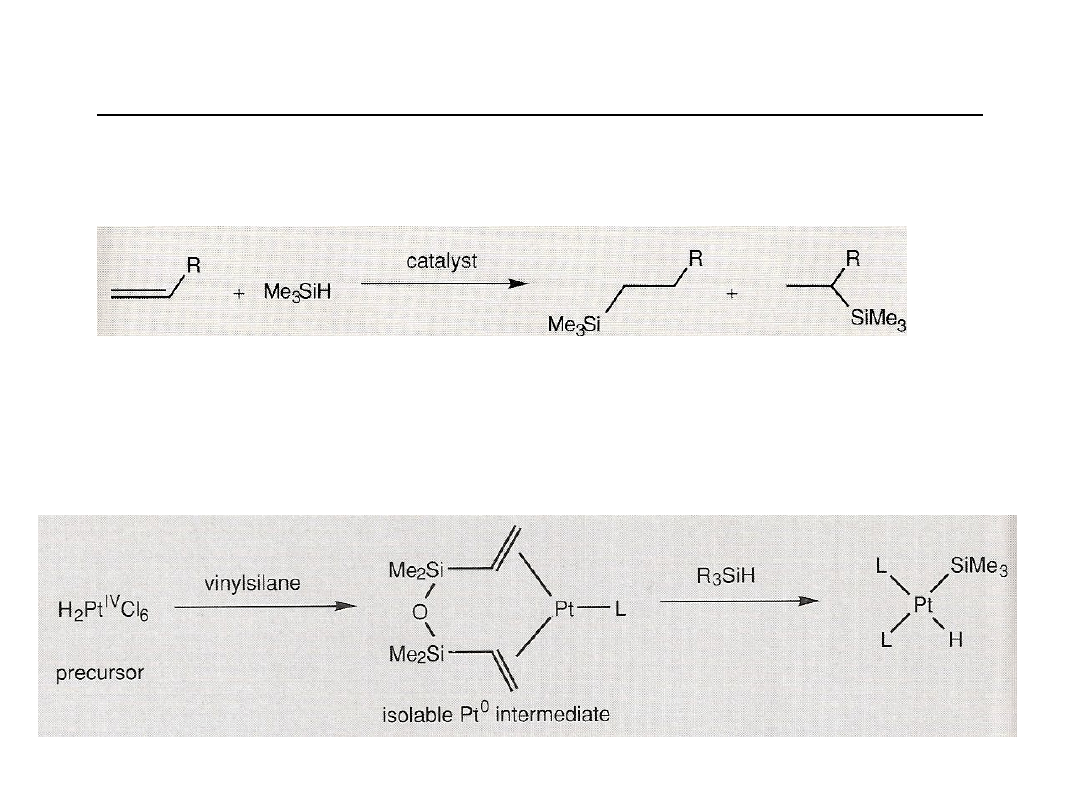
Reakcje z nukleofilami w katalizie. Hydrosililowanie.
Addycja wodorosilanów (np. R
3
SiH) do wiązań C=C (hydrosililowanie) jest katalizowana
przez kompleksy metali szlachetnych, takich jak katalizator Wilkinsona [RhCl(PPh
3
)
3
,
kobalt i iryd.
Najbardziej aktywne są kompleksy platyny H
2
PtCl
6
(katalizator Speier’a)
oraz PTDD (platinum tetramethyldivinyldisiloxane) katalizator Karstedt’a.
Aktywnym czynnikiem jest platyna (0).
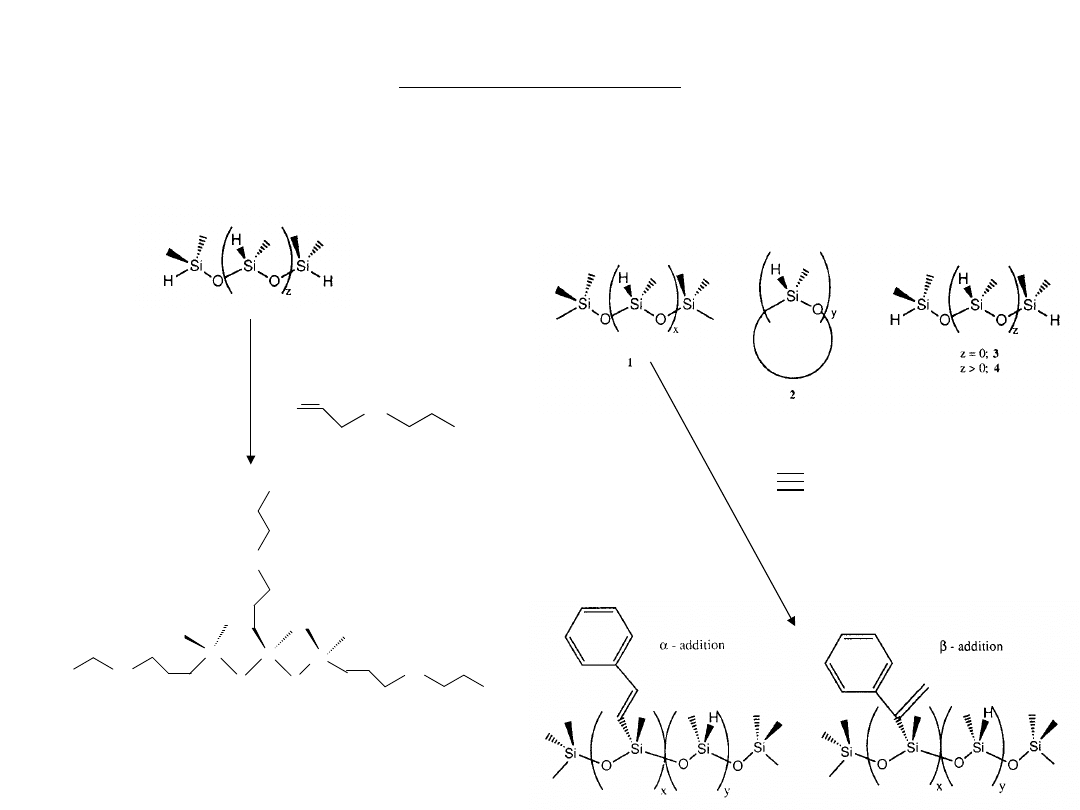
Hydrosililowanie
Reakcja hydrosililowania (hydrosilowania) ma szerokie zastosowanie w przemyśle
silikonowym. Większość funkcjonalizowanych polimerów i monomerów otrzymywana jest na tej
drodze.
CH
CH
PTDD
HC C-Ph
PTDD
PTDD
NH
NH
2
Si
O
Si
O
Si
NH
NH
2
NH
2
NH
NH
NH
2
( )
z
Dodatki do szamponów i tkanin
„soft touch”
„shine” – RI = 1,58
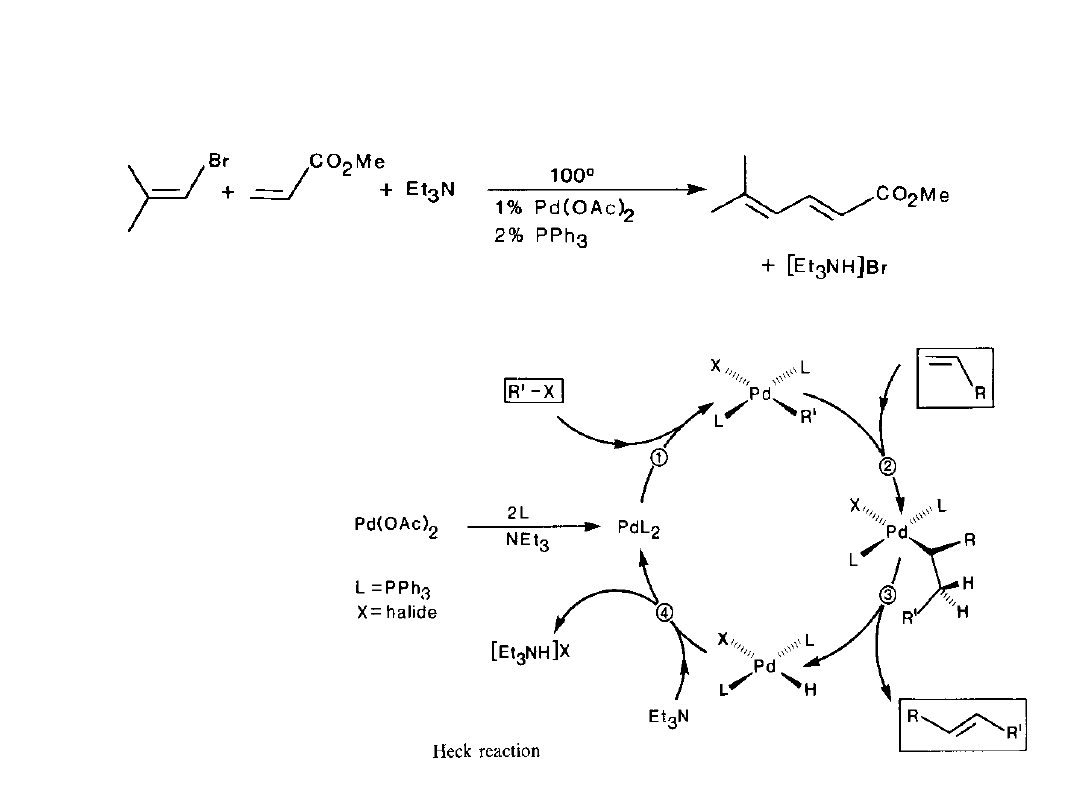
Reakcja Heck’a
W tej reakcji winylowy atom wodoru jest zastępowany grupą winylową, benzylową lub
arylową. Katalizatorem jest kompleks Pd(0) otrzymywany np. in situ z Pd(OAc)
2
, Et
3
N i PPh
3
.
Mechanizm obejmuje:
1
- utleniającą addycję
halogenku do Pd z
utworzeniem trans-
R’PdL
2
X
R’X może być tylko
halogenkiem
winylowym,
benzylowym lub
arylowym aby nie
zachodziła β-
eliminacja.
2
– Insercja olefiny do
wiazania Pd-C.
3
- β-eliminacja
podstawionej olefiny.
4
-regeneracja
katalizatora PdL
2
w
reakcji ze
stechiometryczną
ilością Et
3
N.

Alternatywne metody otrzymywania polimerów o
wysokim RI
PTDD katalizator Karstedt'a
Me
3
Si O [Si O]
n
-SiMe
3
+ HC
Me
Me
3
Si O [Si O ]
n
SiMe
Me
CH
CH
Ph
H
C Ph
1.
Hydrosililowani
e
Zalety: wysoka selektywność, niskie stężenie katalizatora –10
-6
-10
-5
Wady: cena fenyloacetylenu i katalizatora
Jest to interesujący przykład możliwości stosowania różnych układów
katalitycznych do wytwarzania polisiloksanów o wysokim współczynniku
refrakcji (kosmetyki)
Alternatywne metody otrzymywania polimerów o
wysokim RI
Me
3
Si O [Si O ]
n
SiMe
3
+ Br-Ph
Me
Me
3
Si O [Si O ]
n
SiMe
Me
CH
CH
Ph
Et
3
N
-
Et
3
N HBr
2. Reakcja Heck’a
[
Pd
]
Zalety: wysoka selektywność,
Wady: stechiometryczna ilość aminy, przemysł odchodzi od
halogenków
Alternatywne metody otrzymywania polimerów o
wysokim RI
Me
3
Si O [Si O ]
n
SiMe
3
+ CH
2
=CH-Ph
Me
Me
3
Si O [Si O ]
n
SiMe
Me
CH
CH
Ph
- CH
2
=CH
2
[Ru]=C
[Mo]=C
3. Metateza
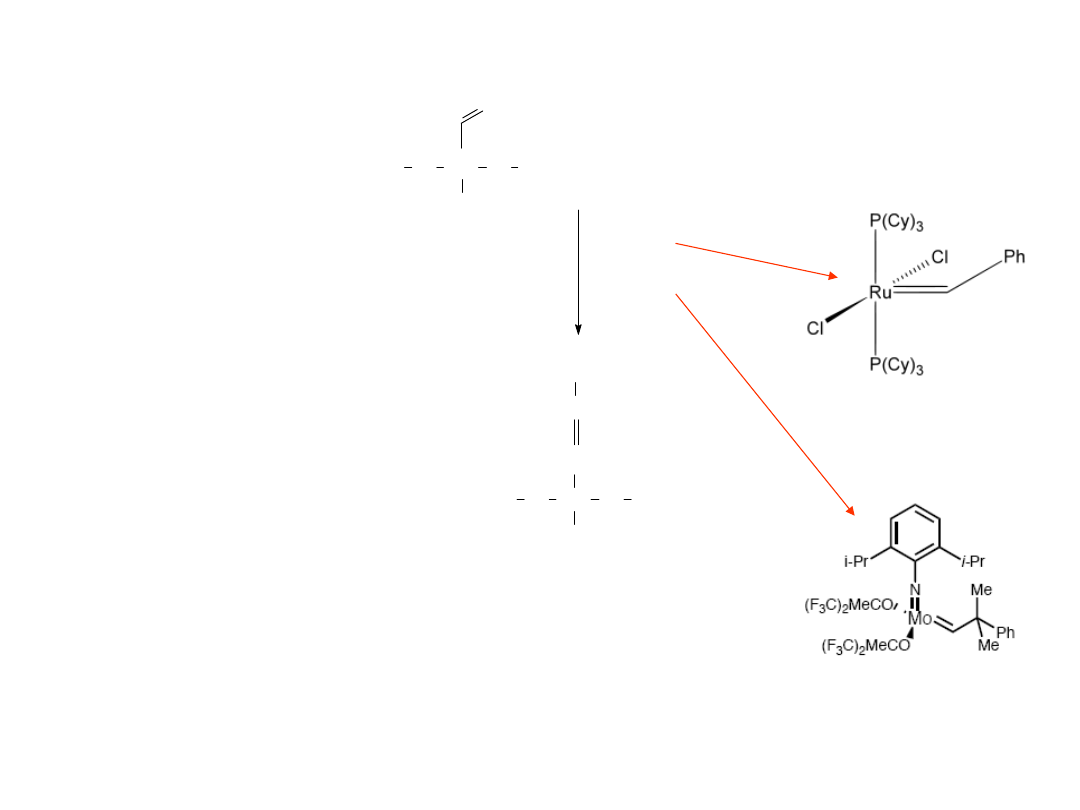
Katalizator Grubbs’a
Zalety: dostępne handlowo katalizatory, lotny produkt
uboczny
Wady: konieczność stosowania nadmiaru styrenu,
uboczna polimeryzacja do polistyrenu

Alternatywne metody otrzymywania polimerów o
wysokim RI
4. Silujące sprzęganie
Me
3
Si O [Si O ]
n
SiMe
3
+ CH
2
=CH-Ph
Me
Me
3
Si O [Si O ]
n
SiMe
Me
CH
CH
Ph
- CH
2
=CH
2
[RuCl(H)(CO)(PPh
3
)
3
]
Zalety: Syntetycznie prosty układ katalityczny, tańszy od związków
platyny
i palladu, lotny produkt uboczny
Wady: Konieczność stosowania nadmiaru styrenu, uboczna
polimeryzacja do
polistyrenu (można ją ograniczyć stosując pułapki wolnych
rodników –
np. hydrochinon, lub wyeliminować stosując α-metylostyren
jako
substrat)
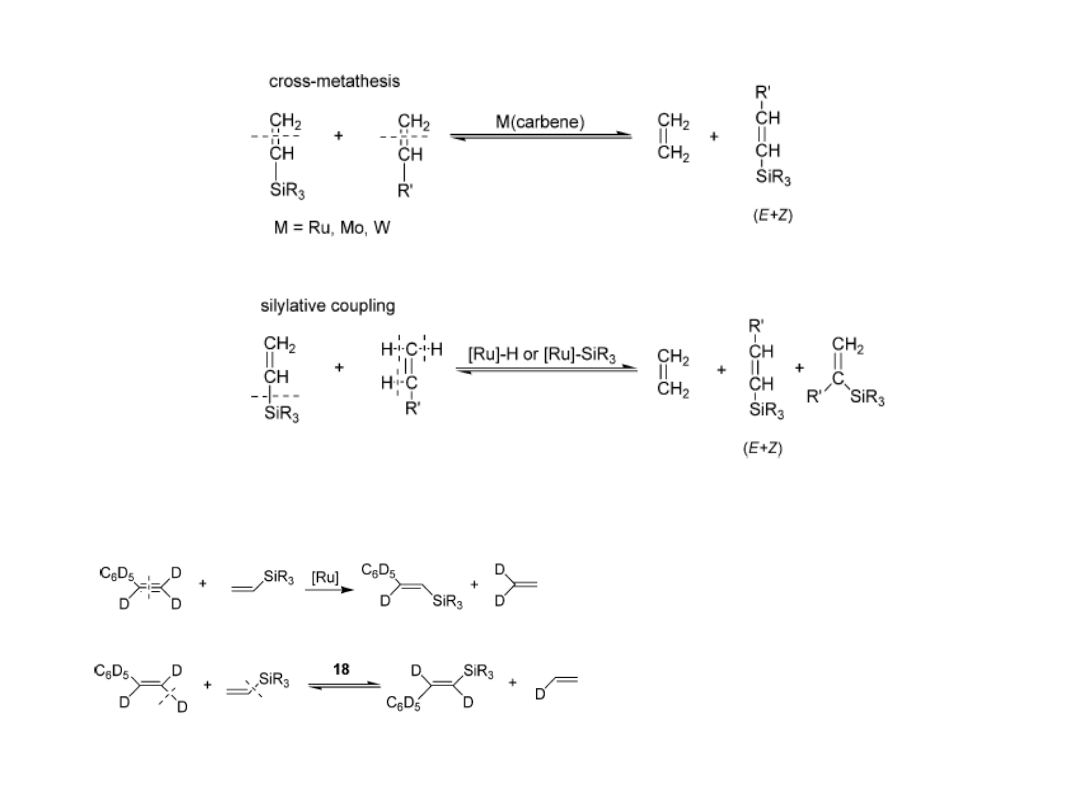
Metateza a sililujące sprzęganie
Jak można te procesy odróżnić?
18 = [Ru]-H
metateza
Sililujące sprzęganie
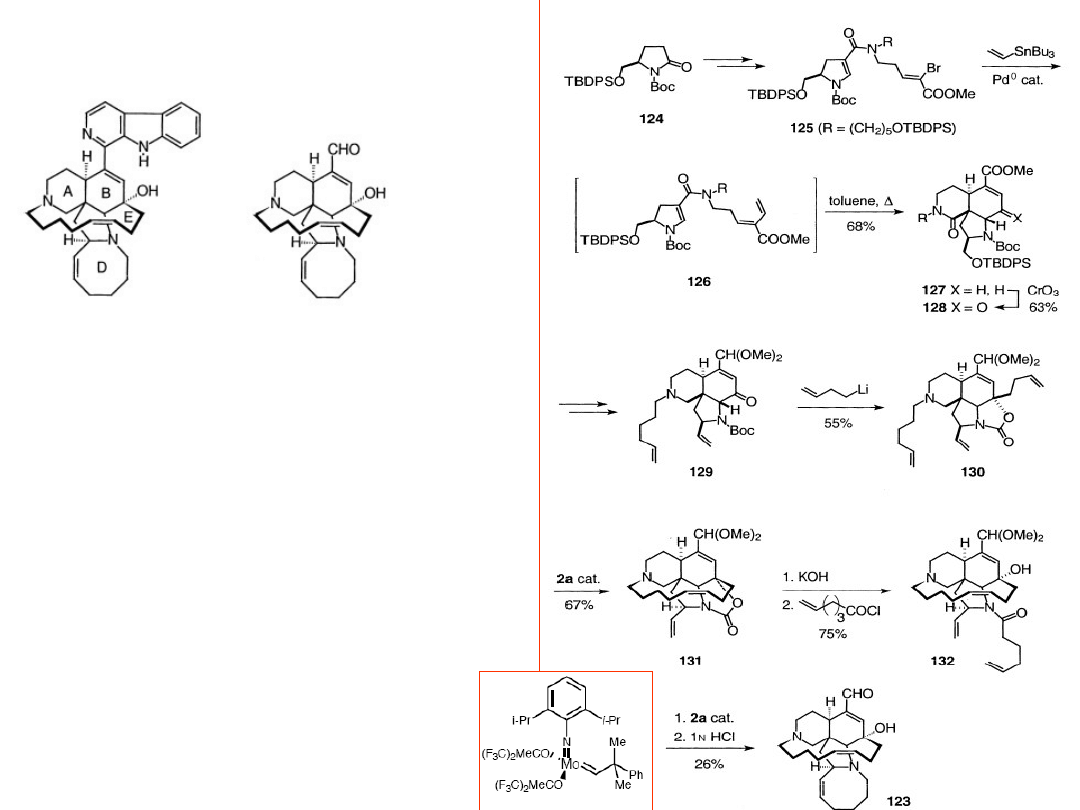
Synteza ircinalu A –
prekursora manzaminy A
Jeśli istnieje szereg wad np.
procesów metatetycznych to
dlaczego nagroda Nobla i czy w
ogóle jest sens ich stosowania?
Tak
1. Poszukiwania nowych
efektywnych katalizatorów
2. Stosuje się je tam gdzie cena
jest rzeczą wtórną (farmaceutyki,
leki etc.).
Manzamina Ircinal
2a =
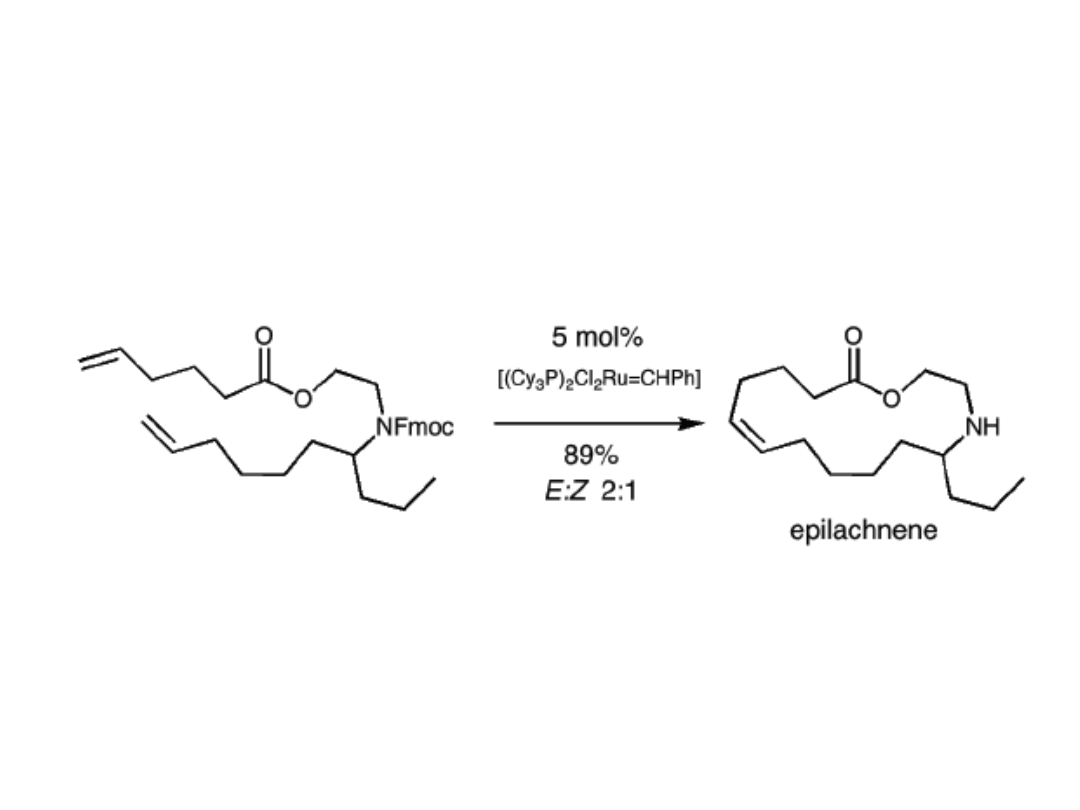
Synteza epilachnenu
Epilachnen, wykryty w 1993 w wydzielinie poczwarki chrząszcza
meksykańskiego Epilachnar varivestis, jest silnym repelentem owadów.
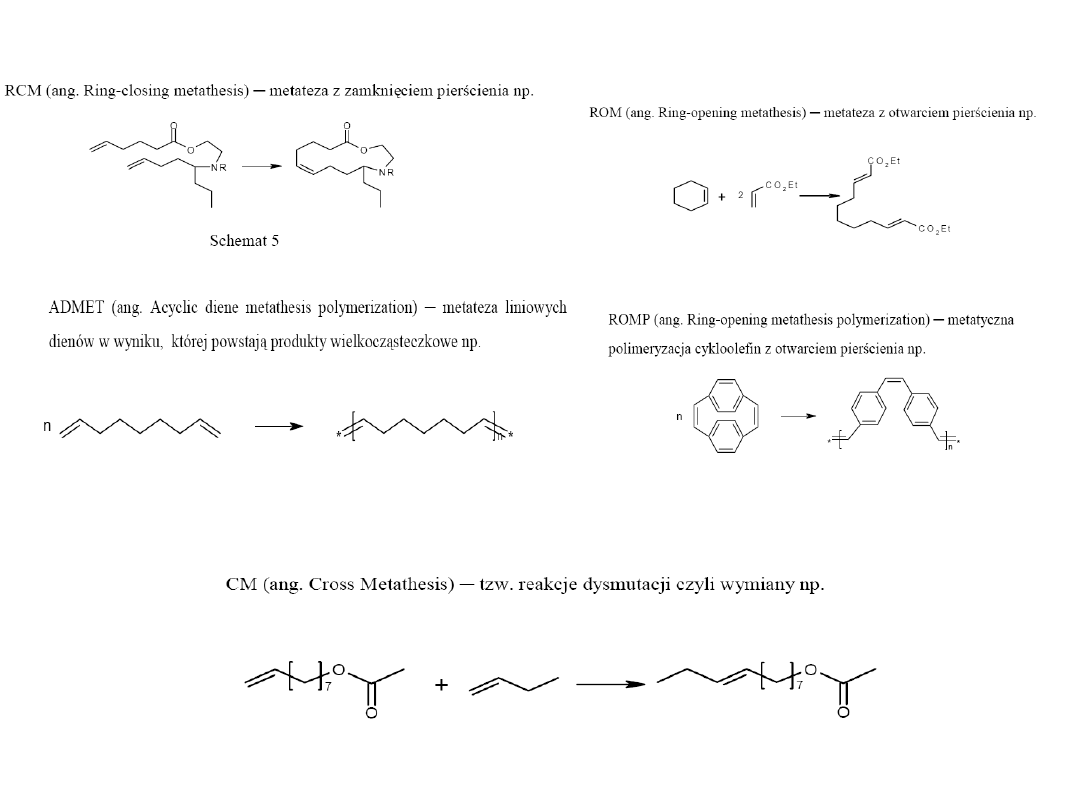
Zakres stosowania reakcji metatezy
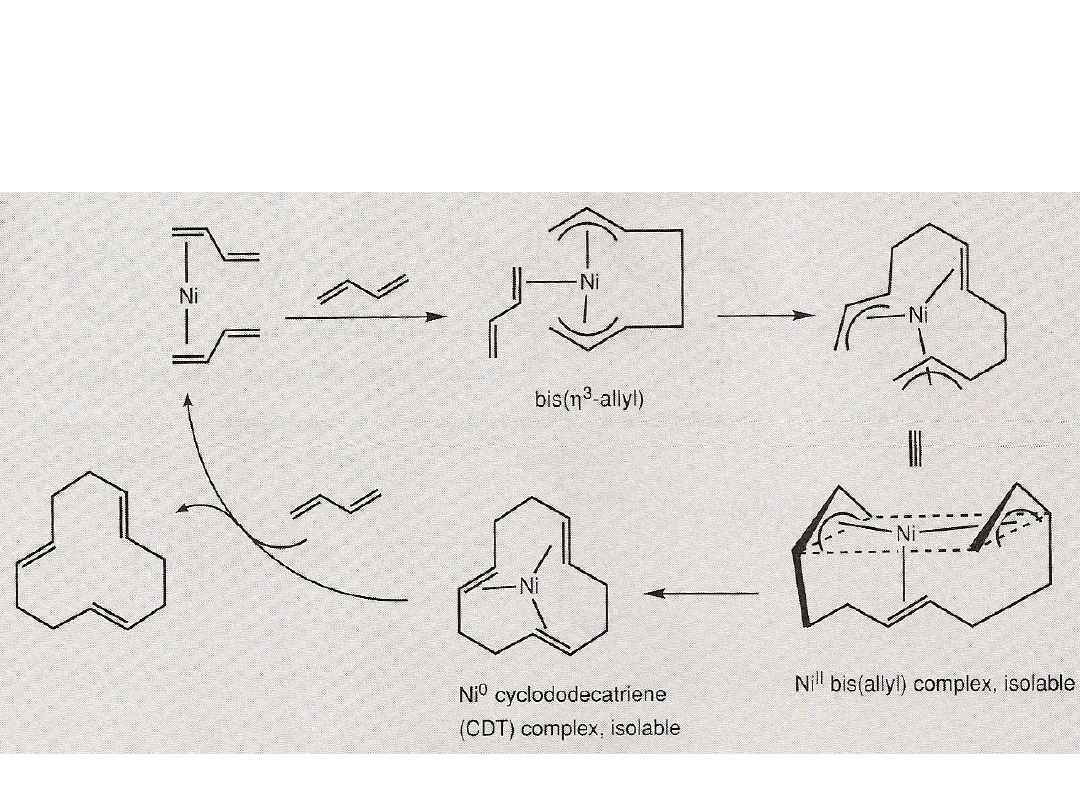
Oligomeryzacja (telomeryzacja butadienu)
Telomeryzacja to oligomeryzacja obejmuje włączenie dwóch części cząsteczki A-B na
końcach oligomeru. Telomeryzacja butadienu jest katalizowana bis(η
3
-allilo)niklem.
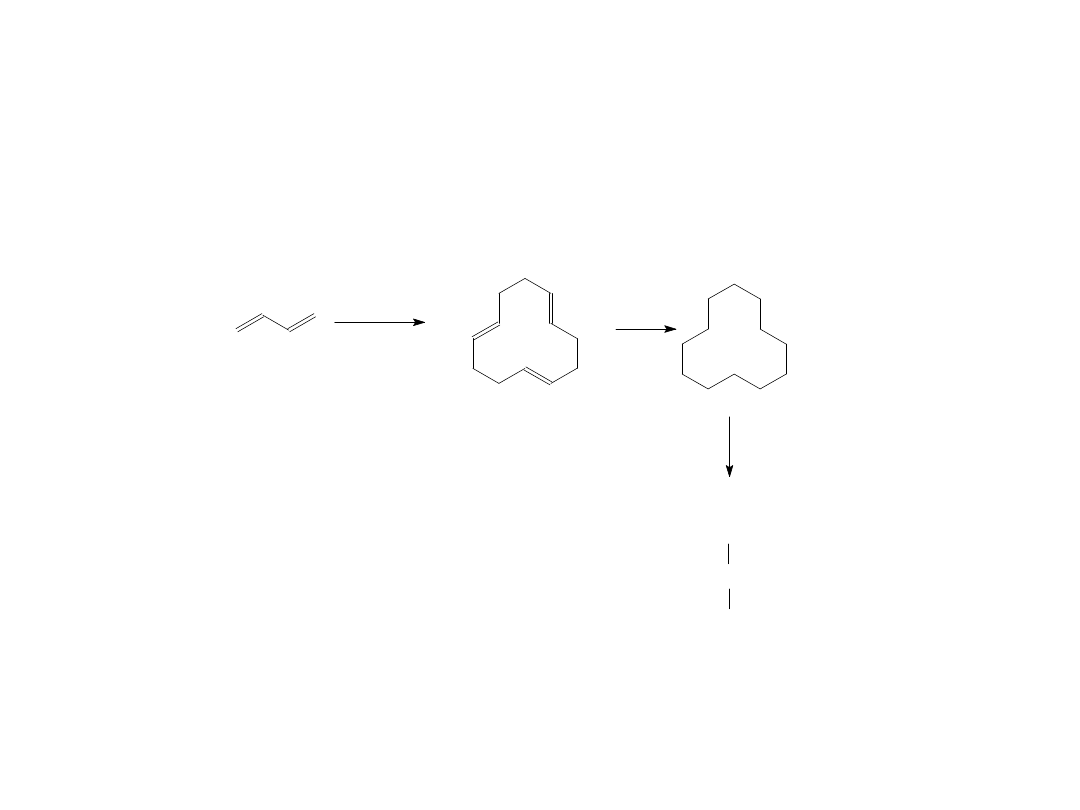
Oligomeryzacja (telomeryzacja butadienu)
Trimer – 1,5,9-cyklododekatrien otrzymywany na skalę przemysłową wobec
TiCl
4
jako mieszanina izomerów, głównie cis,trans,trans (wobec Ni
powstaje wyłącznie izomer trans,trans,trans). Jest on następnie
przekształcany w kwas 1,12-dikarboksylowy, substrat do produkcji
poliamidu (nylonu-12).
TiCl
4
R
3
Al
2
Cl
3
H
2
O
2
, HNO
3
COOH
(CH
2
)
10
COOH
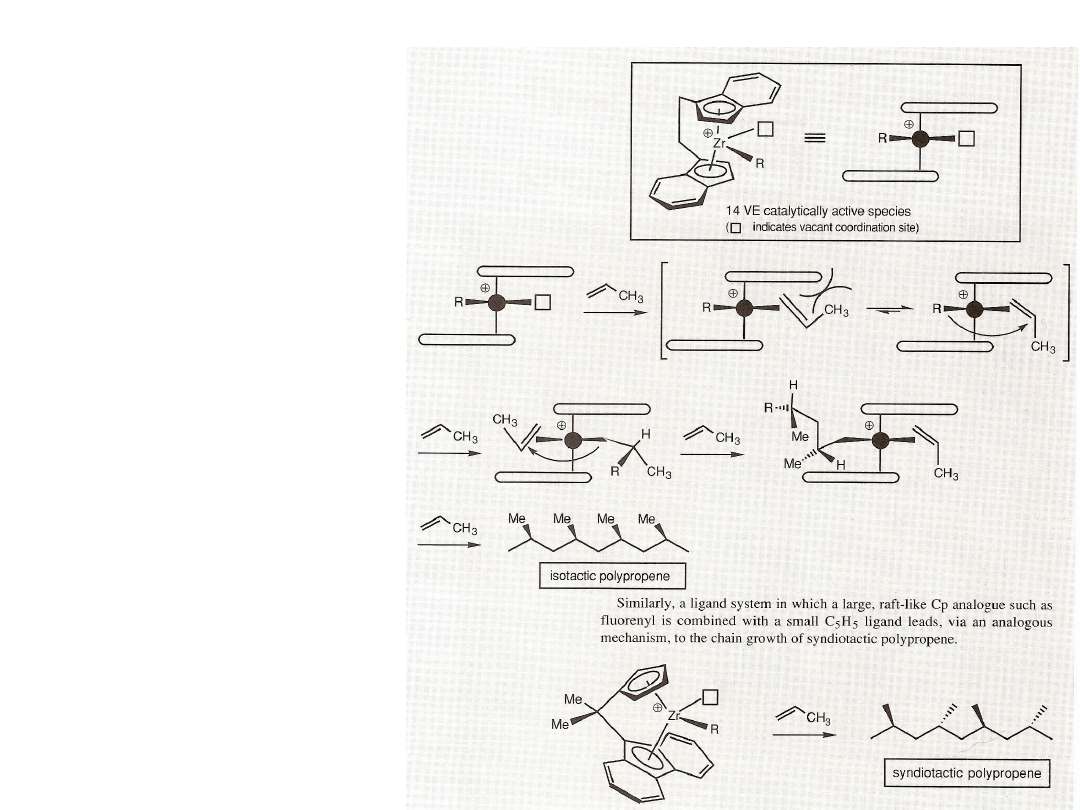
Polimeryzacja
Polimeryzacja
stereoselektywna
propenu daje polimer o
wyższej temperaturze
topnienia i twardości niż
polimery statystyczne
(ataktyczne). Katalizatory
posiadają zmodyfikowane
ligandy cyklopentadienylowe
– indenylowe, fluorenylowe
Dziś i jutro syntezy organicznej
Wymagania ochrony środowiska dotyczące czystych technologii
ukierunkowują syntezę na procesy katalityczne – katalizę homogeniczną,
heterogeniczną i enzymatyczną. Każda z nich ma swe zalety i ograniczenia,
zaś wszystkie pozwalają uniknąć procesów stechiometrycznych. Te ostatnie
prowadzą do olbrzymich ilości odpadów, przede wszystkim jako soli
nieorganicznych – NaCl, Na
2
SO
4
, (NH
4
)
2
SO
4
, powstających w reakcjach lub
jako produkty uboczne procesów neutralizacji.
Segment
przemysłu
Produkcja (tony/rok)
E (kg odpadów/kg
produktu
Produkcja wielko-
tonażowa
< 10
4
– 10
6
< 1 do 5
Produkty
specjalistyczne
(fine chemicals)
10 $ / kg
10
2
- 10
4
5 do > 50
Farmaceutyki
10 - 10
3
25 do > 100
Czynniki E w przemyśle
chemicznym
Kataliza homogeniczna – szeroko stosowana w produkcji wielko-tonażowej i
specjalistycznej, dogodna ale wykorzystuje rozpuszczalniki organiczne
(możliwość stosowania cieczy jonowych)
Kataliza heterogeniczna – możliwość odzyskiwania katalizatora i recyklingu.
Szeroko stosowana w procesach ciągłych
Kataliza enzymatyczna – łagodne warunki reakcji, chemo-, regio- i
enancjoselektywność – duży potencjał w syntezie specjalistycznej

Kataliza heterogeniczna
1.Heterogeniczna kataliza kwasowa: glinki kwasowe, zeolity, kwasy
adsorbowane na
krzemionce, sulfonowane polimery (polisiloksany, żywice
perfluoroalkilowe)
2. Heterogeniczna kataliza zasadowa: glinki zasadowe, mezoporowata
krzemionka modyfikowana przez powierzchniowe przyłączenie zasad
3. Katalityczne uwodornienie: metale szlachetne na nośnikach,
immobilizowane kompleksy metaloorganiczne (metal koordynuje do
ligandu związanego z powierzchnią nośnika)
4. Katalityczne utlenienie: mieszane tlenki (TiO
2
-SiO
2
), jony metali
inkorporowane w sieci zeolitów, lub sit molekularnych, metale szlachetne
na nośnikach
5. Katalityczne tworzenie wiązań C=C: heterogenizowane kompleksy
metaloorganiczne
na powierzchni SiO
2
lub nośników mezoporowatych. (SOMC = Surface
Organometallic
chemistry)
Heterogeniczne katalizatory są szeroko stosowane w przemyśle
(dogodny sposób
oddzielania od środowiska reakcji. Chemia układów homogenicznych jest
dobrze
poznana stąd SOMC.
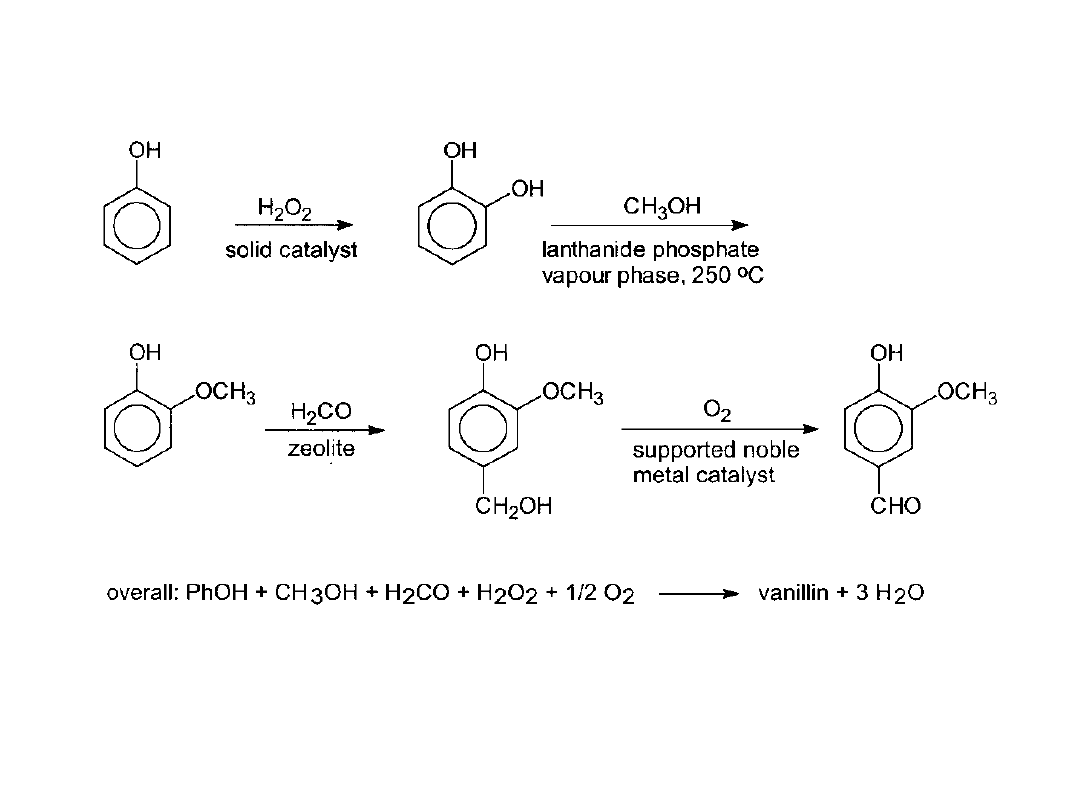
Kataliza heterogeniczna w wieloetapowej syntezie:
Wanilina
Wanilina, składnik kompozycji zapachowych i smakowych (10000 ton/rok)
otrzymywana jest w nowym procesie katalitycznym (Rhodia). Pierwszy etap-
hydroksylowanie na TiO
2
/SiO
2
, następnie metoksylowanie,
hydroksymetylowanie i ostatecznie utlenianie. Jedynym produktem ubocznym
jest woda. Jest to przykład doskonałej syntezy organicznej.
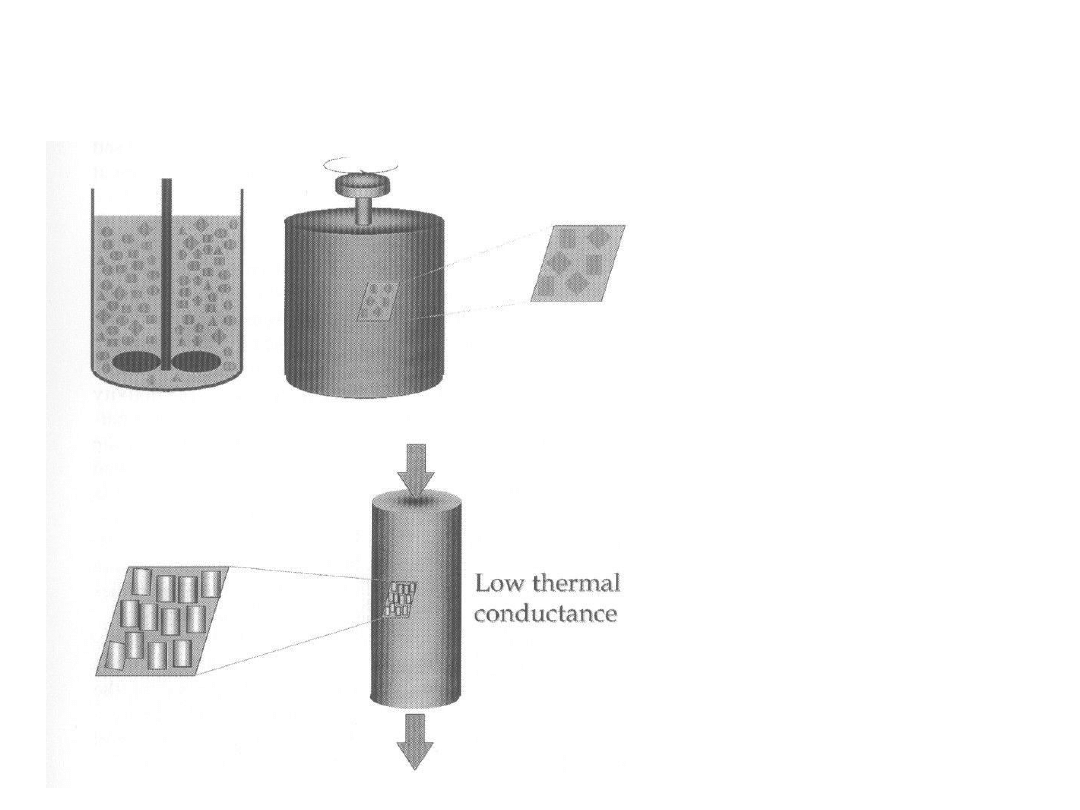
Modele reaktorów
Reakcje w fazie
ciekłej
Reakcje w fazie
gazowej
Proces w fazie gazowej

Proces w fazie gazowej
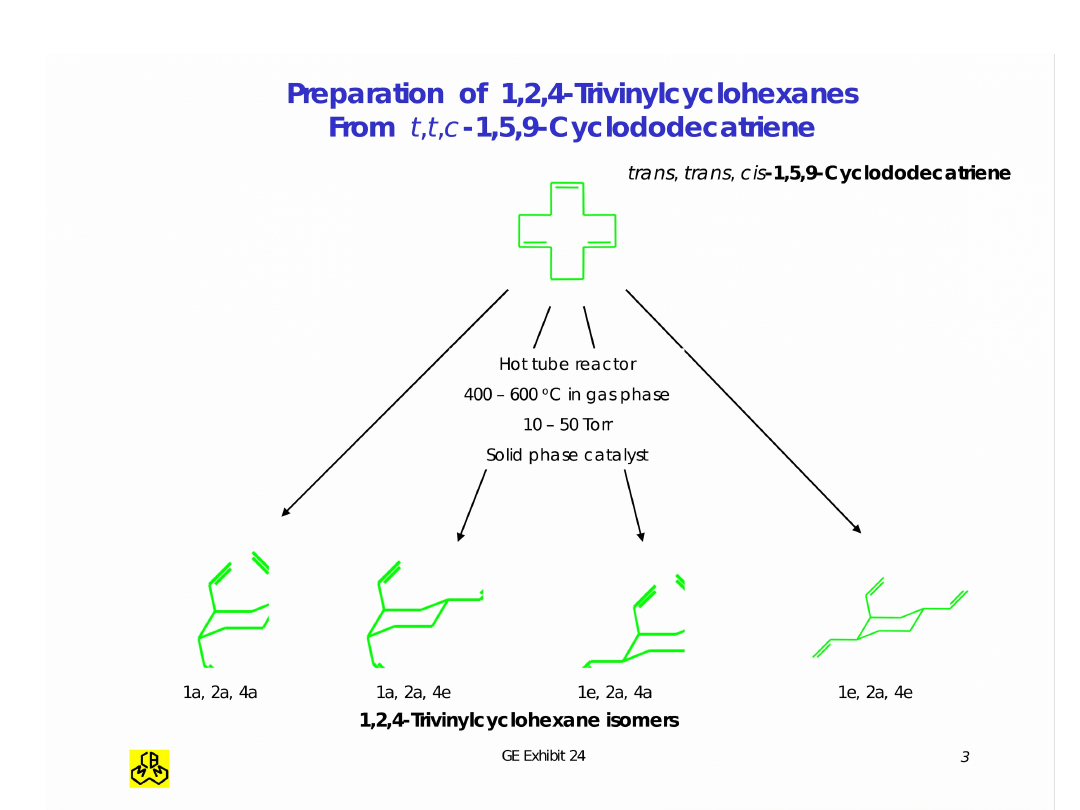
Izomeryzacja CDT do TVC
Imobilizacja katalizatorów homogenicznych
Kompleksy metaloorganiczne o wysokiej efektywności mogą być niekiedy
przekształcane w
układy heterogeniczne, aby umożliwić ich recykling. Można stosować szereg strategii
wiążąc je fizycznie lub chemicznie z nośnikami: wymiana jonowa, szczepienie na
polimerach, wiązanie chemicznie z nośnikiem, okluzja na membranach, nasycanie
zeolitów
(enkapsulacja).
W procesach utleniania olefin (epoksydowanie – nadtlenki, H
2
O
2
) pierwszym takim
katalizatorem był TiO
2
na SiO
2
, zawierający 2% wagowo TiO
2
(Shell). Katalizator
otrzymuje
impregnując krzemionkę za pomocą TiCl
4
, i kolejno hydrolizę parą wodną
oraz wygrzewanie. Można też stosować tetralkoksytytan.
Ilość związanego TiO
2
jest ograniczona ilością grup hydroksylowych na powierzchni
krzemionki. Tak otrzymany katalizator na nośniku jest efektywnym i
selektywnym
katalizatorem epoksydowania olefin wobec wodoronadtlenku t-butylowego (TBHP).
Przykłady katalizatorów
heterogenizowanych
Ti
O O
O
Ti
O O
O
Ti
O O
O
OR' O OR"
OR"
+
O
C
C
C=C
R"OOH
-
R'OH
Selektywność
– ilość moli produktu / (ilość moli substratu – ilość moli
nieprzereagowanego substratu)
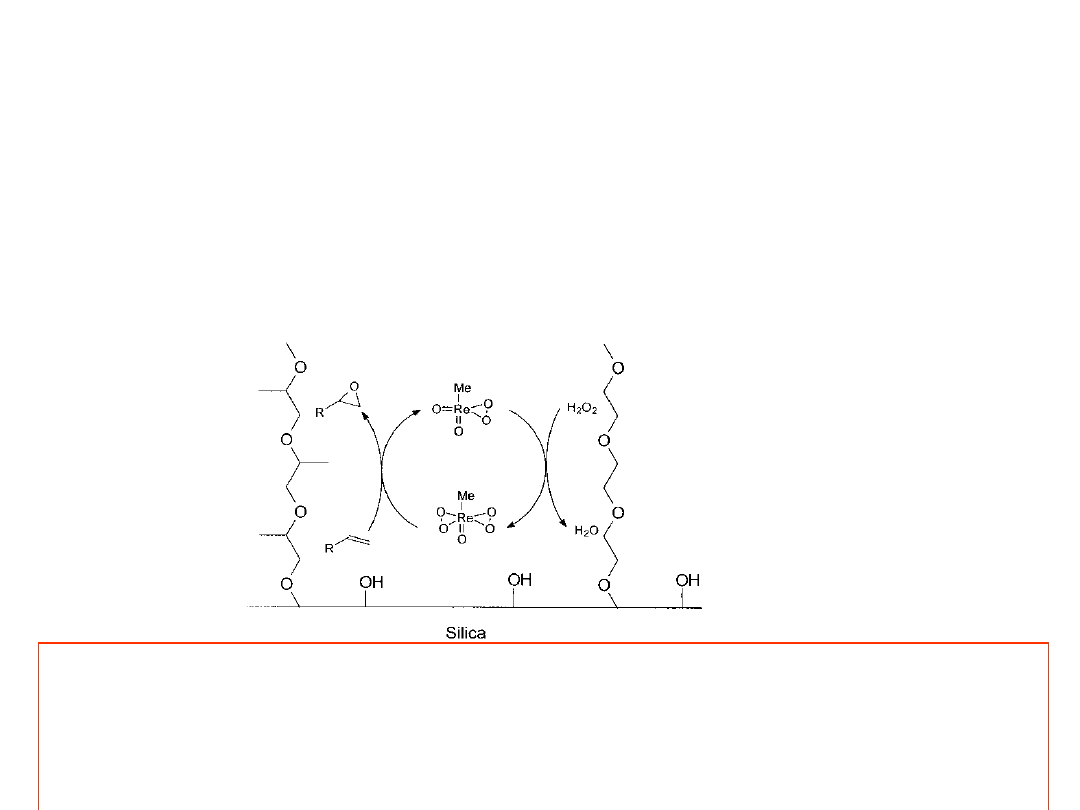
Przykłady katalizatorów heterogenizowanych, stosowanych
do utleniania
Metylotetraoksoren
(MTO)
na
nośniku
krzemionkowym,
funkcjonalizowanym kowalencyjnie związanym polieterem, katalizuje
utlenianie olefin 30% H
2
O
2
, bez stosowania rozpuszczalnika. Polietery na
powierzchni krzemionki spełniają rolę rozpuszczalnika MTO. Właściwości
hydrofobowo-hydrofilowe tego „rozpuszczalnika” można regulować
stosunkiem jednostek PPO do PEO. Na przykład przy utlenianiu
cykloheksenu, optymalny wynik (86% wydajności) uzyskuje się przy 1:1
PPO:PEO. Po piątym cyklu reakcyjnym konwersja i selektywność znacznie
spada.
Konwersja
= ilość moli reagenta – ilość moli reagenta w produktach /
ilość moli
reagenta
Wydajność
= ilość moli produktu / ilość moli reagenta =
konwersja x
selektywność
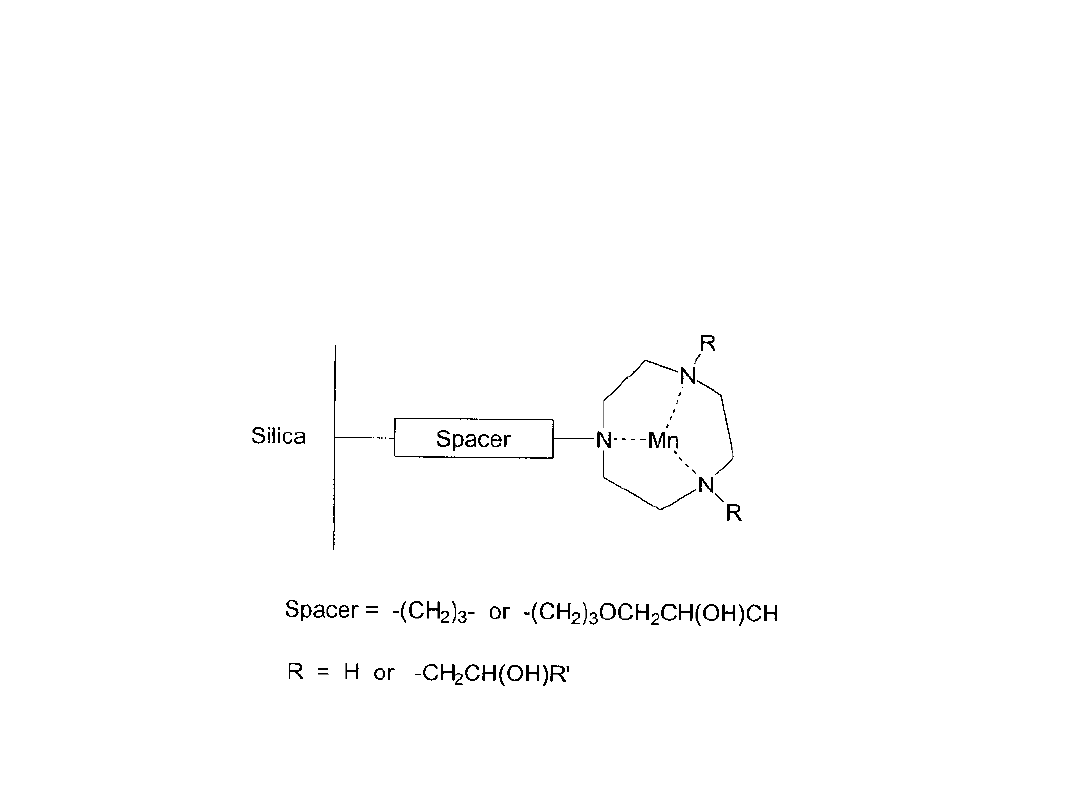
Przykłady katalizatorów heterogenizowanych
Bardzo ważnym czynnikiem jest ilość cykli katalitycznych dla danego układu
heterogenicznego (turnovers). Zwykle aktywność układu katalitycznego
spada w czasie na skutek wymywania (leaching) aktywnych katalitycznie
cząstek. Lepiej jest jeśli kompleks wiąże się kowalencyjnie (np. mangan z
ligandem triazacyklononanowym (tacn).
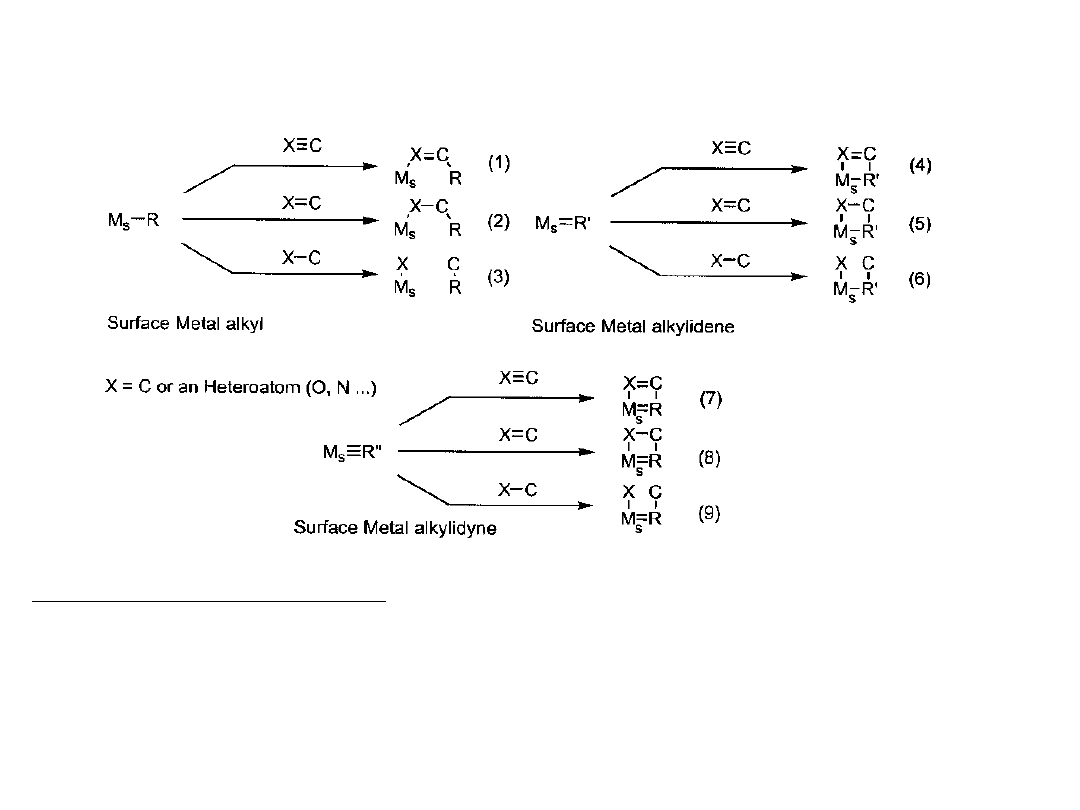
SOMC – chemia metaloorganiczna na powierzchni
Potencjalne możliwości
Obecnie poznane są procesy: (1) insercji alkenów do wiązania metal-alkil
(polimeryzacja
Zieglera-Natty)- 2; (2) reakcje alkenów z metalaalkilidenami (metateza
alkenów)-5;
(3) metateza alkanów (3)
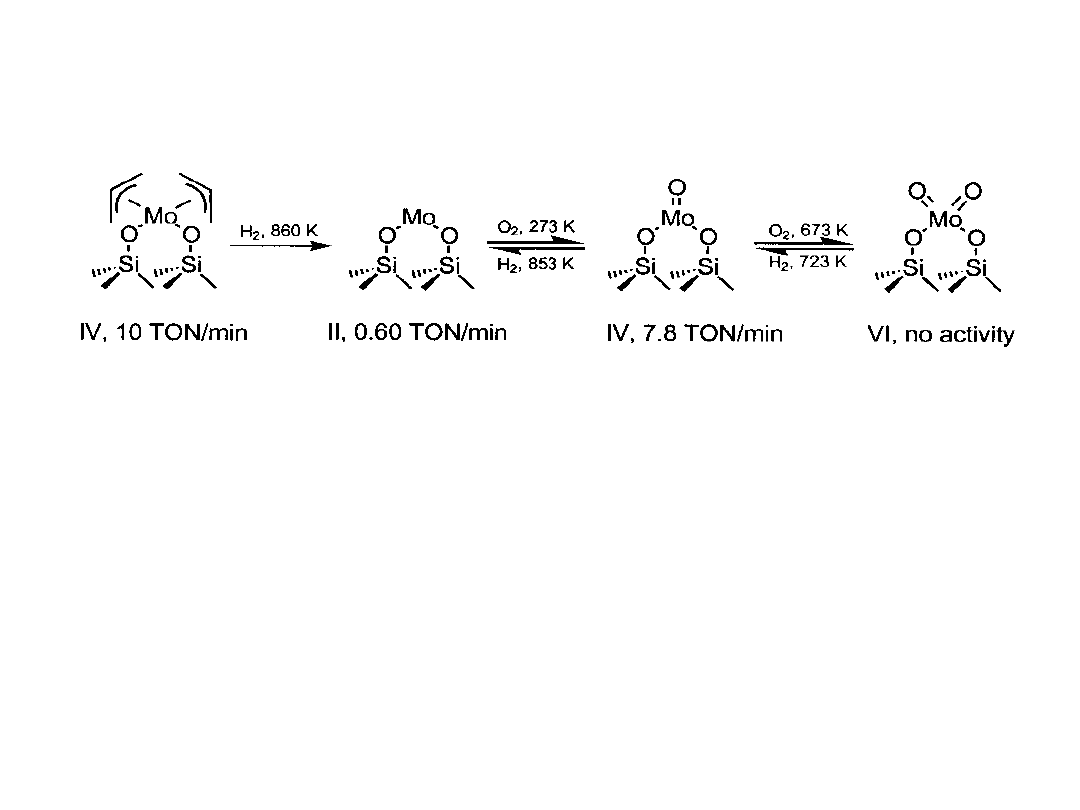
Przykłady katalizatorów heterogenizowanych
w metatezie alkenów
Wśród katalizatorów molibdenowych, związanych z powierzchnią krzemionki,
zbadana została ich aktywność w procesie metatezy propenu; po szeregu
modyfikacji tlenem i wodorem w wysokich temperaturach najwyższą
aktywność wykazują kompleksy Mo(IV). Substratem metaloorganicznym jest
Mo(allil)
4
m
Turnover number = liczba cząsteczek reagujących w określonym czasie
(minuty, sekundy) z jednym centrum aktywnym. Zwykle 0,6 – 6000 min
-1
.
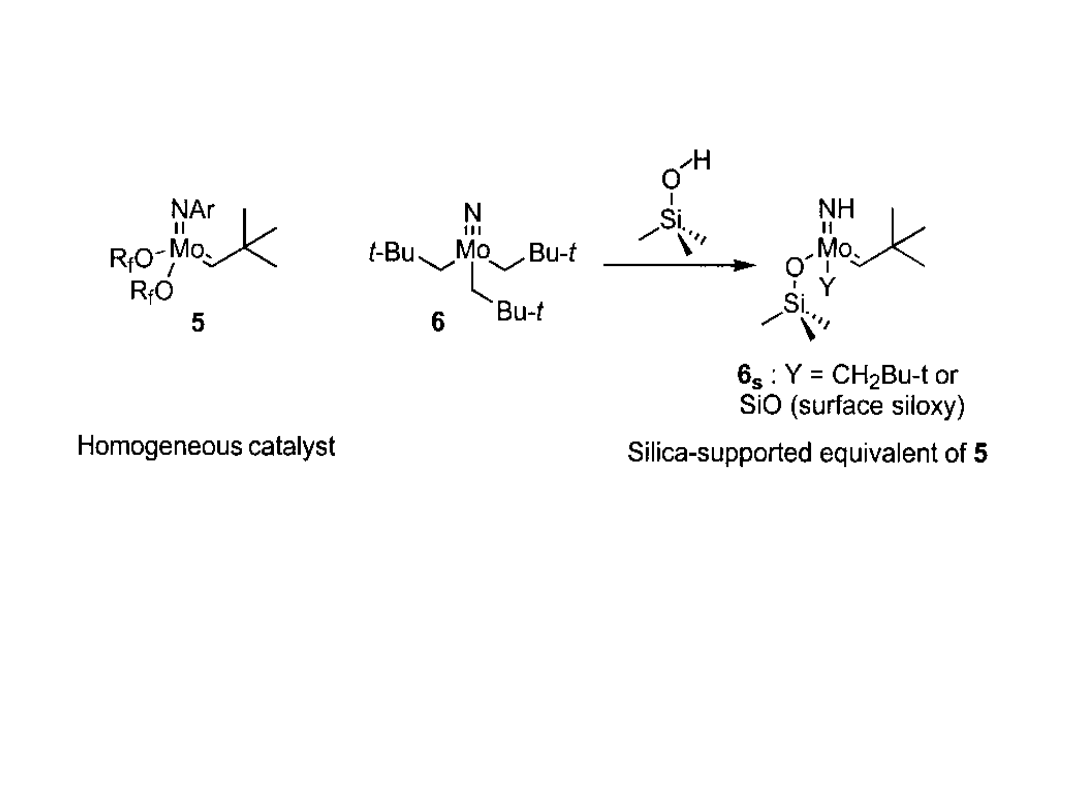
Przykłady katalizatorów heterogenizowanych
w metatezie alkenów
Bardzo aktywny katalizator metatezy został opracowany przez Schrock’a
(5). Jego analog powierzchniowy (6
s
) uzyskuje się w reakcji kompleksu
azotkowego (6) z hydrofilową krzemionką. Jest on niestety mniej aktywny
niż jego homogeniczny analog (obecność nie podstawionej grupy iminowej
redukuje elektrofilowość metalu w kompleksowaniu olefiny).
Kataliza heterogeniczna – spojrzenie w przyszłość
Jeszcze niedawno katalizatory heterogeniczne i heterogenizowane
stosowane były głównie przemyśle rafineryjnym ropy naftowej i produkcji
wiekotonażowej.
Obecnie, ze względu na przepisy o ochronie środowiska zaznacza
się wyraźny trend do wprowadzania czystych, katalitycznych technologii
także w syntezie produktów specjalistycznych (fine chemicals).
Przyszłość
1. Poprawienie selektywności przez dodatek modyfikatorów (np. dodatek
bizmutu
w katalizowanych metalami szlachetnymi reakcjach utlenienia)
2. Lepsze poznanie mechanizmów reakcji i roli chiralnych układów
promujących
katalizę enancjoselektywną
3. Procesy katalityczne w wodzie lub układach wodno-organicznych
(kataliza na
granicy faz). Na przykład triflaty lantanowców są bardzo dobrymi
katalizatorami typu
kwasów Lewisa w środowisku wodnym
4. Integracja różnych procesów katalitycznych przez stosowanie
wielofunkcyjnych
katalizatorów
5. Wykorzystanie materiałów naturalnych jako rusztowań do
zamocowania układów
katalitycznych (pochodne wanadu na fitazie [białko] – nowym
enancjoselektywnym
katalizatorem utleniania.
Kataliza enzymatyczna
Enzymy są „końmi roboczymi” komórki. Łączą one wszystkie zawarte w niej cząsteczki. W
komórce zachodzą tysiące reakcji chemicznych o podstawowym znaczeniu. Żadna z nich nie
może zachodzić bez katalizy enzymatycznej.
Ze względu na stosunkowo niską temperaturę w systemach żywych, czas ich trwania byłby
zbyt długi bez pomocy enzymów.
Kataliza enzymatyczna jest kosztowna. Stanowi 10% udziału układów
katalitycznych stosowanych w przemyśle na świecie.
ZALETY:
1. Skuteczność 100 – 10
12
razy szybsze niż w katalizie tradycyjnej
2. Łagodne warunki reakcji
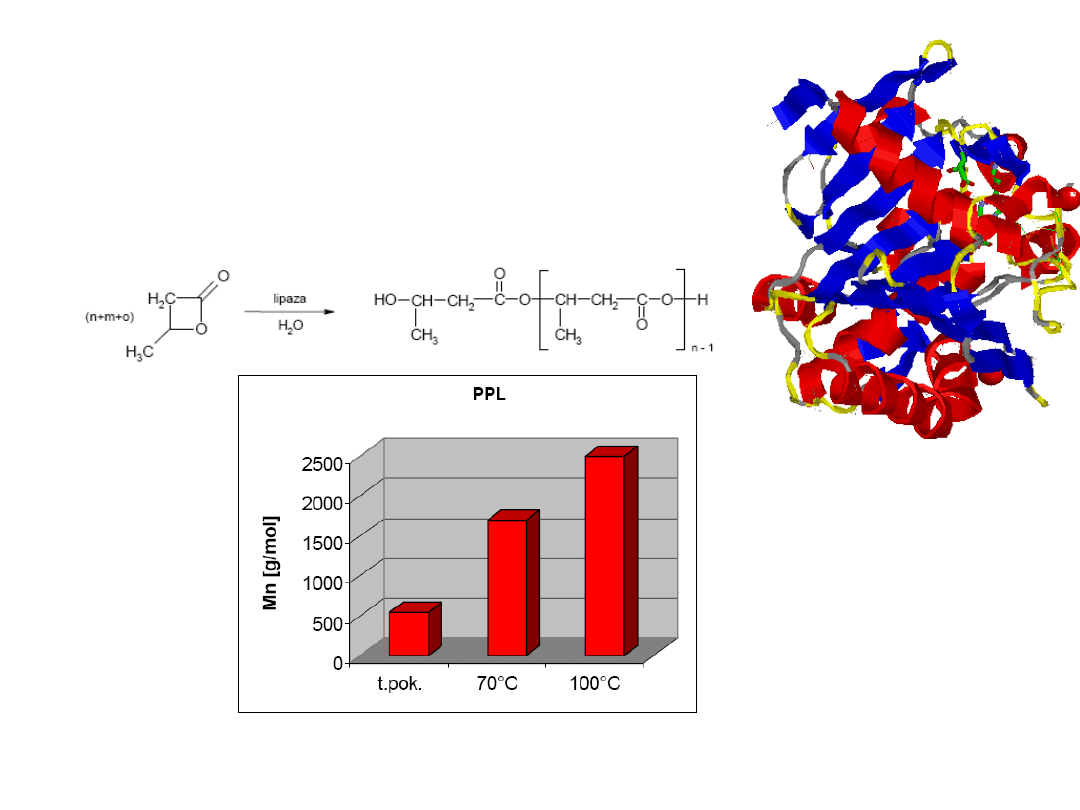
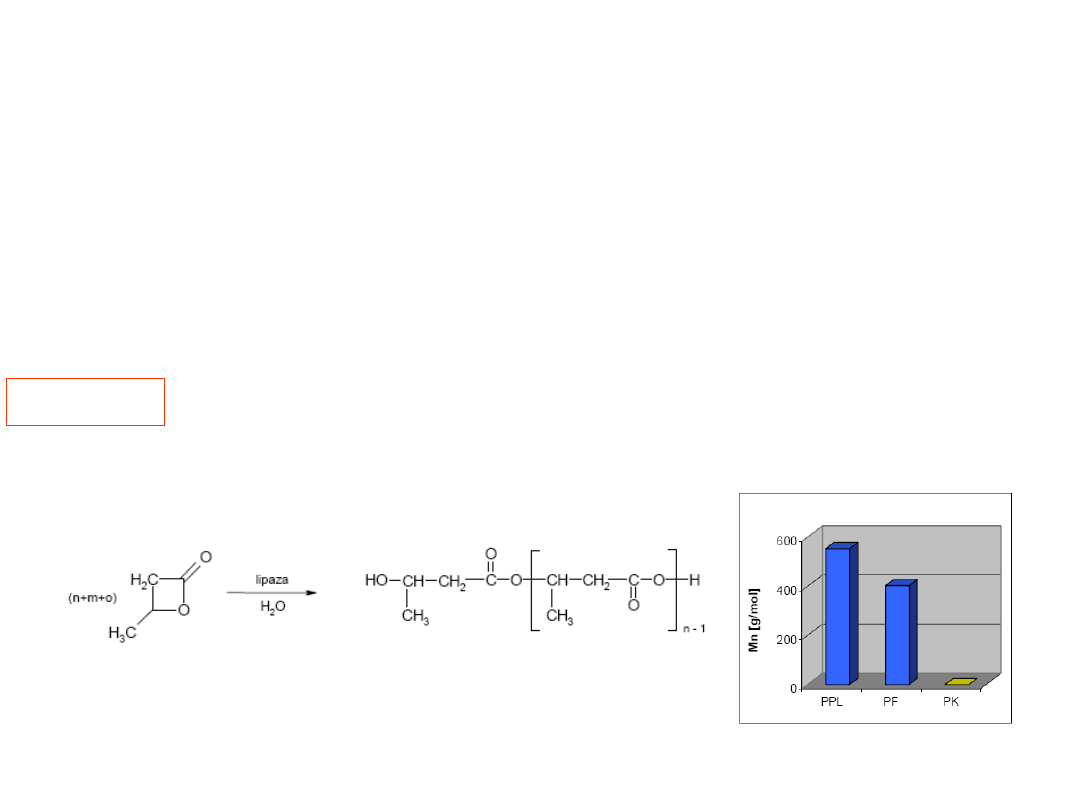
Kataliza enzymatyczna. Lipaza
Lipaza jest enzymem, który hydrolizuje
wiązania estrowe
Oligokondensacja β-butyrolaktonu wobec 1%
wagowego enzymu
Dla reakcji prowadzonej w masie (bez rozpuszczalnika) temperatura wzrost
temperatury zwiększa średnią masę cząsteczkową oligoestrów a w 70 i 100
o
C
konwersja wynosi 100%.
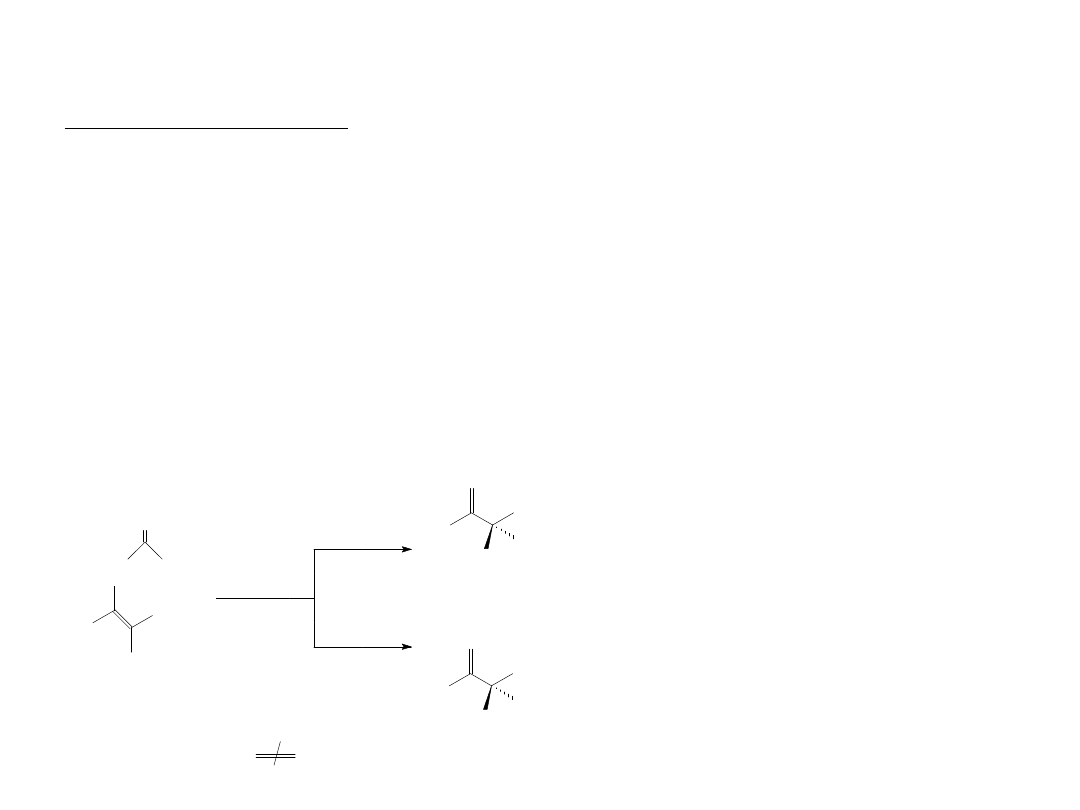
Kataliza enzymatyczna
3. Stereospecyficzność
Enancjoselektywność.
Enancjoselektywność. selektywność wykazywana przez enzymy jest najczęściej
wykorzystywaną cechą w syntezie. Enancjoselektywne syntezy przy użyciu
enzymów
realizowane są na przykład na drodze „różnicowania enancjofacjalnego”,
polegającego na zdolności enzymu do rozróżnienia dwóch enancjomerycznych
stron
prochiralnego substratu. Atak reagenta następuje preferencyjnie z jednej
strony, co
prowadzi do utworzenia w przewadze jednego enancjomeru.
O
R
1
O
R
4
R
2
R
3
H
2
O
hydrolaza
k
1
k
2
R
4
O
R
3
R
4
O
R
3
H R
2
k
1
k
2
H
R
3
Hydroliza podstawionych estrów
enolanowych
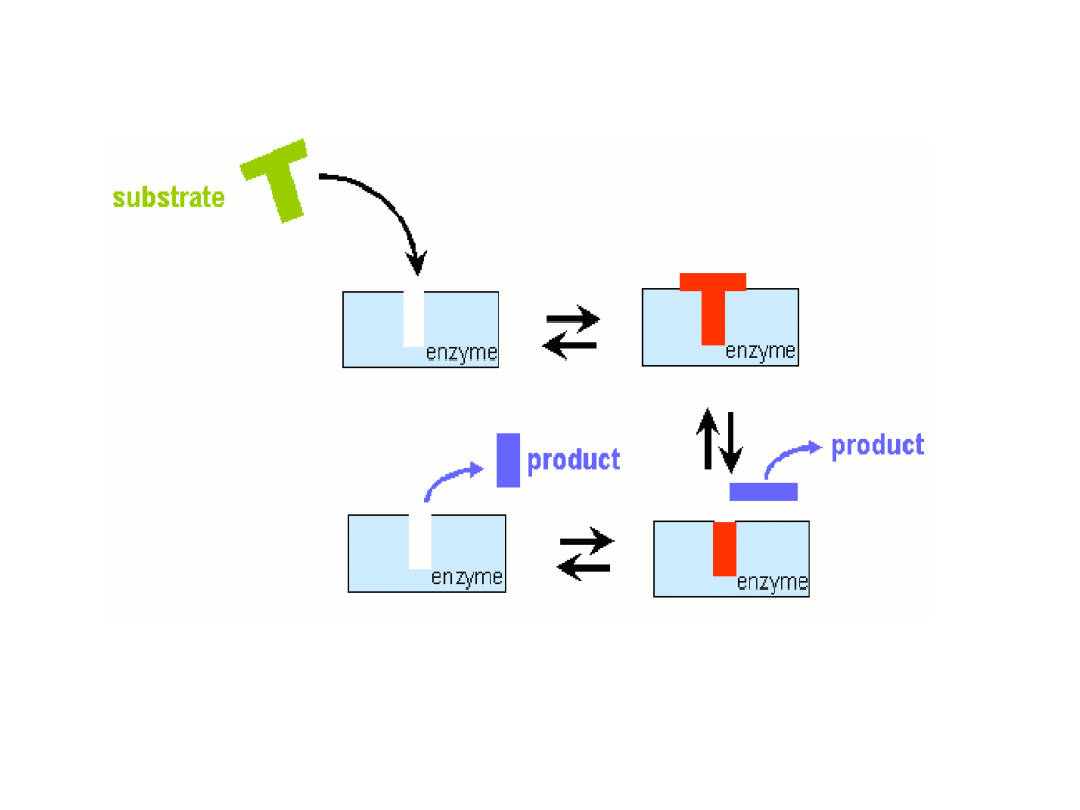
Kataliza enzymatyczna
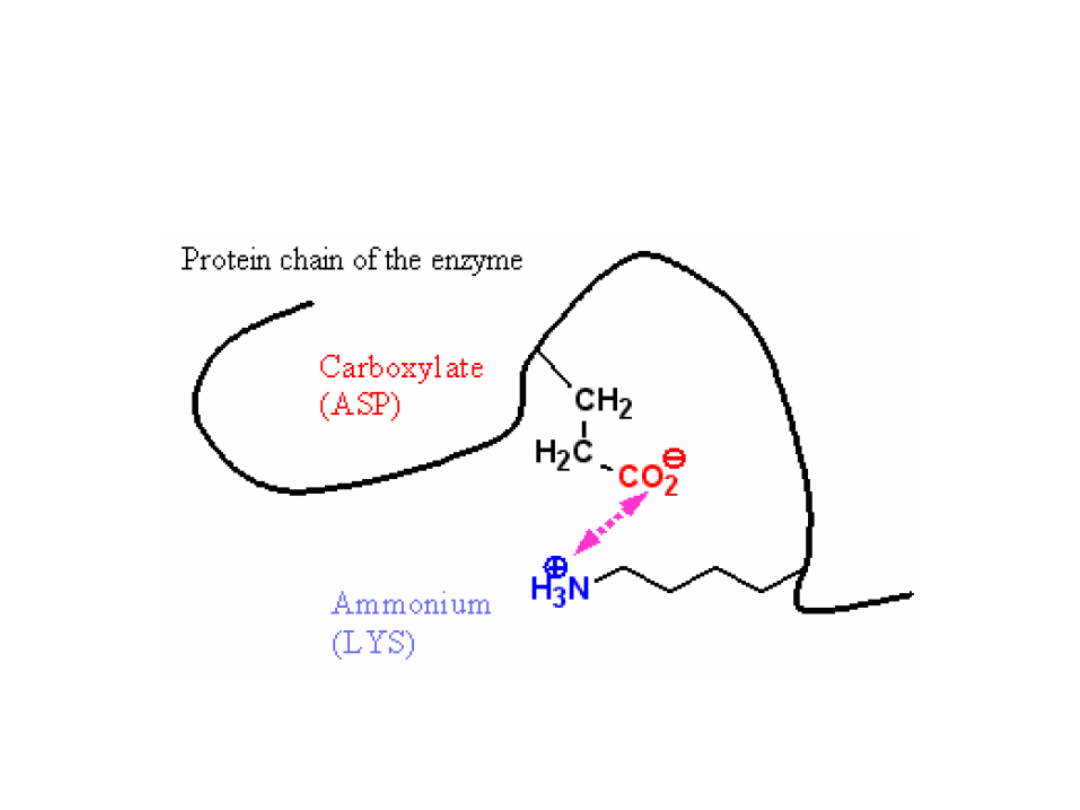
Koordynacja substratu
Oddziaływanie między resztami kwasu asparginowymi i lizyny wynosi ok. 20 kJ mol
-1
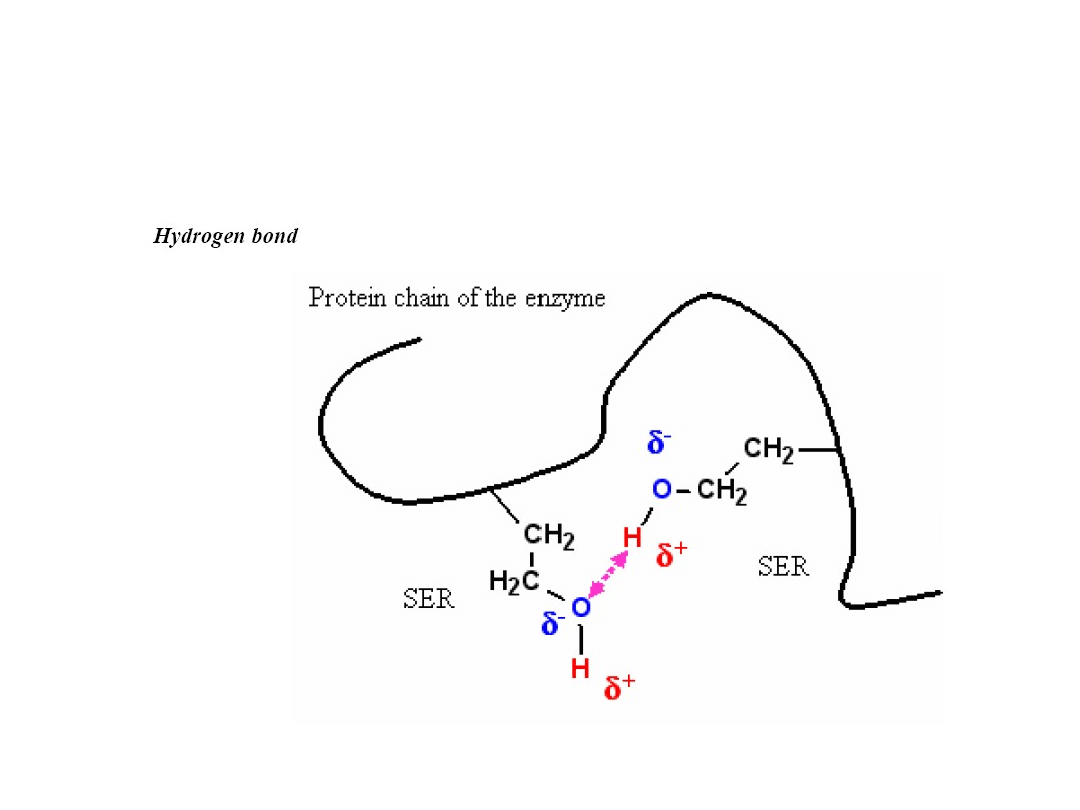
Koordynacja substratu
Oddziaływanie dwóch reszt serynowych. 20-60 kJ mol
-1
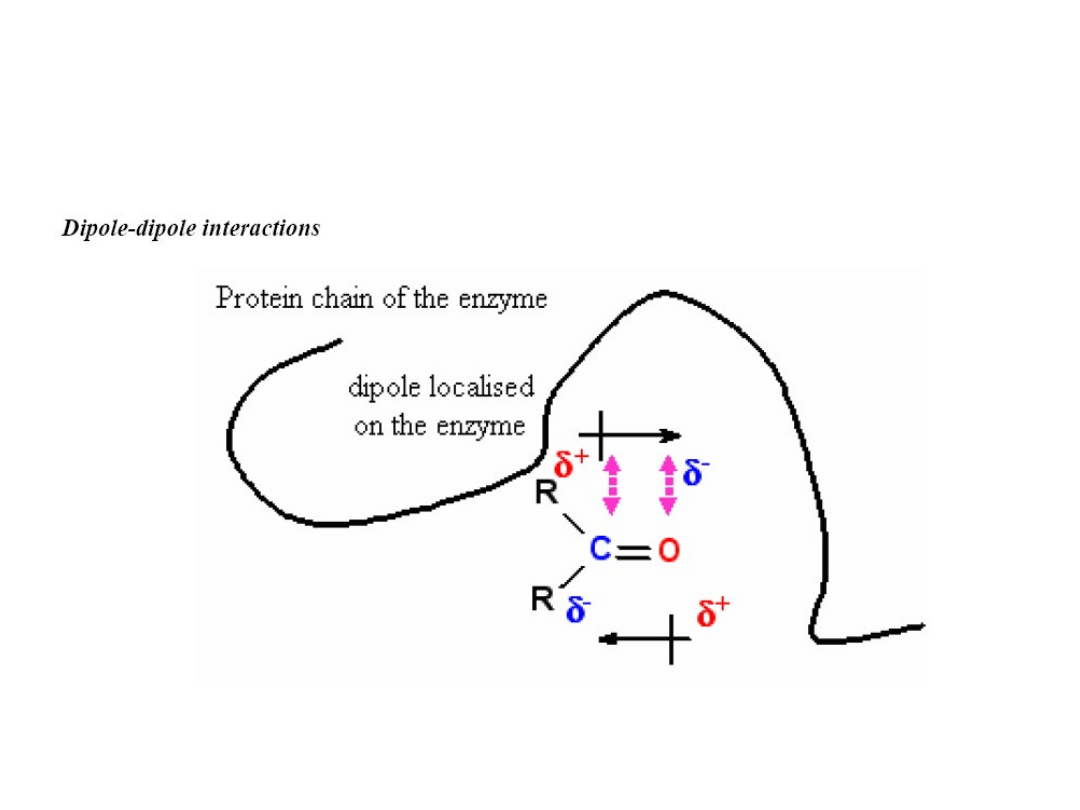
Koordynacja substratu
Czasami dipolarna cząsteczka indukuje dipol w niepolarnej cząsteczce
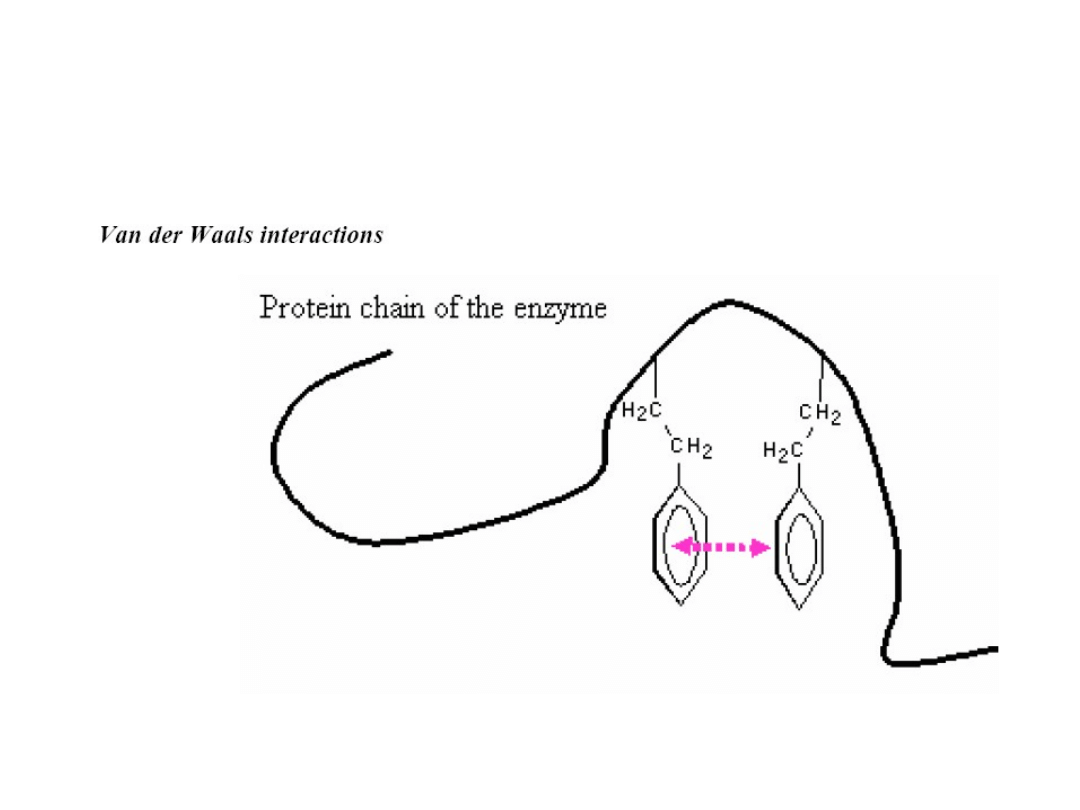
Koordynacja substratu
Oddziaływanie między podstawnikami fenylowymi dwóch reszt
fenyloalaniny. 1-5 kJ mol
-1
.
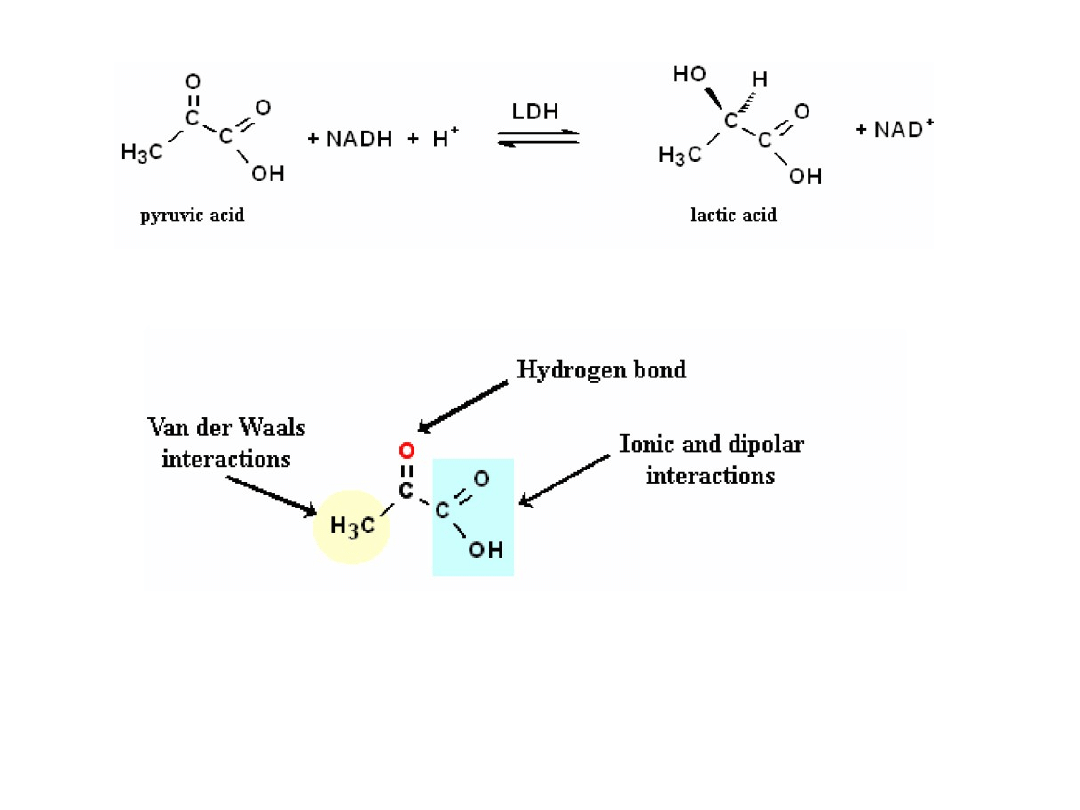
Redukcja wobec LDH
Redukcja kwasu pirogronowego do kwasu mlekowego przez NADH (nicotinamide
adenine dinucleotide) wobec LDH (lactase dehydrogenaze).
Kwas pirogronowy pozostaje związany w matrycy enzymu w wyniku szeregu
Oddziaływań.
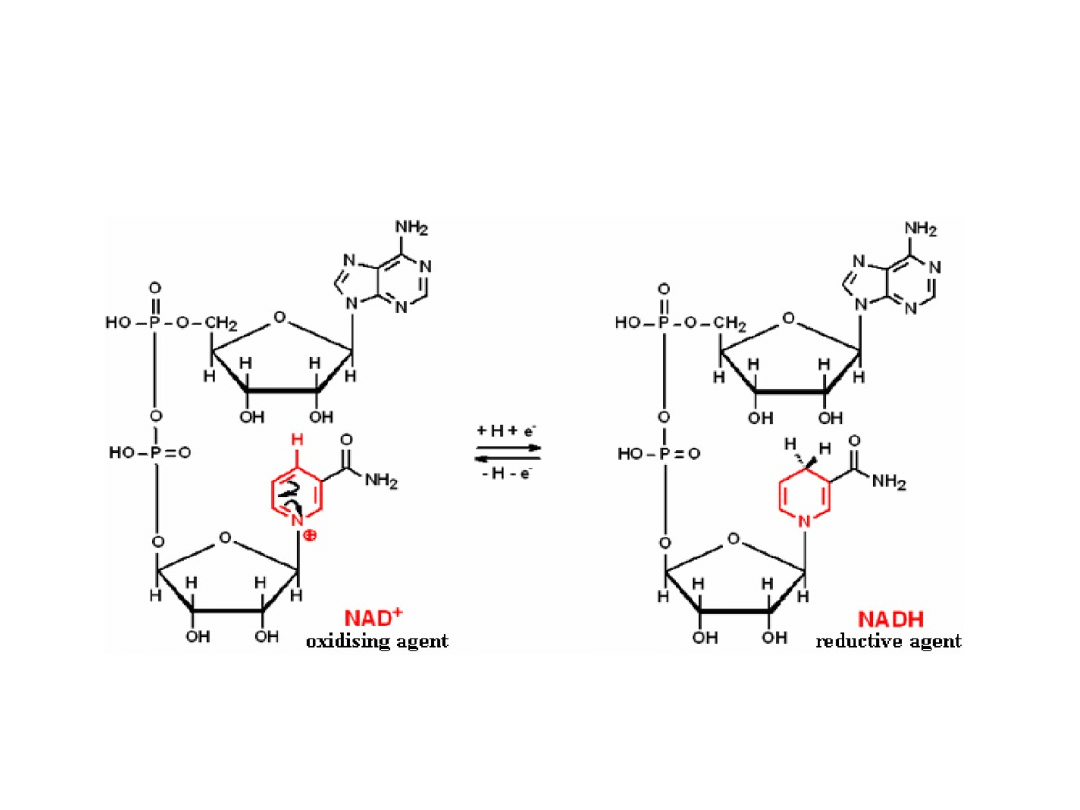
Redukcja NAD
+
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
Wyszukiwarka
Podobne podstrony:
Sprawozdanie 4 GIG B chemia labor, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia
Sprawozdanie 6 GIG B chemia labor, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia
Sprawozdanie 3 GIG B chemia labor, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia
Sprawozdanie I GIG B chemia labor, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia
Grupy inne, Studia, Budownictwo Ladowe i Wodne, Semestr II, Chemia materialow budowlanych, EGZAMIN
Sprawozdanie1 I GIG B chemia labor, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemi
Sprawozdanie 2 GIG B chemia labor, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia
Chemia wyklad I i II (konfiguracja wiÄ…zania Pauling hybrydyzacja wiazania pi i sigma)
Chemia materiałów V
zadania - stężenia, Notatki i materiały dodatkowe, Chemia, materiały od Romka
Laborki 2, Studia, Wytrzymałość materiałów II, Test z laborek wydymalka, lab
Chemia materiałów budowlanych, Studia e Liceum, Chemia, Materiałów budowlanych
quota, !!!Uczelnia, wsti, materialy, II SEM, systemy operacyjne linux
Temat3, Mechanika i Budowa Maszyn PG, semestr 2, Materiałoznawstwo II, laborki
mater. - wskaźniki, chemia, materiały do lekcji
więcej podobnych podstron