Katedra Metaloznawstwa i Technologii
Materiałowych
Zakład Metaloznawstwa i Obróbki Cieplnej
Wykład 3:
KRYSTALIZACJA METALI
FAZY STOPÓW
Krystalizacja
metalu następuje w wyniku
nakładania się na siebie dwóch niezależnych
procesów:
a) tworzenia zarodków fazy stałej
(zarodkowania)
b) rozrostu zarodków
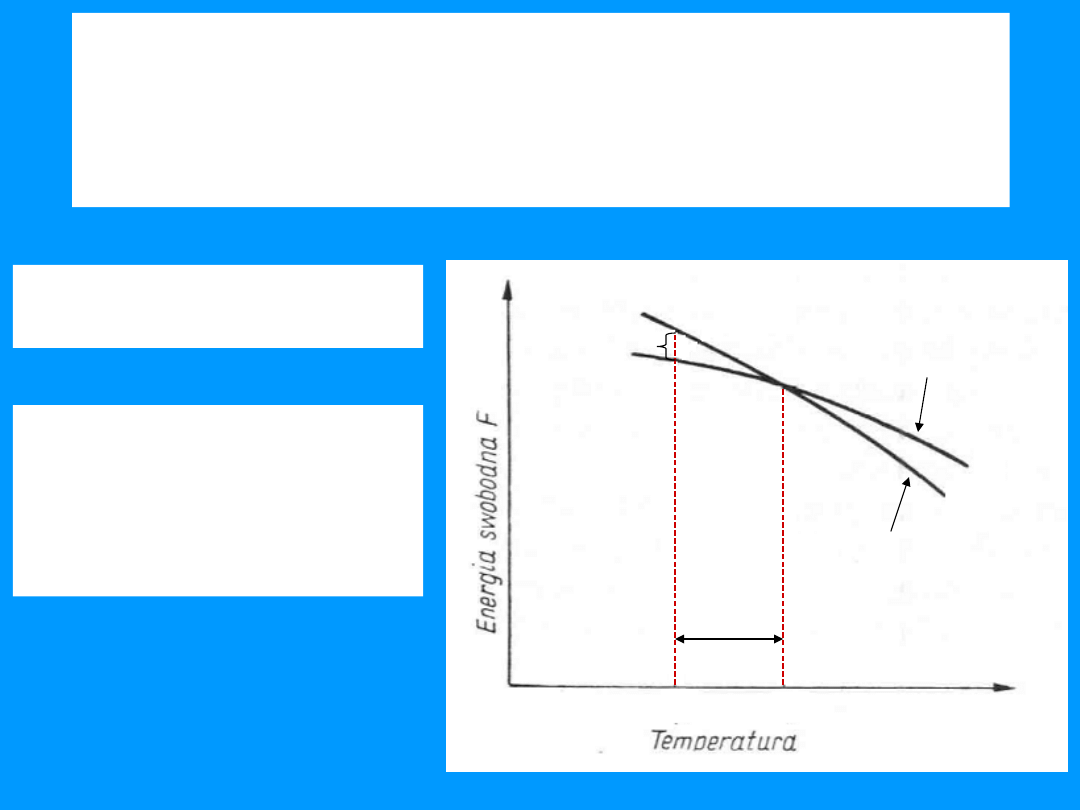
Co jest siłą napędową
procesu krystalizacji?
Siłą napędową procesu
krystalizacji
jest
różnica
pomiędzy
energiami
stanu
stałego i ciekłego.
T
0
stan stały
stan ciekły
T
1
T
F
Temperatu
ry
topnienia
metali:
Al - 660
0
C
Cu - 1083
0
C
Fe - 1538
0
C
W - 3377
0
C
T
0
stan stały
stan ciekły
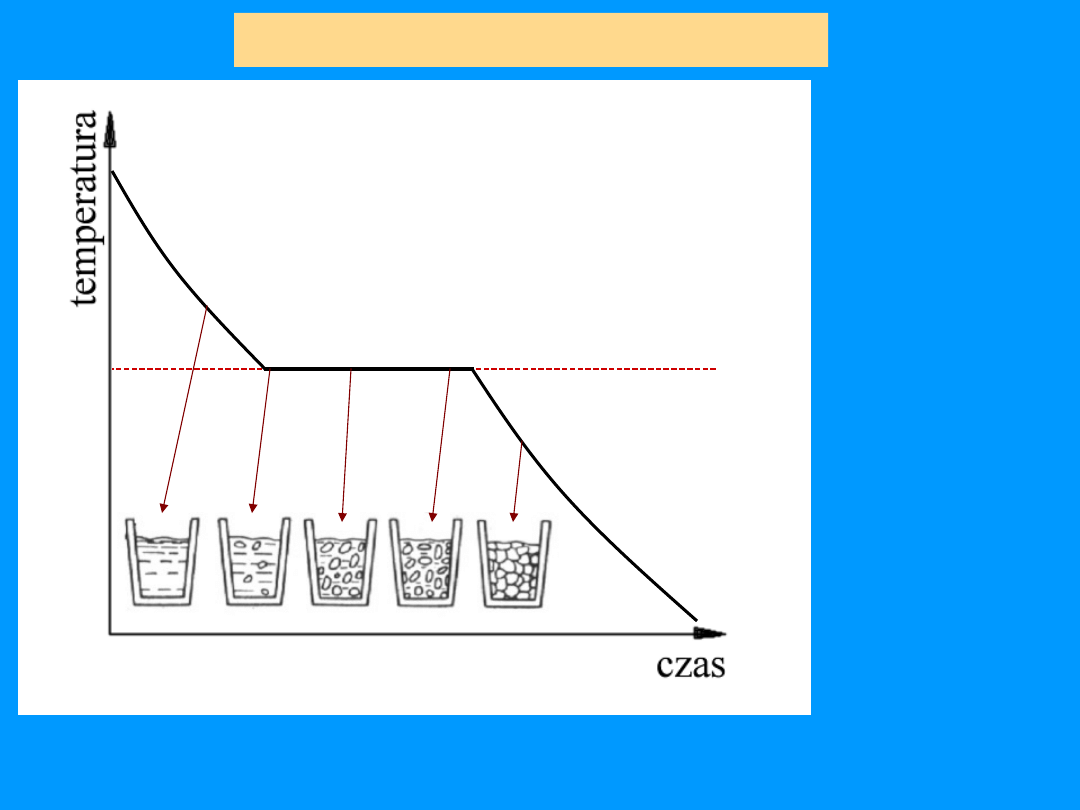
Krystalizacja czystych metali
T
0
stan stały
stan ciekły
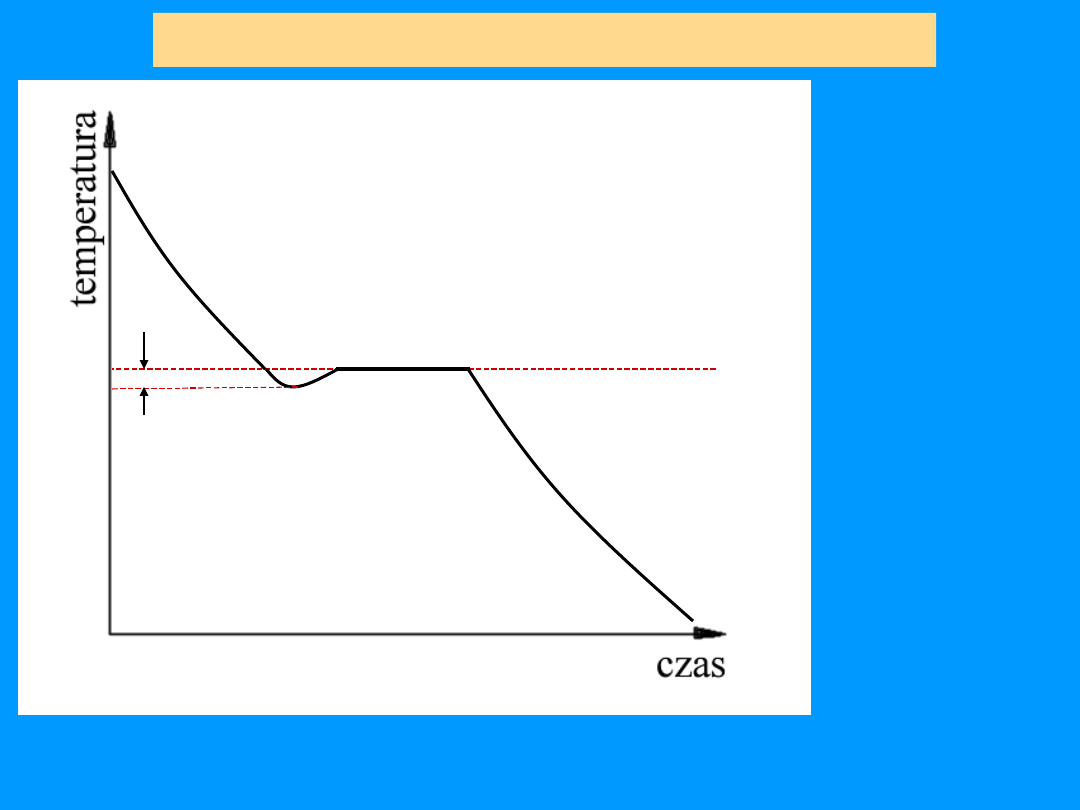
Rzeczywisty przebieg krystalizacji
czystych metali
T
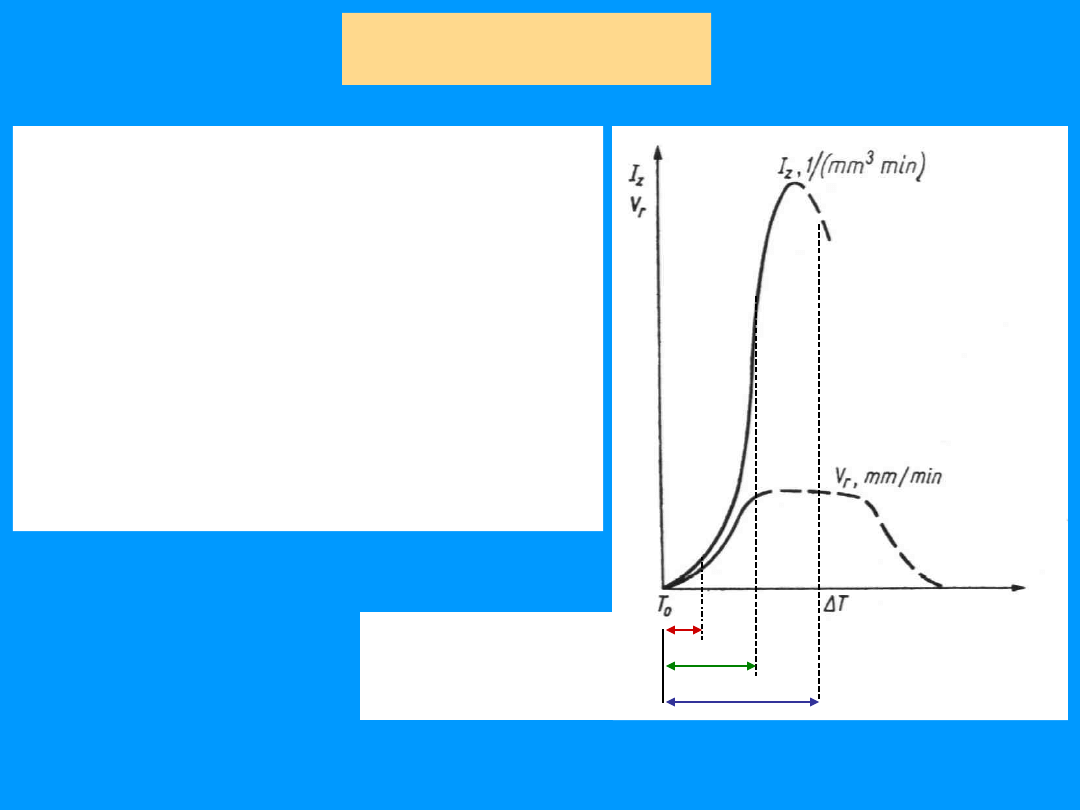
Prawo
Tammanna
Szybkość krystalizacji i
struktura
zakrzepłego
metalu zależą od szybkości
z jaką powstają zarodki fazy
stałej i od szybkości ich
rozrostu, a te z kolei zależą
od wielkości przechłodzenia
T
poniżej
temperatury
równowagowego
współ-
istnienia obu faz T
0
.
struktura gruboziarnista
struktura drobnoziarnista
szkło metaliczne
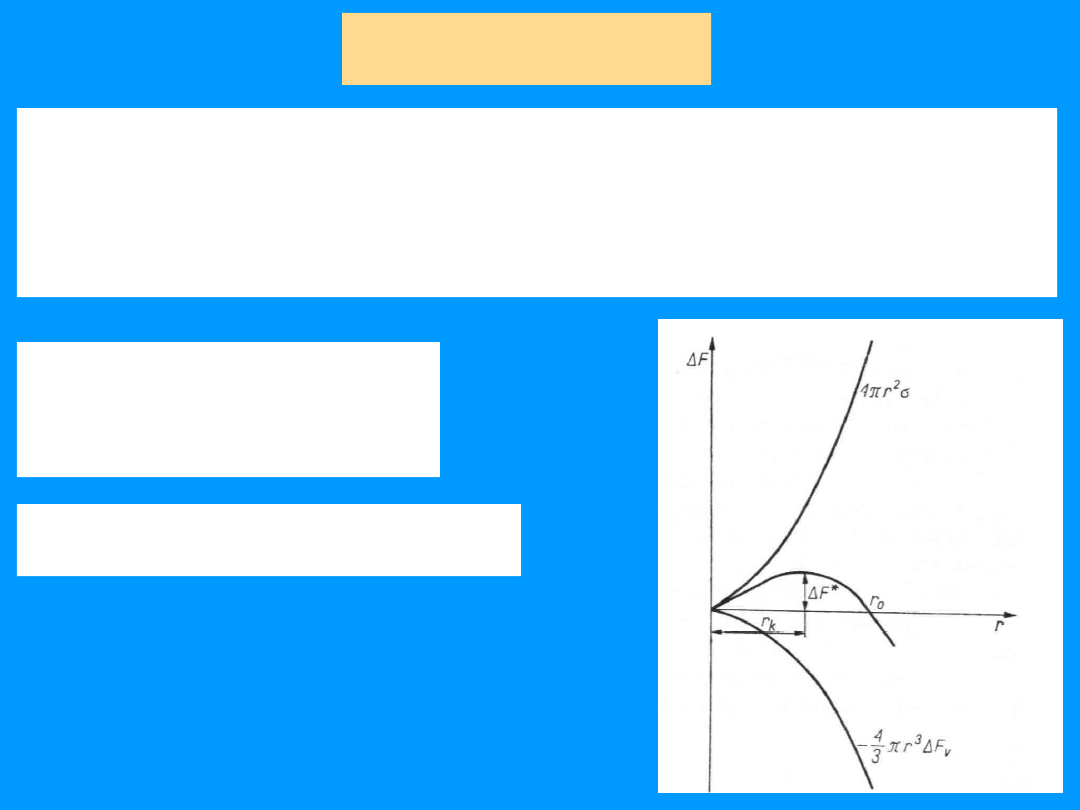
Zarodkowanie
Zarodkami
krystalizacji
nazywamy
kilkusetatomowe skupiska fazy stałej, o typowej
dla
niej
strukturze
krystalicznej,
powstałe
wewnątrz fazy ciekłej, które rozrastając się
powodują stopniowo przechodzenie fazy ciekłej w
fazę stałą.
Zarodkowanie
może być:
- homogeniczne
- heterogeniczne
Co to jest zarodek
krytyczny ?
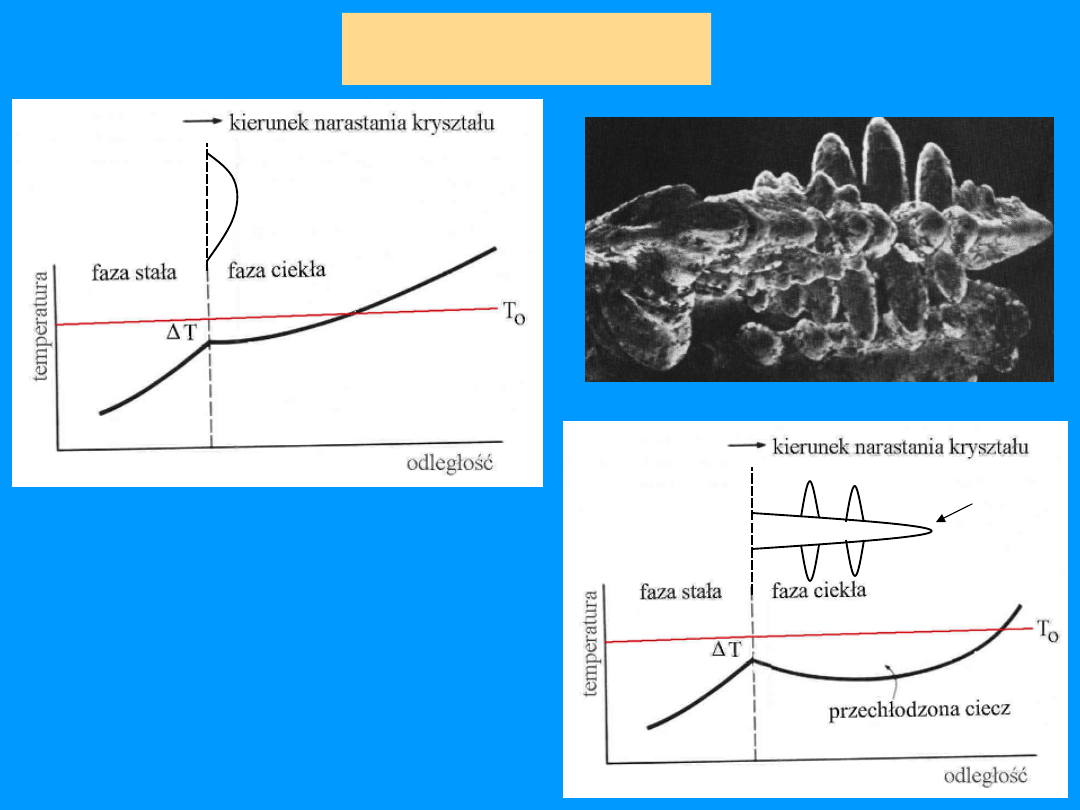
Wzrost
kryształów
dendryt
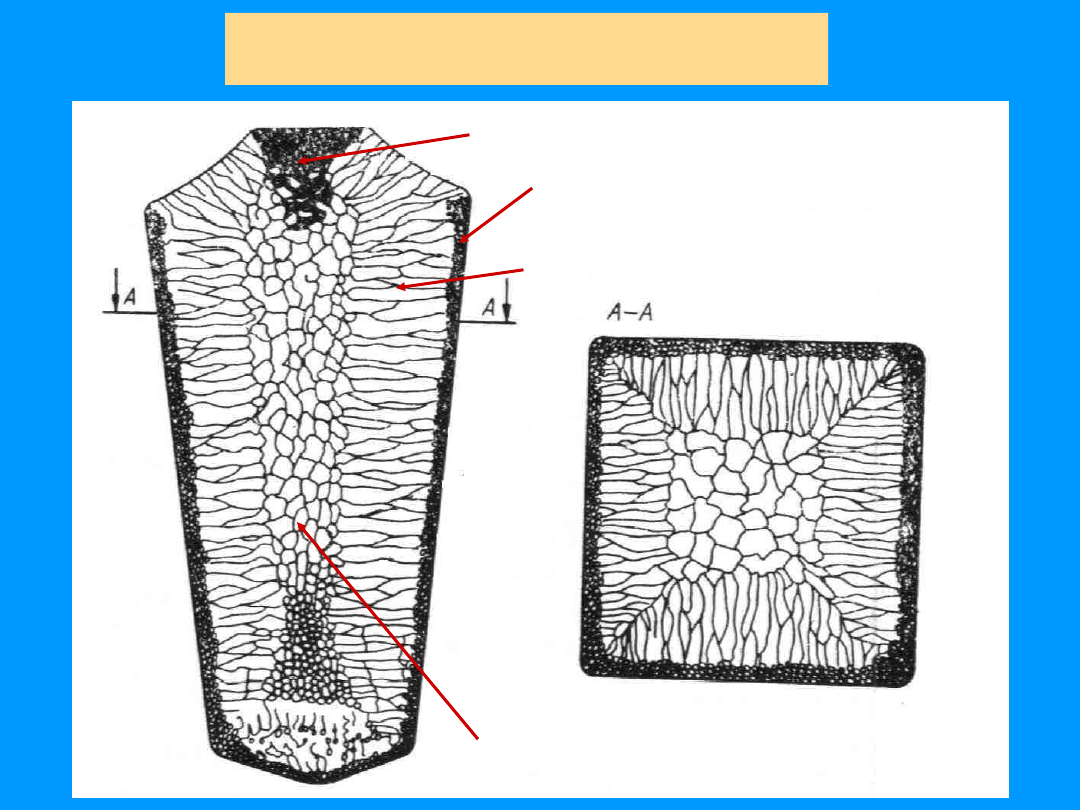
Krystalizacja wlewka
stalowego
strefa kryształów zamrożonych
jama skurczowa
strefa kryształów kolumnowych
strefa kryształów równoosiowych

Zjawiska towarzyszące
krystalizacji
1.
Skurcz
Skurcz różnych metali:
Al 6,5% Fe 3,0%
Cu 4,2% Bi
- 3,3%
2.
Wydzielanie gazów
( H
2
, N
2
, O
2
,
CO , CO
2
)
3.
Segregacja:
- grawitacyjna
-
makroskopow
a
-
mikrosegrega
cja
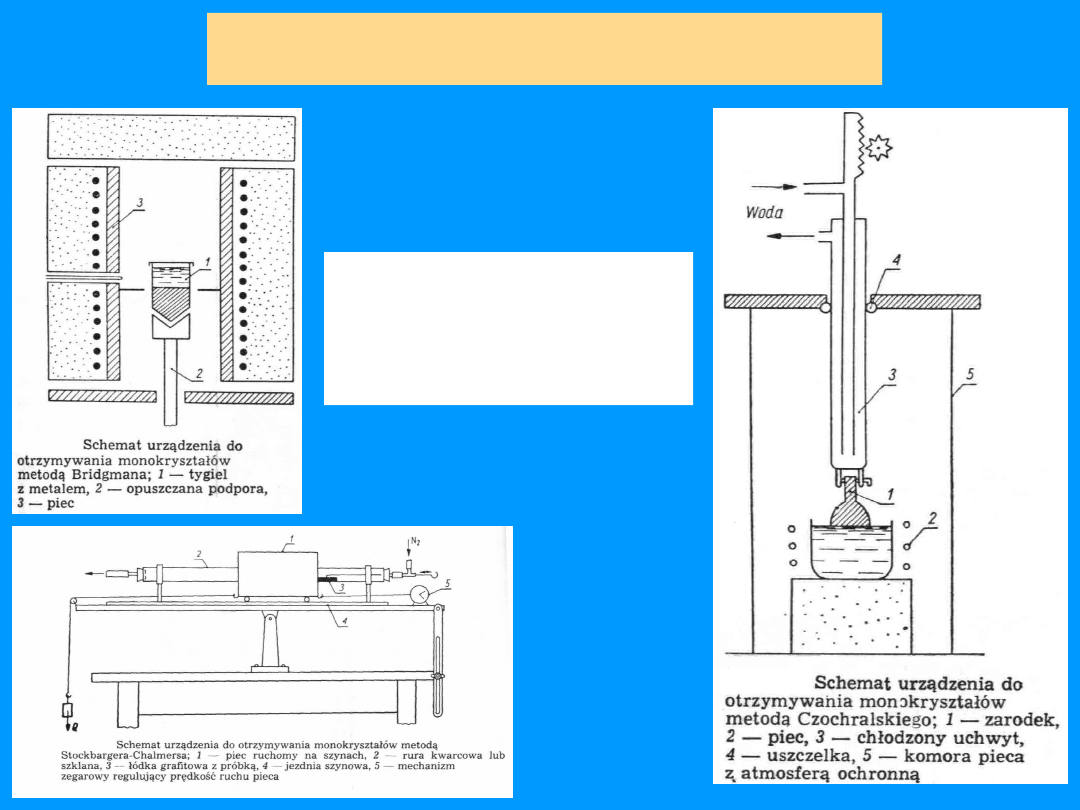
Metody wytwarzania
monokryształów
- Czochralskiego
- Bridgmana
- Stockbergera-Chalmersa

Stopy
Stop
- tworzywo powstałe zazwyczaj przez
stopienie metalu stanowiącego większość z co
najmniej
jednym
pierwiastkiem
zwanym
pierwiastkiem
stopowym.
Celem
dodawania
pierwiastka stopowego jest zmiana struktury i
własności w określonym i zamierzonym
kierunku. Każdy stop składa się z faz.
Składniki stopu
- substancje proste (np.
pierwiastki ) lub związki, które tworzą dany stop.
Faza
- część układu jednorodna pod
względem chemicznym i krystalograficznym,
oddzielona od reszty układu granicą między-
fazową po przekroczeniu której własności
zmieniają się skokowo.
Układ
- zbiór faz.
Równowaga fazowa
- istnieje wówczas gdy w
określonych warun- kach termodynamicznych
stosunki ilościowe między fazami układu
pozostają stałe.
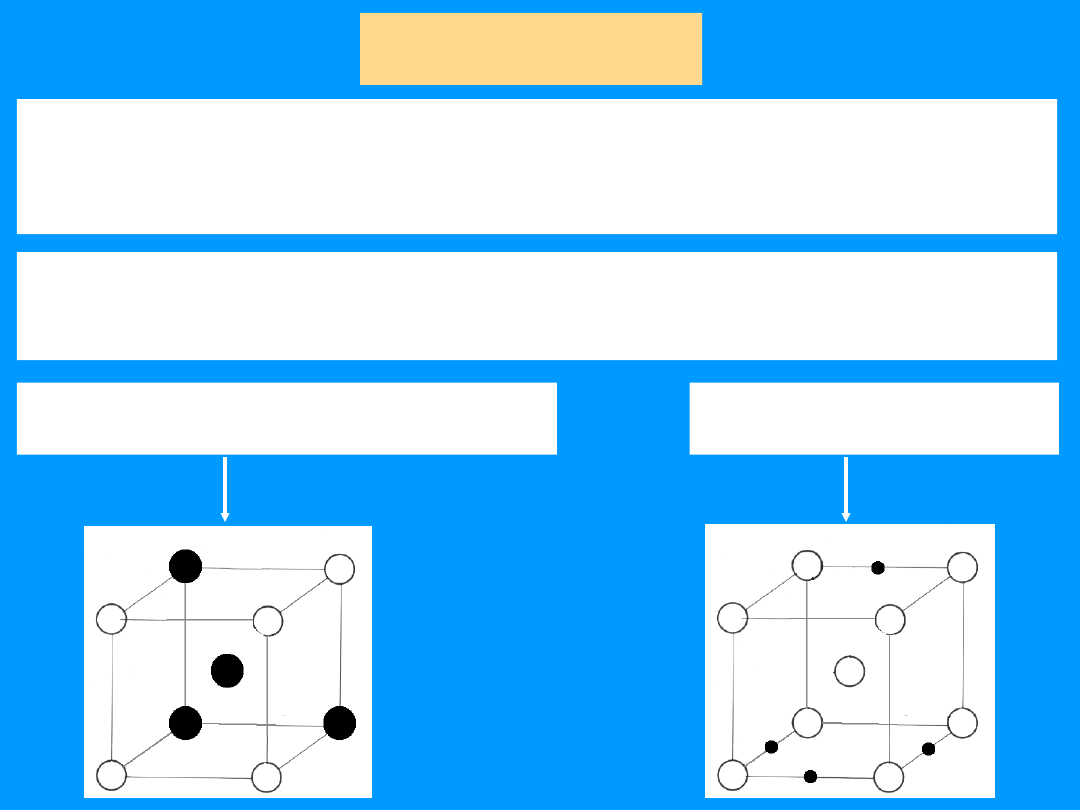
Struktura
stopów
1. Mieszanina kryształów A i B
2. Związek chemiczny lub międzymetaliczny nA +
mB A
n
B
m
3. Roztwory stałe
Roztwory stałe -
są to fazy w których
rozmieszczenie atomów składników A i B jest
całkowicie przypadkowe. Mogą być:
a) różnowęzłowe
( substytucyjne )
b)
międzywęzłowe
Reguła faz
Gibbsa
S = n - f + 1
S
- liczba stopni swobody, czyli liczba czynników
wewnętrznych i zewnętrznych które możemy zmienić
nie powodując zmiany liczby faz w układzie,
n
- liczba
składników stopu,
f
- liczba faz,
p
= const.
T
0
S = 1 - 1 + 1 = 1
S = 1 - 1 + 1 = 1
S = 1 - 2 + 1 = 0
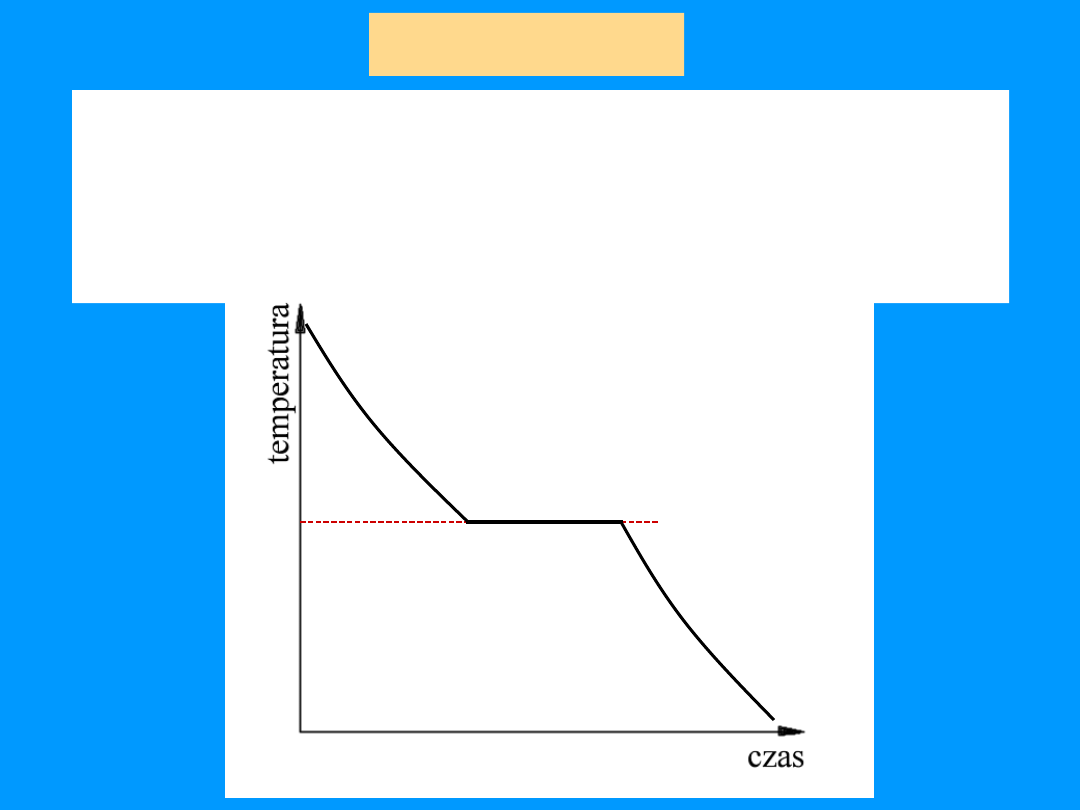
Krzywa chłodzenia czystego
metalu
bez odmian alotropowych
np. Cu, Al
S = 1 - 1 + 1 = 1
S = 1 - 1 + 1 = 1
S = 1 - 1 + 1 = 1
S = 1 - 2 + 1 = 0
S = 1 - 2 + 1 = 0
S = 1 - 2 + 1 = 0
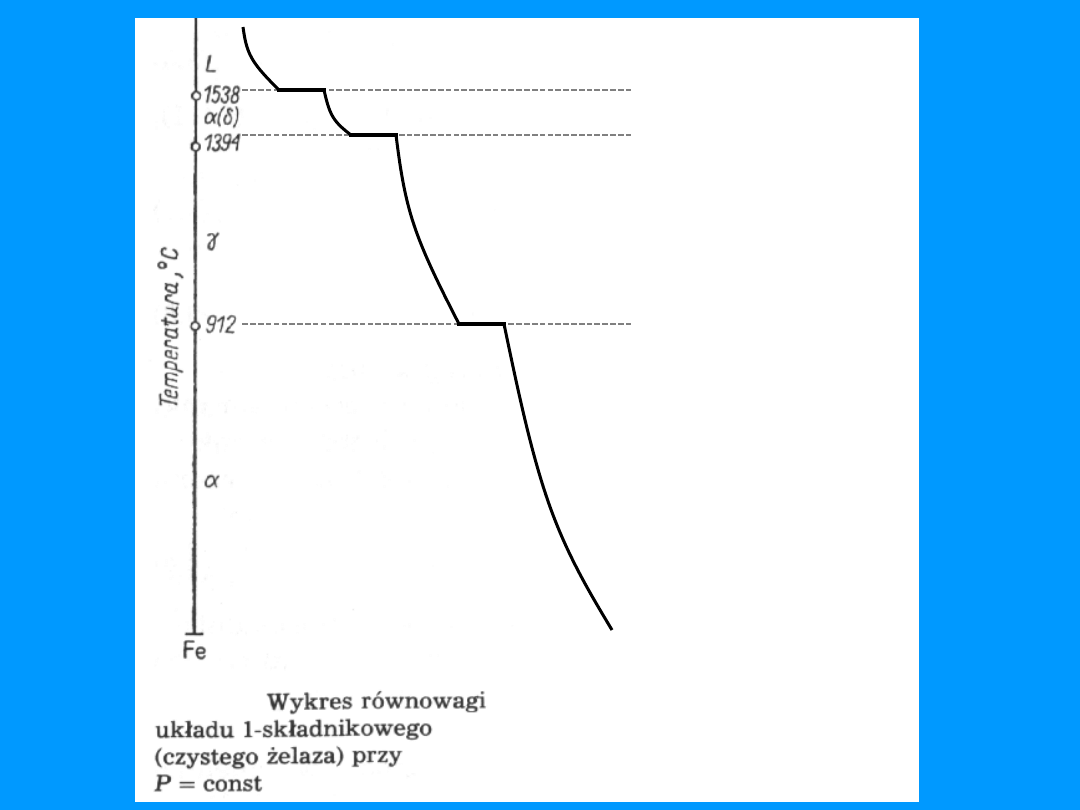
Krzywa chłodzenia czystego
metalu
posiadającego odmiany
alotropowe
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
Wyszukiwarka
Podobne podstrony:
wykład+nr+4+ +Wykresy+równowagi+fazowej+stopów
wykład+nr+5+ +Wykresy+równowagi+fazowej+stopów+c d
wykład+nr+11+ +Stopy+metali+nieżelaznych+c d
wykład+nr+10+ +Stopy+metali+nieżelaznych
wykład+nr+9+ +Stale+stopowe
Krystalizacja Metali i stopow
Wykład nr 4
Wykład nr 7
Wyklad 7 Wlasnosci elektryczne metali
WYKŁAD NR 3 KB2 PŁYTY WIELOKIERUNKOWO ZBROJONE
Wykład nr 5 podstawy decyzji producenta
Hydrologia Wyklad nr 11
wykład+nr+8+ +Obróbki+powierzchniowe
Ochrona Środowiska wykład Nr 1 z dnia 27 streszczenie, ochrona środowiska(1)
Wykład nr 1, materiał♫y z pedagogiki
Biochemia wykład nr 3 kopia
STANDARDY Wyklad nr 2
Wykład nr 7
więcej podobnych podstron