
1
WĘGLOWODANY
Klasyfikacja na podstawie liczby jednostek
Monosacharydy Oligosacharydy Polisacharydy
Klasyfikacja monosacharydów na podstawie
grup funkcyjnych
aldozy ketozy
Klasyfikacja monosacharydów na podstawie
ilości at. C
triozy tetrozy pentozy heksozy
3 4 5 6

2
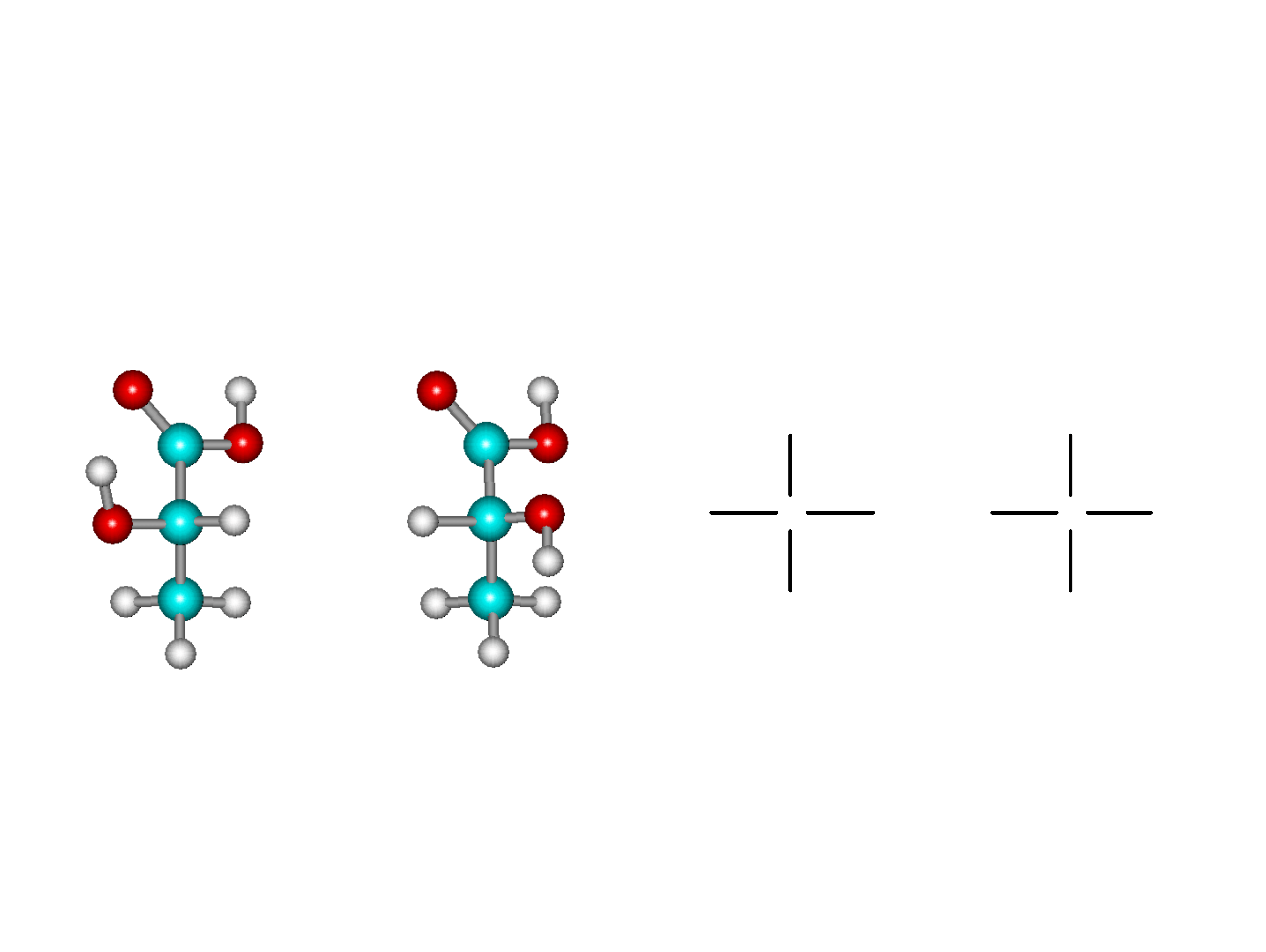
Izomeria optyczna
Izomeria optyczna jest jednym z
przypadków stereoizomerii.
Izomery optyczne różnią się przestrzenną
orientacją podstawników przyłączonych do
chiralnego (asymetrycznego) centrum.
W przypadku węglowodanów chiralnym
centrum jest atom węgla posiadający 4
różne grupy.
3
Izomery optyczne kwasu mlekowego
C
HO
H
COOH
CH
3
C
H
OH
COOH
CH
3
*
*

4
Liczba izomerów optycznych zależy od liczby
chiralnych (asymetrycznych) atomów węgla w
cząsteczce i może być obliczona za pomocą jednego
z podanych wzorów:
2
n
lub 2
n
-1
Gdzie „n” jest liczba chiralnych centrów.
Poza węglem chiralne centra mogą być tworzone
przez atomy innych pierwiastków, które mogą
przyjmować hybrydyzację sp
3
i posiadać 4 różne
podstawniki (krzem, fosfor, azot).
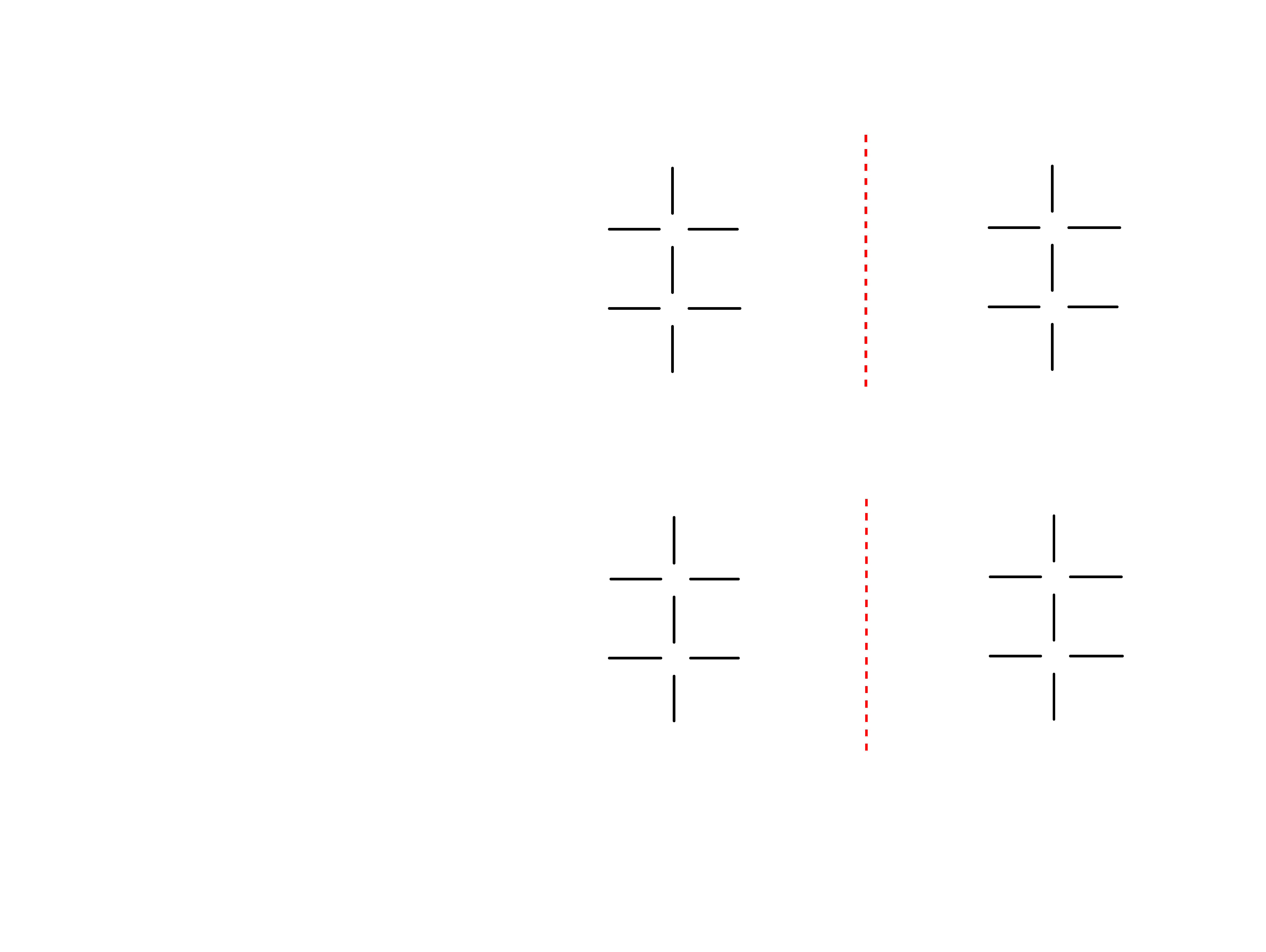
5
C
H
OH
COH
C
CH
2
OH
H
HO
C
HO
H
COH
C
CH
2
OH
OH
H
*
*
*
*
C
H
OH
COH
C
CH
2
OH
OH
H
C
HO
H
COH
C
CH
2
OH
H
HO
*
*
*
*
n = 2
2
2
= 4 izomery
2 pary enancjomerów

6
Enancjomery i diastereoizomery
Izomery optyczne mogą być względem siebie
enancjomerami lub diastereoizomerami.
Enancjomery – para cząsteczek, które mają
odwrotną konfigurację podstawników przy
wszystkich chiralnych centrach. Są względem
siebie odbiciami lustrzanymi.
Enancjomery posiadaja tę samą nazwę
chemiczną.
Enacjomery cukrów i ich pochodnych odróżniamy
poprzez podawanie przed ich nazwą liter L lub D
(konwencja Fischera).
Np. kwas D-mlekowy i kwas L-mlekowy

7
Diastereoizomery są izomerami optycznymi,
które nie są względem siebie enancjomerami.
Diastereoizomery mają inne nazwy chemiczne
mimo posiadania tych samych grup
podstawnikach przy tych samych atomach węgla.
Np. D-glukoza, D-mannoza i D-galaktoza są
diastereoizomerami.
Enancjomery mają takie same temperatury
wrzenia i topnienia, diastereoizomery mają różne.
Zarówno diastereizomery jak i enencjomery są
odróżnia-ne przez cząsteczki innych chiralnych
związków. Np. enzymy (białka) odróżniają L-
glukozę od D-glukozy.
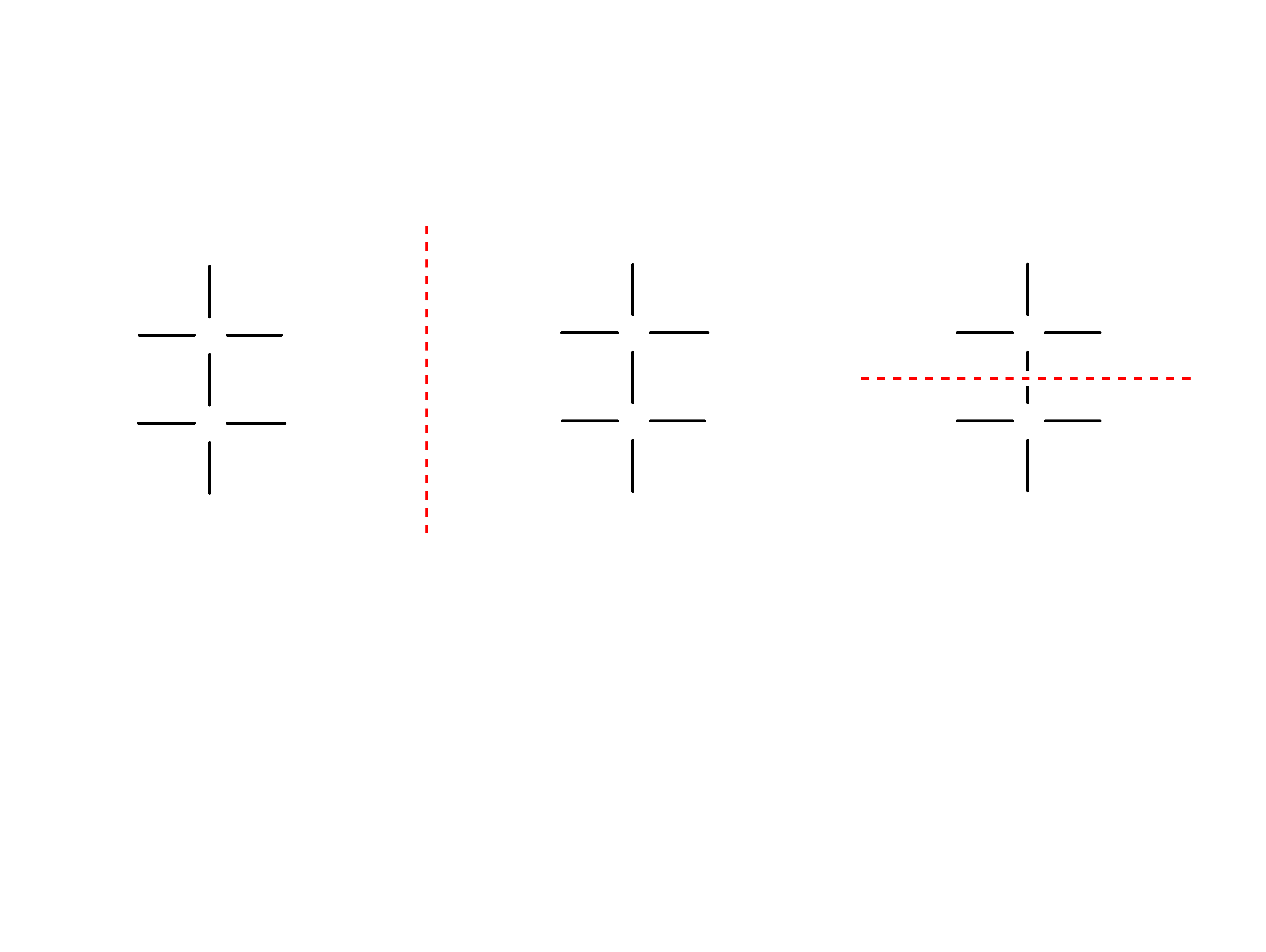
8
C
H
OH
COOH
C
C
H
OH
COOH
C
COOH
COOH
H
OH
H
HO
C
HO
H
COOH
C
COOH
OH
H
*
*
*
*
*
*
Izomery optyczne kwasu winowego
2
2
-1 = 3
1 2
3
1 i 2 są enancjomerami; 3 jest diastereoizomerem
względem 1 i 2.
Izomer 3 jest achiralnym (nieczynnym optycznie)
izomerem nazywanym izomerem typu „mezo”.
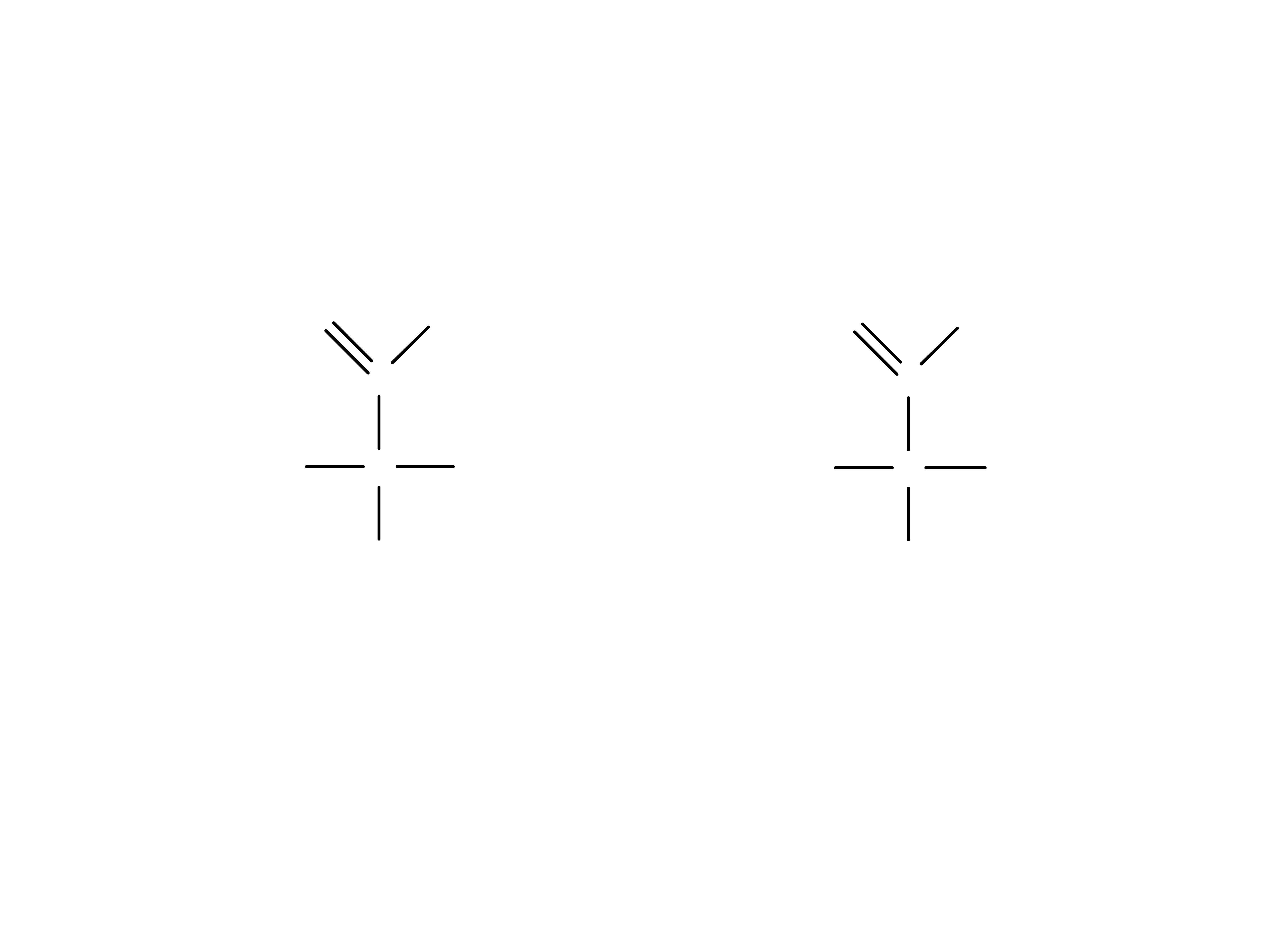
9
Równomolowa mieszanina enencjomerów jest
optycznie nieczynna. Jest to mieszanina
racemiczna.
C
H
OH
C
CH
2
OH
O
H
C
HO
H
C
CH
2
OH
O
H
aldehyd D-(+)-glicerynowy
aldehyd L-(-)-glicerynowy
*
*
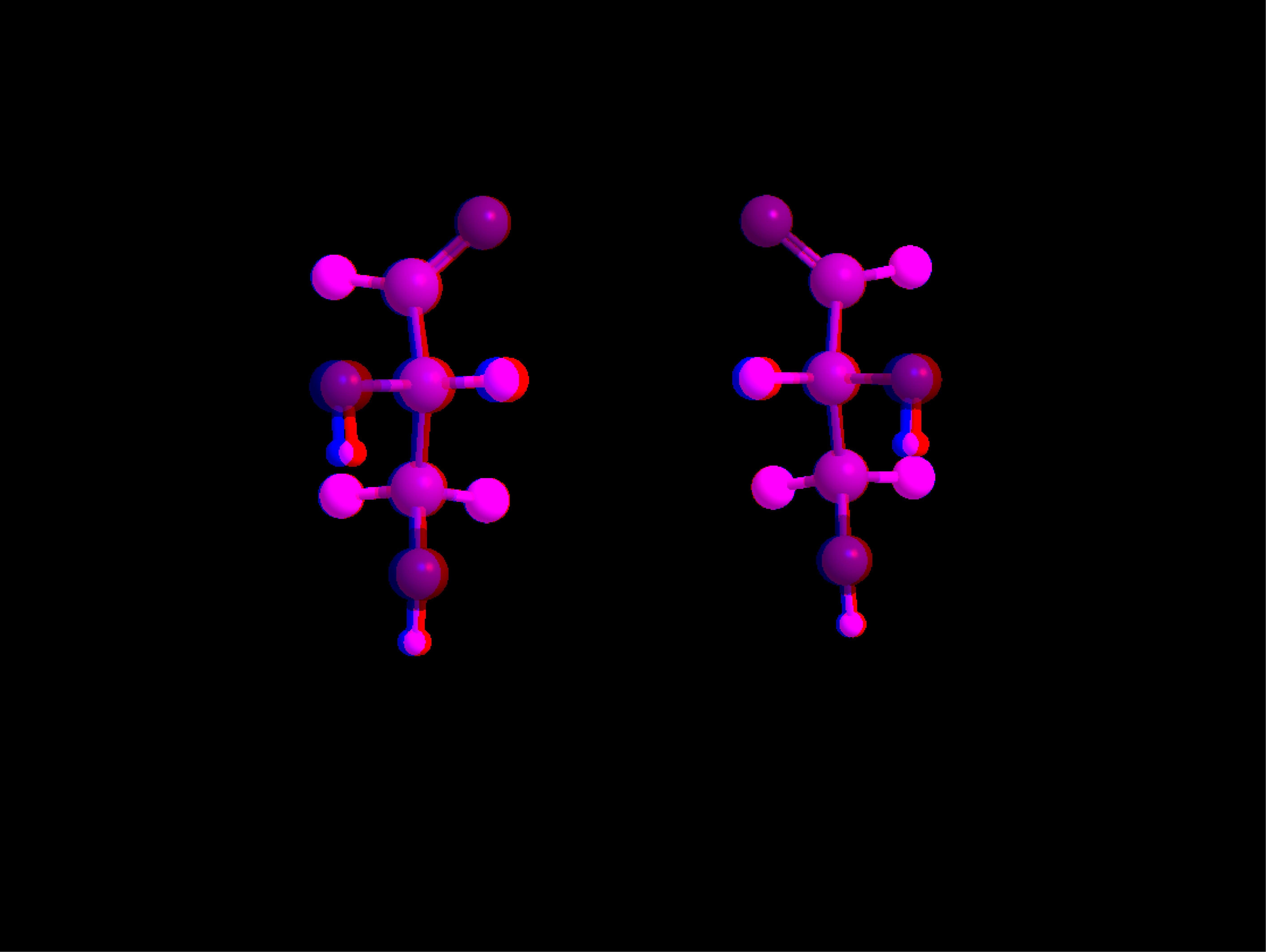
10
L D
11
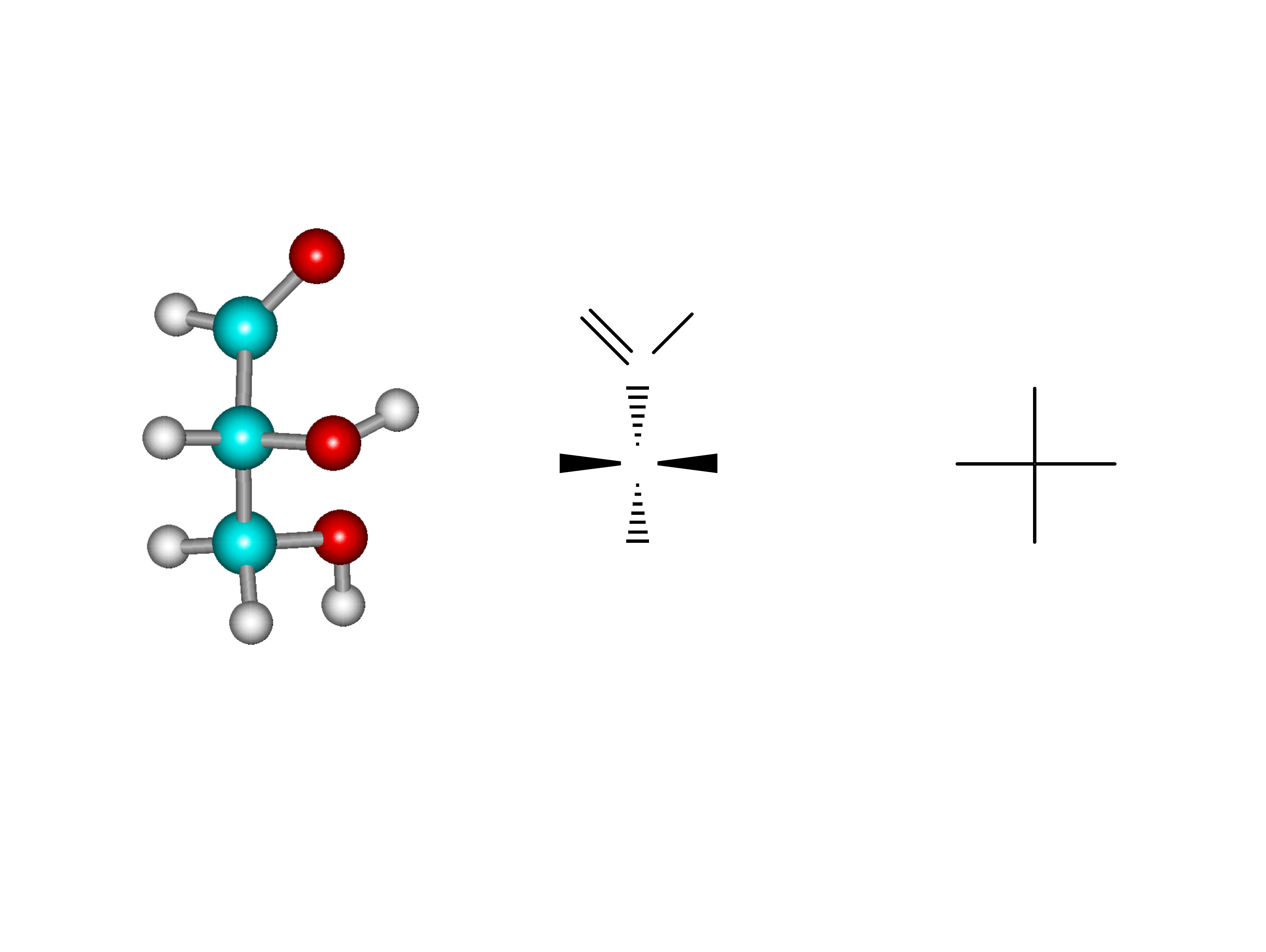
C
H
OH
C
CH
2
OH
O
H
H
OH
CHO
CH
2
OH
*
*
Wzory rzutowe (projekcyjne) Fischera
Model przestrzenny Wzór 3D Wzór
rzutowy
Fishera
12
H
OH
CHO
CH
2
OH
H
CHO
OH
H
HO
OH
H
OH
H
CH
2
OH
HO
CHO
H
OH
H
HO
H
HO
CH
2
OH
*
*
*
*
*
*
*
*
*
1
2
3
4
5
6
#
#
aldehyd D-glicerynowy
D-glukoza
L-glukoza
*
atom chiralny
#
atom konfiguracyjny
#
H
CHO
OH
H
HO
OH
H
H
HO
CH
2
OH
*
*
*
*
1
2
3
4
5
6
#
L-idoza
Szeregi D i L cukrów wg Fishera
13
H
CHO
OH
H
HO
OH
H
OH
H
CH
2
OH
*
*
*
*
1
2
3
4
5
6
#
Formy pierścieniowe monosacharydów
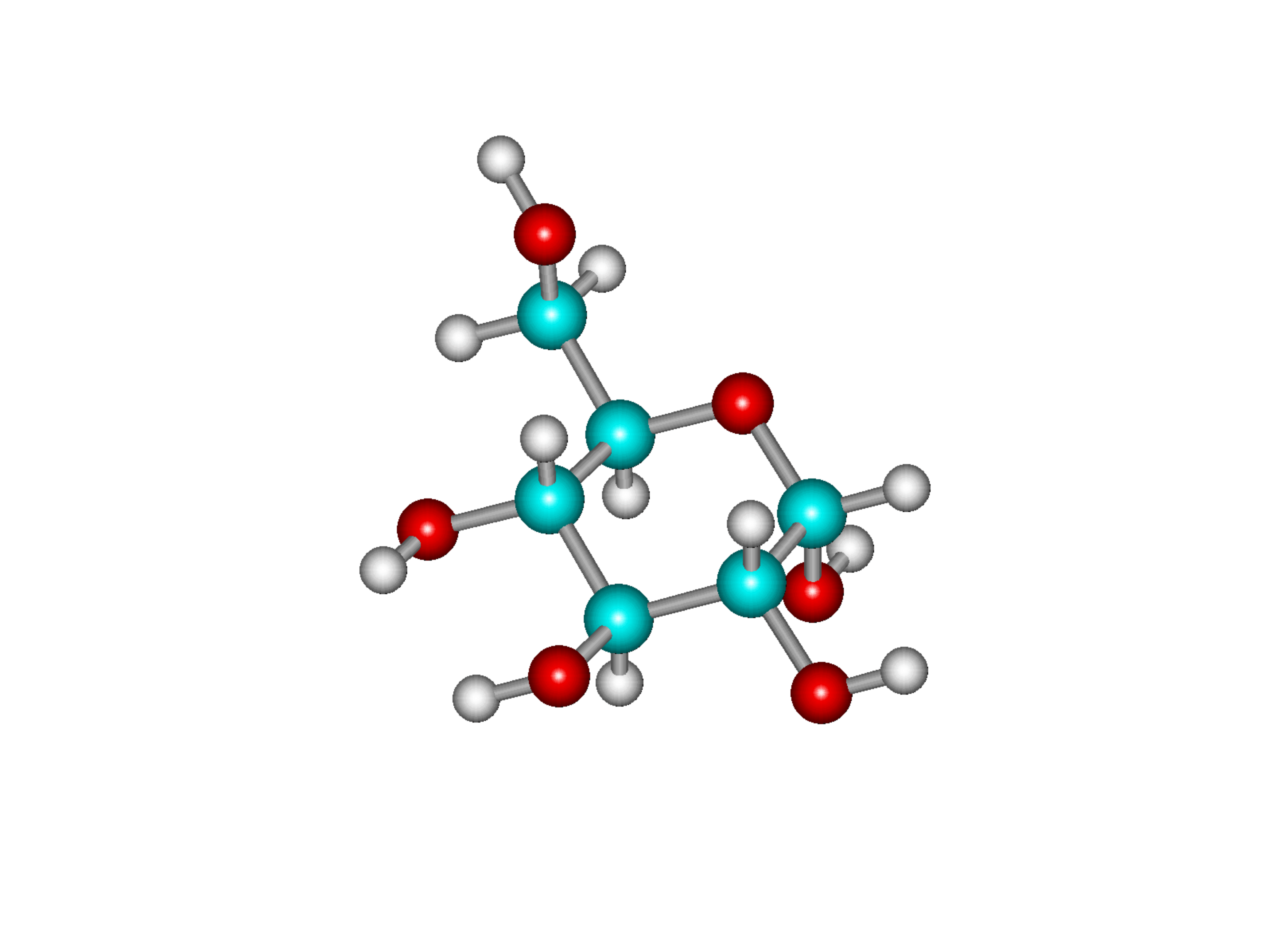
14
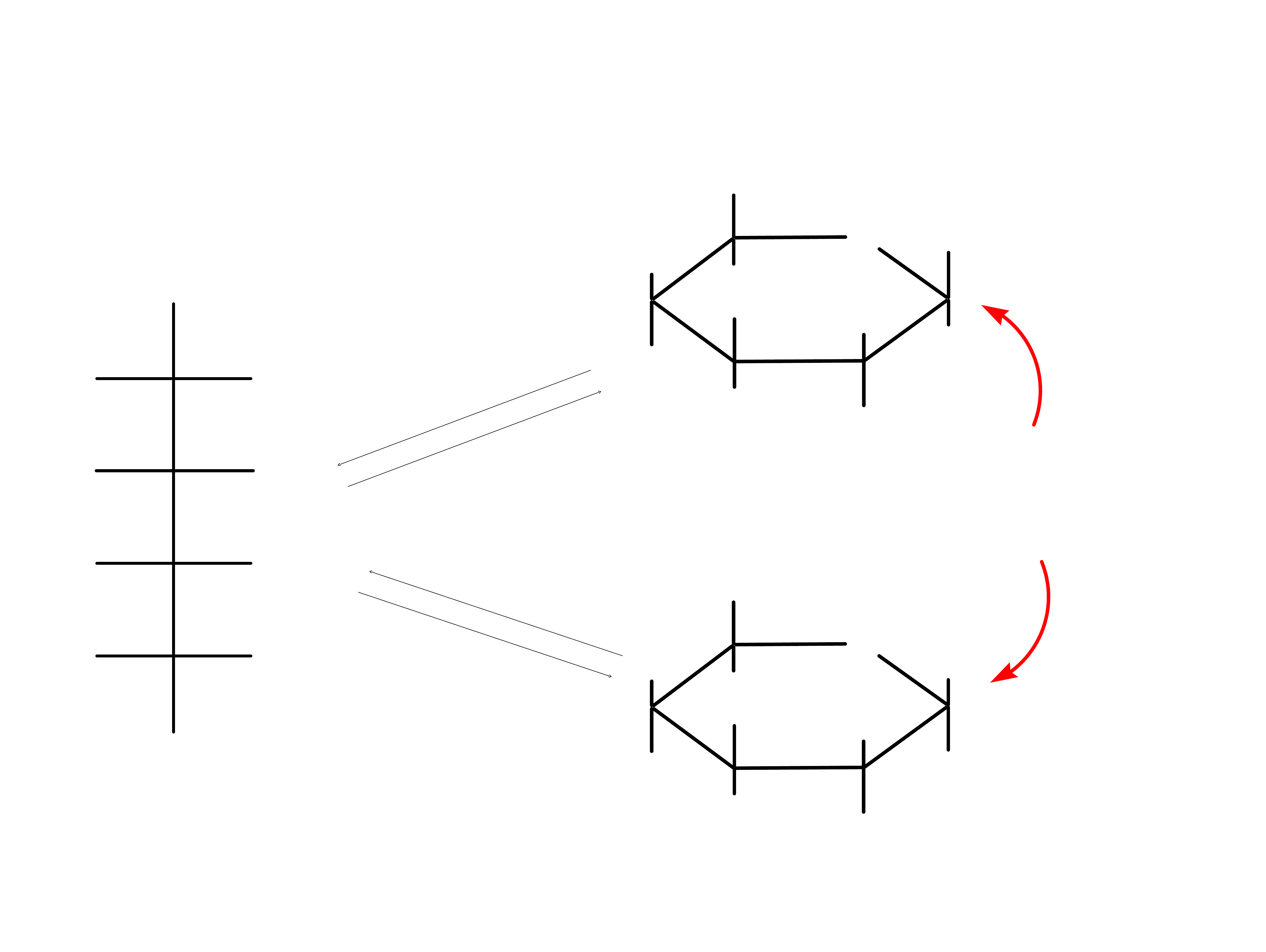
15
O
CH
2
OH
OH
OH
OH
OH
*
*
*
*
*
#
anomer
H
CHO
OH
H
HO
OH
H
OH
H
CH
2
OH
*
*
*
*
1
2
3
4
5
6
#
O
CH
2
OH
OH
OH
OH
OH
*
*
*
*
*
#
anomeryczny
atom wêgla
anomer
Mutarotacja
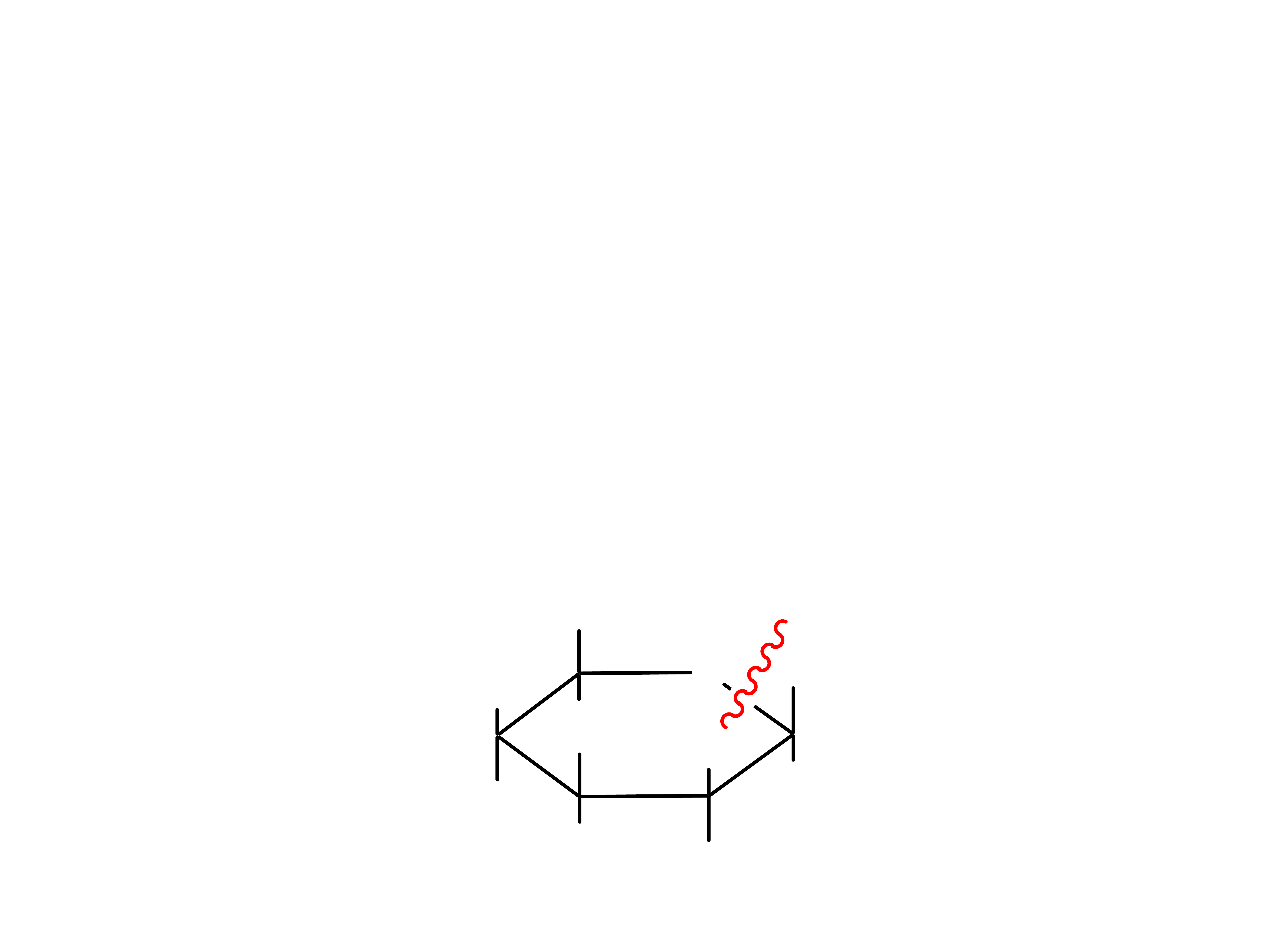
16
Formy α i β nazywamy anomerami.
Mutarotacja jest zmianą skręcalności optycznej
spowodowanej ustalaniem się równowagi
pomiędzy anomerami.
Wiązanie hemiacetalowe jest nietrwałe w
środowisku alkalicznym, a więc pierścieniowe
formy monosacharydów nie mogą istnieć w
wysokim pH.
O
CH
2
OH
OH
OH
OH
OH
OH
-
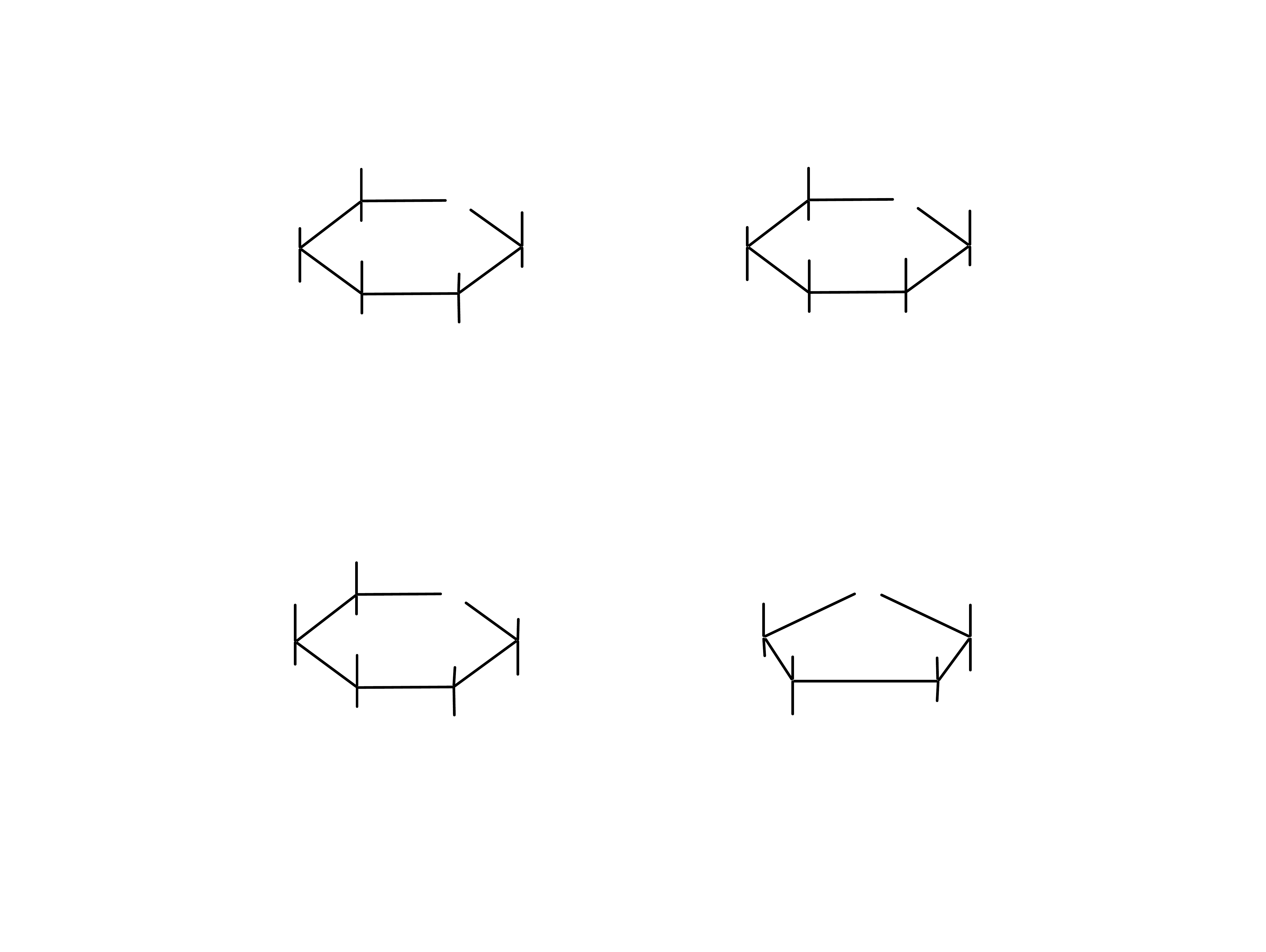
17
O
CH
2
OH
OH
OH
OH
OH
O
CH
2
OH
OH
OH
OH
OH
-D-glukopiranoza
-D-mannopiranoza
O
CH
2
OH
OH
OH
OH
OH
-D-galaktopiranoza
O
CH
2
OH
OH
OH
HO
HOH
2
C
-D-fruktofuranoza
18
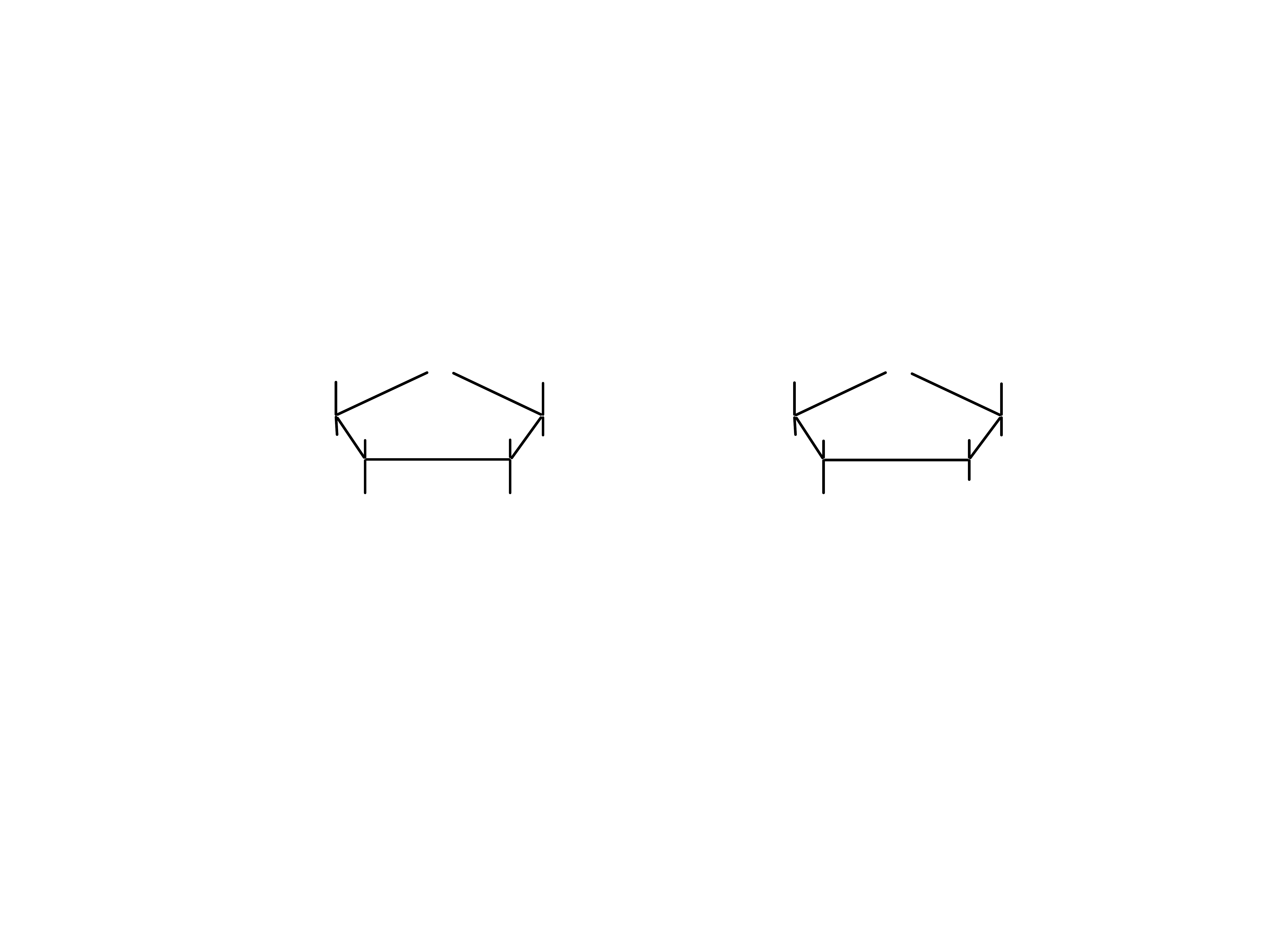
-D-rybofuranoza
O
OH
HOH
2
C
O
OH
HOH
2
C
OH
OH
OH
-D-deoksyrybofuranoza
19
H
CHO
OH
H
HO
OH
H
OH
H
CH
2
OH
H
COOH
OH
H
HO
OH
H
OH
H
CH
2
OH
Br
2
, O
2
H
COOH
OH
H
HO
OH
H
OH
H
COOH
D-glukoza kwas D-glukonowy kwas D-glukarowy
kwasy aldonowe kwasy aldarowe
HNO
3
Cu
2+
, Ag
+
Utlenianie łańcuchowych form
monosacharydów
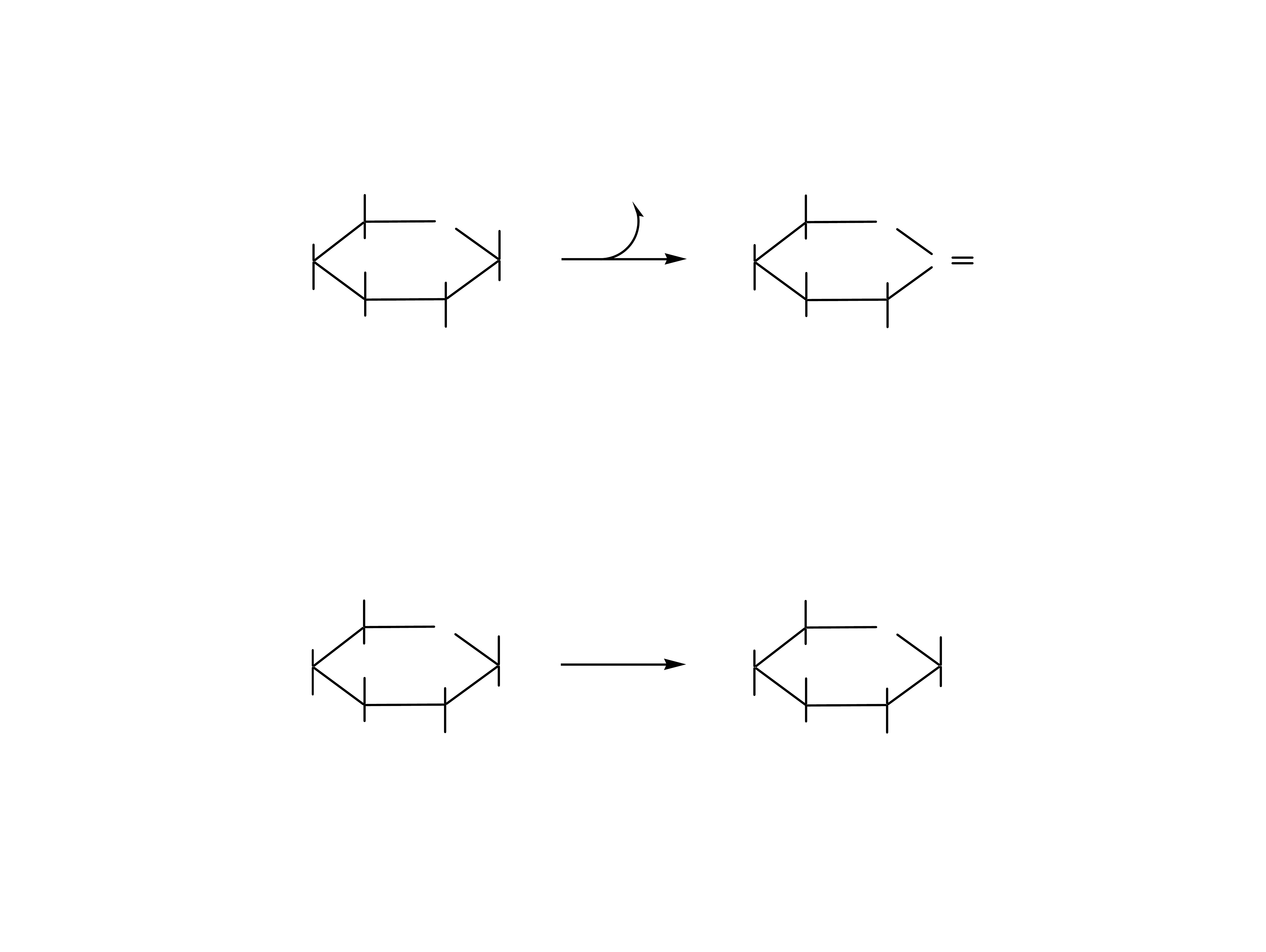
20
O
CH
2
OH
OH
OH
OH
OH
H
C
O
CH
2
OH
OH
OH
OH
2H
O
-D-glukopiranoza D-glukonolakton
O
CH
2
OH
OH
OH
OH
OH
H
-D-glukopiranoza kwas-D-glukuronowy
[O]
O
COOH
OH
OH
OH
OH
H
Laktony są cyklicznymi estrami hydroksykwasów.
Utlenianie pierścieniowych form
monosacharydów
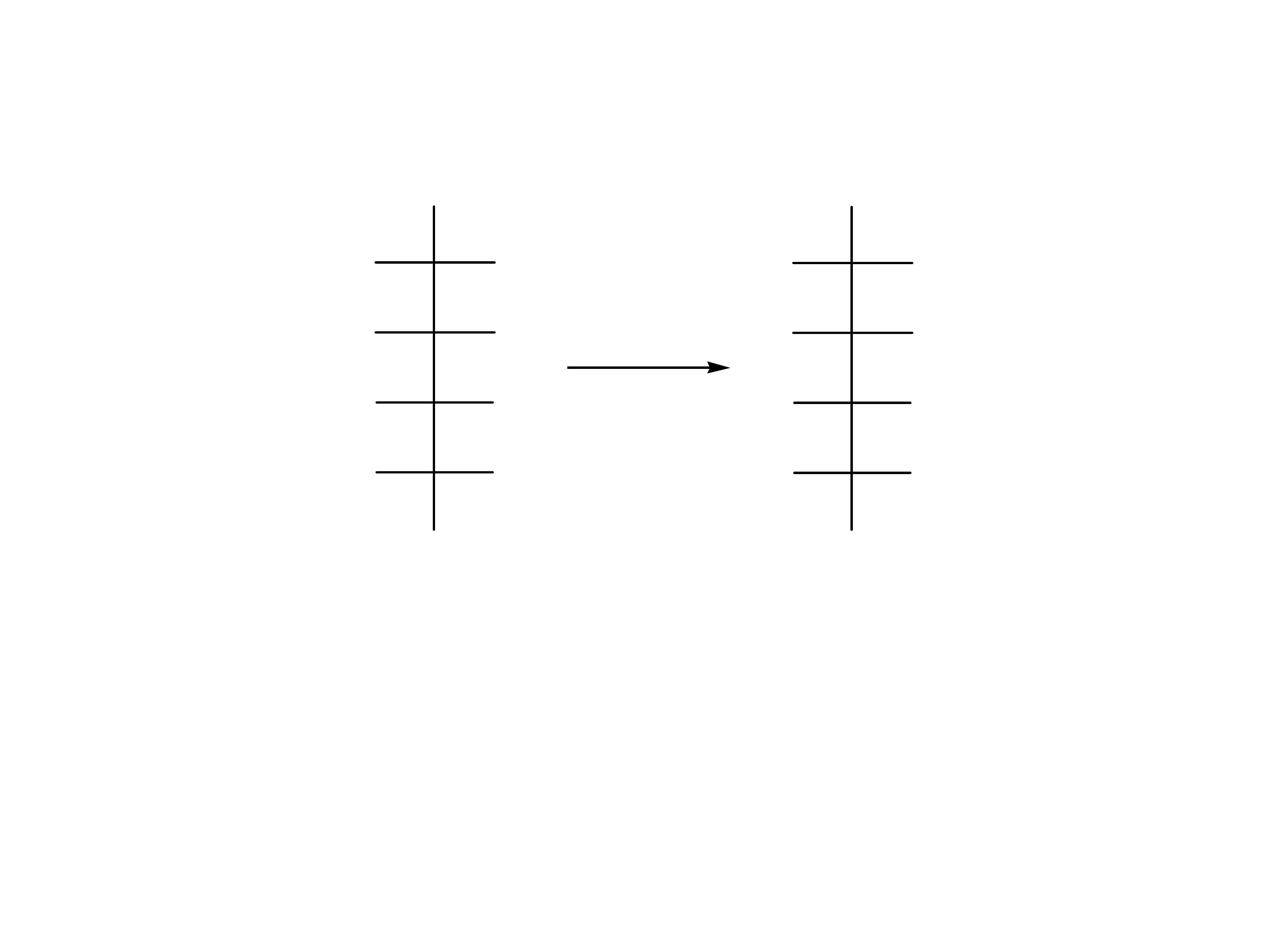
21
HO
CHO
H
H
HO
OH
H
OH
H
CH
2
OH
HO
CH
2
OH
H
H
HO
OH
H
OH
H
CH
2
OH
D-mannoza D-mannitol
H
2
Redukcja monosacharydów
Produktami redukcji są poliole zwane alditolami.
(glukoza – glucitol, galaktoza – galakcitol, ryboza –
rybitol)
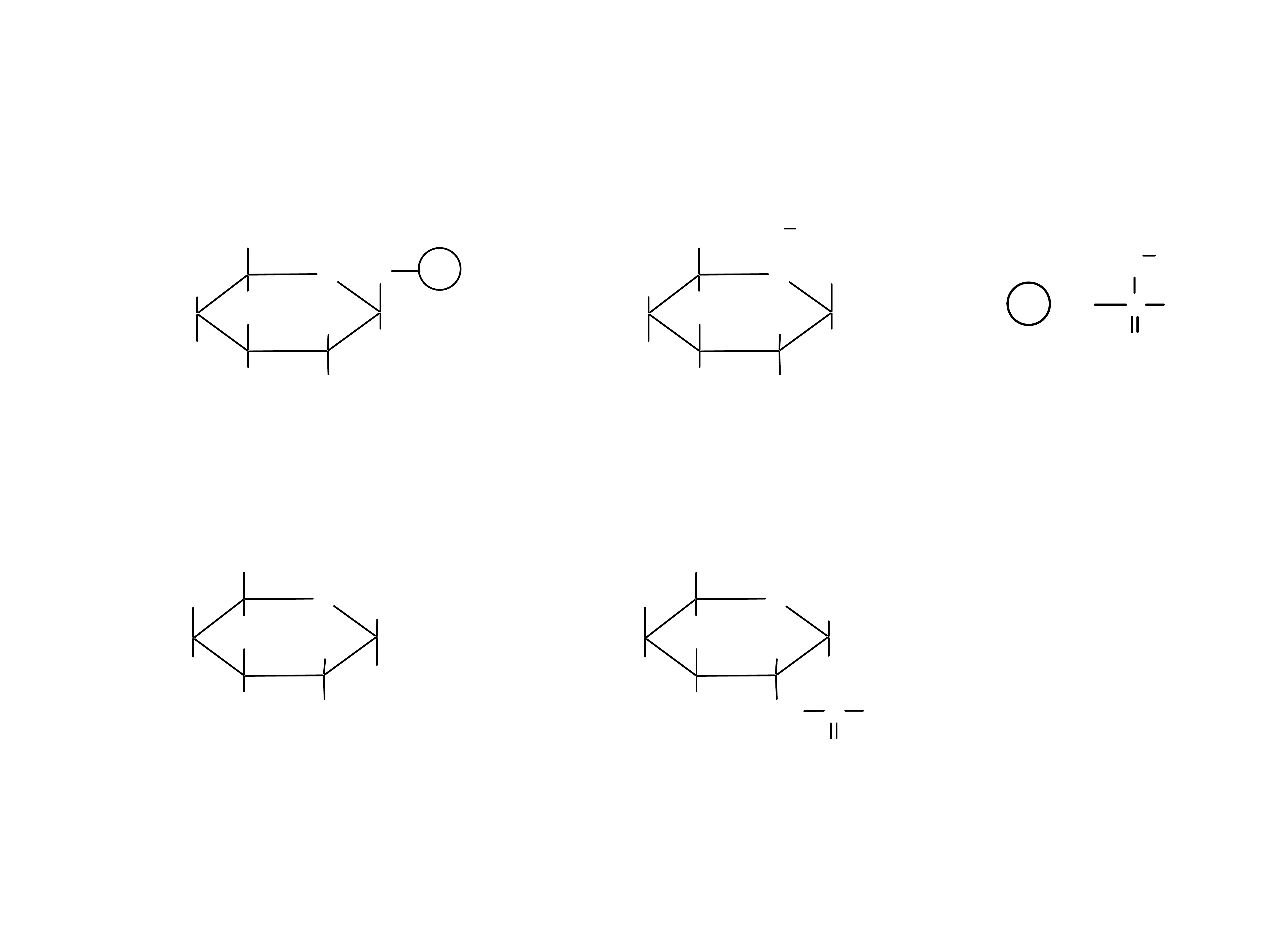
22
O
CH
2
OH
O
OH
OH
OH
-D-glukopiranozylo-1-fosforan
glukozo-1-fosforan
O
CH
2
OH
OH
NH
2
OH
OH
D-galaktozoamina
nazwa zwyczajowa
P
O
CH
2
OSO
3
OH
OH
OH
OH
-D-glukopiranozo-6-siarczan
O
CH
2
OH
NH
OH
OH
C CH
3
O
N-acetylo-D-galaktozoamina
OH
Estry i pochodne aminowe monosacharydów
P =
P
O
OH
O
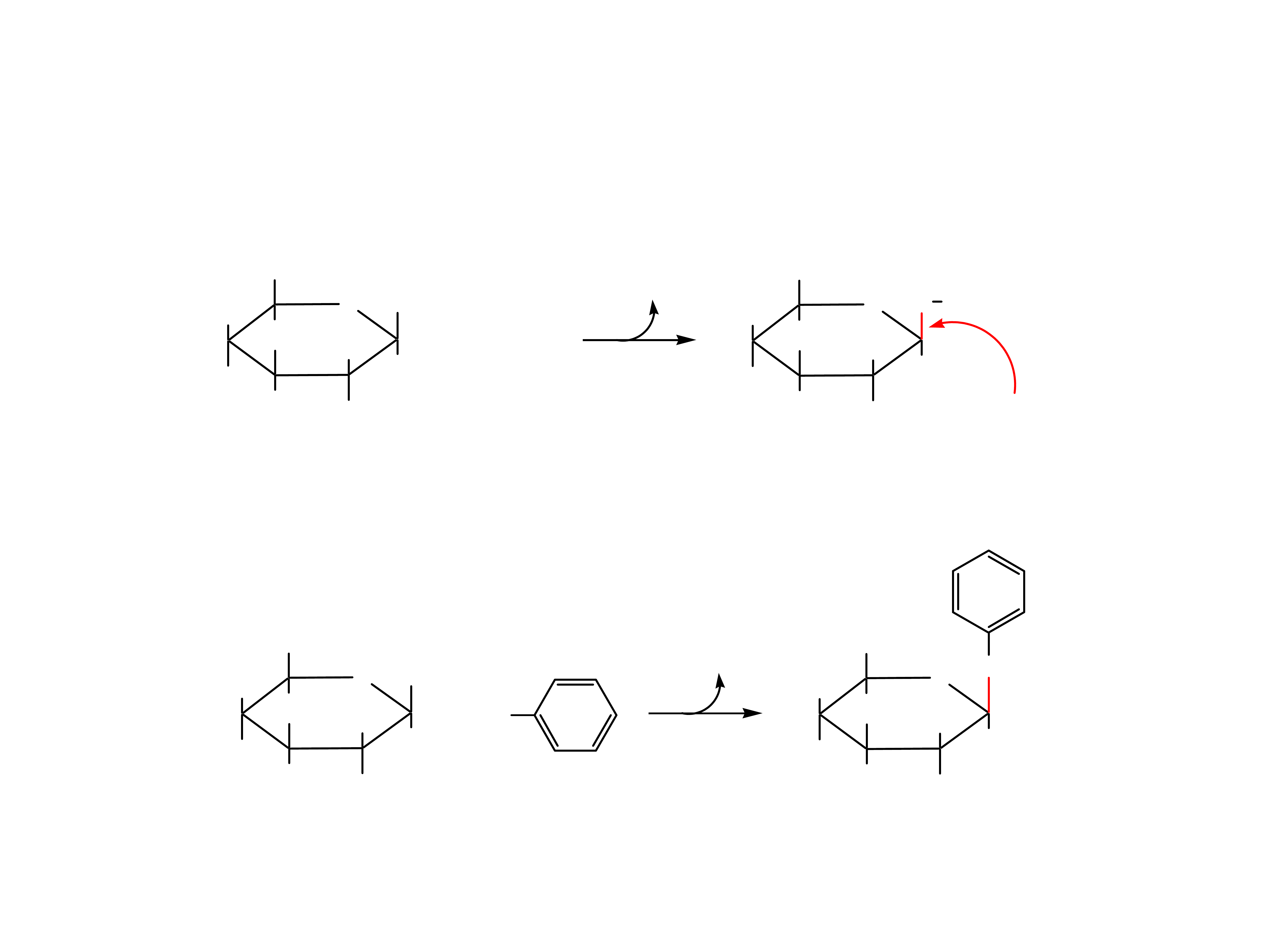
23
O
CH
2
OH
OH
OH
OH
OH
-D-glukopiranoza metyl--D-glukopiranozyd
+
HOCH
3
O
CH
2
OH
O
OH
OH
OH
CH
3
H
2
O
wi¹zanie
glikozydowe
O
COOH
OH
OH
OH
OH
kwas -D-glukuronowy fenylo -D-glukuronid
O
COOH
OH
OH
OH
H
2
O
HO
+
O
Glikozydy
Glikozydy są acetalami otrzymanymi w reakcji
pierścieniowych form monosacharydów z alkoholami.

24
Oligosacharydy
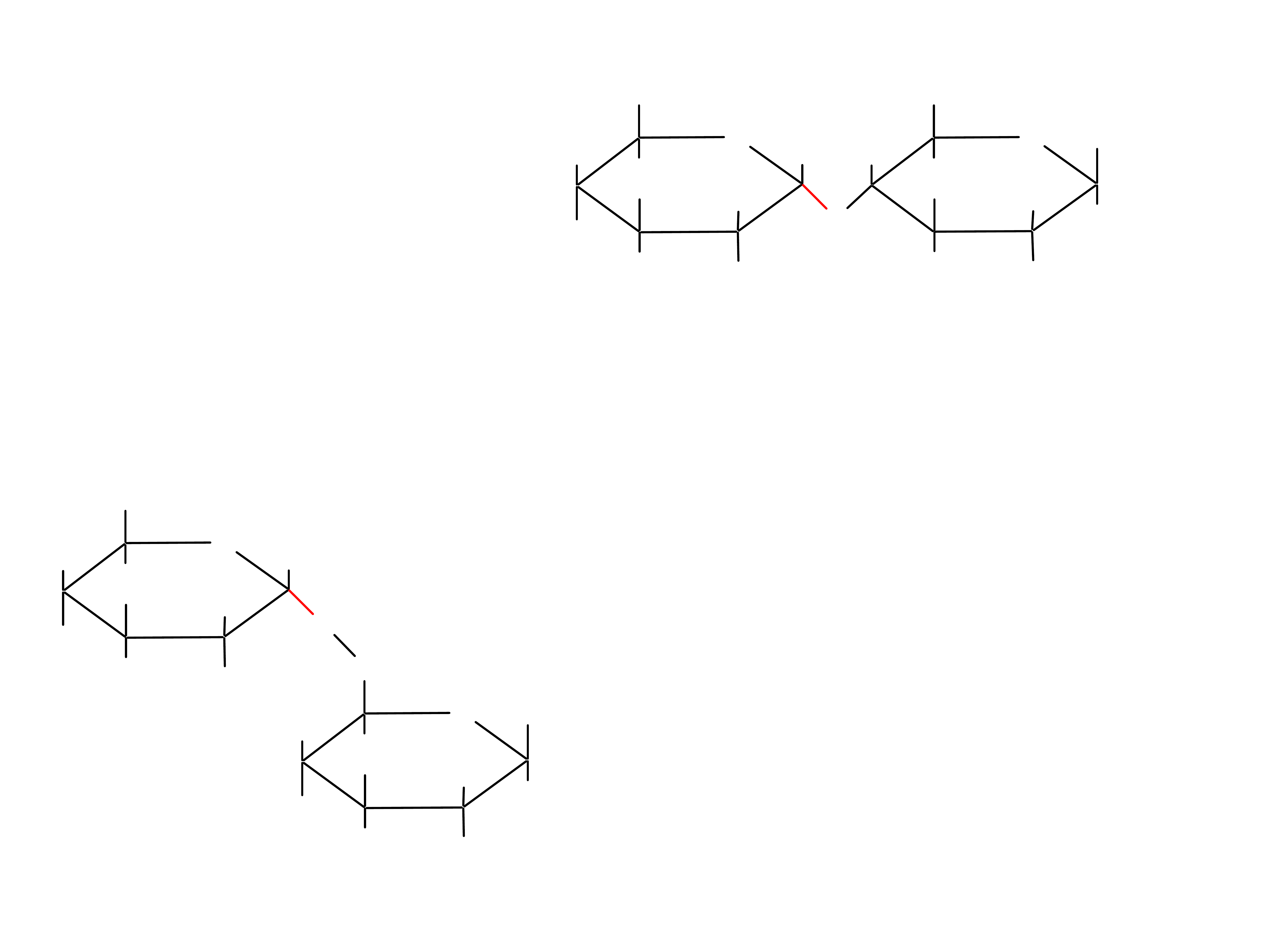
25
O
CH
2
OH
OH
OH
OH
maltoza
4---D-glukopiranozylo--D-glukopiranoza
O
CH
2
OH
OH
OH
OH
O
O
CH
2
OH
OH
OH
OH
izomaltoza
6---D-glukopiranozylo--D-glukopiranoza
O
CH
2
OH
OH
OH
O
OH
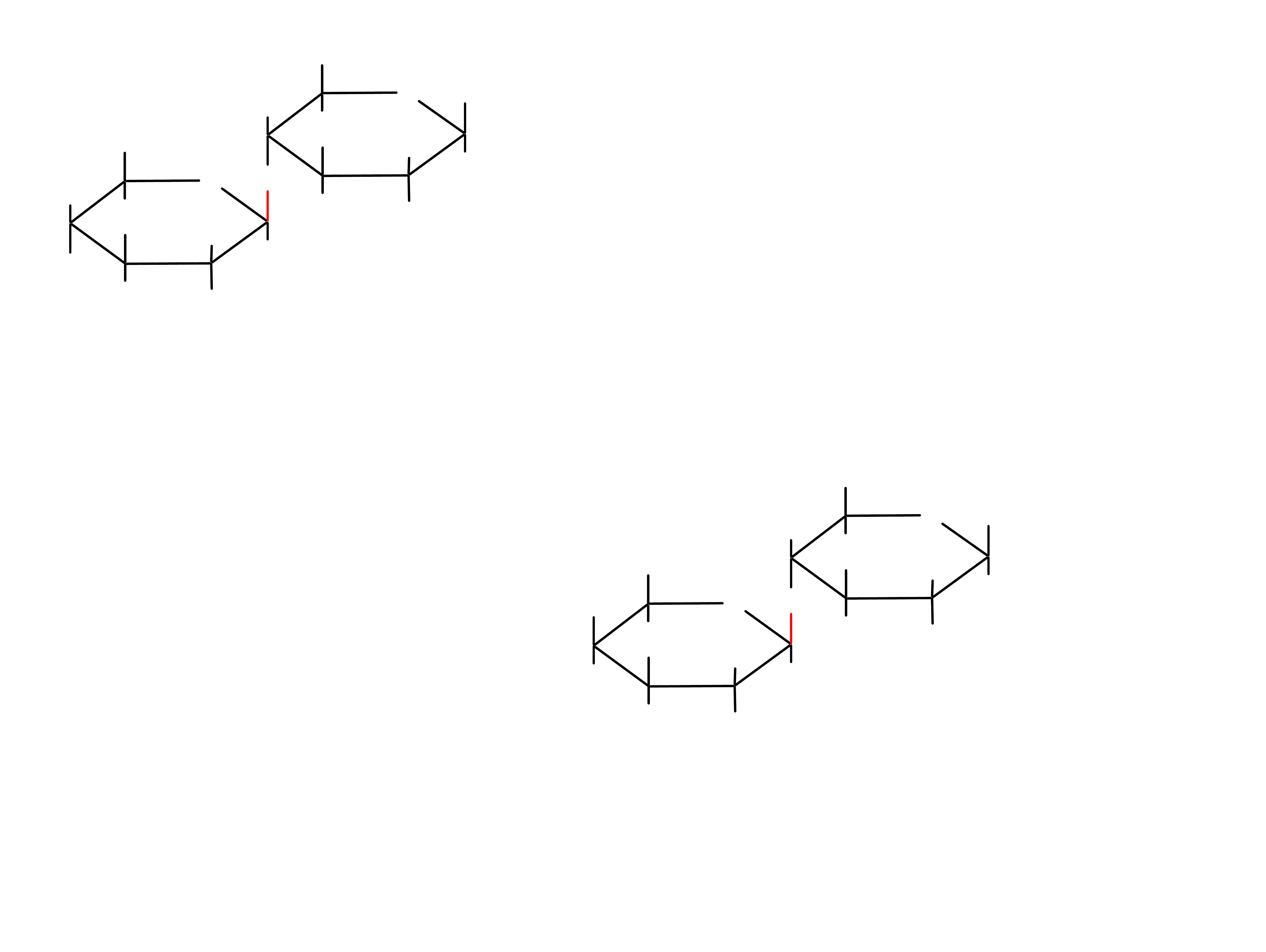
26
O
CH
2
OH
OH
OH
OH
celobioza
4---D-glukopiranozylo--D-glukopiranoza
O
CH
2
OH
OH
OH
OH
O
O
CH
2
OH
OH
OH
OH
laktoza
4---D-galaktopiranozylo--D-glukopiranoza
O
CH
2
OH
OH
OH
OH
O
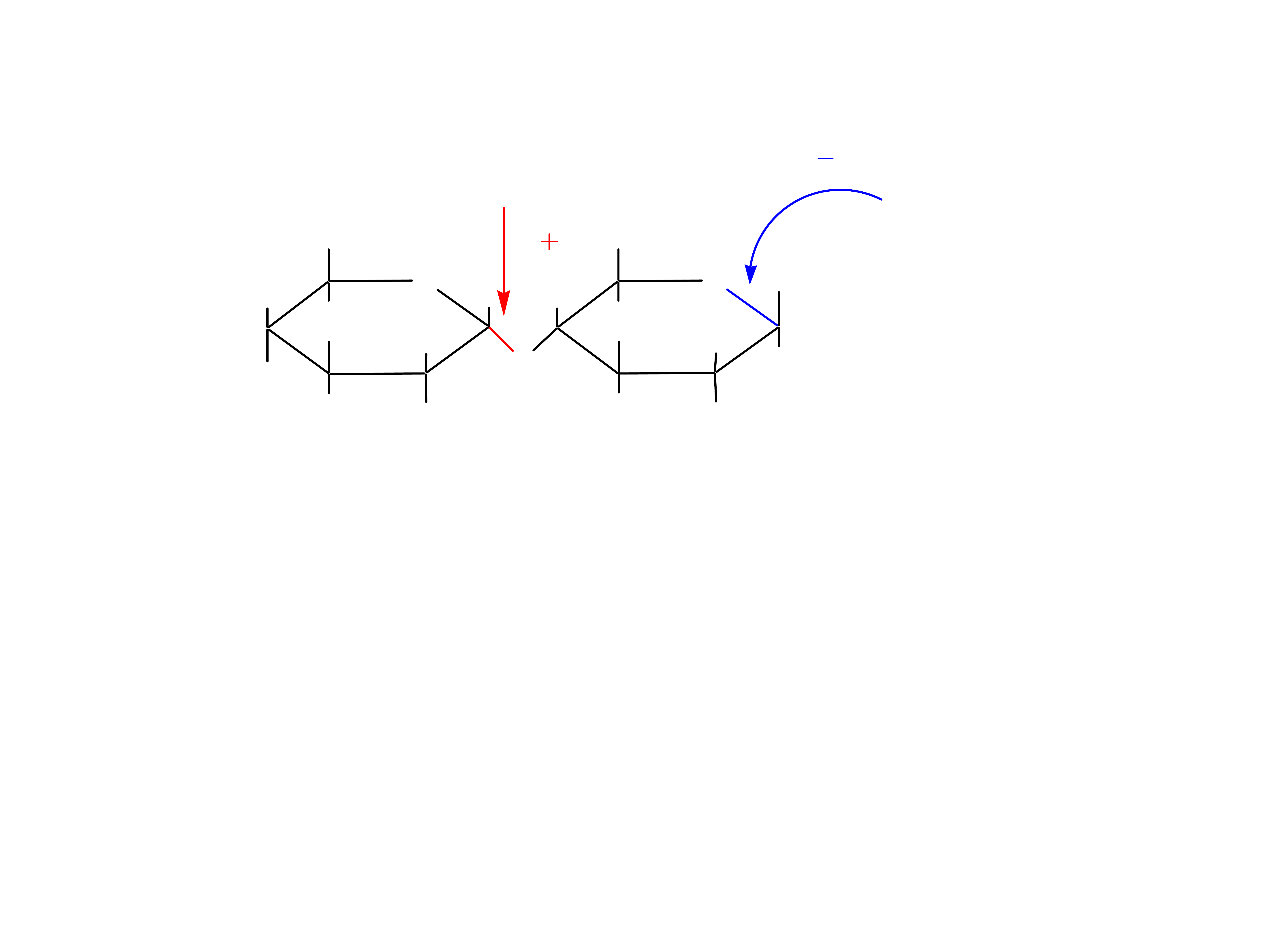
27
O
CH
2
OH
OH
OH
OH
Maltoza
O
CH
2
OH
OH
OH
OH
O
wi¹zanie
glikozydowe
wi¹zanie
pó³acetalowe
H
OH
Wiazanie glikozydowe jest nietrwałe w środowisku kwaśnym.
Wiązanie hemiacetalowe jest nietrwałe w środowisku alkalicznym.
Dlatego cykliczne formy monosacharydów z niezablokowanym
anomerycznym atomem węgla przechodzą w obecności zasad w
formy aldehydowe.
Disacharydy z jedną jednostką monosacharydową posiadającą
niezabloko-wany węgiel anomeryczny ulegają mutarotacji. Jeżeli po
otwarciu pierścienia powstaje grupa aldehydowa disacharyd
wykazuje właściwości redukujące.
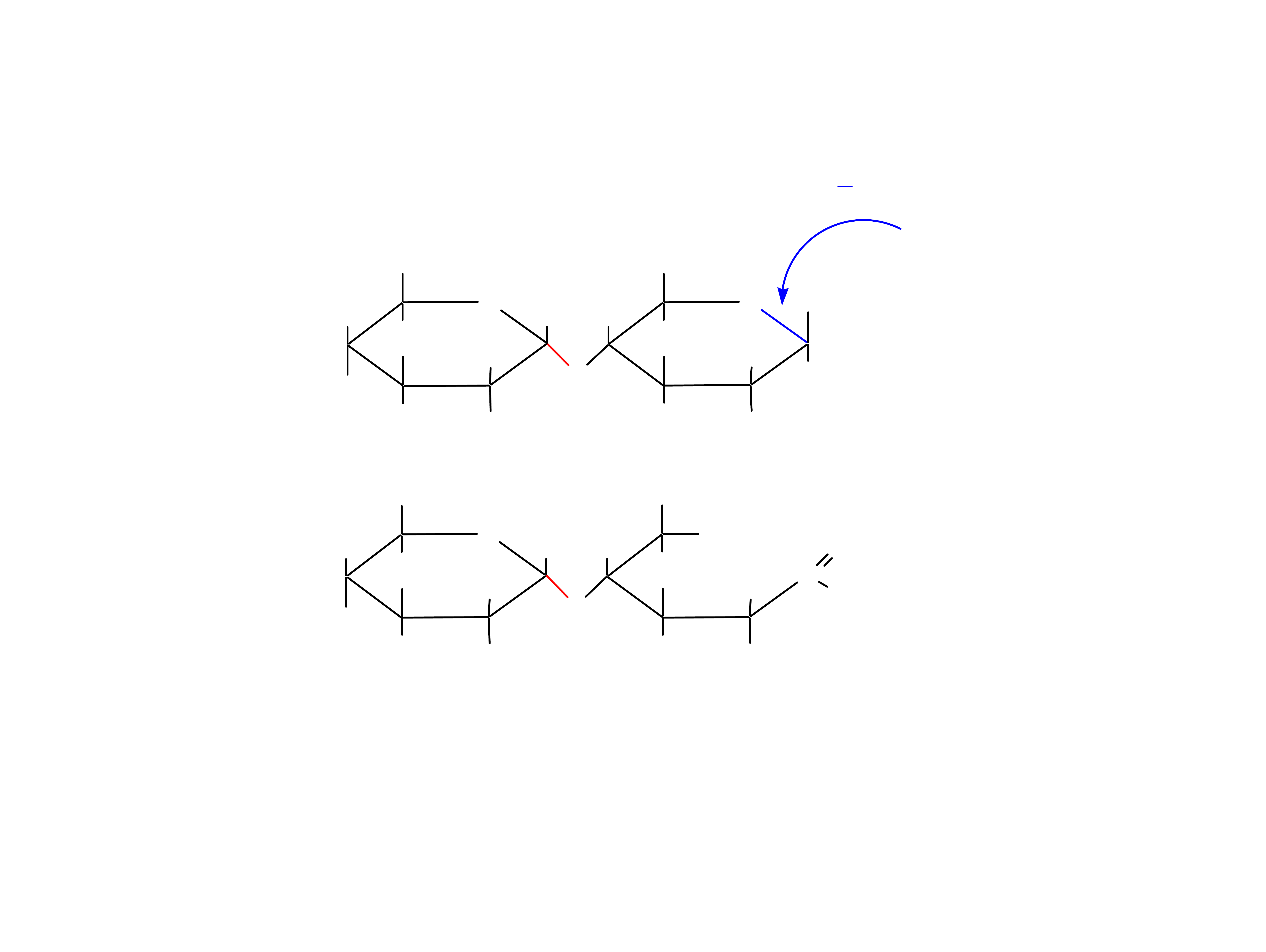
28
O
CH
2
OH
OH
OH
OH
O
CH
2
OH
OH
OH
OH
O
wi¹zanie
hemiacetalowe
O
CH
2
OH
OH
OH
OH
C
OH
CH
2
OH
O
OH
OH
H
O
OH
Inne redukujące disacharydy: izomaltoza, laktoza, celobioza.
Sacharoza nie jest cukrem redukującym.
Maltoza w œ
rodowisku alkalicznym jest cukrem redukuj¹cym
29
C
R
H
H
2
N
O
OH
*
Aminokwasy
Aminokwasy są związkami zawierającymi grupę
aminową i grupę o charakterze kwasowym. W
przypadku aminokwa-sów białkowych jest to grupa
karboksylowa
.
Wzór ogólny L-aminokwasów
Gwiazdka wskazuje węgiel , który we wszystkich
ami-nokwasach poza glicyną jest chiralny.

30
Klasyfikacja aminokwasów białkowych
1. Aminokwasy z rodnikiem apolarnym:
Val, Leu, Ile, Met, Phe, Pro, Trp, Gly
2. Aminokwasy z rodnikiem polarnym nie ulegającym
jonizacji:
Asn, Gln, Ser, Thr, Tyr, Cys
3. Aminokwasy z rodnikiem polarnym ulegającym
jonizacji:
Asp, Glu Arg, Lys, His
kwaśne
zasadowe
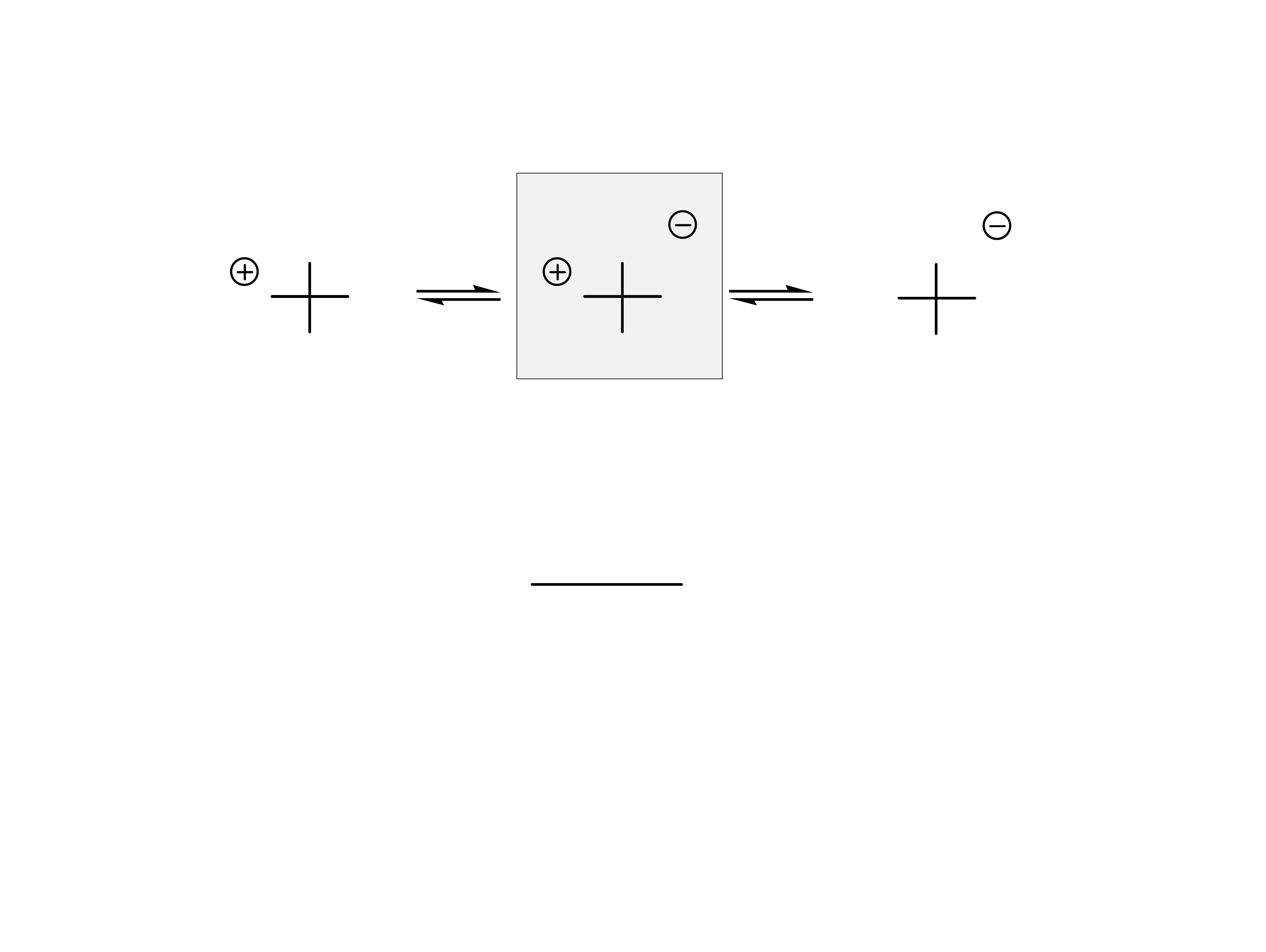
31
Aminokwasy grupy 1 i 2 (obojętne) mają trzy formy
jonowe.
COOH
R
H
H
3
N
COO
R
H
H
3
N
COO
R
H
H
2
N
pK
1
pK
2
jon
obojnaczy
kation anion
pH
i
=
pK
1
+ pK
2
2
zwykle oko³o 6
W warunkach fizjologicznych występują głównie w
formie jonu obojnaczego.
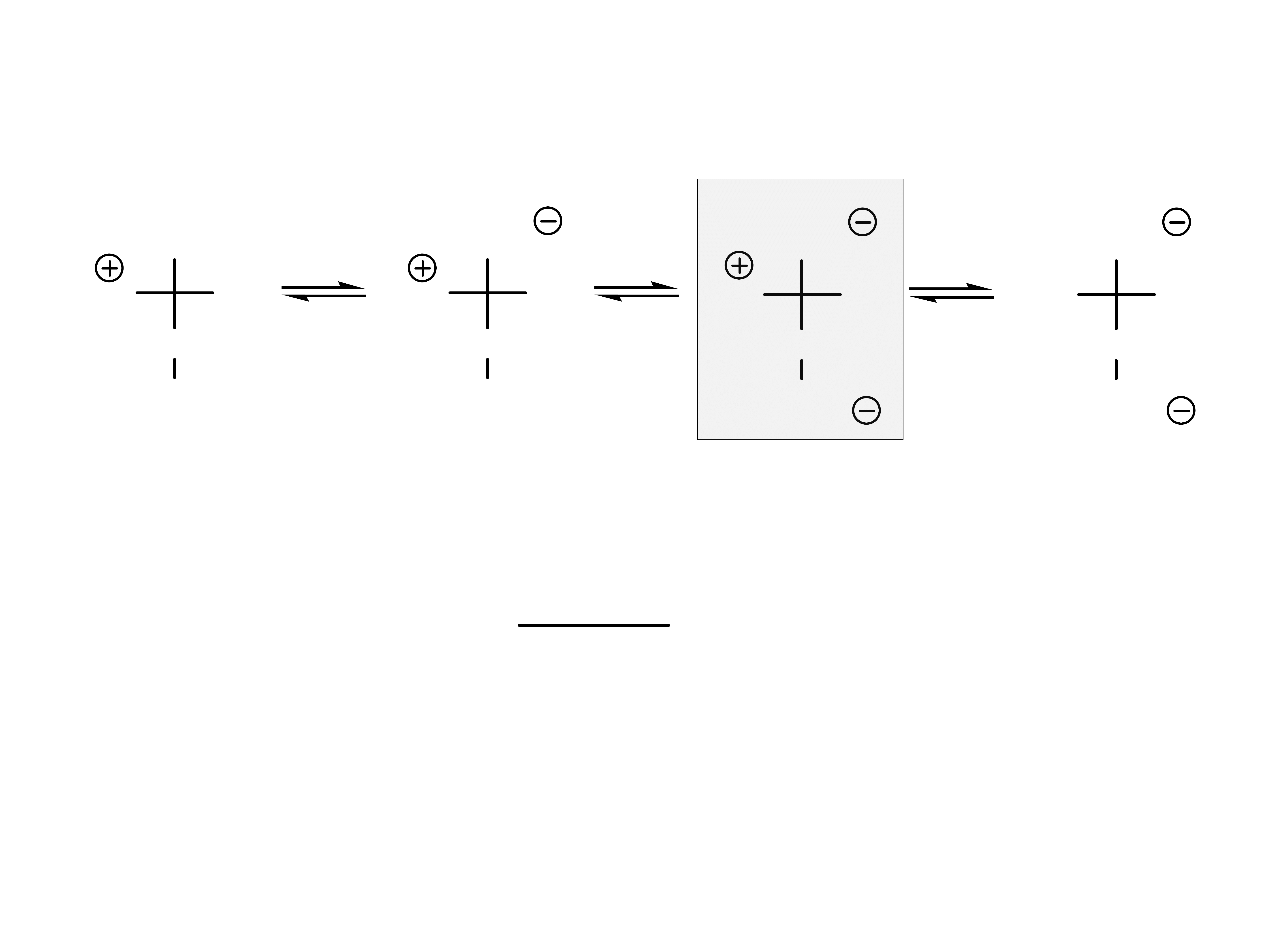
32
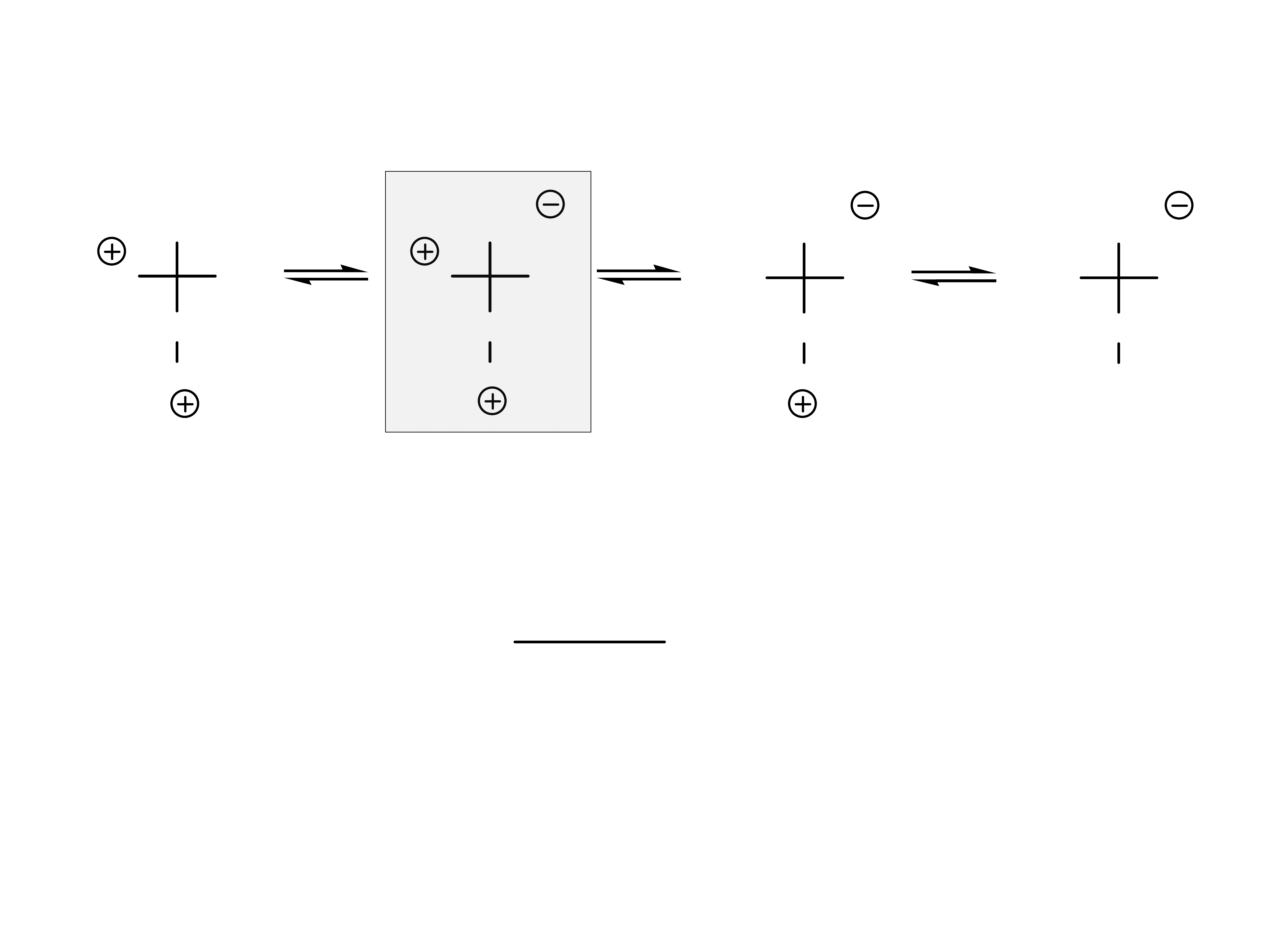
Aminokwasy kwaśne mają cztery formy jonowe.
COOH
CH
2
H
H
3
N
COO
CH
2
H
H
3
N
COO
CH
2
H
H
3
N
pK
1
pK
2
jon
obojnaczy
kation anion -1 anion -2
pH
i
=
pK
1
+ pK
2
2
COOH
COOH
COO
COO
CH
2
H
H
2
N
COO
pK
3
zwykle oko³o 3
W warunkach fizjologicznych występują głównie w
formie anionu -1 (forma maksymalnie zjonizowana).
33
Aminokwasy zasadowe mają cztery formy jonowe.
COOH
(CH
2
)
4
H
H
3
N
COO
(CH
2
)
4
H
H
3
N
COO
(CH
2
)
4
H
H
2
N
pK
1
pK
2
kation +2 kation +1 jon anion
pH
i
=
pK
2
+ pK
3
2
NH
3
NH
3
NH
3
COO
(CH
2
)
4
H
H
2
N
NH
2
pK
3
zwykle oko³o 9
obojnaczy
W warunkach fizjologicznych występują głównie w
formie kationu +1 (forma maksymalnie
zjonizowana).
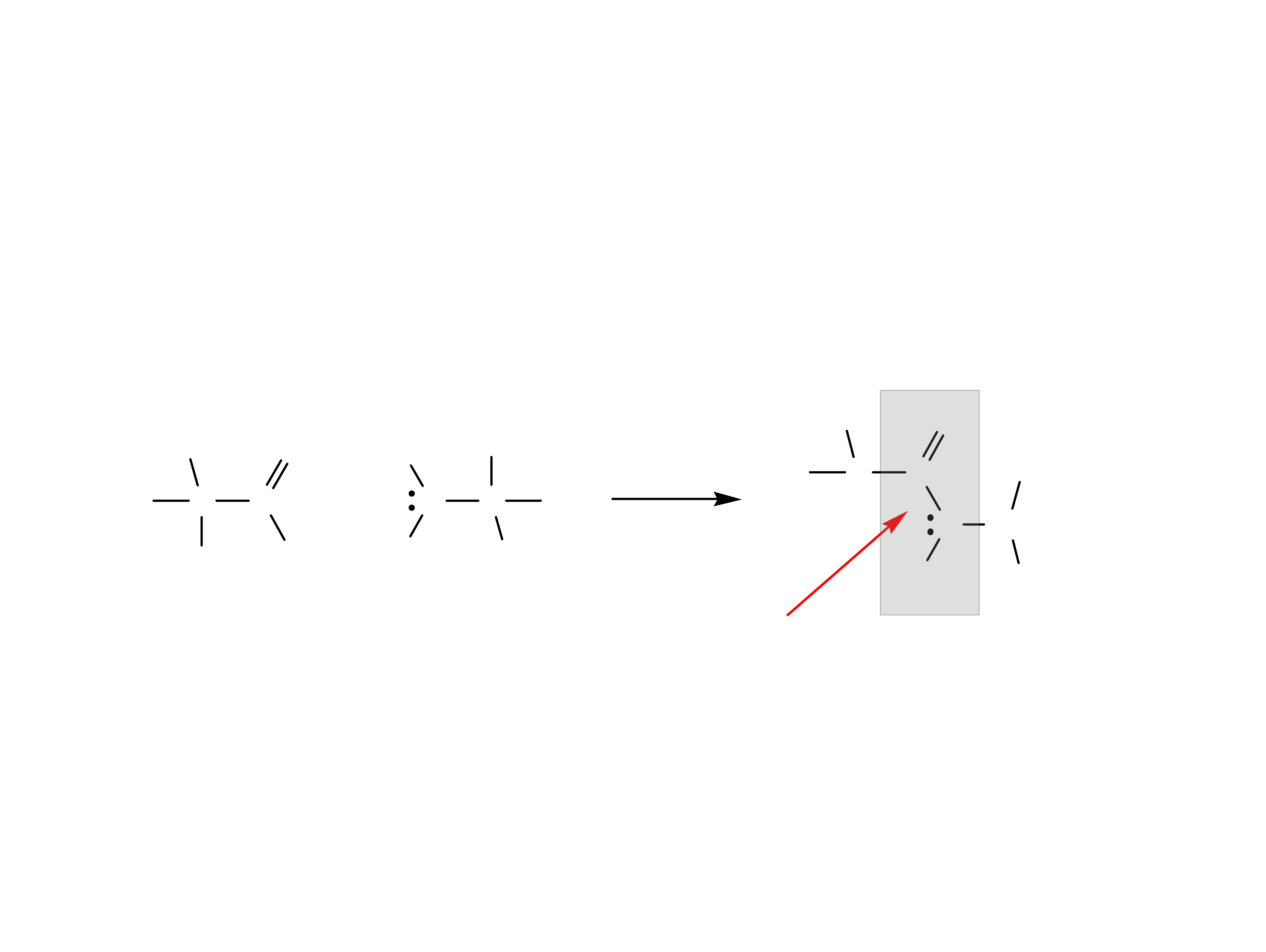
34
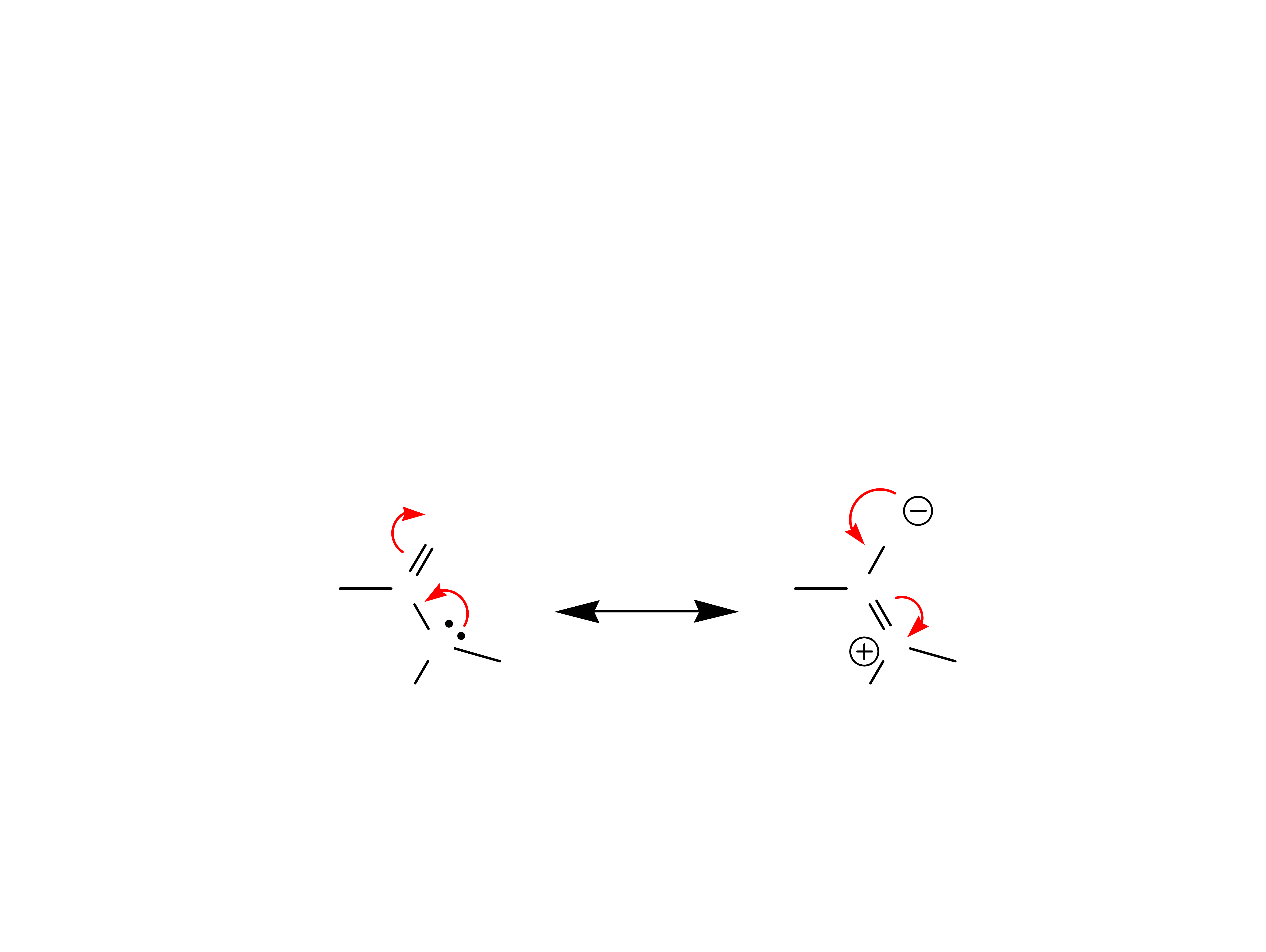
Peptydy
Peptydy są związkami składającymi się z
aminokwasów połączonych ze sobą wiązaniem
amidowym (peptydowym).
W warunkach laboratoryjnych peptydy są
otrzymywane poprzez aminoacylację aminokwasów.
C
C
O
Cl
N
C
H
H
+
C
H
C
O
N
H
CH
HCl
+
R
1
H
H
2
N
COOH
R
2
H
H
2
N
R
1
COOH
R
2
wi¹zanie
peptydowe
dipeptyd
aminoacylo-aminokwas
R
1
– aminokwas N-
terminalny
R
2
– aminokwas C-
terminalny
35
Dlaczego wiazanie peptydowe jest planarne?
Powodem planarności układu atomów wiązania
peptydo-wego jest rezonans elektronów atomu
tlenu oraz pary elektronowej atomu azotu. Skutkiem
rezonansu wiązanie
C – N ma charakter pośredni pomiędzy wiązaniem
pojedynczym i podwójnym, co prowadzi do
zablokowania rotacji.
C
O
N
H
C
O
N
H
struktury graniczne wi¹zania peptydowego

36
Nazewnictwo peptydów
Nazwe zaczynamy od aminokwasu N-terminalnego,
a kończymy na C-terminalnym. Początkowy
aminokwas i aminokwasy środkowe mają końcówkę
–ylo.
Przykłady
glicyna + seryna = glicylo-seryna
walina + lizyna + alanina = walilo-lizylo-alanina
Trp-Gln-Cys = tryptofanylo-glutaminylo-cysteina
Trp-Glu-Cys = tryptofanylo-glutamylo-cysteina
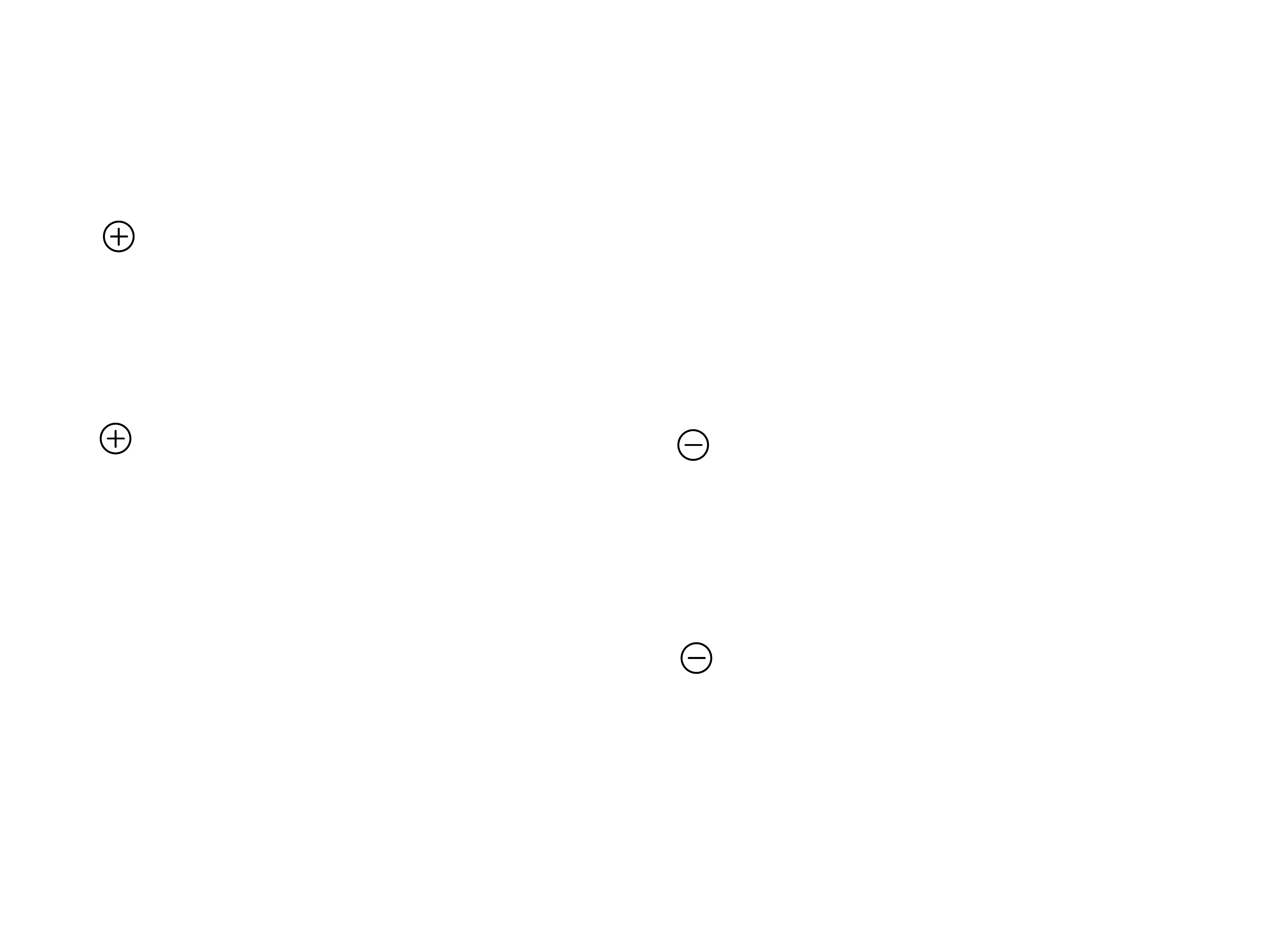
37
Formy jonowe peptydów
H
3
N - Gli - Pro - Ser - Gln - Wal - COOH
pH = 1
H
3
N - Gli - Pro - Ser - Gln - Wal - COO
pH = 7
H
2
N - Gli - Pro - Ser - Gln - Wal - COO
pH = 12
Nie ma
przewagi
aminokwasów
kwaśnych lub
zasadowych
pH
i
około 7

38
H
3
N - Gli - Pro - Ser -
Glu
- Wal - COOH
pH = 1
H
3
N - Gli - Pro - Ser -
Glu
- Wal - COO
pH = 7
H
2
N - Gli - Pro - Ser -
Glu
- Wal - COO
pH = 12
Przewaga
aminokwasów
kwaśnych
pH
i
poniżej 7
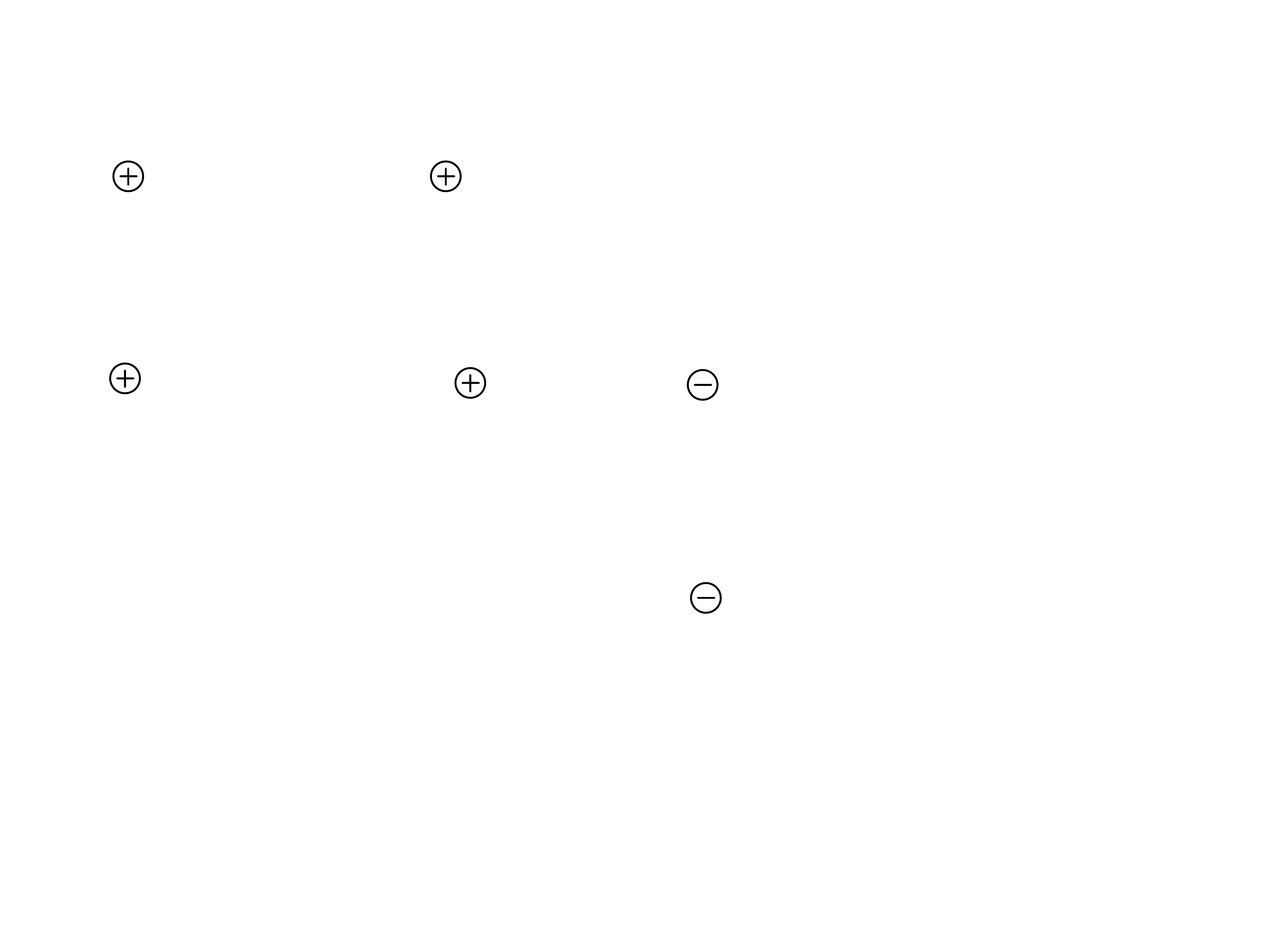
39
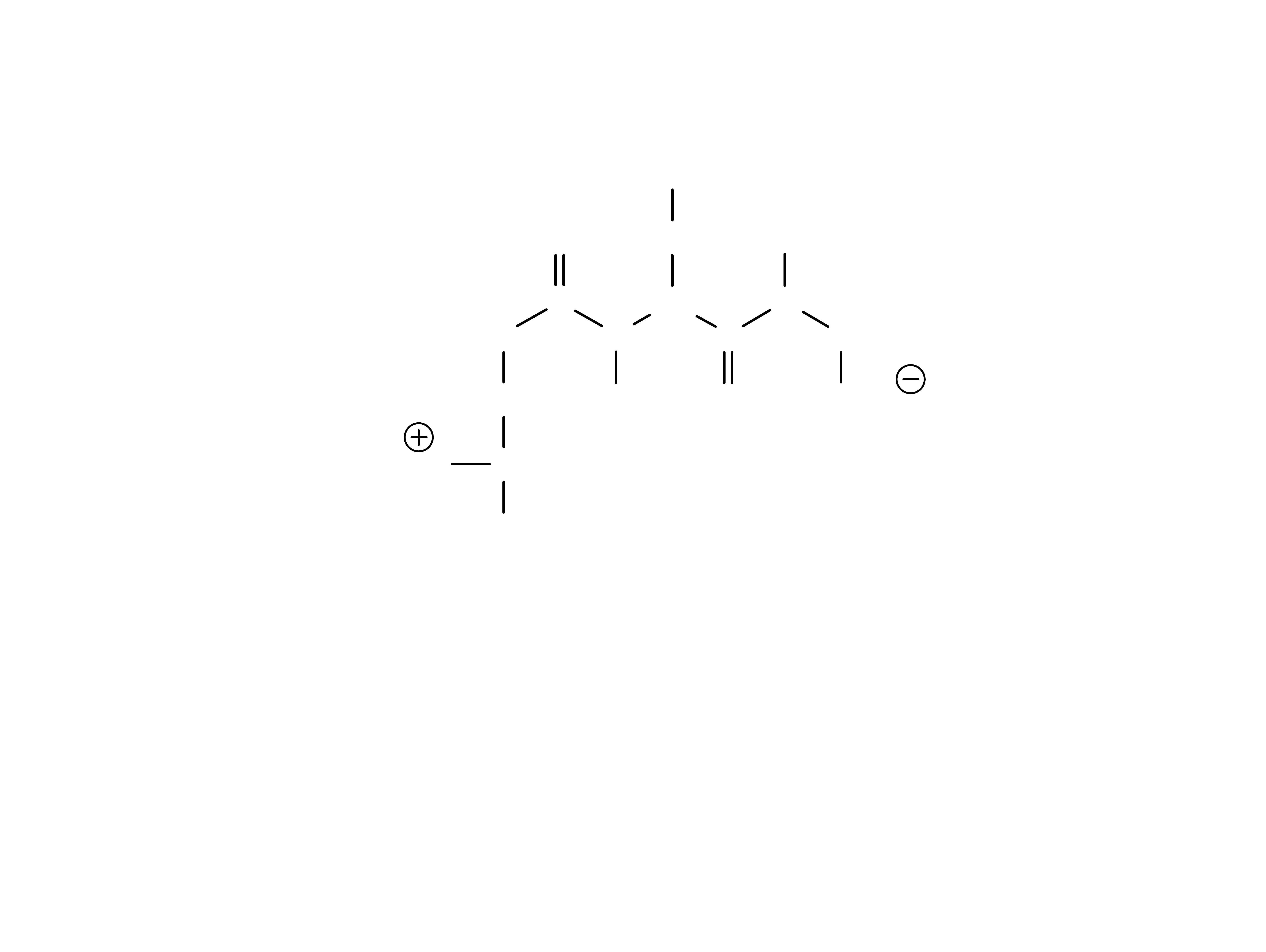
H
3
N - Gli - Pro - Ser -
Liz
- Wal - COOH
pH = 1
H
3
N - Gli - Pro - Ser -
Liz
- Wal - COO
pH = 7
H
2
N - Gli - Pro - Ser -
Liz
- Wal - COO
pH = 12
Przewaga
aminokwasów
zasadowych
pH
i
powyżej 7
40
Peptydy o znaczeniu fizjologicznym
C
N
H
2
C
O
CH
H
CH
2
CH
COOH
H
3
N
C
CH
2
SH
N
O
CH
2
H
COO
Glutation (-glutamylo-cysteinylo-glicyna)
Czynnik antyoksydacyjny. Bierze udział w
detoksykacji reaktywnych form tlenu i uczestniczy w
powstawaniu prawi-dłowych wiązań disulfidowych w
białkach.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
Wyszukiwarka
Podobne podstrony:
Wykłady chemia cz 8
Wykłady chemia cz 7
Wykłady chemia cz 6
Wykłady chemia cz 2
Wykład Chemia kwantowa 11
Wykład 9 CHEMIA ORGANICZNA
Mikrobiologia wykład IV cz 1
Zakres materiału obowiązujący na II kolokwium wykładowe, Chemia ogólna i nieorganiczna, giełdy
WYKŁAD 1 chemia, Chemia
wykłady WDS cz.5, Geologia, I semestr, Socjologia
wykłady chemia sem 1
Rzeczy których nie ma u piegusa wykład chemia( 02 2014
Wykład III cz II moder kot
WYKŁAD chemia gips
więcej podobnych podstron