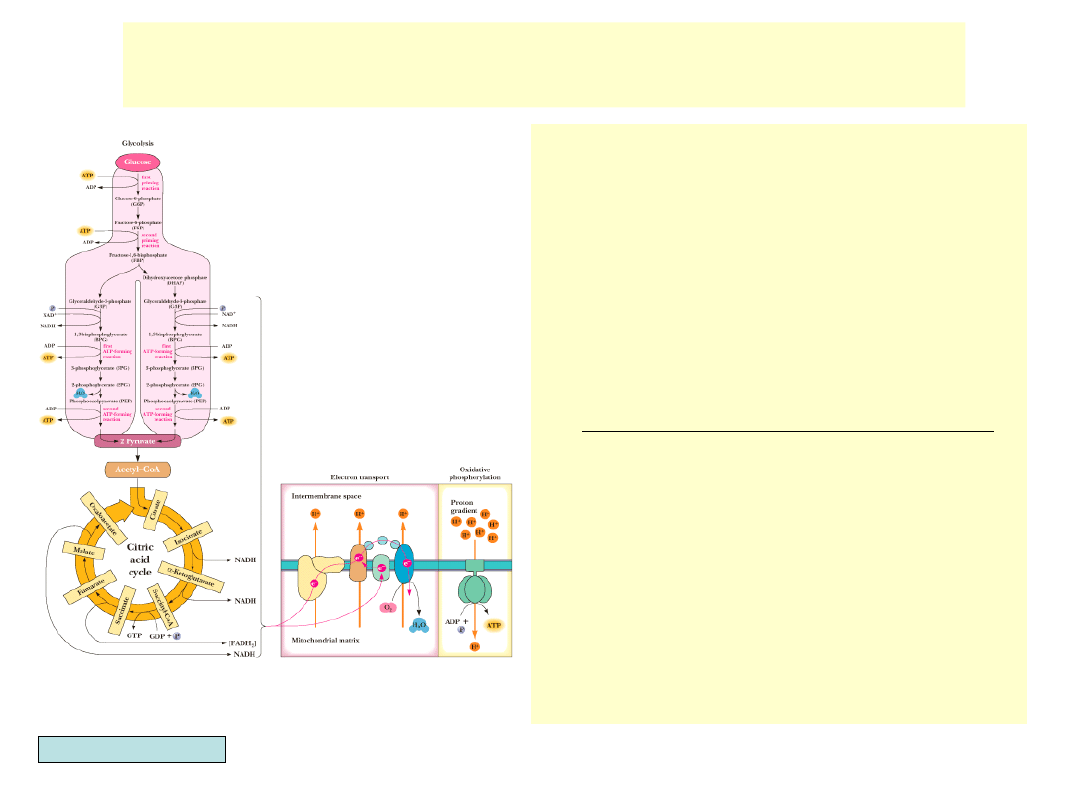
Cykl kwasów trójkarboksylowych (CKT)
•
Glikoliza wykorzystuje tylko
niewielką część potencjalnej energii
zawartej w glukozie.
•
W obecności tlenu zredukowany w
gliko-lizie NADH nie jest
regenerowany przez redukcję
pirogronianu do mleczanu czy
aldehydu octowego do etanolu, ale
nastę-puje jego utlenianie w
łańcuchu transportu elektronów.
•
Pirogronian przekształcany jest w
acetylo-CoA i utleniany do CO
2
w
cyklu kwasów trójkarboksylowych.
•
Elektrony uwalniane w czasie tego
procesu przekazywane są przez
związany z błoną mitochondrialną
system transportu na końcowy
akceptor – tlen. Przekazywanie
elektronów generuje gradient
protonów napędzający syntezę ATP.
•
Synteza ATP jako konsekwencja
transportu elektronów to
fosforylacja oksydacyjna.
•
System ten pozwala na wytworzenie
30 – 38 cząsteczek ATP z utleniania
jednej cząsteczki glukozy.
Garrett & Grisham, Biochemistry
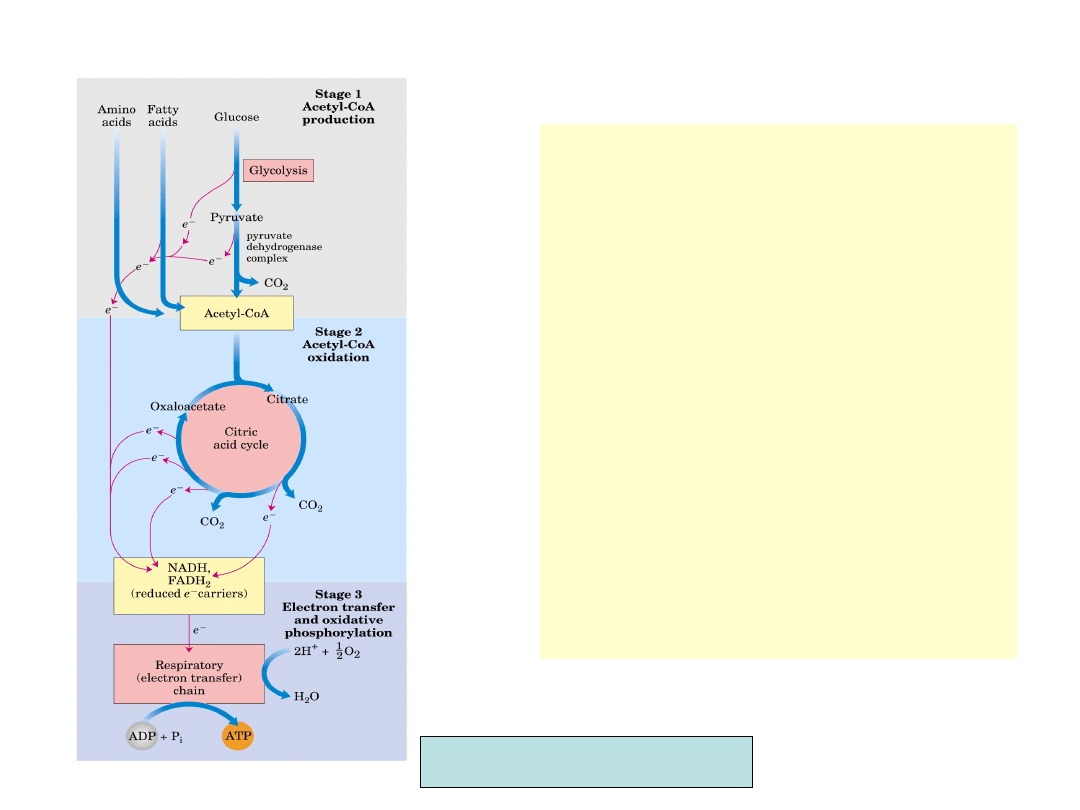
• Wejście nowych
fragmentów
węglowych do cyklu
odbywa się przez
acetylo-CoA
• Acetylo-CoA tworzony
jest z pirogronianu
dostarczanego przez
glikolizę albo z
utleniania kwasów
tłuszczowych
• Acetylo-CoA
pochodzić może
również z katabolizmu
aminokwasów
Nelson, Cox, Lehninger Principles of Biochemistry
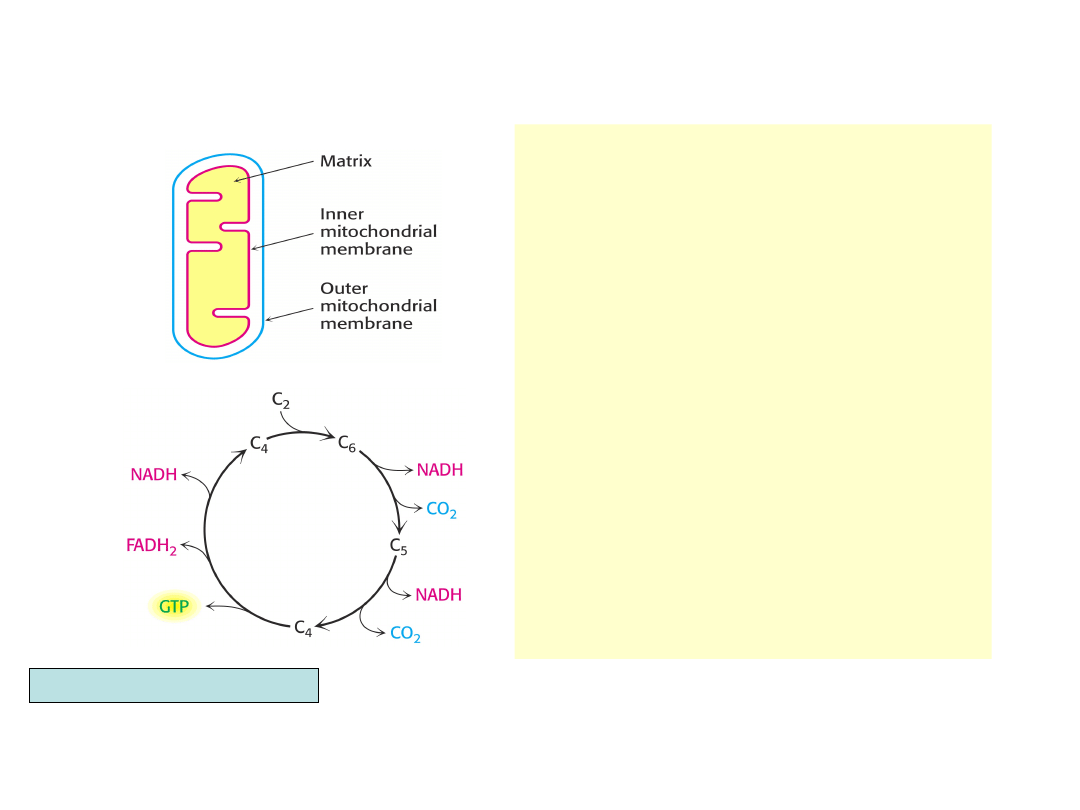
• Cykl kwasów
trójkarboksy-lowych, w
przeciwieństwie do
glikolizy, zachodzi w
macierzy
mitochondrialnej
• Transfer dwuwęglowej
reszty acetylowej z
acetylo-CoA na
czterowęglowy
szczawiooctan z udziałem
syntazy cytrynianowej
daje sześciowęglowy
cytrynian
Berg, Tymoczko, Stryer, Biochemistry
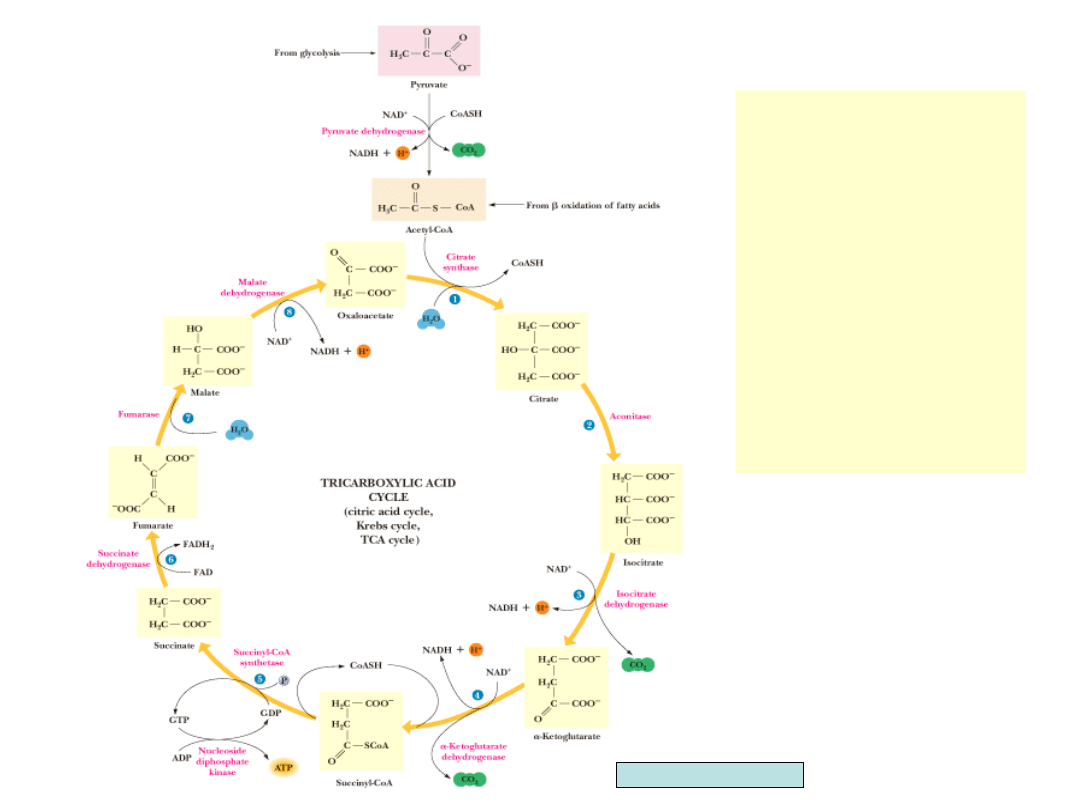
•
Odwodnienie i uwodnienie
przekształca cytrynian
przy udziale akonitazy w
izocytrynian
•
Dwie kolejne dekarboksy-
lacje z udziałem dehydro-
genazy izocytrynianowej i
dehydrogenazy -ketoglu-
taranowej produkują -ke-
toglutaran i bursztynylo-
CoA, czterowęglową jed-
nostkę, z której regenero-
wany jest szczawiooctan
•
Energia powstająca w
wyniku utleniania
magazynowana jest w
postaci ATP, NADH i FADH
2
Garrett & Grisham, Biochemistry

• Dlaczego tak skomplikowany proces dla rozbicia
dwuwęglowej jednostki na 2 CO
2
?
• Dla dwuwęglowej jednostki nie jest możliwe, typowe
dla większych biopolimerów, rozszczepienie przy
węglu wobec grupy karbonylowej (np. rozkład
fruktozo-1,6-bisfosforanu na aldehyd 3-
fosfoglicerynowy i fosfodihydroksyaceton)
O
║
-C-C-C-
• Dlatego dochodzi najpierw do kondensacji:
C4+C2=C6
a następnie do kolejnych dekarboksylacji poprzez
rozszczepie-nie wiązania przy węglu .
Etap wiążący glikolizę z cyklem kwasów
trójkarboksylowych
•
Oksydacyjna dekarboksylacja pirogronianu
przez dehydrogenazę pirogronianową
•
Pirogronian musi przejść z cytoplazmy,
gdzie odbywała się glikoliza, do
mitochondrium gdzie zachodzi cykl TCA
Pirogronian + CoA +NAD
+
acetylo-CoA+CO
2
+NADH+H
+
•
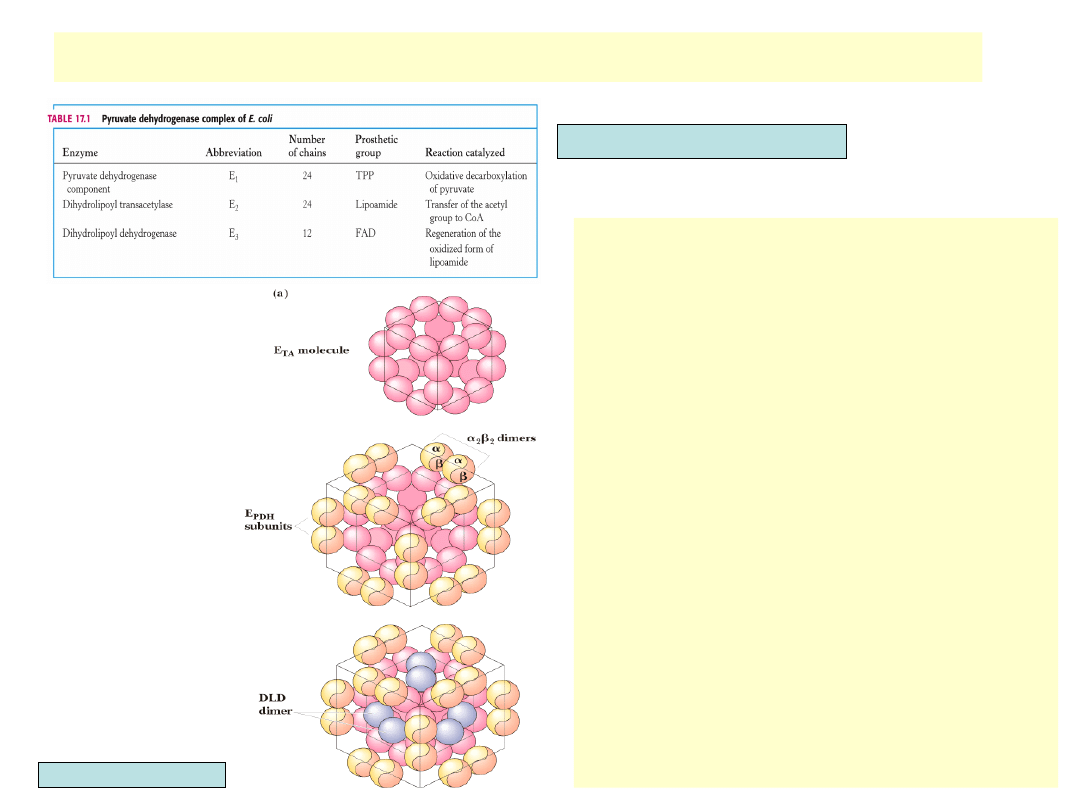
Dehydrogenaza pirogronianowa: kompleks
multienzymatyczny trzech enzymów
•
Produkt pierwszej reakcji przechodzi bezpo-
średnio do centrum aktywnego następnego
enzymu. Nie ma dyfuzji substratów i
pośrednich produktów w otoczeniu
•
Do reakcji potrzeba pięciu koenzymów:
piro-fosforanu tiaminy (TPP), CoA, kwasu
lipono-wego, NAD
+
i FAD
•
Kompleks enzymatyczny ma strukturę
zbliżoną do sześcianu, którego zrąb tworzą
24 łańcuchy acylotransferazy
dihydroliponianowej. Na każ-dym brzegu
sześcianu znajdują się 4 łańcuchy
podjednostek (łącznie 24) dehydrogenazy
piro-gronianowej. W centrum każdej ściany
występu-ją po dwa (łącznie 12) łańcuchy
dehydrogenazy dihydroliponianowej
Berg, Tymoczko, Stryer, Biochemistry
Garrett & Grisham, Biochemistry
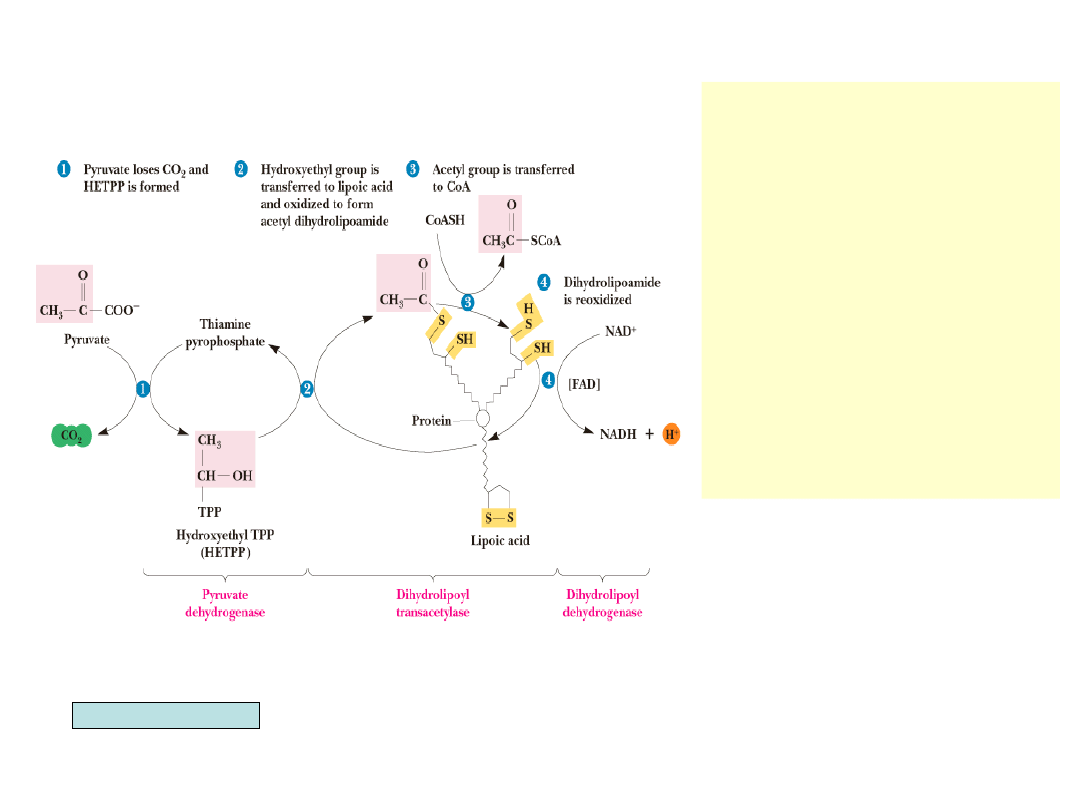
•
W pierwszym etapie reakcji
pirogronian jest dekarboksylo-
wany przez dehydrogenazę
pirogronianową, tworzy się
hydroksyetylo-TPP
•
W drugim etapie grupa hydro-
ksyetylowa jest utleniana do
grupy acetylowej i przenoszona
przez dehydrogenazę pirogro-
nianową na kw. liponowy, two-
rząc acetylodihydrolipoamid.
•
W trzecim etapie acetylotrans-
feraza dihydroliponianowa
przenosi grupę acetylową na
CoA.
•
Czwarty etap polega na reoksy-
dacji dihydroliponianu przez
dehydrogenazę dihydroliponia-
nową przy udziale FAD i NAD
+
Garrett & Grisham, Biochemistry
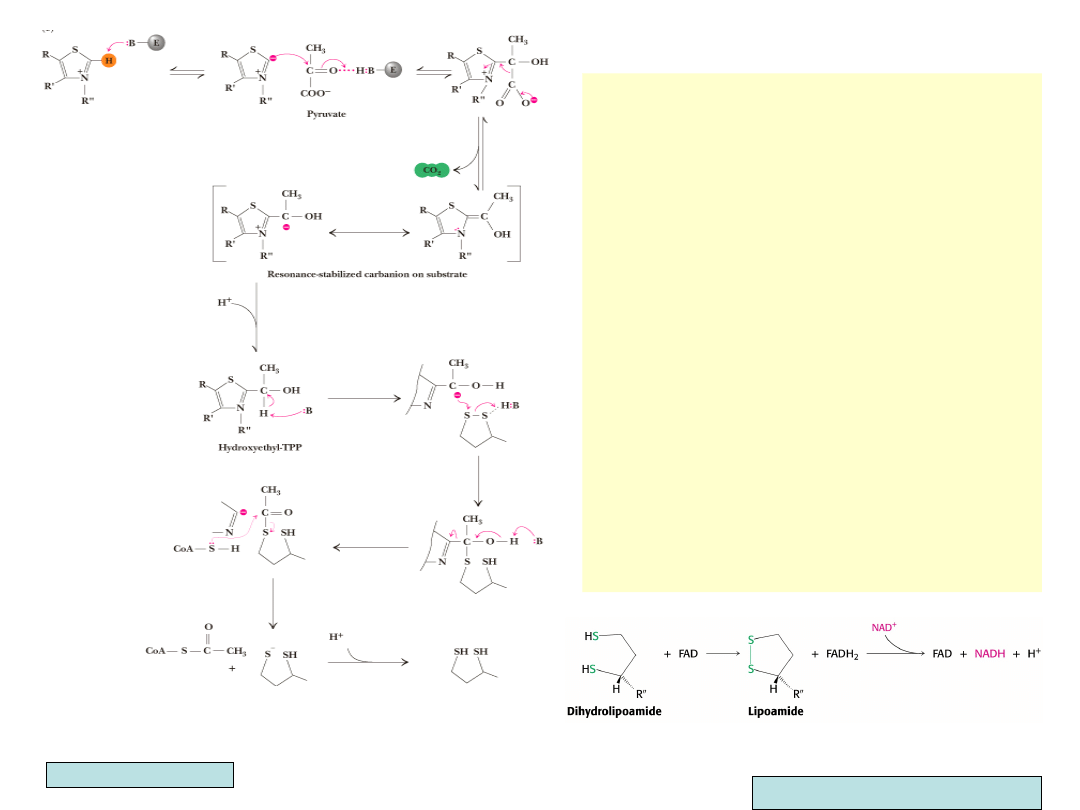
•
Dodatnio naładowany azot i siarka
pierścienia tiazolowego TPP stabilizują
powstawanie karboanionu tego
pierścienia, który szybko łączy się z
grupą karbonylową pirogronianu
•
Azot stabilizuje ujemny ładunek i
odciąga elektrony podczas następującej
dekarbo-ksylacji
•
Powstaje stabilny związek pośredni
(stabilizacja strukturami
rezonansowymi), który po protonacji
przekształca się w pirofosforan
hydroksyetylotiaminy
•
Grupa hydroksylowa reaguje z utlenioną
formą lipoamidu (połączenie kwasu
liponowego z białkiem enzymatycznym).
Następuje redukcja lipoamidu (powstaje
forma hydrosulfidowa) z równoczesnym
utlenieniem grupy hydroksyetylowej do
acetylowej
•
Z powstałego acetylolipoamidu grupa
acetylowa przenoszona jest przez
acetylotransferazę (transacetylazę) dihy-
droliponianową na CoA
•
Ostatni etap reakcji polega na utlenieniu
zredukowanej formy lipoamidu
(disiarczek) zależną od FAD
dehydrogenazą kwasu liponowego,
przekazującą następnie protony na NAD
+
Garrett & Grisham, Biochemistry
Berg, Tymoczko, Stryer, Biochemistry
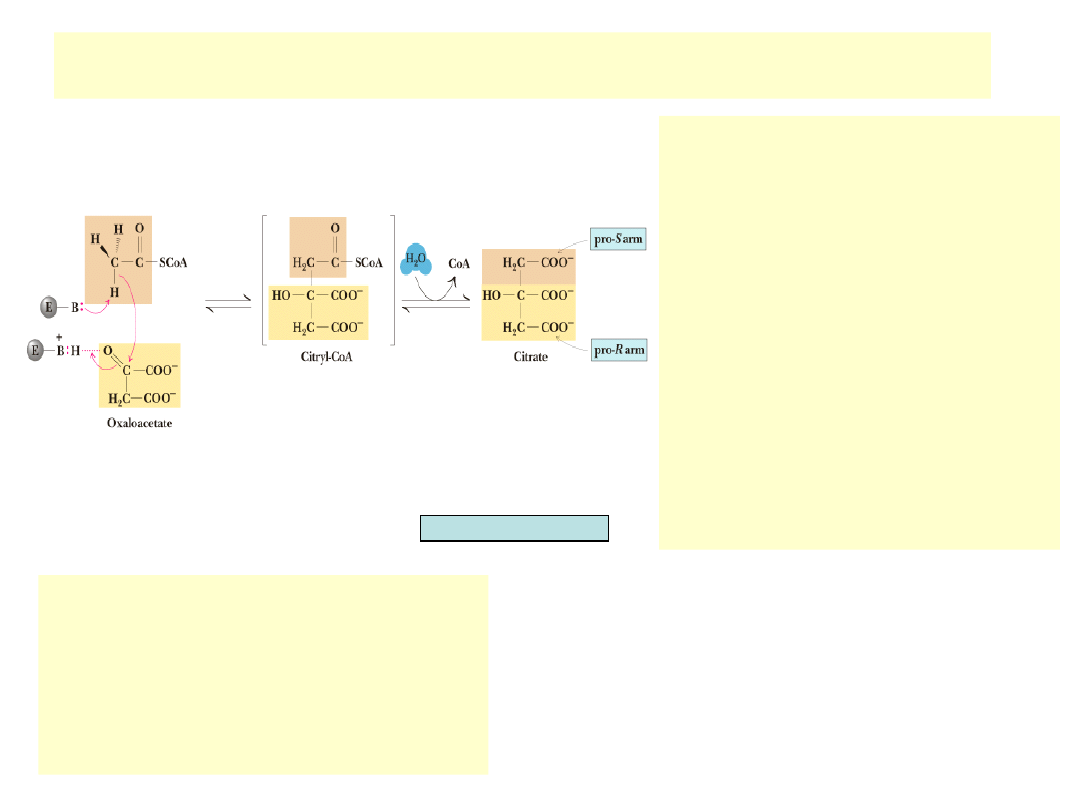
Pierwsza reakcja CKT
• SYNTAZY – katalizują reakcje
kondensacji bez udziału NTP
• SYNTETAZY – katalizują
reakcje kondensacji z
udziałem NTP (np. ATP)
•
Acetylo-CoA reaguje przy udziale syntazy
cytrynianowej z szczawiooctanem dając
cytrynian
•
Enzym odciąga proton z acetylo-CoA,
powstający karboanion podejmuje
nukleofilowy atak na węgiel karbonylowy
szczawiooctanu, powstaje tioester
(cytrynylo-CoA), którego intensywna
hydroliza popycha reakcję do przodu
(G
0
’=-31.4 kJ/mol)
•
Syntaza cytrynianowa ssaków jest homo-
dimerem. Każde z miejsc aktywnych
znajduje się w szczelinie między dwoma
domenami podjednostki, w pobliżu styków
podjednostek.
•
W czasie katalizy najpierw wiązany jest
szczawiooctan, powoduje to
konformacyjną zmianę ułatwiającą
wiązanie acetylo-CoA. Katalityczne reszty
powodujące hydrolizę wiązania
tioestrowego są ustawione w pozycji
umożliwiającej działanie dopiero po
wytworzeniu cytrynylo-CoA. Zapobiega to
hydrolizie wchodzącego do reakcji acetylo-
CoA.
•
Ze względu na duże ujemne G reakcja
jest jednym z regulacyjnych etapów cyklu
kwasu cytrynowego. Inhibitorem syntazy
jest NADH i bursztynylo-CoA (produkty
cyklu TCA).
Garrett & Grisham, Biochemistry
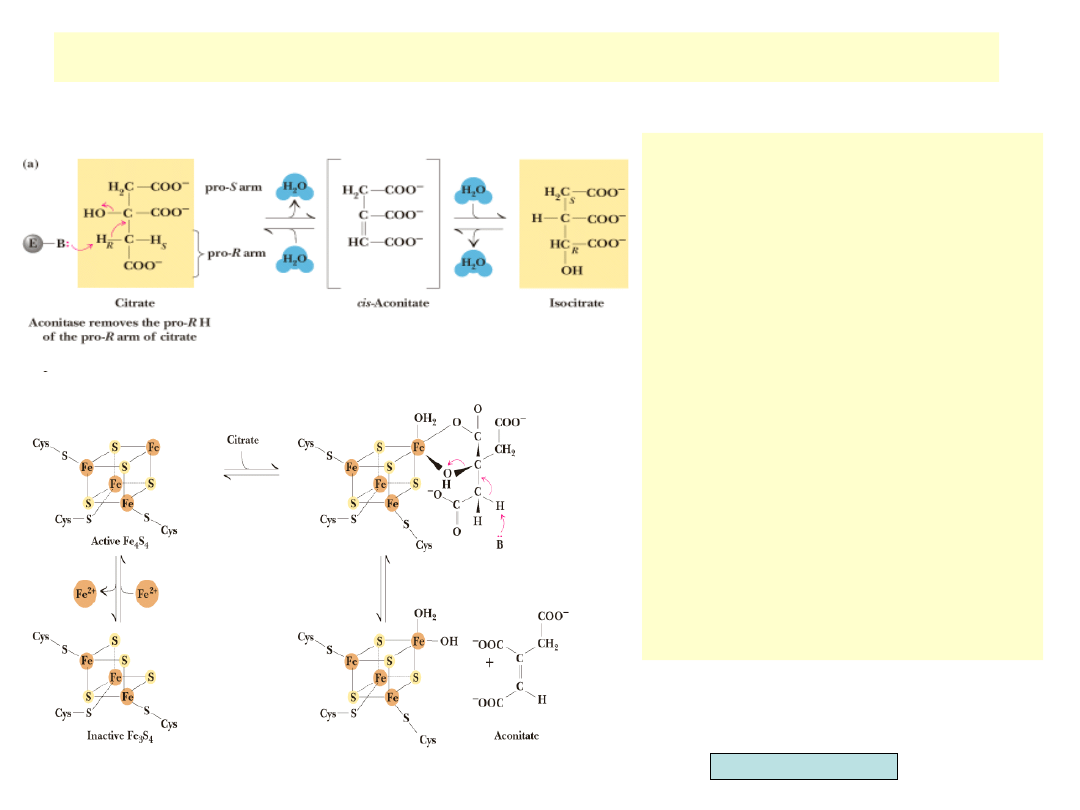
Izomeryzacja cytrynianu do izocytrynianu
•
Cytrynian zawiera trudny do
utlenienia trzeciorzędowy
alkohol. Konieczna jest więc
izomeryzacja do alkoholu
drugorzędowego –
izocytrynianu
•
Izomeryzacja prowadzona jest
przez akonitazę poprzez
pośredni związek – cis-akonitan
•
Akonitaza jest
stereospecyficzna i spośród 4
równoważnych chemicznie
atomów wodoru wybiera
zawsze ten sam
•
W skład akonitazy wchodzi
żelazo niezwiązane z hemem.
Trzy atomy żelaza i 4 atomy
siarki tworzą tzw. klaster
żelazowo-siarkowy o kształcie
zbliżonym do sześcianu. Klaster
wiąże się z akonitazą przez trzy
reszty cysteinowe enzymu.
Przyłączenie czwartego atomu
żelaza do jednego z rogów
sześcianu powoduje aktywację
akonitazy i przyłączenie
cytrynianu
Garrett & Grisham, Biochemistry
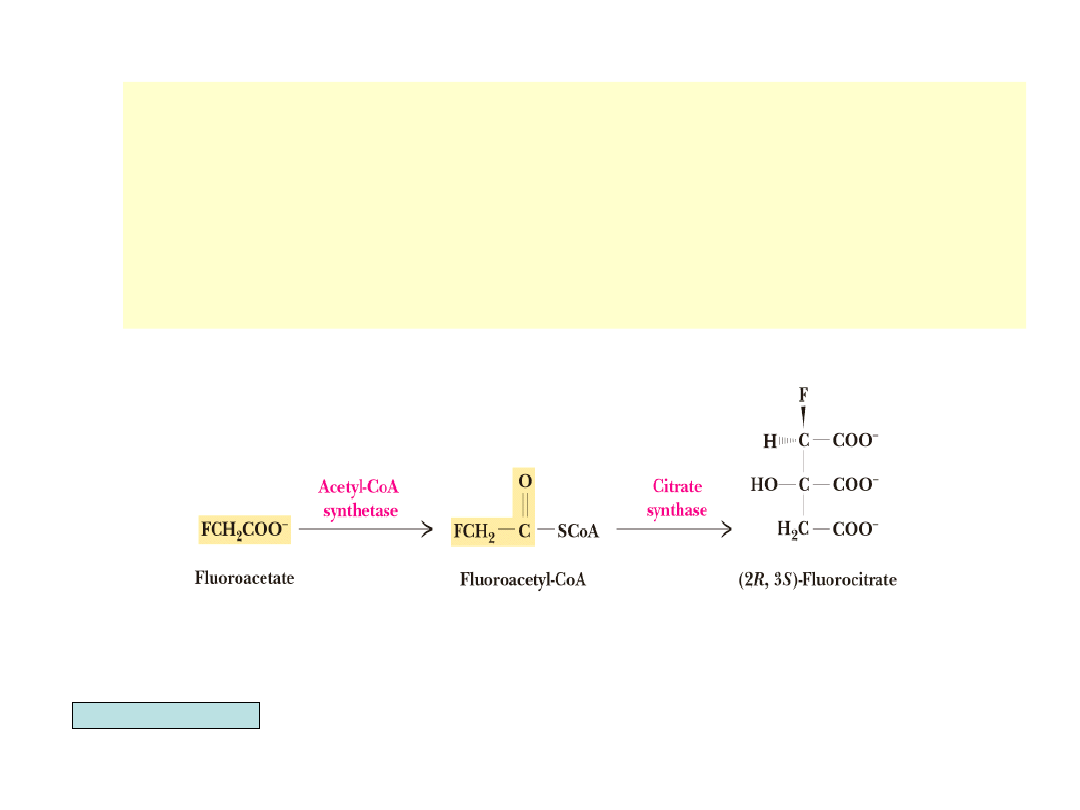
• Inhibitorem cyklu TCA in vivo (ale bez wpływu na
izolowa-ne enzymy cyklu) jest fluorooctan. Wchodzi on
do cyklu jako fluoroacetylo-CoA (syntetyzowany przez
acetylo-CoA syntetazę). Staje się substratem dla syntazy
cytryniano-wej, dając po reakcji z szczawiooctanem
fluorocytrynian, będący inhibitorem akonitazy.
• Jest to przykład tzw. inhibitora typu konia trojańskiego.
Garrett & Grisham, Biochemistry
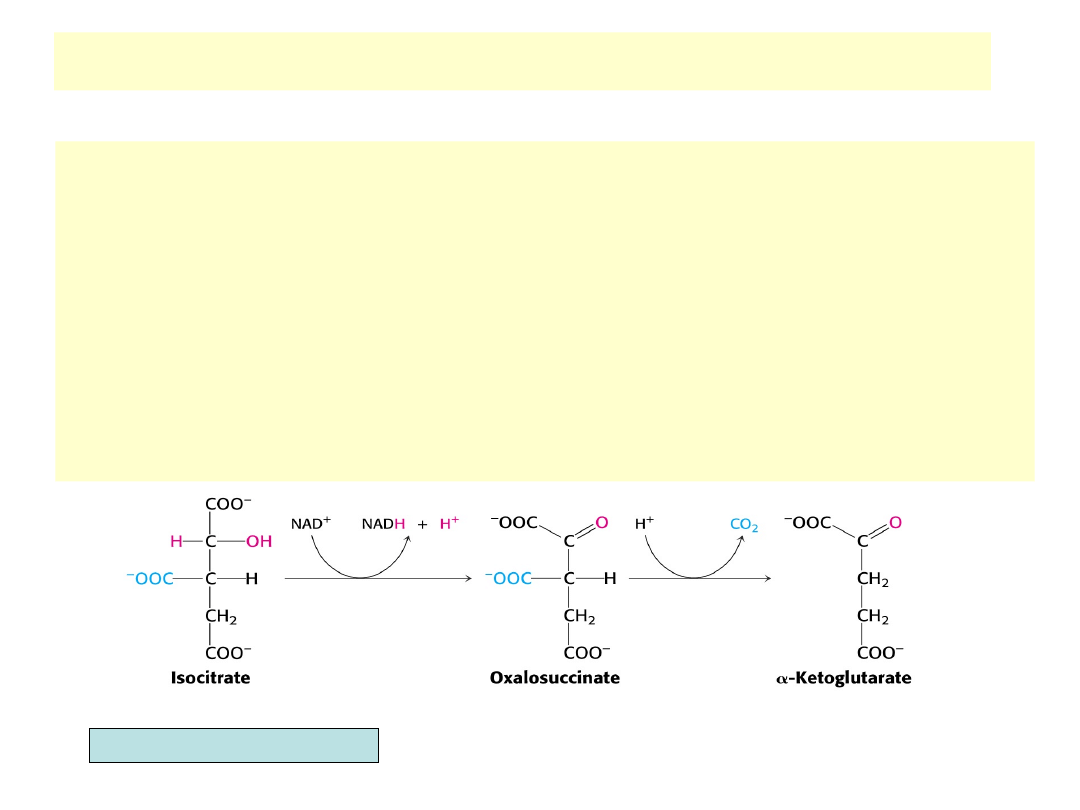
Utlenianie izocytrynianu do
-ketoglutaranu
•
Izocytrynian jest oksydacyjnie dekarboksylowany przez dehydrogenazę
izocytrynianową do -ketoglutaranu z równoczesną redukcją NAD
+
do NADH
G
0
’ wynosi dla tej reakcji –8.4 kJ/mol, co wystarcza, żeby przesunąć na prawo
równowagę poprzedniej reakcji cyklu (z akonitazą)
•
Reakcja jest dwustopniowa: (1) oksydacja alkoholu C2 prowadząca do powstania
szczawio-bursztynianu (intermediat), (2) -dekarboksylacja usuwająca centralną
grupę karboksylową w postaci CO
2
i dająca w rezultacie -ketoglutaran.
•
Reakcja dehydrogenazy izocytrynianowej jest pierwszym połączeniem między
cyklemTCA a fosforylacją oksydacyjną poprzez NADH.
•
Łącząc dwa cykle metaboliczne stanowi dobry punkt regulacyjny. NADH i ATP są
alloste-rycznymi inhibitorami. ADP jest allosterycznym aktywatorem, obniżając
10-krotnie K
M
wobec izocytrynianu. Enzym jest praktycznie nieaktywny przy
braku ADP.
•
Produkt reakcji: -ketoglutaran – zasadniczy -ketokwas dla reakcji
transaminacji, łączy cykl TCA z metabolizmem azotu.
Berg, Tymoczko, Stryer, Biochemistry
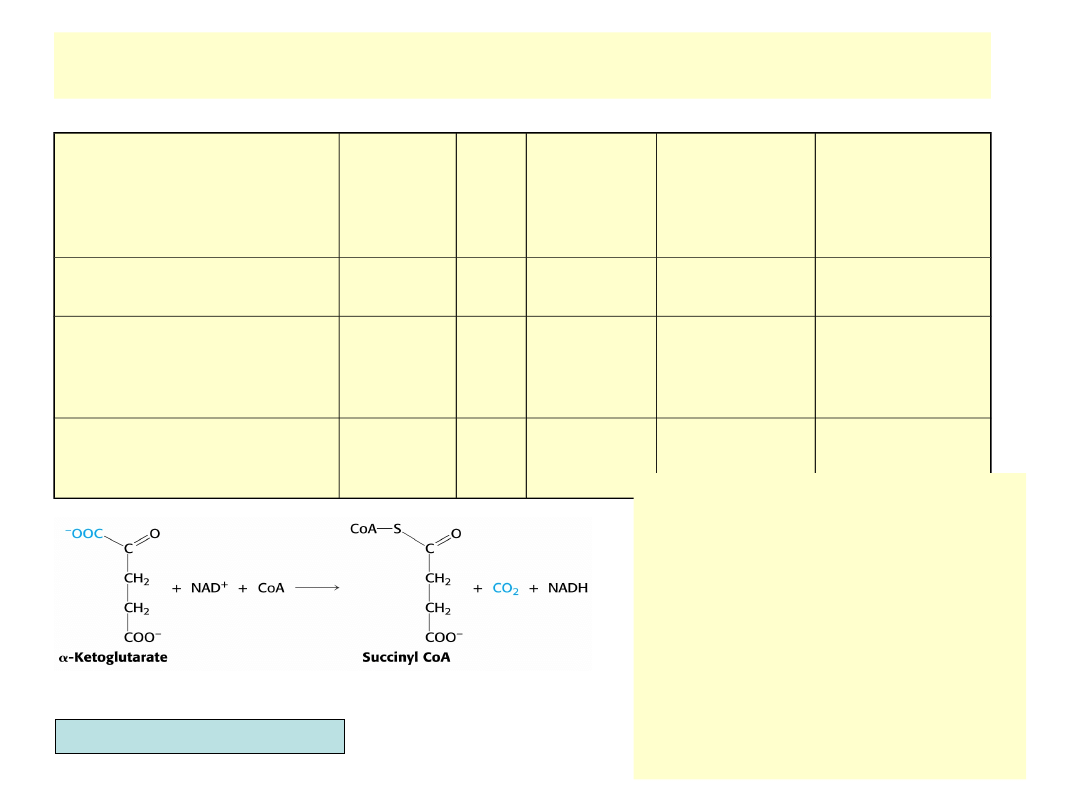
Reakcja dehydrogenazy
-ketoglutaranowej
Enzym
(E. coli)
Koenzy
m
M
r
(kD)
Ilość
podjedn.
M
r
podjednost
ek
(kD)
Ilość
podjedn. w
kompleksie
Dehydrogenaza
α-ketoglutaranu
TPP
192
2
96
24
Bursztynylotransferaza
(Transacylaza
bursztynianowa)
Kw.
liponowy
,
CoASH
170
0
24
70
24
Dehydrogenaza amidu
kwasu
liponowego
FAD,
NAD
+
112
2
56
12
• Jest drugą oksydacyjną
dekarboksylacją cyklu
TCA
• Dehydrogenaza
-
ketogluta-ranowa stanowi
multienzy-matyczny
kompleks
• Mechanizm reakcji jest
identyczny z reakcją
dehy-drogenazy
pirogronianowej
• Produktem reakcji jest
bursztynylo-CoA i NADH
Berg, Tymoczko, Stryer, Biochemistry
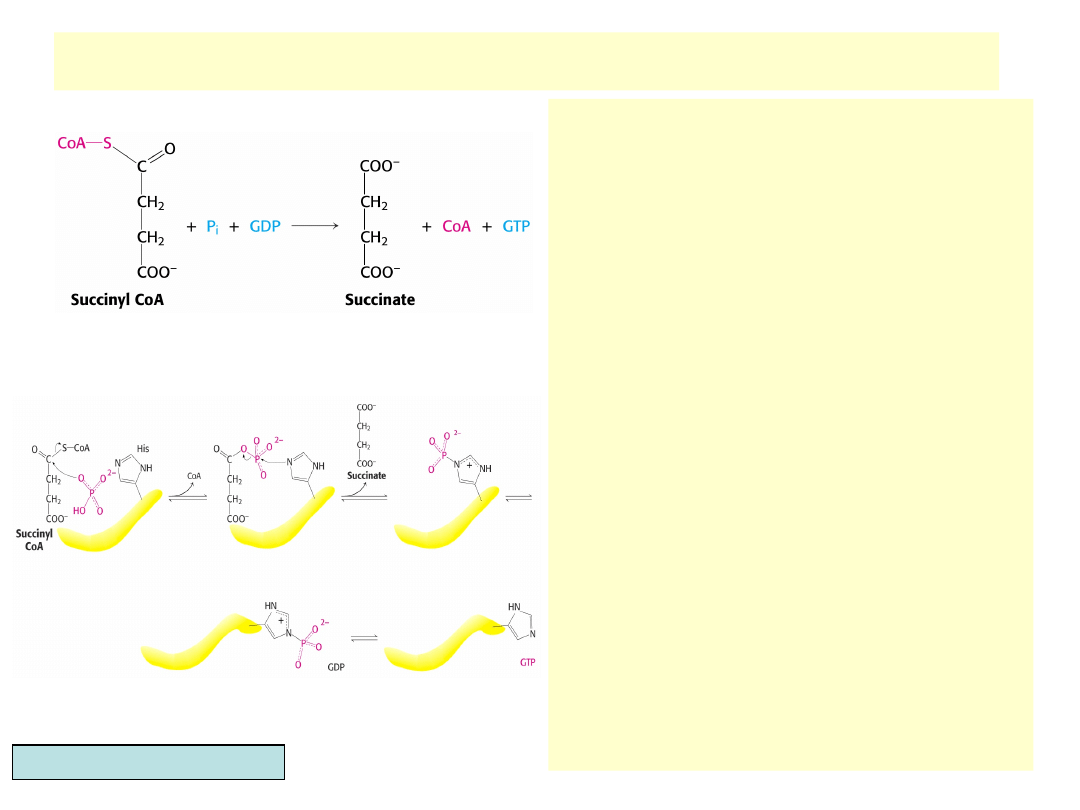
Reakcja syntetazy bursztynylo-CoA
•
Fosforylacja na poziomie
substratowym.
•
NADH z poprzedniego etapu
przekazuje elektrony (energię) na
syntezę ATP w fosforylacji
oksydacyjnej, bursztynylo-CoA, będąc
wysokoenergetycznym związkiem
używany jest w tej reakcji do syntezy
GTP (u ssaków) lub ATP (rośliny i
bakterie)
•
Reakcję katalizuje syntetaza
bursztynylo-CoA (tiokinaza
bursztynianowa)
G
0
’reakcji wynosi –3.3 kJ/mol
•
Jedyna reakcja substratowej
fosforylacji w cyklu
•
GTP powstający u ssaków może
wymie-niać terminalną resztę
fosforanową z ADP w reakcji z kinazą
nukleozydodifosforano-wą:
GTP+ADPATP+GDP
•
Mechanizm reakcji zawiera: (1)
wyparcie CoA przez fosforan, (2)
utworzenie w centrum aktywnym
bursztynylofosforanu, (3)
przemieszczenie reszty fosforanowej
na histydynę centrum aktywnego, (4)
powstanie bursztynianu, (5)
przeniesienie reszty fosforanowej na
GDP
Tioester[bursztynylo-P]
[fosfohistydyna] GTPATP
Berg, Tymoczko, Stryer, Biochemistry

• Pierwsze pięć reakcji cyklu TCA
polega-ło na wprowadzeniu
dwuwęglowego fragmentu jako
acetylo-CoA.
• Po połączeniu ze
szczawiooctanem nastąpiły dwie
dekarboksylacje (2 CO
2
),
powstały dwie cząsteczki NADH,
jedna cząsteczka GTP lub ATP i
jedna cząsteczka bursztynianu
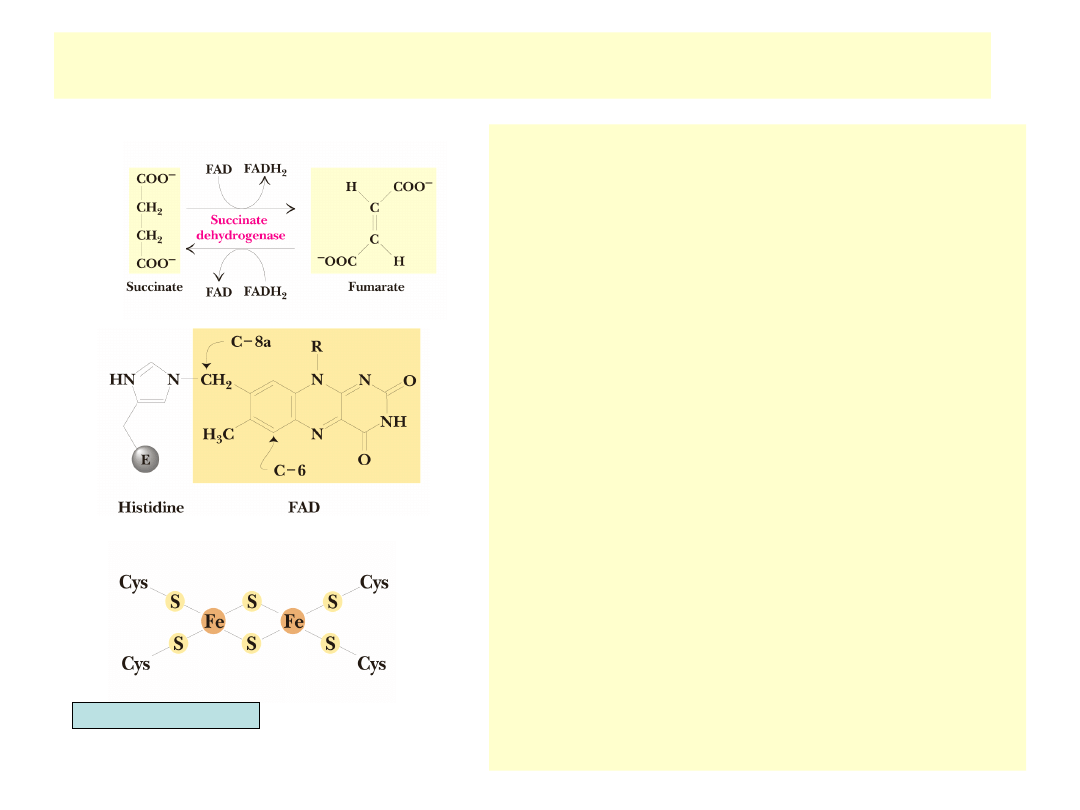
Reakcja dehydrogenazy bursztynianowej
•
Utlenianie bursztynianu z udziałem FAD
•
Enzym związany jest z wewnętrzną błoną
mito-chondrialną i stanowi część łańcucha
trans-portu elektronów (wchodzi w skład
reduktazy bursztynylo-koenzym Q)
•
Utlenianie bursztynianu polega na
usunięciu atomów wodoru z dwóch
sąsiednich węgli i powstaniu trans-
nienasyconego fumaranu. Reakcja
utleniania alkanu do alkenu nie jest
wystarczająco egzotermiczna żeby
zredukować NAD
+
, energii wystarcza tylko
na redukcję FAD (utlenianie alkoholi do
ketonów daje więcej energii i pozwala na
redukcję NAD
+
)
•
Dehydrogenaza bursztynianowa jest
dimerem (70 kD + 27 kD)
•
FAD wiąże się kowalencyjnie z większą
podjednostką (wiązanie między
metylenową grupą C8a FAD-u a N3
histydyny enzymu)
•
Enzym zawiera 3 różne klastery żelazowo-
siarkowe, które przechwytują elektrony z
FAD i przekazują na koenzym Q (UQ), ten
przekazuje je dalej do łańcucha transportu
elektronów.
Garrett & Grisham, Biochemistry
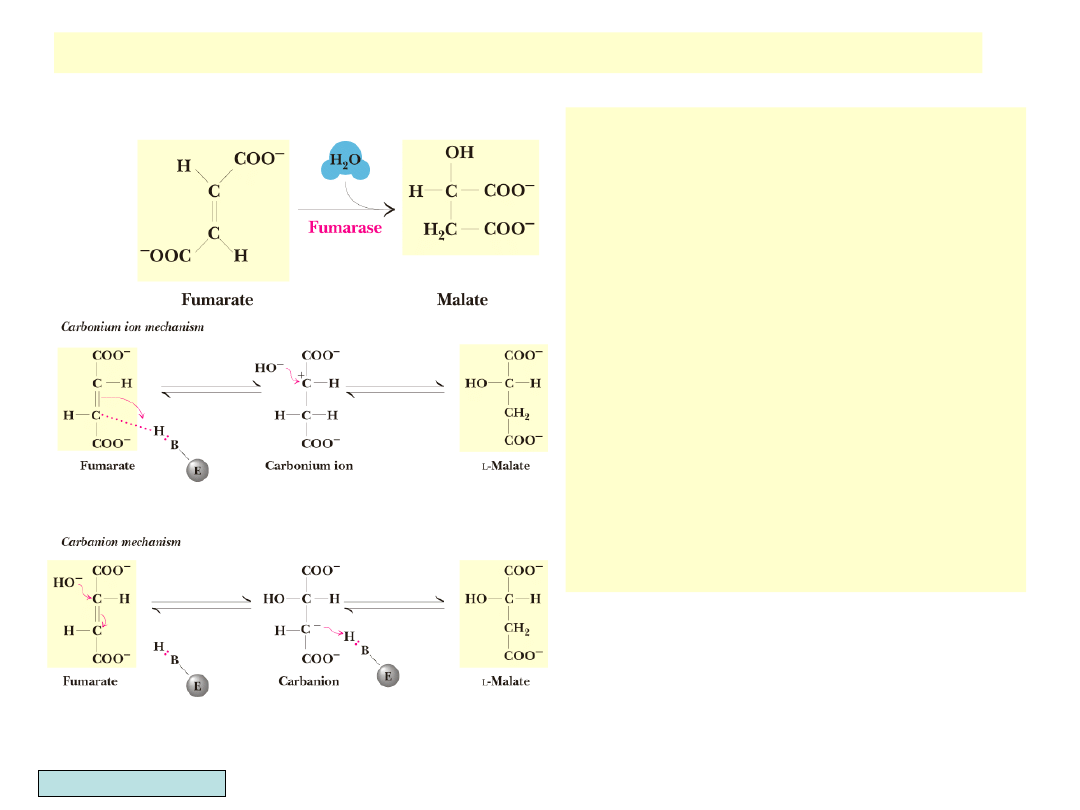
Reakcja trans-uwodnienia fumaranu
• Katalizowana przez fumarazę
• Stereospecyficzna reakcja
przyłączenia H i OH w pozycji
trans
• Produktem jest L-jabłczan
• Mechanizm reakcji jest
niepewny: może zawierać
protonację pod-wójnego
wiązania z wytworzeniem jonu
karboniowego jako inter-
mediatu albo może polegać na
ataku cząsteczki wody lub jonu
hydroksylowego, w wyniku
czego powstaje karboanion
jako związek pośredni i L-
jabłczan jako produkt
Garrett & Grisham, Biochemistry
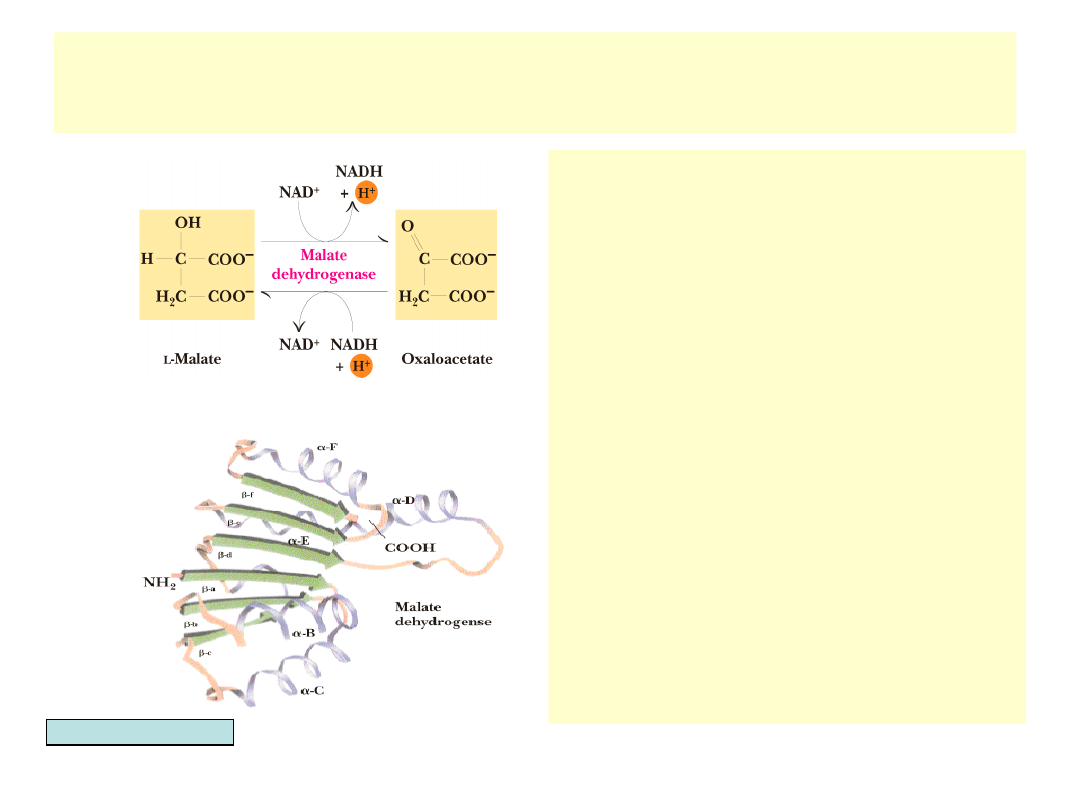
Ostatnia reakcja cyklu TCA – dehydrogenaza jabłczanowa
• L-jabłczan utleniany jest przez
dehydrogenazę jabłczanową
do szczawiooctanu
• Reakcja jest bardzo
endotermiczna (+30 kJ/mol)
• Reakcja napędzana jest przez
następną w cyklu reakcję
syntazy cytrynianowej
• Utlenianie jabłczanu związane
jest z redukcją NAD
+
(trzecia w
cyklu)
• Dehydrogenaza jabłczanowa
jest strukturalnie i
funkcjonalnie podobna do
innych dehydrogenaz (np.
dehydrogenazy mleczanowej)
• Zbudowana jest z przemiennie
wys-tępujących fragmentów -
struktury i -helisy
• Wiązanie NAD
+
powoduje
konfor-macyjne zmiany w 20-
aminokwa-sowym fragmencie
wiążącym -struktury D i E.
Garrett & Grisham, Biochemistry

Podsumowanie cyklu TCA
• Utlenienie jednej reszty octanowej daje dwie cząsteczki CO
2
,
jedną cząsteczkę ATP i cztery cząsteczki zredukowanych
koenzymów:
Acetylo-CoA + 3NAD
+
+ [FAD] + ADP + P
i
+ 2H
2
O 2CO
2
+
3NADH +
+ 3H
+
+ [FADH
2
] + ATP + CoASH
• Sumarycznie cykl jest procesem egzoergicznym, jeden obrót
cyklu daje
G
0
’=-40 kJ/mol
• Jedna cząsteczka glukozy poprzez glikolizę daje dwie
cząsteczki pirogronianu i w konsekwencji dwie cząsteczki
acetylo-CoA, które mogą wejść w cykl TCA
Glukoza + 2H
2
O + 10NAD
+
+ 2[FAD] + 4ADP + 4P
i
6CO
2
+10NADH + 10H+ + 2[FADH
2
] + 4ATP
• Wszystkie 6 węgli glukozy są uwalniane jako CO
2
, 4
cząsteczki ATP powstają na drodze fosforylacji substratowej,
12 zredukowanych cząsteczek koenzymów poprzez szlak
transportu elektronów i fosforylacji oksydacyjnej
wyprodukować może 34 cząsteczki ATP (10x3) + (2x2):
NADH + H
+
+ ½ O
2
+ 3ADP + 3P
i
NAD
+
+ 3ATP + 4H
2
O
[FADH
2
] + ½O
2
+ 2ADP + 2P
i
[FAD] + 2ATP + 3H
2
O
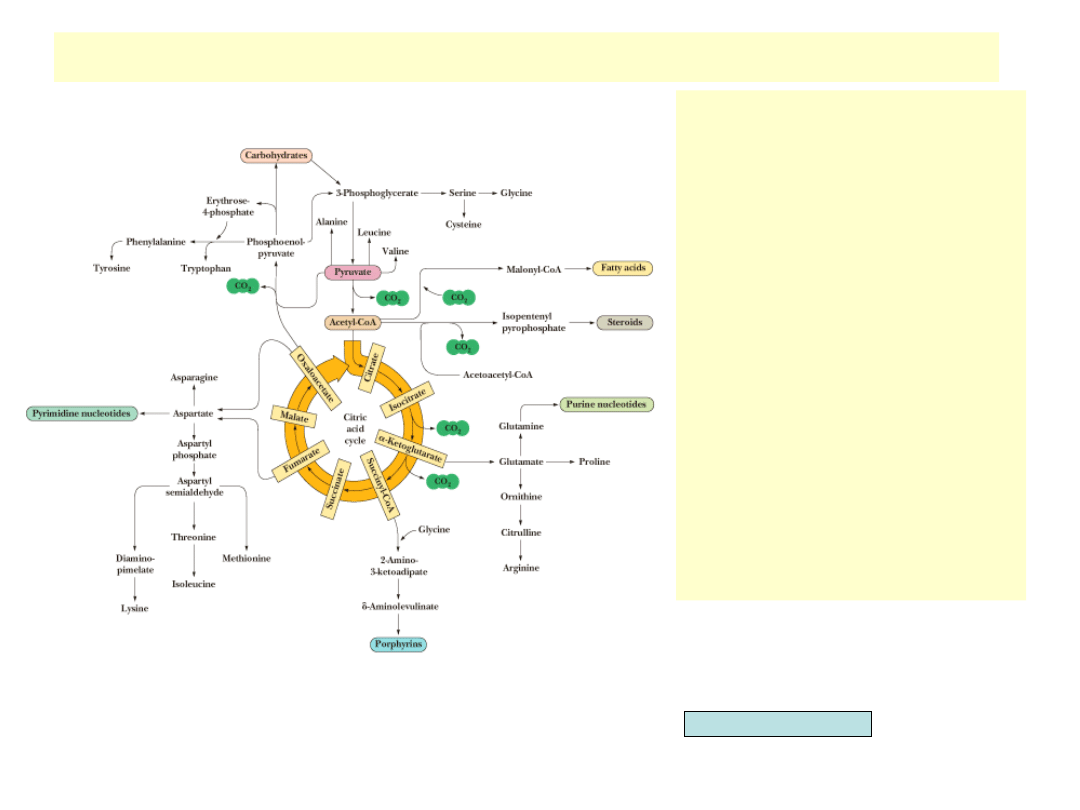
Cykl TCA dostarcza substratów do biosyntezy
•
Cykl ma zasadniczo charakter
kataboliczny, jednak szereg jego
intermediatów jest eksportowanych z
mitochondriów do cytoplazmy i
używanych jako substraty w
procesach biosyntetycznych
-ketoglutaran w reakcji
transaminacji przekształcany jest w
glutaminian, będący prekursorem
proliny, argininy i glutaminy
•
Bursztynylo-CoA dostarcza atomów
węgla do syntezy porfiryn
•
Szczawiooctan po transaminacji
przekształcany jest w kwas
asparaginowy będący prekursorem
dla syntezy nukleotydów
pirymidynowych, asparaginy, lizyny,
treoniny, izoleucyny i metioniny
•
Dekarboksylacja szczawiooctanu
przekształca go w
fosfoenolopirogronian będący u
roślin i mikroorganizmów
prekursorem aromatycznych
aminokwasów (tyrozyny,
fenyloalaniny i tryptofanu)
•
Przekształcenie
fosfoenolopirogronianu w 3-
fosfoglicerynian prowadzi do dalszej
biosyntezy seryny, glicyny i cysteiny
Garrett & Grisham, Biochemistry
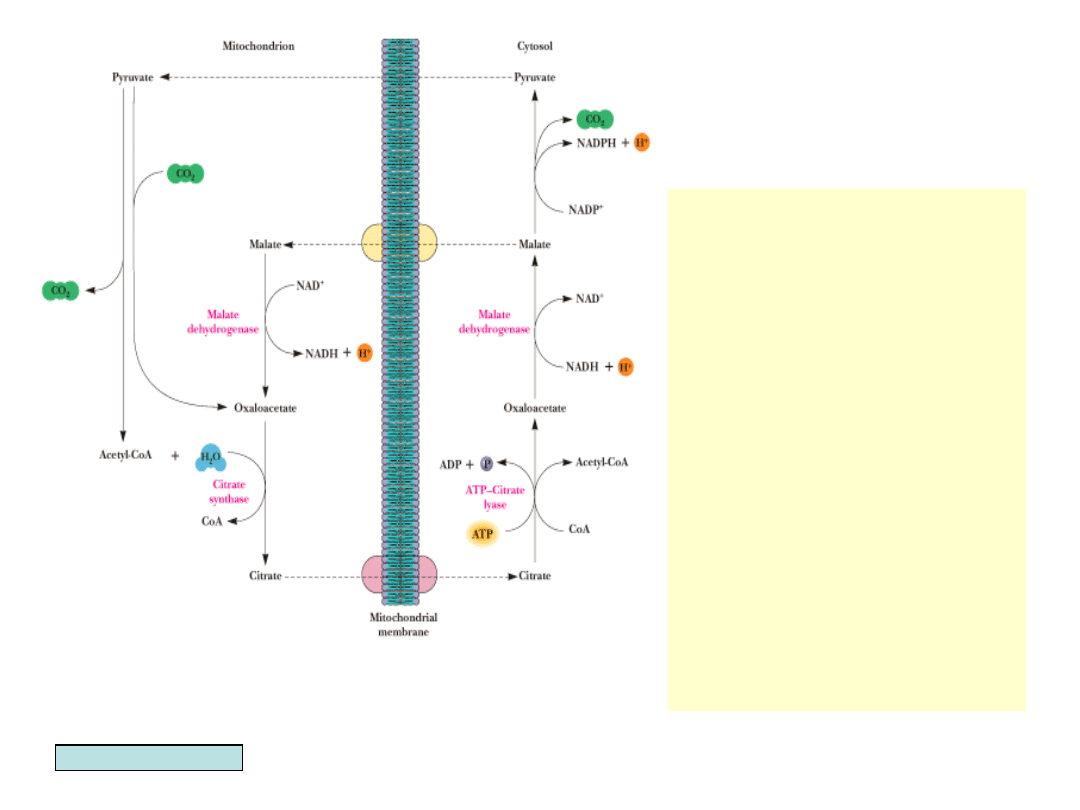
• Cytrynian może być
eksportowany z mito-
chondriów i rozkładany
przez liazę cytrynian-
ATP do szczawiooctanu
i acetylo-CoA, który
uży-wany jest do
biosyntezy kwasów
tłuszczowych.
• Powstały
szczawiooctan może
ulec szybkiej redukcji
do jabłczanu. Ten albo
jest transpor-towany
do mitochon-drium
albo dekarboksy-
lowany do
pirogronianu, który
także jest transpor-
towany do mitochon-
drium
Garrett & Grisham, Biochemistry

Reakcje anaplerotyczne
Komórkowy metabolizm również zaopatruje cykl TCA
w intermediaty poprzez tzw. reakcje anaplerotyczne
Nelson, Cox, Lehninger Principles of Biochemistry
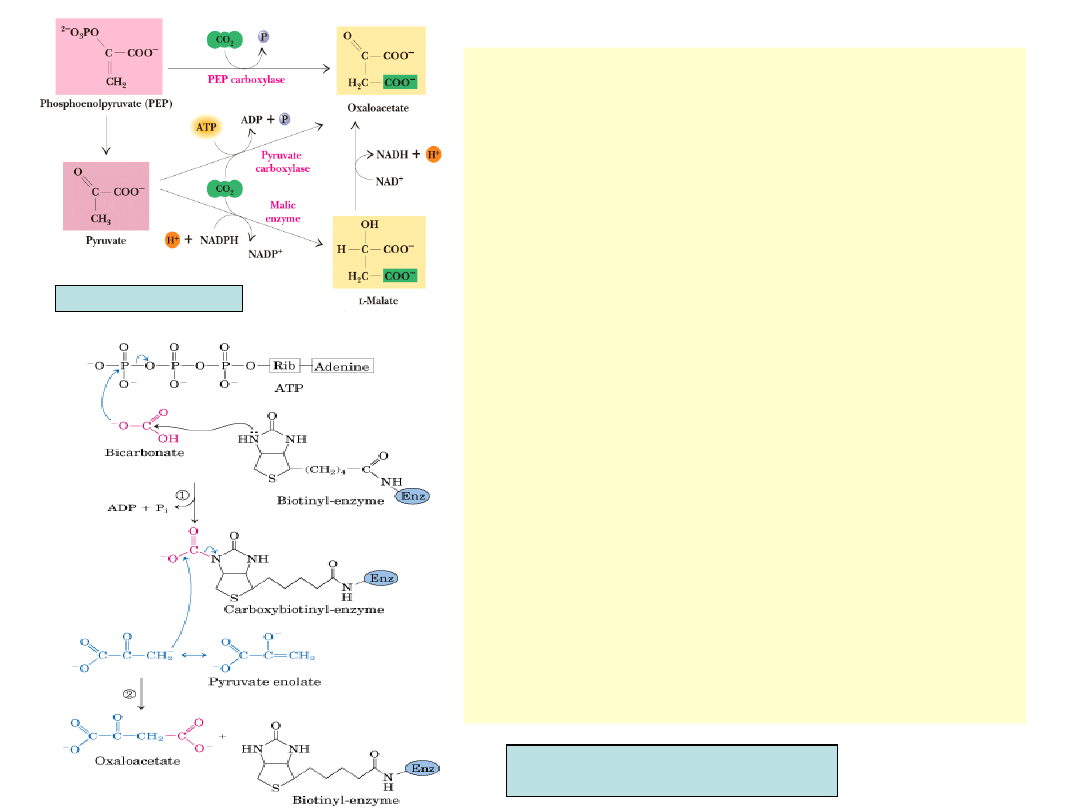
•
Karboksylaza fosfoenolopirogronianowa z
PEP, a karboksylaza pirogronianowa z
pirogronianu syn-tetyzują szczawiooctan
•
Karboksylaza pirogronianowa występuje
tylko w zwierzęcych mitochondriach i
stanowi bezpoś-redni łącznik między
glikolizą a cyklem TCA. Jest tetramerem
wiążącym cząsteczkę biotyny i atom Mg
2+
z
każdą podjednostką. Wymaga acetylo-CoA
jako allosterycznego efektora. Jeśli poziom
acety-lo-CoA przewyższa dostępny poziom
szczawio-octanu, to allosteryczna aktywacja
przez acetylo-CoA przyspiesza działanie
karboksylazy i zwięk-sza poziom
szczawiooctanu, umożliwiając syn-tezę
pierwszego intermediatu cyklu TCA –
cytrynianu
•
Karboksylaza fosfoenolopirogronianowa
wystę-puje u drożdży, bakterii i roślin, nie
ma jej u zwie-rząt. Inhibowana jest przez kw.
asparaginowy (z transaminacji
szczawiooctanu). Enzym kontroluje w ten
sposób produkcję kwasu asparaginowego w
organizmie
•
Katabolizm aminokwasów dostarcza
pirogronia-nu, acetylo-CoA, szczawiooctanu,
fumaranu, -ketoglutaranu, bursztynianu.
Związki te mogą być utleniane w cyklu TCA.
Białka stanowią więc doskonałe źródło
energii
Garrett & Grisham, Biochemistry
Nelson, Cox, Lehninger Principles of Biochemistry
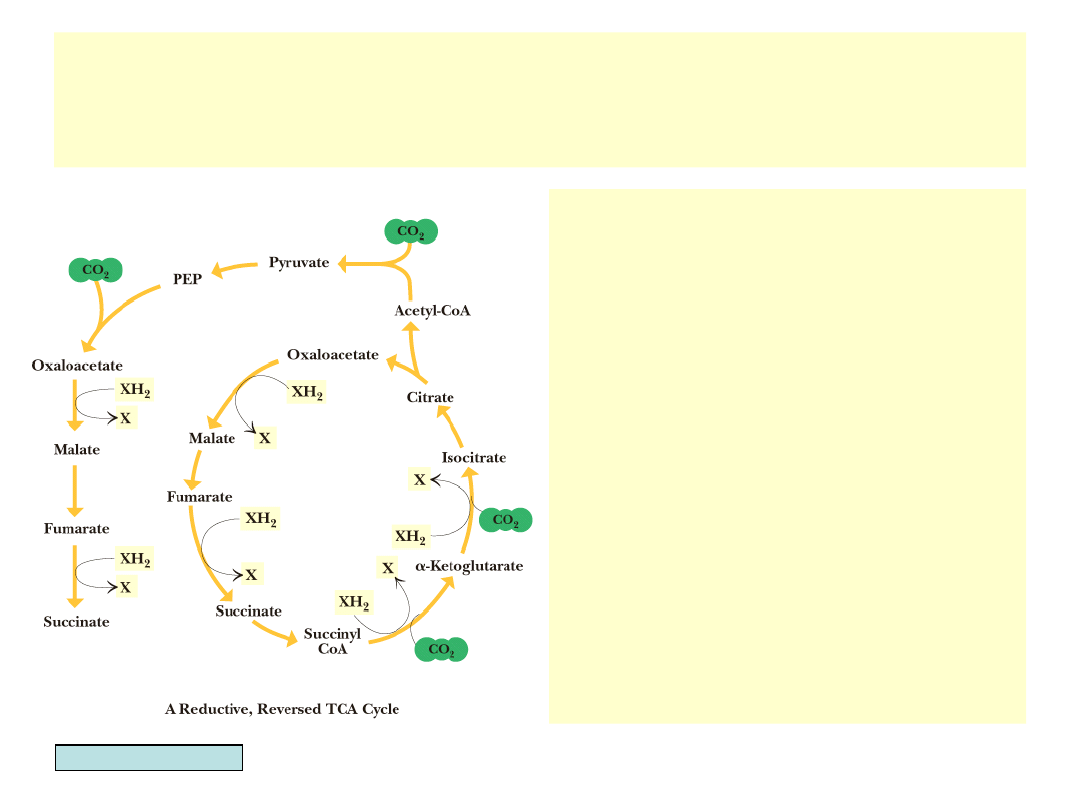
Odwrotny cykl kwasów trójkarboksylowych – pierwotny szlak
metaboliczny?
(Hipoteza G. Wächterhausera)
• Odwrócenie cyklu mogłoby
powo-dować asymilację dwóch
cząste-czek CO
2
i powstanie 1
cząsteczki izocytrynianu w
jednym obrocie cyklu oraz
asymilację dwóch dodat-kowych
cząsteczek CO
2
w redukcyj-nym
przejściu od acetylo-CoA do
szczawiooctanu
• Na każdą cząsteczkę
bursztynianu wchodzącą w cykl
przypadałaby synteza nowej
cząsteczki tego związku
• Cykl mógłby być napędzany
reakcją:
FeS + H
2
S FeS
2
(piryt) + H
2
G
0
’= -38 kJ/mol
• Duża ilość związków żelaza i
siarki w archaicznym środowisku
mogła-by się przyczynić do
rozwoju białek zawierających
struktury siarkowo-żelazowe
Garrett & Grisham, Biochemistry
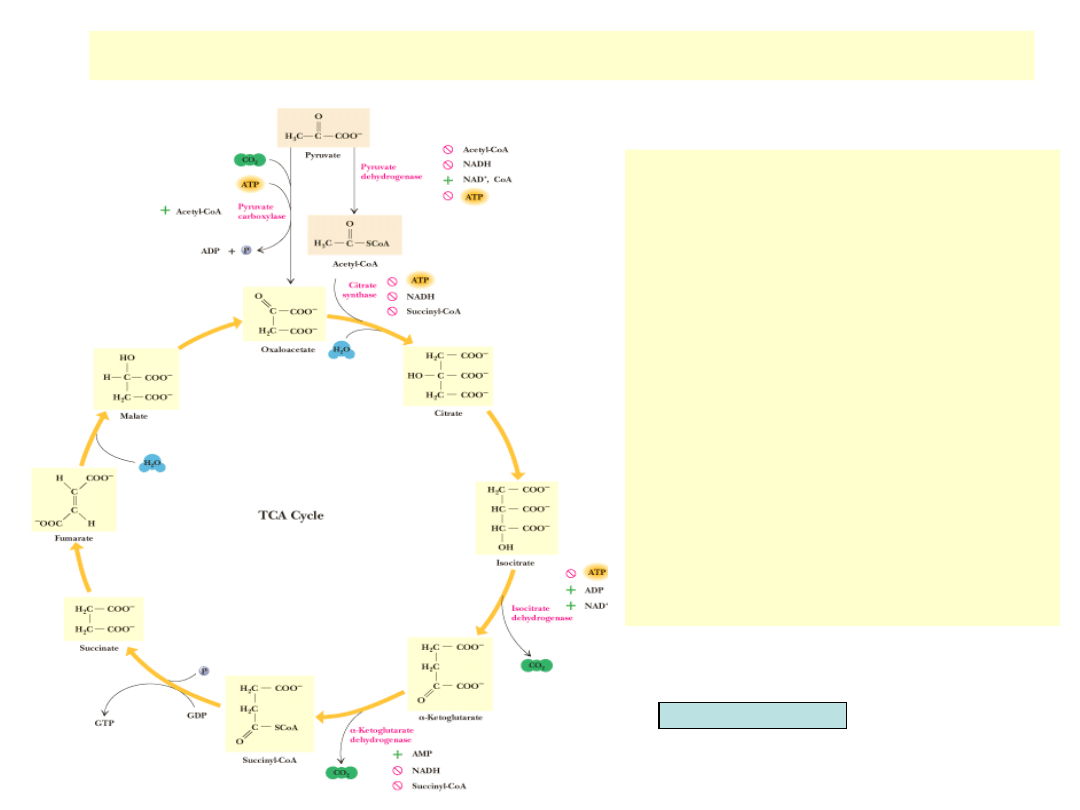
Regulacja cyklu TCA
•
Cykl regulowany jest przez reakcje z dużą
ujemną zmianą G
0
’: reakcje syntazy
cytrynianowej, dehydrogenazy
izocytrynianowej i dehydrogenazy -
ketoglutaranu
•
Regulacja występuje również na poziomie
reakcji bezpośrednio poprzedzającej cykl
(dehydrogenaza pirogronianowa)
•
Wszystkie wymienione wyżej enzymy
hamowane są przez NADH
•
ATP inhibuje dehydrogenazę pirogronianową,
syntazę cytrynianową i dehydrogenazę
izocytry-nianową
•
Cykl jest aktywowany przez wysoki stosunek
ADP/ATP lub NAD
+
/NADH
•
O wszystkich powyższych regulacjach
decyduje stan energetyczny komórki
•
Wewnątrz cyklu istnieje inhibicja syntazy
cytry-nianowej i dehydrogenazy -
ketoglutaranowej przez bursztynylo-CoA
•
Acetylo-CoA inhibuje dehydrogenazę pirogro-
nianową, a aktywuje karboksylazę
pirogronianową dostarczającą
szczawiooctanu do wiązania acetylo-CoA
Garrett & Grisham, Biochemistry
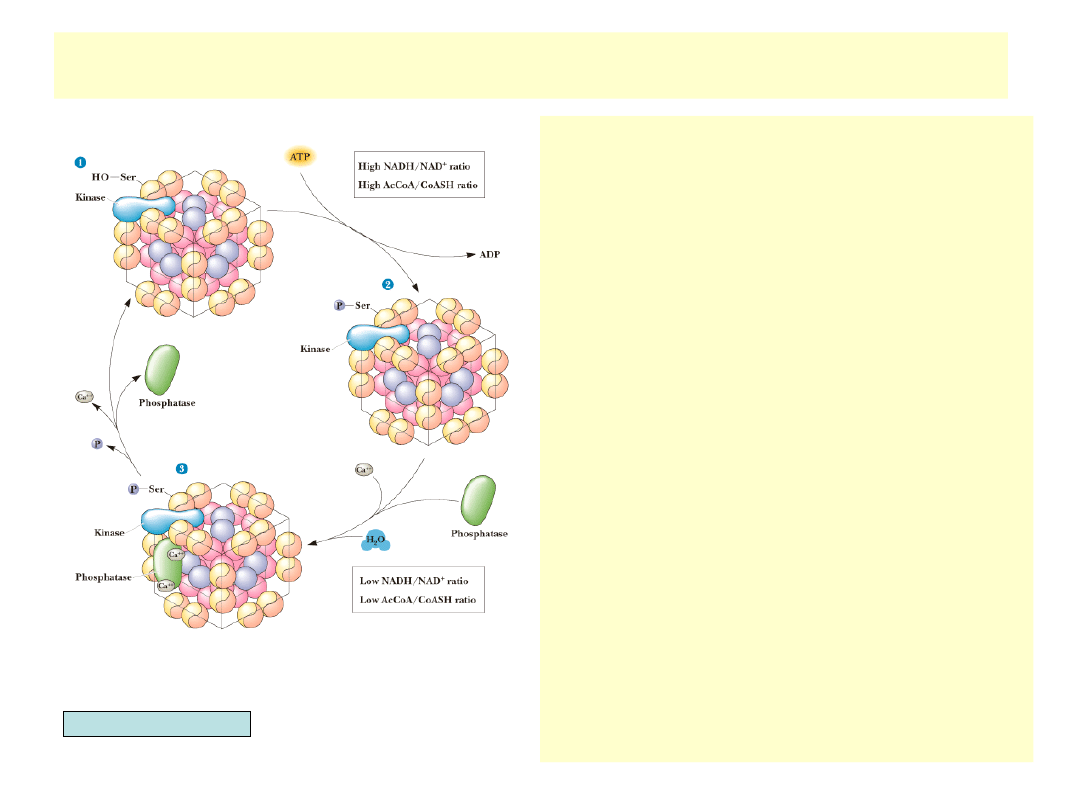
Regulacja dehydrogenazy pirogronianowej
•
Enzym odgrywa zasadniczą rolę w
kiero-waniu produktów glikolizy
(pirogronianu) po konwersji do acetylo-
CoA na drogę utleniania w cyklu TCA
lub szlak syntezy kwasów tłuszczowych
•
Wysoki poziom produktów: acetylo-CoA
i NADH hamuje kompleks
enzymatyczny. Acetylo-CoA działa na
transacetylazę dihy-droliponianową,
NADH na dehydrogenazę
dihydroliponianową
•
Ssacza dehydrogenaza pirogronianowa
regulowana jest przez kowalencyjną
modyfikację (fosforylację). Enzymem
modyfikującym jest Mg
2+
-zależna kinaza
dehydrogenazy pirogronianowej.
Kinaza aktywowana jest allosterycznie
przez NADH i acetylo-CoA.
Defosforylacja dehydrogenazy
pirogronianowej zachodzi przez
działanie specyficznej fosfatazy
aktywowanej przez Ca
2+
, niski stosunek
NADH
+
/NAD i niski poziom acetylo-CoA.
Insulina i Ca
2+
aktywują defosforylację,
pirogronian inhibuje fosforylację
•
Dehydrogenaza pirogronianowa jest
wrażliwa na stan energetyczny
komórki. Wysoki poziom AMP (słabe
zaopatrzenie komórki w energię)
uruchamia dehydroge-nazę. Wysoki
poziom GTP hamuje enzym.
Garrett & Grisham, Biochemistry
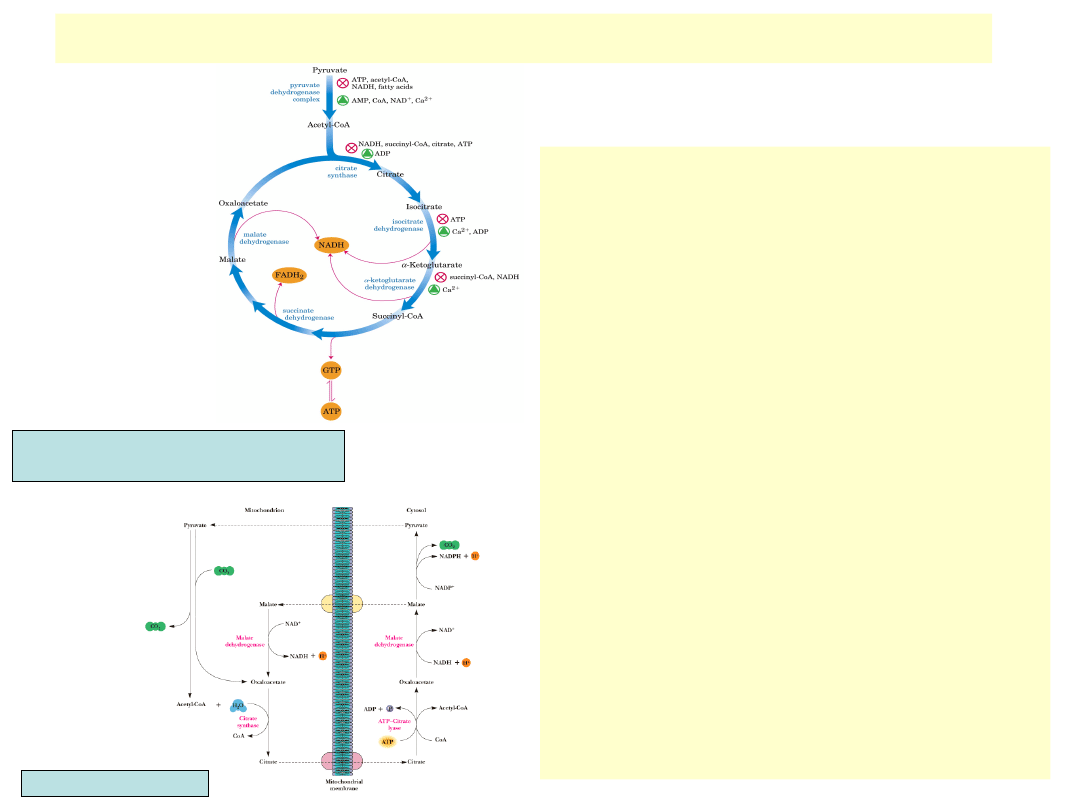
Regulacja dehydrogenazy izocytrynianowej
• Wysokie stosunki stężeń NAD
+
/NADH
i ADP/ATP stymulują dehydrogenazę
izocytrynianową
• U E. coli występuje kowalencyjna
mo-dyfikacja (fosforylacja i
defosforylacja) enzymu. Wysoki
poziom intermediatów cyklu TCA
stymuluje specyficzną de-
fosforylującą fosfatazę, niski poziom
intermediatów stymuluje kinazę,
która fosforylując, inaktywuje
dehydrogena-zę izocytrynianową.
Następuje wtedy kierowanie
substratu dehydrogenazy
(izocytrynianu) na szlak cyklu kwasu
glioksalowego
• Regulacja dehydrogenazy
izocytrynia-nowej wpływa na
cytoplazmatyczną syntezę acetylo-
CoA z cytrynianu. Cytrynian
pochodzi tu z mitochon-drium.
Aktywna dehydrogenaza fawo-ryzuje
kataboliczny szlak dla cytrynia-nu
(wewnątrz cyklu TCA). Inaktywacja
dehydrogenazy zwiększa eksport
cytrynianu na zewnątrz mitochon-
drium, gdzie zachodzi jego
degradacja do szczawiooctanu i
acetylo-CoA.
Nelson, Cox, Lehninger Principles of Biochemistry
Garrett & Grisham, Biochemistry
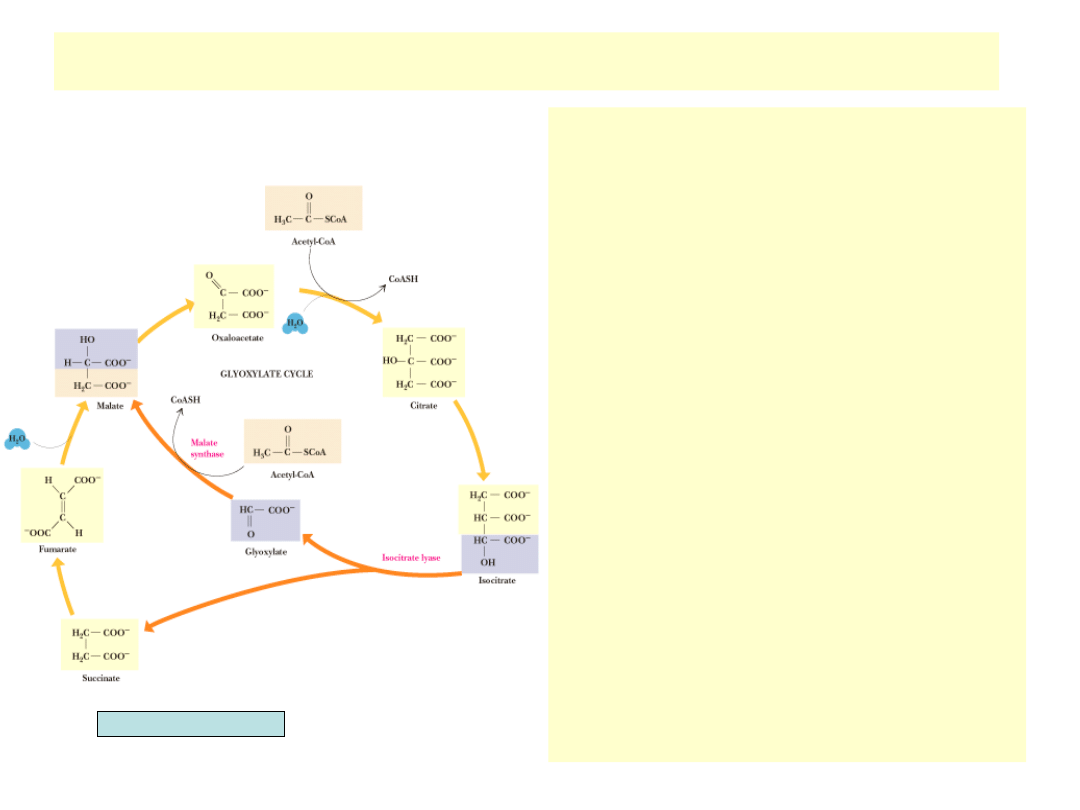
Cykl glioksalowy (bakterie i rośliny)
• Rośliny (szczególnie kiełki
jeszcze niezdolne do
fotosyntezy), a także glony i
bakterie mogą poprzez cykl
glioksalowy używać octanu jako
wyłącznego źródła syntezy
wszystkich związków
węglowych
• Cykl TCA nakierowany jest na
produkcję energii i “marnuje”
łańcuchy węglowe
przekształcając je w lotny CO
2
.
Modyfikacja cyklu TCA zwana
cyklem glioksalowym produkuje
z reszt octowych cztero-
węglowe kwasy karboksylowe
(a w konsekwencji cukry)
• Cykl glioksalowy omija dwie
dekarboksylacje, kierując
izocytrynian do reakcji z liazą
izocytrynianową, powstający
gliok-salan reaguje z cząsteczką
acetylo-CoA, dając pod
wpływem syntazy jabłczanowej
jabłczan
Garrett & Grisham, Biochemistry
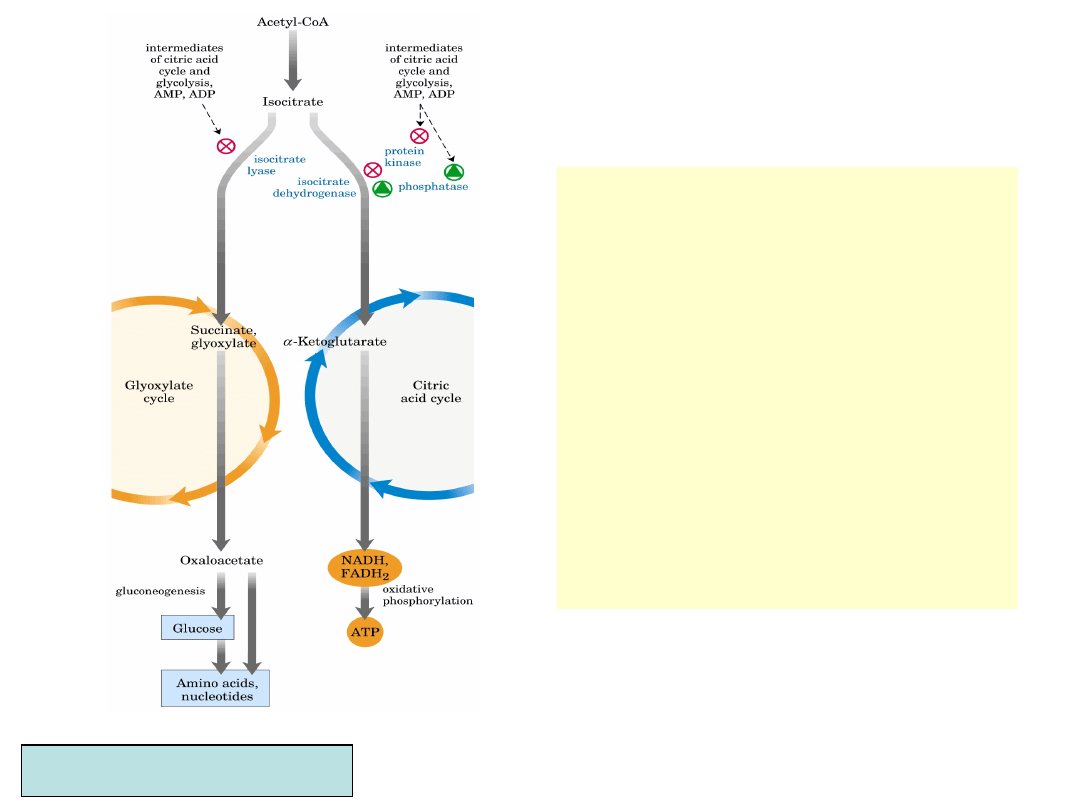
• Końcowy efekt cyklu –
z dwóch reszt acetylo-
CoA powstaje jeden
szczawio-octan,
którego część
przekształcana jest w
PEP i dalej w glukozę
• U bakterii i glonów cykl
glioksalowy zachodzi w
cytoplazmie, u roślin w
wyspecjalizowanych
organellach – glioksy-
somach
Nelson, Cox, Lehninger Principles of Biochemistry
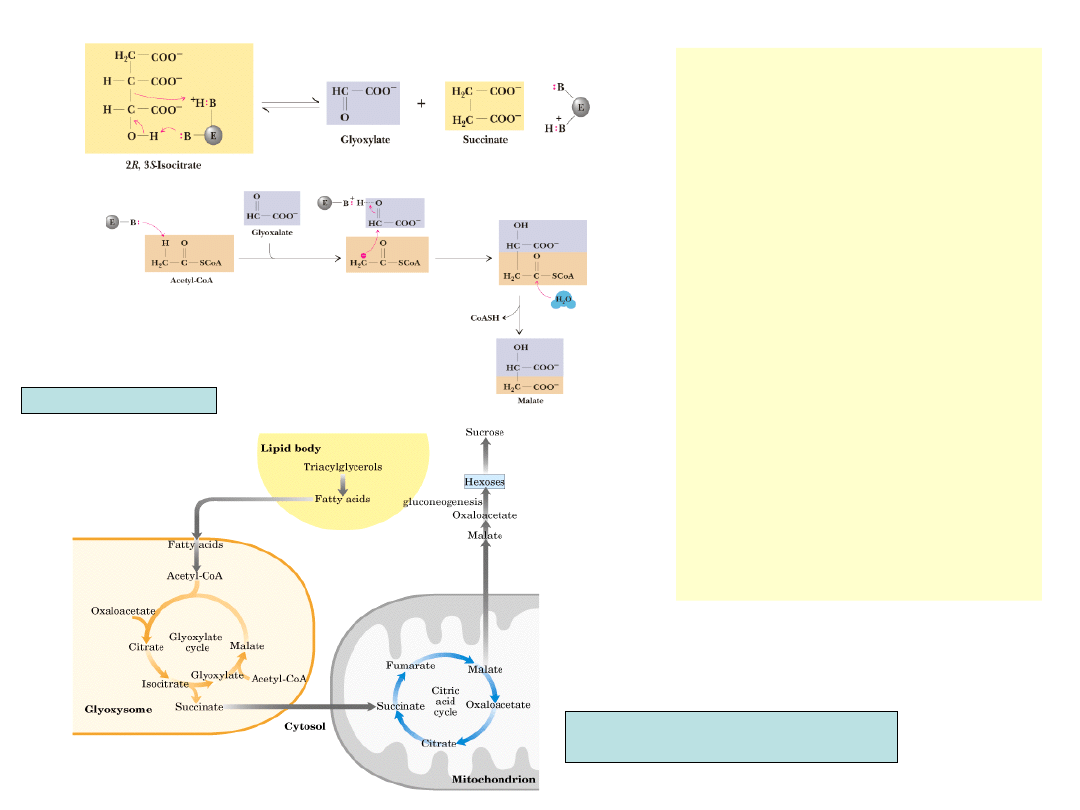
•
Liaza izocytrynianowa prowadzi
reakcję o mechanizmie
zbliżonym do aldolazy z
glikolizy
•
Kondensacja acetylo-CoA z
glioksalanem jest podobna do
reakcji syntazy cytrynianowej
•
Cykl glioksalowy ma tylko 5
etapów w porównaniu z 8
etapami cyklu TCA
•
Nie powstaje w nim CO
2
•
Na 1 cykl zużywa się 2
cząsteczki acetylo-CoA i
powstaje 1 czterowę-glowa
cząsteczka szczawiooctanu
•
Dzięki cyklowi glioksalowemu
możliwy jest rozwój nasion w
ciemności przy braku
fotosyntezy. Acetylo-CoA
pochodzi z degradacji kwasów
tłuszczowych z zapasów
lipidowych nasion
•
Po rozpoczęciu fotosyntezy
glioksysomy zanikają
Garrett & Grisham, Biochemistry
Nelson, Cox, Lehninger Principles of Biochemistry
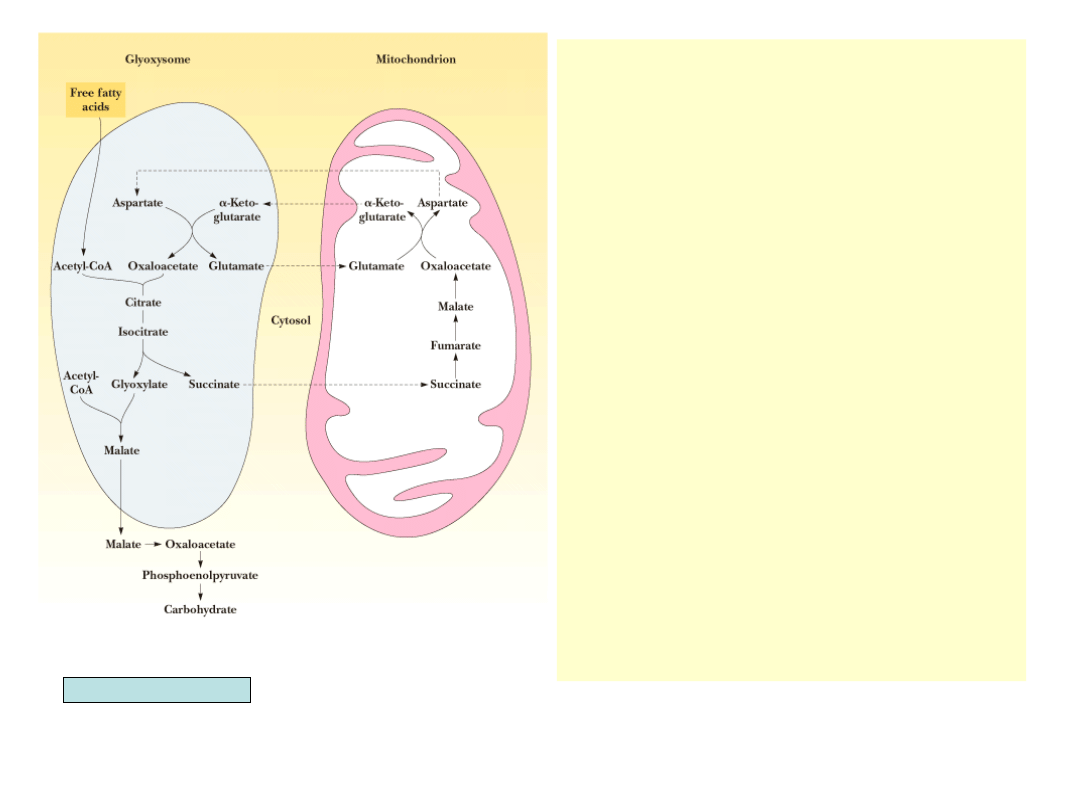
• W glioksysomach brakuje
dehydro-genazy
bursztynianowej, fumarazy i
dehydrogenazy jabłczanowej.
Do przeprowadzenia cyklu
konieczna jest kooperacja z
mitochondrium. Bursztynian
przenoszony jest z
glioksysomów do
mitochondrium, tam
przekształcany jest kolejno w
szczawiooctan i asparaginian,
który wraca do glioksysomów
(sam szczawiooctan nie może
opuścić mitochondrium). W
glioksysomach asparaginian po
transaminacji przekształcany
jest w szczawio-octan
• Grupy aminowe z
asparaginianu przenoszone są
na -ketoglutaran. Powstały w
ten sposób glutaminian
eksportowany jest do
mitochon-drium, gdzie
dostarcza reszt ami-nowych do
aminacji szczawioocta-nu
Garrett & Grisham, Biochemistry
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
Wyszukiwarka
Podobne podstrony:
Cykl kwasów trikarboksylowych, Biochemia
Równowaga kwasowo zasadowa fizjot3
8 Cykl koniunkturalny
Oznaczanie kwasowości
Cykl życiowy komórki
Rˇwnowaga kwasowo zasadowa
5a Równowaga kwasowo
Trójkąty podobne
Równowaga kwasowo zasadowa fizjot3
Prezentacja trójkątów Pascala
!!!Właściwości nasyconych kwasów karboksylowych
Kąpiele kwasowęglowe
Wskaźniki kwasowo zasadowe
więcej podobnych podstron