
Seminarium 2
Równowaga kwasowo-
zasadowa
Biochemia z biofizyką

• We wszystkich roztworach wodnych iloczyn
stężeń molarnych jonów wodorowych i
wodorotlenowych zwany
iloczynem jonowym
wody
jest wielkością stałą i zależną tylko od
temperatury
• pH ujemny logarytm ze stężenia jonów
wodorowych
• W temperaturze 23°C iloczyn jonowy wody
wynosi
10
-14
[H
+
] x [OH
-
] = 10
-14

pH = - log
10
[H
+
]
Prawidłowe pH krwi tętniczej wynosi
7,40
a żylnej
7,35
Życie jest możliwe w stosunkowo wąskich granicach
pH od
6,8 - 7,8
Wartość pH płynów śródkomórkowych, w których na
skutek procesów metabolicznych stale tworzy się
dwutlenek węgla i inne kwaśne metabolity jest
mniejsza niż krwi i wynosi średnio 7,0, wahając się od
4,5 – 8,0
Im większy metabolizm i im wolniejszy przepływ krwi,
tym więcej gromadzi się dwutlenku węgla i jest niższe
pH

Czynniki zakwaszające
1)
CO
2
– 250 ml/min = 360 l/dobę = 10 000 mMoli H
+
{ale dzięki płucom jest wydalany na zewnątrz}
2)
Kwasy
: siarkowy, fosforowy, mlekowy, solny,
moczowy, cytrynowy – 50-100 mMoli/dobę
Głównym źródłem jest metabolizm, szczególnie
białkowy
{dzięki nerkom nielotne kwasy są usuwane na
zewnątrz}
Im większa kwasica, tym więcej nerki produkują
amoniaku

BUFORY
1) CHEMICZNE
• hemoglobinowy
• białczanowy
• wodorowęglanowy
• fosforanowy
2) BIOLOGICZNE
• układ oddechowy
• nerki

• bufory chemiczne zapobiegają zmianom
stężenia jonów wodorowych już w ułamku
sekundy
• układ oddechowy niweluje zmiany stężeń tych
jonów w ciągu 1-3 minut
• nerki (najważniejszy mechanizm buforowania
biologicznego) wyrównują stężenie jonów
wodorowych w ciągu kilku do 24 godzin
• układ oddechowy posiada pojemność
buforową 2 razy większą od wszystkich
chemicznych układów buforowych ustroju, a
nerki – wielokrotnie większą niż układ
oddechowy

BUFOR WODOROWĘGLANOWY
równanie Hendersona-Hasselbalcha:
pH = 6,1 + log [HCO
3-
] / [CO
2
]
zatem: pH = const. + nerki / płuca
• bufor wodorowęglanowy jest stosunkowo
słaby
• mimo to jest to
NAJWAŻNIEJSZY BUFOR
CHEMICZNY USTROJU
ponieważ obie jego
składowe mogą być szybko i skutecznie
regulowane: CO
2
przez układ oddechowy, a
wodorowęglany przez nerki

pH = 6,8 + log [HPO
4--
] / [H
2
PO
4-
]
• Bufor ten ma znaczenie głównie w
utrzymaniu śródkomórkowego pH (ze
względu na duże stężenie fosforanów w
płynie śródkomórkowym)
BUFOR FOSFORANOWY

• JEST TO NAJWAŻNIEJSZY UKŁAD
BUFOROWY PŁYNU ŚRÓDKOMÓRKOWEGO
• Płyn śródkomórkowy posiada około 75%
całkowitej pojemności buforowej płynów
ustrojowych, a w tym najważniejszy udział
ma bufor białczanowy
BUFOR BIAŁCZANOWY

• OBECNY W KRWINKACH CZERWONYCH
(ERYTROCYTACH)
• w miarę odtlenowania krwi, jakie zachodzi
podczas przepływu przez tkanki Hb staje
się słabszym kwasem, a więc lepszym
buforem wiążącym więcej jonów
wodorowych, co z kolei prowadzi do
zobojętnienia nowo powstałego tam kwasu
węglowego z CO
2
i H
2
O pod działaniem
anhydrazy węglanowej
BUFOR HEMOGLOBINOWY

Oddechowa regulacja równowagi
kwasowo-zasadowej
CO
2
w roztworze ~ P
CO2
krwi tętniczej ~ 1/wentylacja pęcherzykowa
Podczas hiperwentylacji spada stężenie we krwi
i podnosi się pH płynów ustrojowych
Dwukrotny wzrost wentylacji prowadzi do
wzrostu pH płynów ustrojowych z 7,4 do 7,63
Spadek wentylacji do ¼ normy obniża pH do 7,0

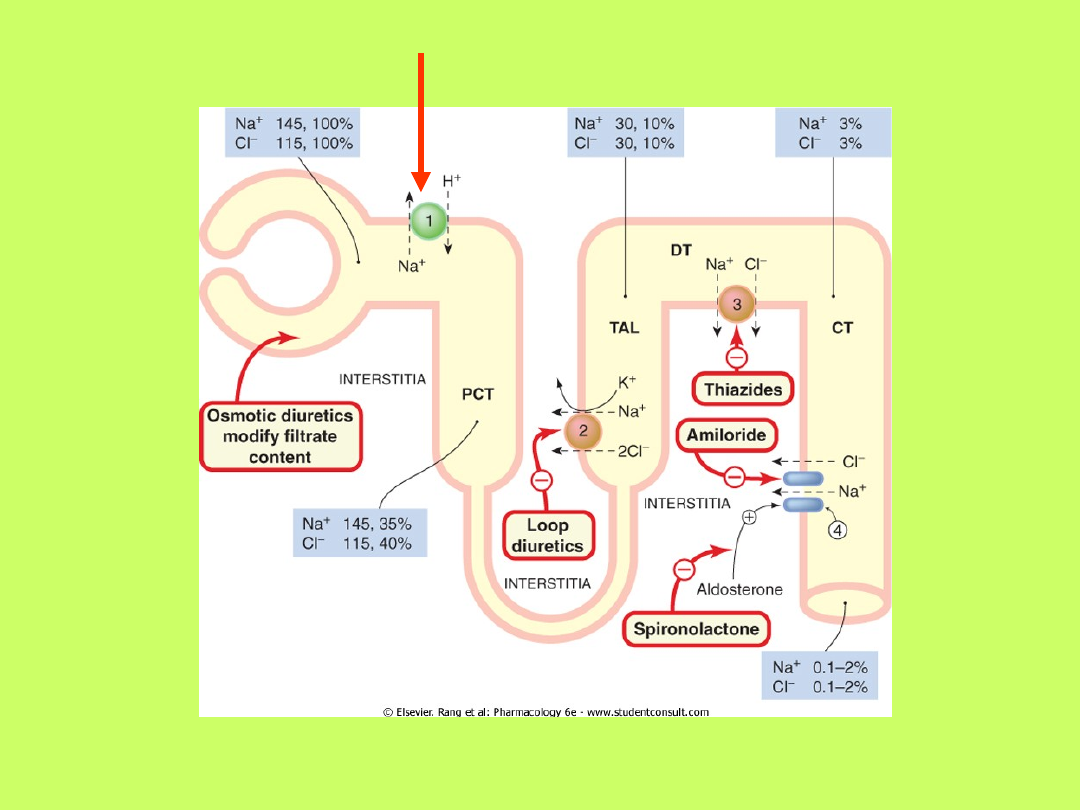
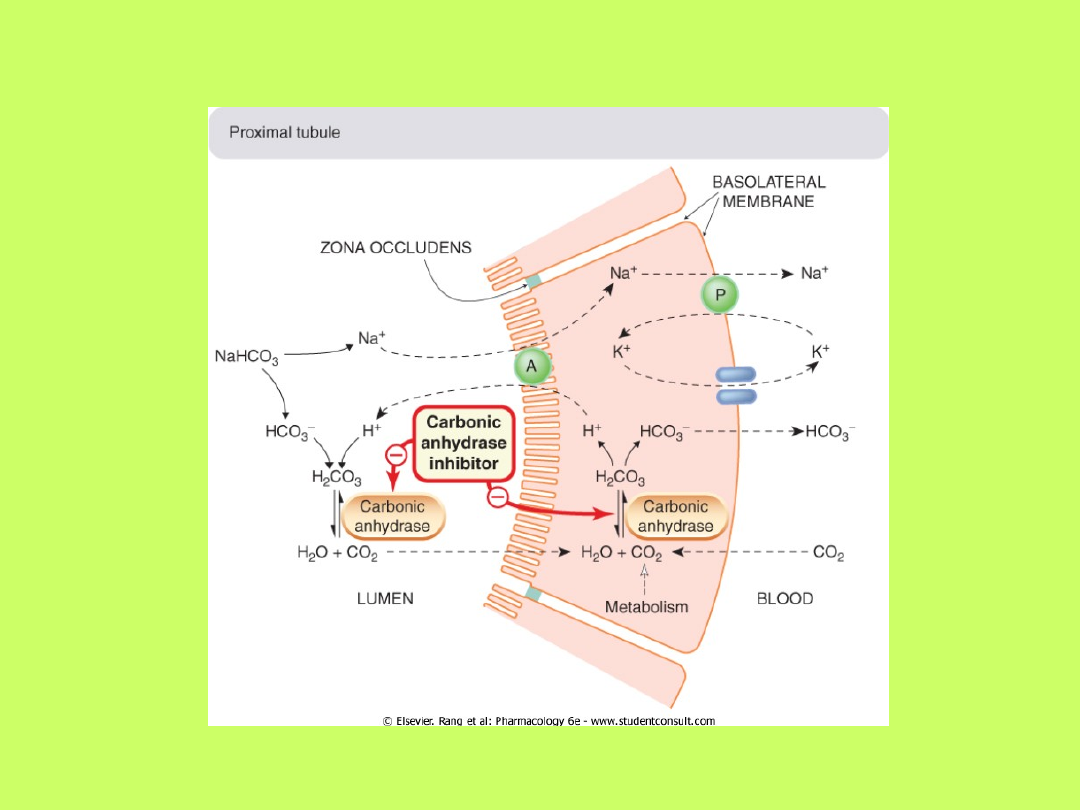
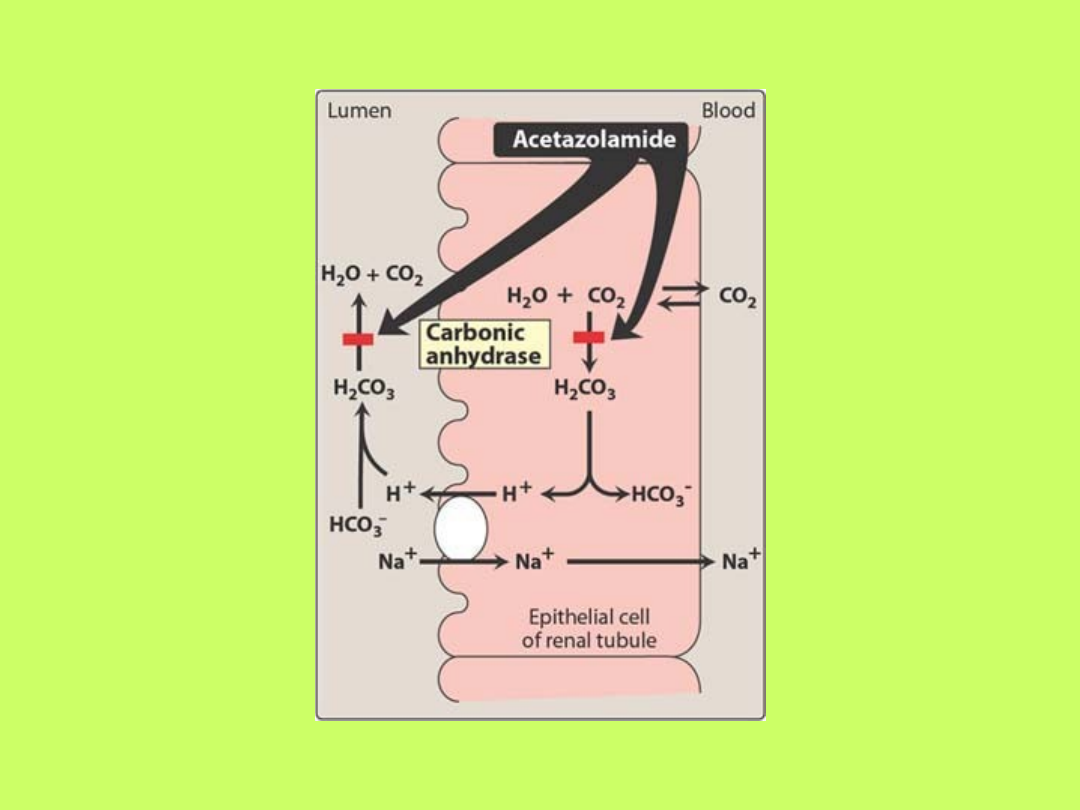
• Wydzielaniu przez komórki cewkowe nerek
jonów wodorowych towarzyszy dyfuzja do tych
komórek kationów, głównie jonów sodowych
• Wydzielone jony wodorowe łączą się z jonami
wodorowęglanowymi moczu kanalikowego,
tworząc kwas węglowy, który z kolei dysocjuje
na CO
2
i H
2
O
• Około 90% tego procesu odbywa się w
cewkach proksymalnych nefronów, których
brzeżek szczoteczkowaty zawiera duże ilości
enzymu
anhydrazy węglanowej
Nerkowa regulacja równowagi
kwasowo-zasadowej

• Nerki mogą też produkować amoniak
z aminokwasu glutaminy (poprzez
enzym glutaminazę)
• Amoniak łączy się z jonami
wodorowymi, tworząc kation
amonowy NH
4+
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
Wyszukiwarka
Podobne podstrony:
Biochemia z biofizyką Seminarium 5
BIOCHEMIA BIOFIZYKA
TEST 2007-8 biochemia, Biochemia i Biofizyka
podzia grup na zaliczenia z Biochemii i Biofizyki, wsmnotatki
Zadania biofizyka 3 seminarium, biofizyka, BIOFIZYKA, Biofizyka AM
Biochemia z biofizyką Wykład 4
biochemia, fizjoterapia, biochemia + biofizyka
skt-n, Pomoce naukowe, Opracowania, II rok, Biochemia, Prezentacje z seminariów, IV koło
Biochemia z biofizyką Wykład 3
Biochemia z biofizyką Wykład 5
Biochemia i biofizyka BUNA, Pielęgniarstwo
mocznikowy, Studia - II rok, Biochemia, KOŁO 4 seminarki 3
Biochemia i biofizyka, Pielęgniarstwo rok I i inne, Biochemia i biofizyka
Biochemia i Biofizyka wykład 4, Pielęgniarstwo rok I i inne, Biochemia i biofizyka
SEMINARIUM plemnik, ★ materiały rok II wety, II rok, BIOCHEMIA, BIOCHEMIA, biochemia, KOŁO 5 seminar
Białka G 3, ★ materiały rok II wety, II rok, BIOCHEMIA, BIOCHEMIA, biochemia, KOŁO 1 seminarki 1, se
Promieniowaniem jonizującym określa się wszystkie rodzaje promieniowania, biochemia, biofizyka
ODDYCHANIE TLENOWE, BIOCHEMIA I BIOFIZYKA
więcej podobnych podstron