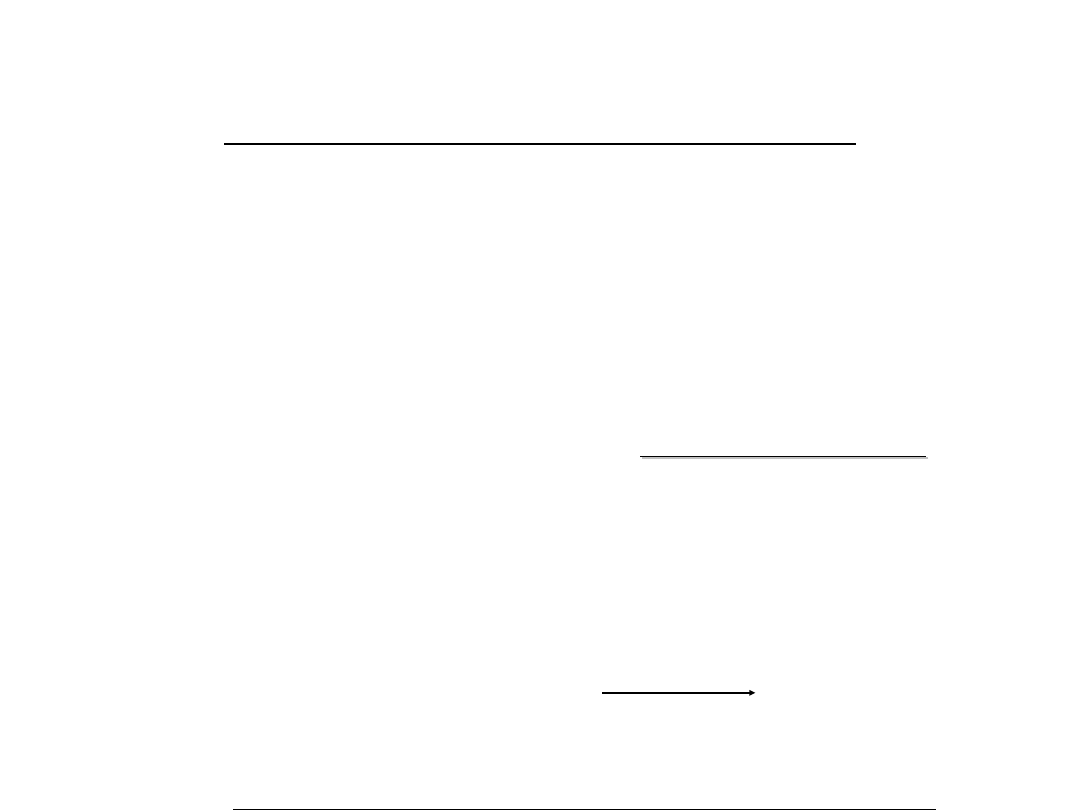
1
CHEMIA ORGANICZNA
CHEMIA ORGANICZNA
Wprowadzenie
Koniec XVIII w.:- zainteresowanie chemików
organizmami żywymi:
- przemiany substancji w tych organizmach,
- wyodrębnienie substancji z organizmów roślinnych i
zwierzęcych
Substancje organiczne:WĘGIEL(
WĘGIEL(
główny składnik)
główny składnik)
Chemia organiczna
Chemia organiczna
Hipoteza “siły życiowej” - “vis vitalis” dotyczyła
przemian i wytwarzania substancji w organizmach
żywych. Możliwość taką tłumaczono interwencją sił
nadprzyrodzonych.
ogrzewanie
NH
2
NH
4
OCN
C = O
cyjanian amonowy
mocznik
NH
2
W 1928 r. WÖHLER przeprowadził pierwszą
syntezę związku organicznego, obalając: hipotezę
„vis vitalis”

2
Oprócz WĘGLA
Oprócz WĘGLA
w związkach organicznych
występują i
nne pierwiastki
: WODÓR (H) TLEN
(O) AZOT (N) SIARKA (S) CHLOROWCE
(F,Cl,Br,I) FOSFOR (P) METALE
CHEMIA ORGANICZNA - chemia związków
CHEMIA ORGANICZNA - chemia związków
węgla
(za
wyjątkiem
kilku
związków
węgla
(za
wyjątkiem
kilku
związków
uważanych za nieorganiczne:
uważanych za nieorganiczne:
CO,
CO
CO,
CO
2
2
,
H
,
H
2
2
CO
CO
3
3
,
,
węglany)
węglany)
Charakterystyczne właściwości związków
Charakterystyczne właściwości związków
organicznych:
organicznych:
1. Duża ilość poznanych związków organicznych: 4
mln w stosunku do ok. 100 tys. związków
nieorganicznych.
2. Niska odporność na wysoką temperaturę - rozkład
już w temp.ok. 500 C, spalanie do CO
2
i H
2
O.
3. Występowanie zjawiska
IZOMERII

3
Elementy budowy związków
organicznych:
1.Skład jakościowo - ilościowy cząsteczki: jakie i
ile pierwiastków tworzy związek:
wzór sumaryczny
wzór sumaryczny
wzór cząsteczkowy
wzór cząsteczkowy
Np.
C
2
H
6
O
wzór sumaryczny (cząsteczkowy) alkoholu
etylowego
C H
2
O
wzór sumaryczny;
C
2
H
4
O
2
wzór
cząsteczkowy
2. Struktura - kolejność powiązania atomów w
cząsteczce.
wzór strukturalny
wzór strukturalny
H H
H—C—C—O—H
wzór strukturalny cząsteczki
H H alkoholu etylowego
CH
3
—CH
2
—OH
wzór strukturalny skrócony
4
4. Stan elektryczny i magnetyczny cząsteczki:
•
rozmieszczenie
elektronów
względem
naładowanych jąder atomowych;
• rozkład i wielkość ładunków elektrycznych,
• dipole - moment dipolowy.
3. Architektura - przestrzenne rozmieszczenie
atomów w cząsteczce.
Istotne elementy:
• długość wiązań,
• odległość między atomami,
• kąty między kierunkami wiązań.
C
H
H
H
H
Np.:Budowa przestrzenna cząsteczki metanu CH
4
:
5
Cechy budowy związków
Cechy budowy związków
organicznych
organicznych
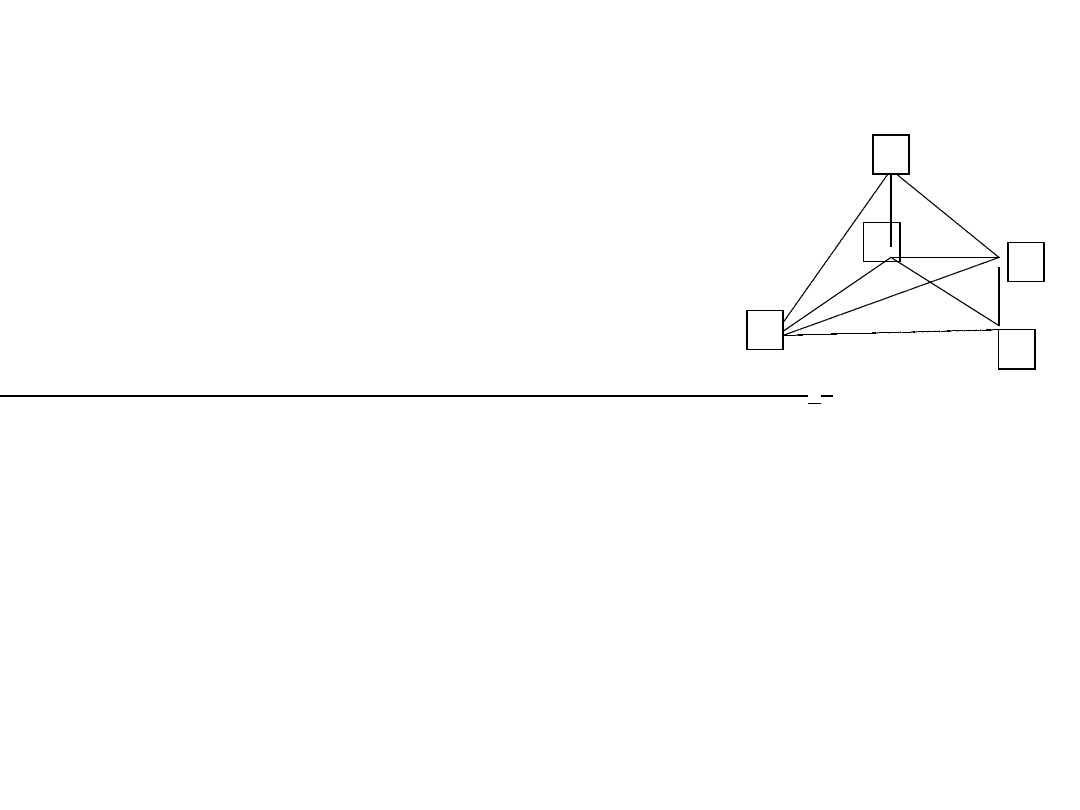
1. Czterowartościowość węgla - wynika z pozycji
jaką węgiel zajmuje w układzie okresowym.
Schemat konfiguracji elektronowej węgla:
Stan wzbudzony
(podczas tworzenia
związków)
stan podstawowy
2. Wszystkie cztery wartościowości węgla są
równocenne, tzn. mają te same właściwości.
Jest to wynikiem hybrydyzacji orbitali atomowych:
2s
1
2p
x
1
2p
y
1
2p
z
1
-
hybrydyzacja sp
3
.
C
6
-
1s
2
2s
2
2p
2
C
6
-
1s
2
2s
1
2p
2

6
4. Wiązania między atomami węgla oraz węgla z
innymi pierwiastkami, poza nielicznymi wyjątkami,
są typu kowalencyjnego (atomowego).
Mogą to być wiązania:
Pojedyncze: C—C C—H
N—H
Podwójne: C=C C=O
Potrójne: C C CN
3. Atomy węgla mogą łączyć się ze sobą tworząc
otwarte struktury łańcuchowe lub zamknięte
pierścienie.
Np. CH
3
—CH
2
—CH
2
—CH
2
—CH
2
—CH
3
n-heksan
Cykloheks
an
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
C
6
H
1
2
7
Klasyfikacja związków
Klasyfikacja związków
organicznych
organicznych
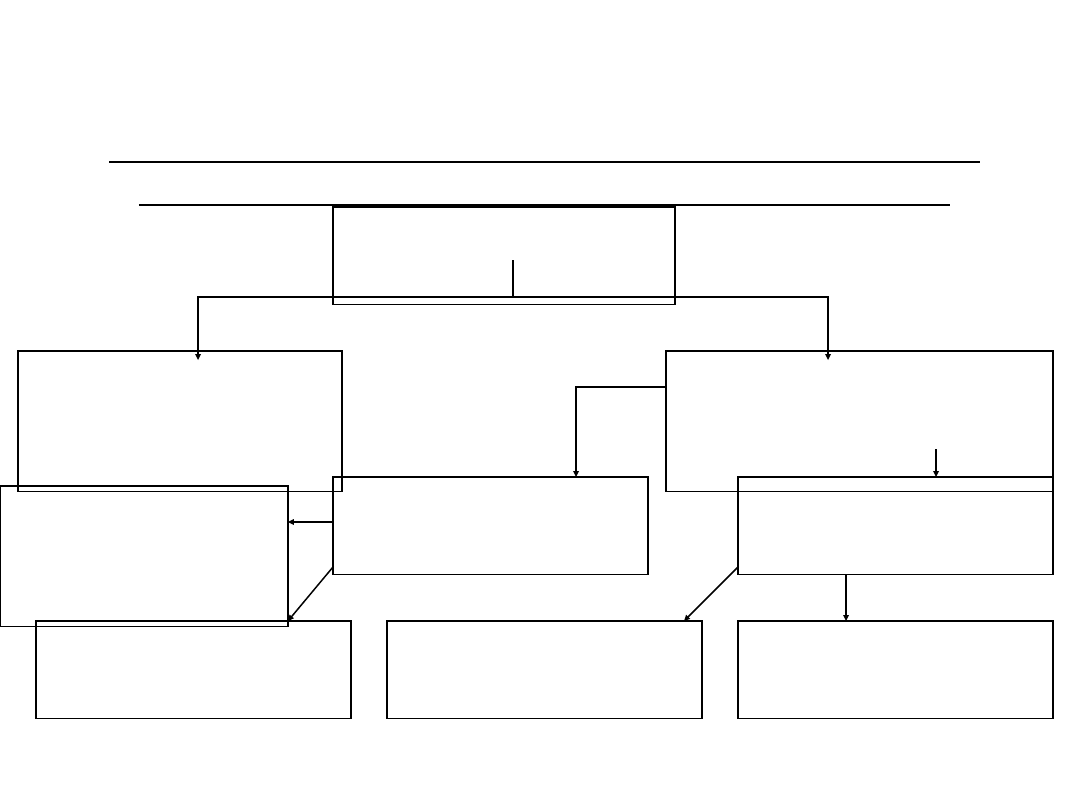
Podział związków organicznych w zależności od
rodzaju szkieletu atomowego cząsteczek.
Związki
organiczne
Związki
łańcuchowe
(acykliczne)
Związki
pierścieniowe
(cykliczne)
Związki
heterocykliczne
Związki
karbocykliczne
Związki
niearomatyczne
Związki
niearomatycz
ne
Związki
aromatyczne
Związki
aromatyczne
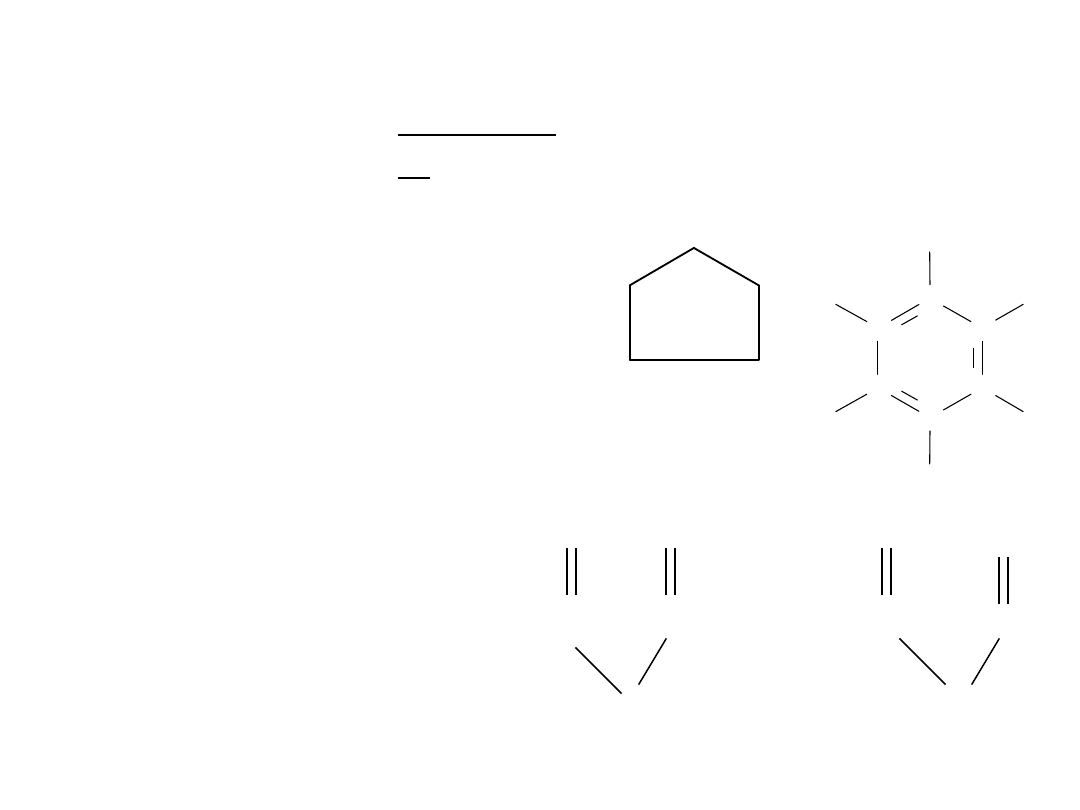
8
Klasyfikacja związków
Klasyfikacja związków
organicznych
organicznych
Przykład
y:
Heterocykliczne - w
pierścieniu
oprócz
atomów
węgla występują atomy
innych pierwiastków
CH — CH
CH — CH
CH CH
CH
CH
S
O
łańcuchow
y
cykliczne
Karbocykliczne - w
pierścieniu występują
tylko atomy węgla
CH
3
CH
3
CH2
CH2
CH2
CH2
CH2
C
C
C
C
C
C
H
H
H
H
H
H
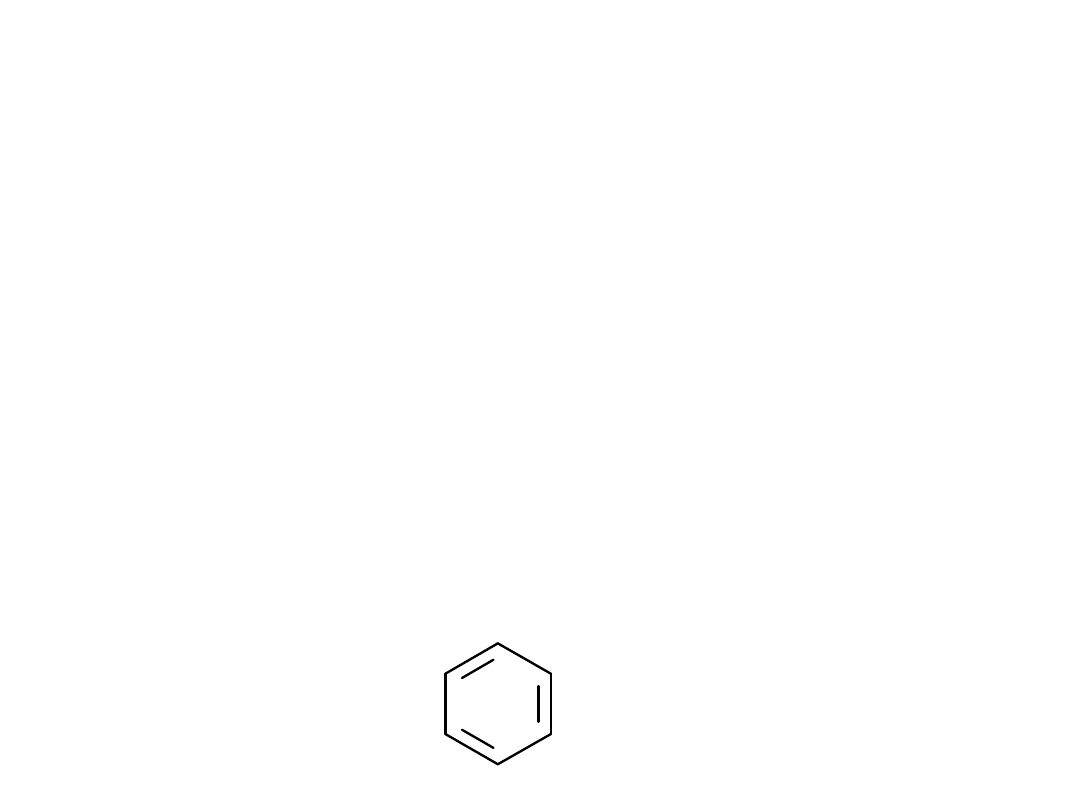
9
Klasyfikacja związków
Klasyfikacja związków
organicznych
organicznych
Z innego punktu widzenia związki organiczne
dzielimy na:
1. związki nasycone
2. związki nienasycone
3. związki aromatyczne
ad.1. Pojedyncze wiązania między atomami węgla
CC
ad.3. Układ wiązań charakterystyczny dla benzenu
ad.2. Podwójne lub potrójne wiązania między atomami węgla
C=C
C C

10
Klasy związków
Klasy związków
organicznych
organicznych
Nazwa
Wzór
Grupa funkcyjna
W
ęglowodory
C H
-
Chlorowco -pochodne
C X
X = F, Cl, Br, I
Chlorowiec
Wodorotlenowe
Pochodne (alkohole i fenole)
C OH
wodorotlenowa
Aldehydy
O=C H
aldehydowa
Ketony
O=C C
C
ketonowa
Aminy
Zwi
ązki nitrowe
Nitryle
C—NH
2
C —NO
2
—C
N
aminowa
nitrowa
nitrylowa
Kwasy karboksylowe -COOH karboksylowa
11
Rodzaje reakcji związków
Rodzaje reakcji związków
organicznych
organicznych
1. Reakcja podstawienia (substytucji) polega na
tym, że atom wodoru lub grupa funkcyjna zostaje
podstawiona (zastąpiona) przez inny atom lub
inną grupę funkcyjną.
CH
4
+ Cl
2
CH
3
Cl + HCl
2.
Reakcje
przyłączenia
(addycji)
są
charakterystyczne dla związków zawierających
wiązania wielokrotne i polegają na przyłączeniu do
cząsteczki związku organicznego atomu lub grupy
atomów.
A = B + RR` R—A—B—R`
3. Reakcje odszczepiania (eliminacji) polegają na
oderwaniu
od
cząsteczki
substratu
dwóch
podstawników.
- eliminacja
:
:
Z A—B Y A=B + ZY
odszczepienie od sąsiednich atomów
związki nienasycone

12
Reakcje jonowe - elektrofilowe (kation) i
nukleofilowe (anion) reaguje ze związkiem
organicznym
W reakcjach jonowych podczas rozerwania
wiązania atomowego para elektronów zostaje przy
jednym fragmencie, który staje się anionem, drugi
fragment staje się kationem:
A
B A: + B
-
+
Reakcje organiczne mogą przebiegać wg dwóch
mechanizmów:
- reakcje rodnikowe
rodnikowe
(homolityczne)
- reakcje jonowe
jonowe
(heterolityczne)
W reakcjach rodnikowych tworzą się tzw. rodniki
- układy pośrednie o nieparzystej liczbie elektronów.
A
B A + B rodniki
Rodniki reagują ze związkiem organicznym
Document Outline
Wyszukiwarka
Podobne podstrony:
1 Chemia organiczna wprowadzenie alkanyid 9109 pptx
Chemia organiczna czesc I poprawiona
chemia organiczna wykład 6
Wykład 9 CHEMIA ORGANICZNA
Chemia Organiczna 4
Chemia organiczna IV
CHEMIA- CHEMIA ORGANICZNA, CHEMIA
bromoacetanilid, Studia, Sprawozdania, Chemia organiczna
Przykladowy egzamin chemia organiczna - ICiP - 2010-zima. , Egzamin
więcej podobnych podstron