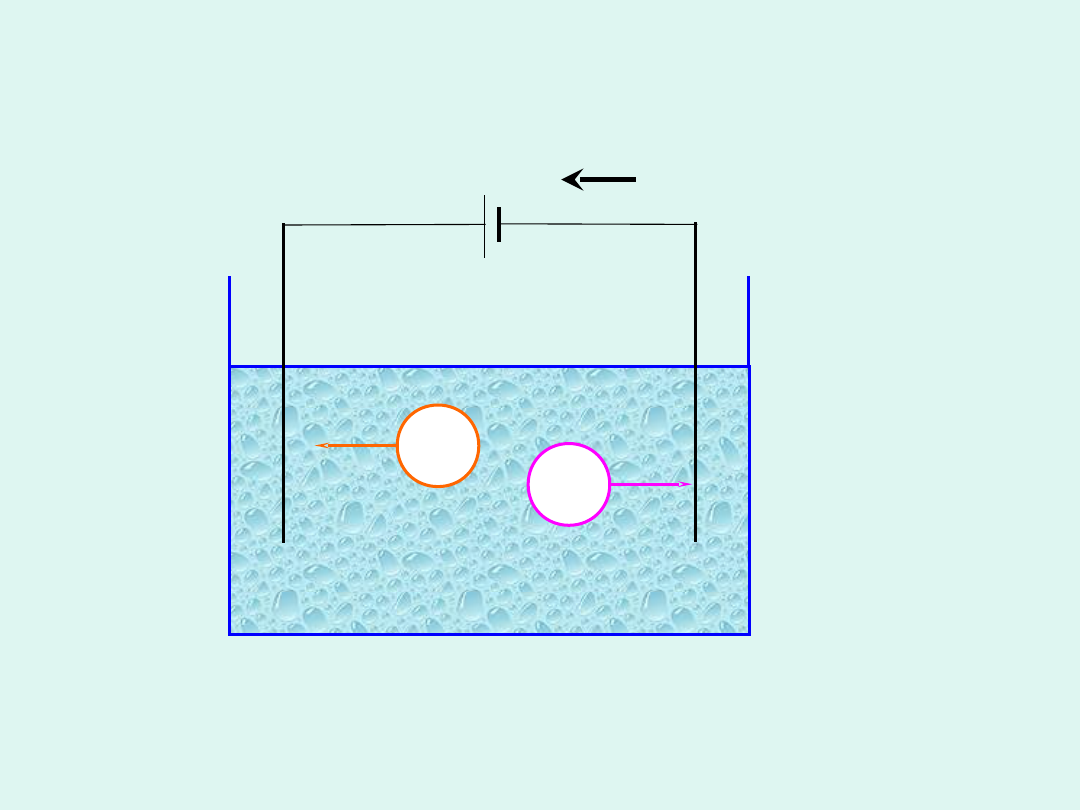
e
_
+
K
+
A
-
katoda anoda
Elektroliza
K
e
K
A
e
A

Prawa elektrolizy Faraday’a
I
Masa substancji wydzielonej na
elektrodzie jest wprost proporcjonalna do
ładunku, jaki przepłynął przez roztwór.
dla prądu stałego
II
Jeżeli przez roztwory przepłynął ten
sam ładunek, to masy dwu substancji
wydzielonych na elektrodach mają się do
siebie jak ich współczynniki
elektrochemiczne.
q
k
m
t
I
k
m
const
q
gdy
k
k
m
m
2
1
2
1

Prawa Ohma
I
Natężenie prądu płynącego przez
opornik jest wprost proporcjonalne do
napięcia.
II
Opór opornika jest wprost
proporcjonalny do jego długości, a
odwrotnie proporcjonalny do jego pola
przekroju poprzecznego do kierunku
prądu.
R
I
U
R
U
I
A
l
R

Przewodnictwo właściwe
jest to
przewodnictwo roztworu elektrolitu
zawartego
pomiędzy
równoległymi
elektrodami odległymi o jednostkę (1
m) i polu przekroju poprzecznego słupa
cieczy
zawartego
między
nimi
jednostkowym (1 m
2
), przy czym pole
elektryczne pomiędzy elektrodami jest
jednorodne.
G
A
l
R
1
A
l
1
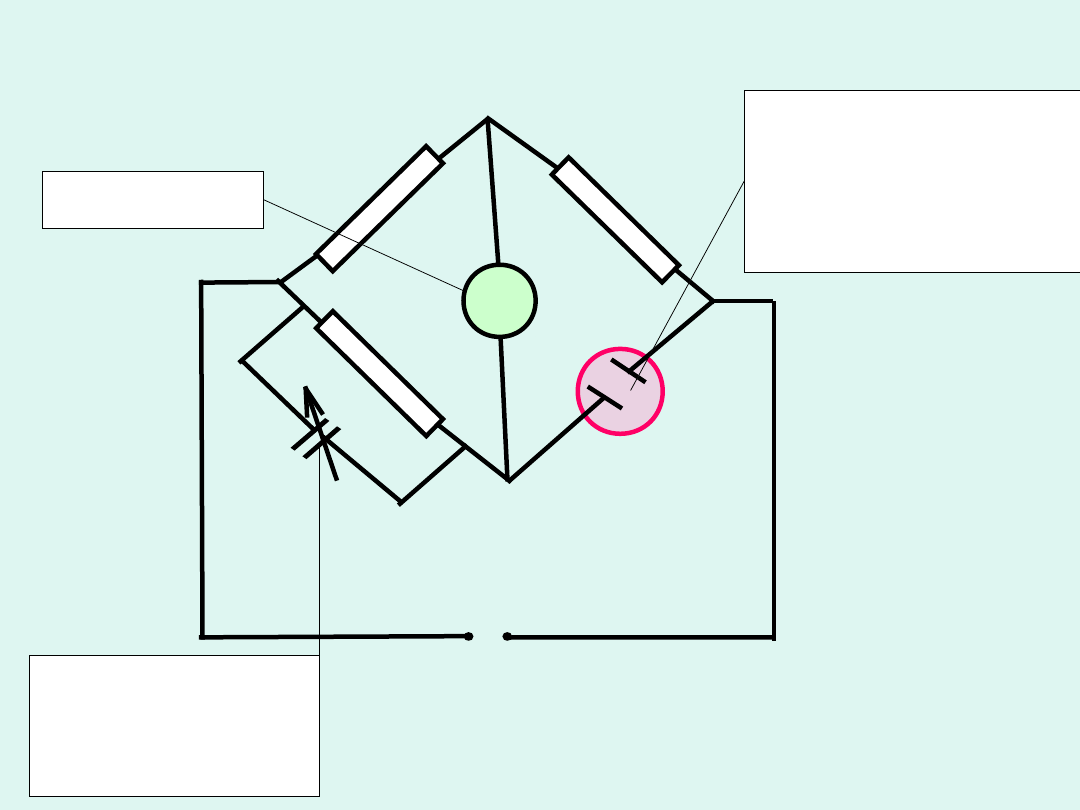
~
prąd zmienny o
częstotliwości
1000 Hz
naczyńko
konduktometrycz
ne
(koniecznie musi
być
termostatowane)
kondensator o
zmiennej
pojemności
galwanome
tr
A
D
C
B
C
2
R
x
R
3
R
2
R
1
C
x
G
Zmodyfikowany mostek
Wheatstone’a
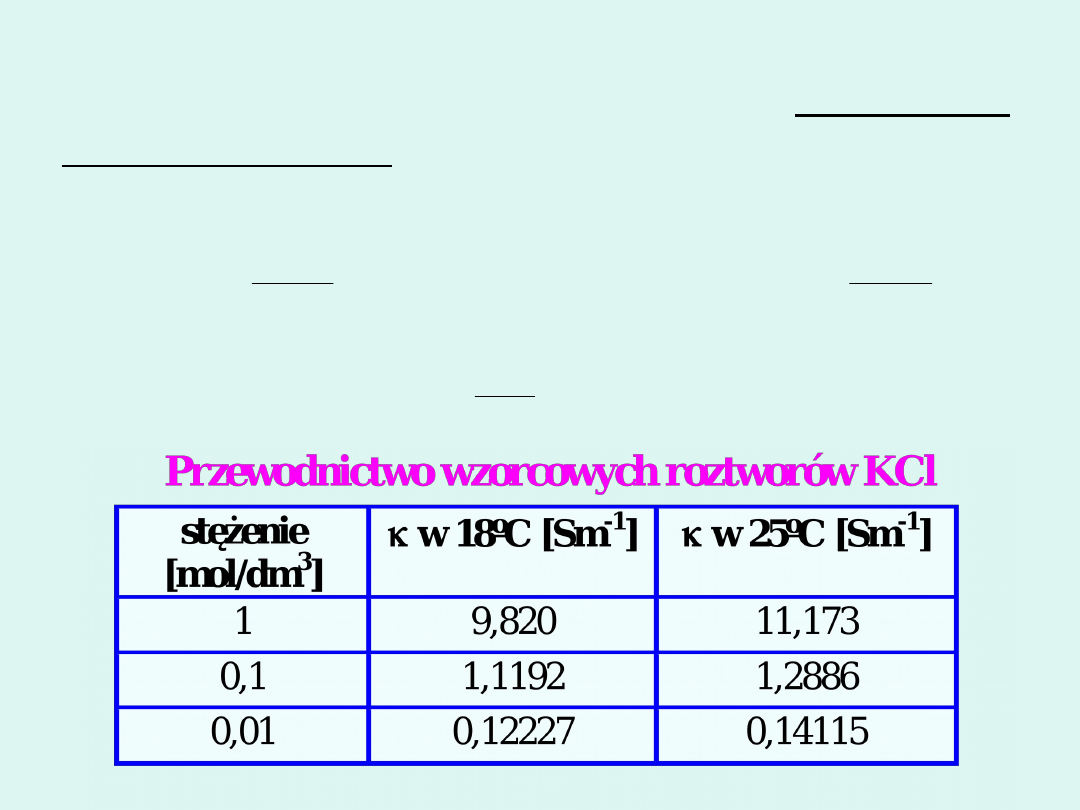
Pomiar
przewodnictwa
właściwego
roztworu
elektrolitu
jest
pomiarem
porównawczym. Stałą naczyńka ustalamy
przez pomiar oporu naczynka napełnionego
wzorcowym roztworem elektrolitu.
G
k
R
k
G
R
k
G
k
R
k
x
x
x
wz
wz
wz
wz
wz
wz
wz
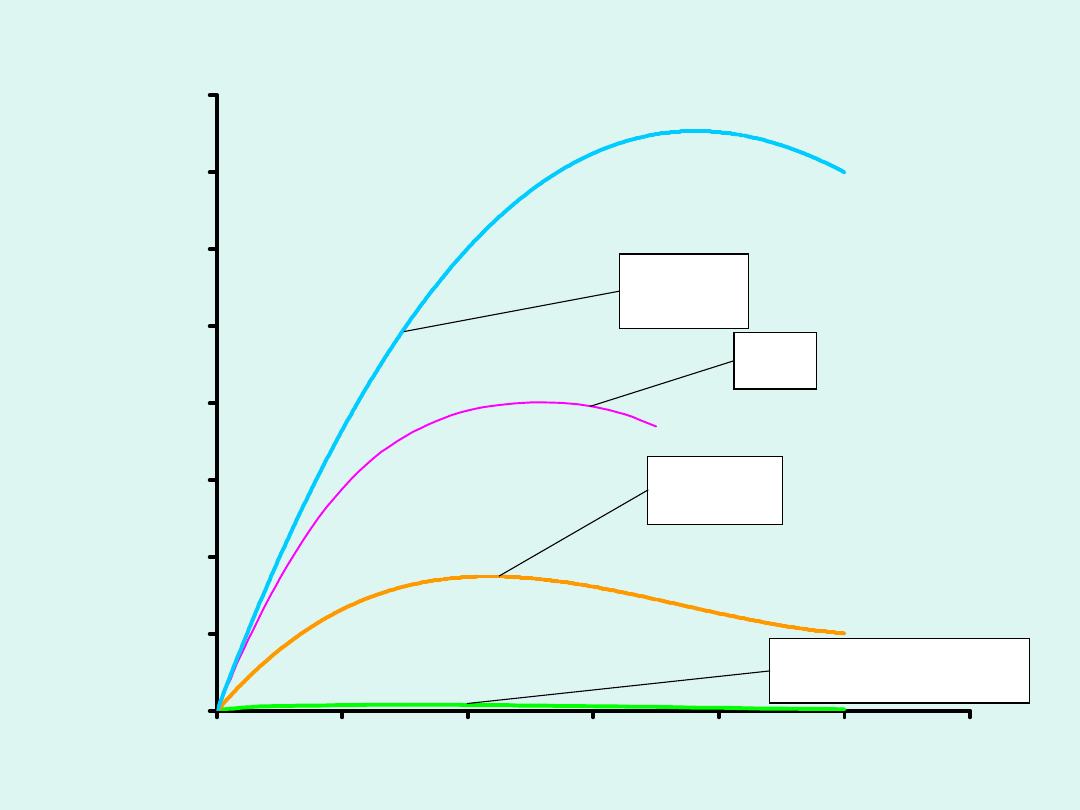
0
20
40
60
80
100
120
140
160
0
2
4
6
8
10
12
c [mol/dm
3
]
p
rz
ew
o
d
n
ic
tw
o
w
ła
śc
iw
e
Sm
-1
H
2
SO
4
NaO
H
HJ
CH
3
COOH
x10
Przykłady zależności
przewodnictwa właściwego od
stężenia

Przewodnictwo molowe
jest to
przewodnictwo
roztworu
elektrolitu
zawartego
pomiędzy
równoległymi
elektrodami odległymi o jednostkę (1 m) i
o takim polu przekroju poprzecznego słupa
cieczy zawartego między nimi, że w tak
utworzonej objętości zawarty jest jeden
mol elektrolitu, przy czym pole elektryczne
pomiędzy elektrodami jest jednorodne.
c
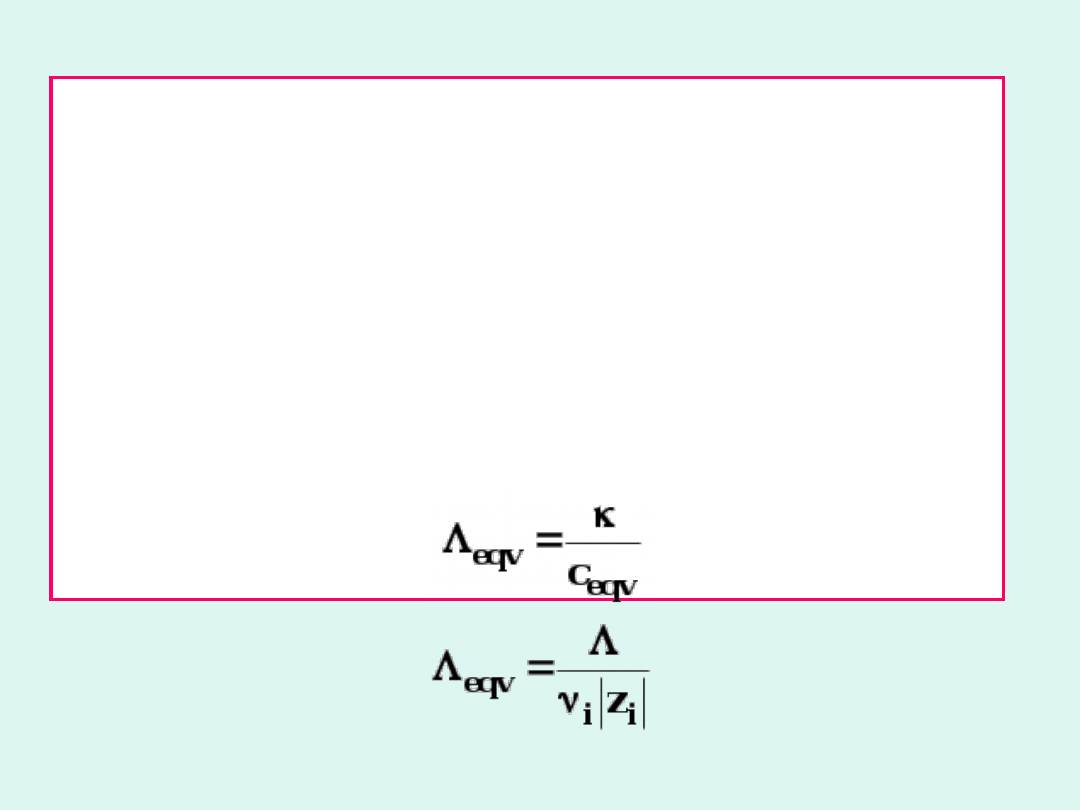
Przewodnictwo równoważnikowe
eqv
jest to przewodnictwo roztworu elektrolitu
zawartego
pomiędzy
równoległymi
elektrodami odległymi o jednostkę (1 m) i o
takim polu przekroju poprzecznego słupa
cieczy zawartego między nimi, że w tak
utworzonej objętości zawarty jest jeden
gramorównoważnik elektrolitu, przy czym
pole elektryczne pomiędzy elektrodami jest
jednorodne.
[Sm
2
mol
-
1
]
o
CH
3
COO
H
CH
3
COON
a
[(mol/dm
3
)
1/2
]
c
c
b
o
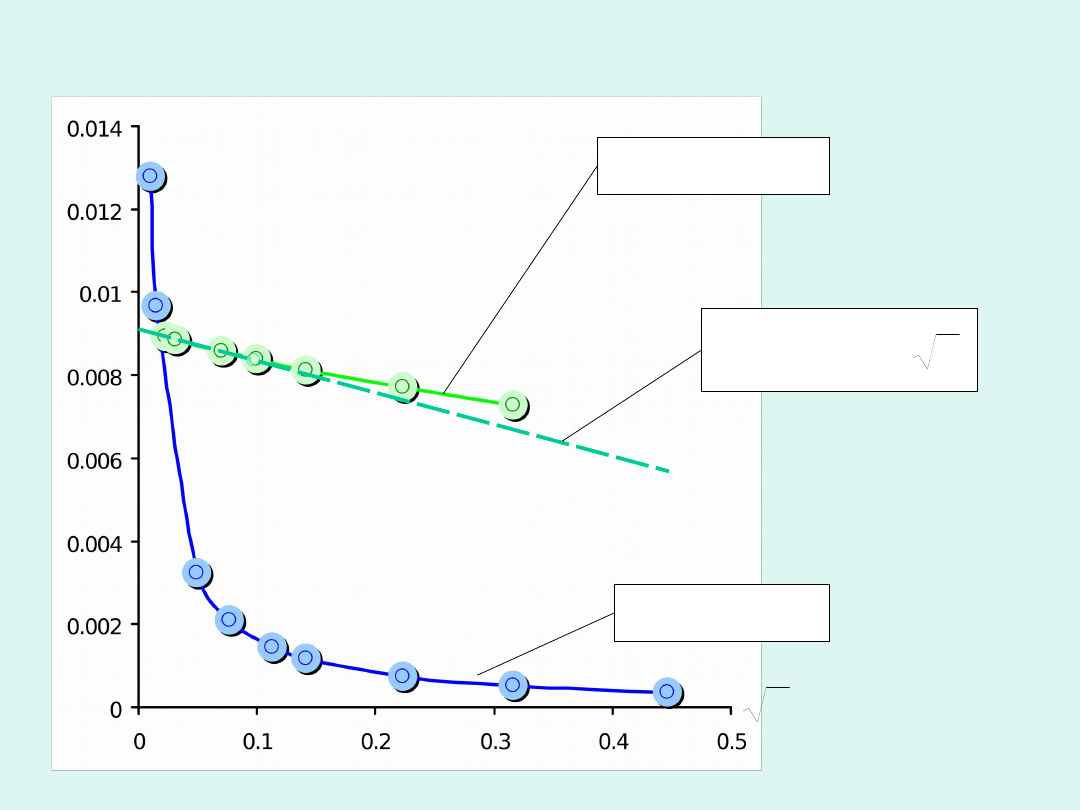
Przykładowe zależności przewodnictwa
molowego od pierwiastka ze stężenia
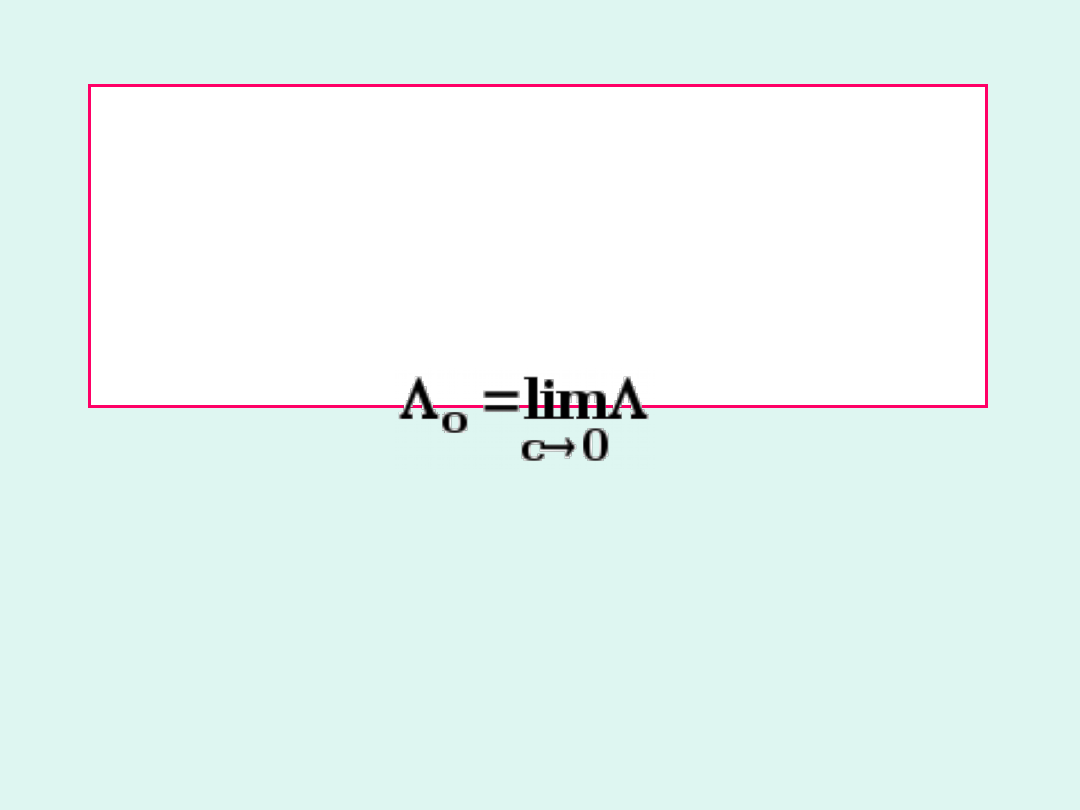
Graniczne przewodnictwo molowe
(równoważnikowe)
o
(
eqv,o
)
to
przewodnictwo
molowe
(równoważnikowe)
w
rozcieńczeniu
nieskończenie wielkim (gdy stężenie
dąży do zera).

Prawo niezależnej wędrówki
jonów Kohlrauscha
Jony w roztworze w polu elektrycznym
wędrują niezależnie od siebie, a
przewodnictwo roztworu elektrolitu
jest sumą przewodnictw pochodzących
od poszczególnych jonów (kationów i
anionów).
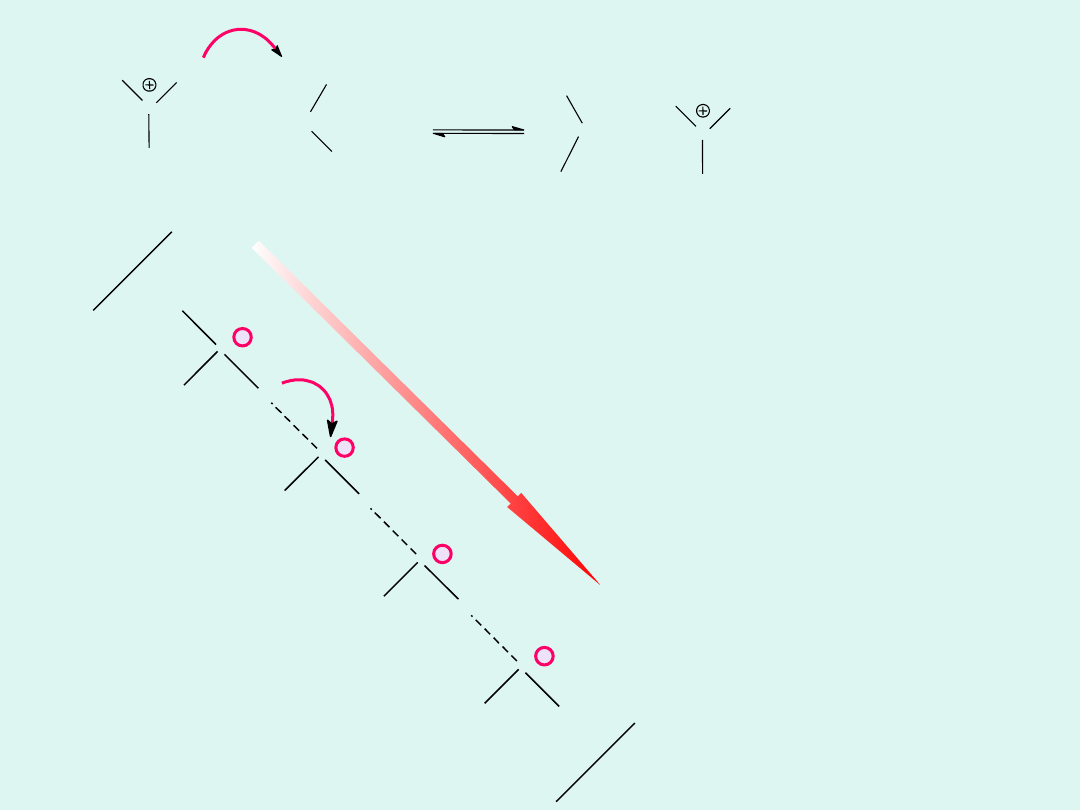
Mechanizm
łańcuchowy
transportu
jonów
wodorowych w
wodzie
O
H
H
O
H
H
O
H
H
O
H
H
H
H
+
_
+
+
+
+
+
+
O
H
H
H
+
O
H
H
H
O
H
H
H
+
O
H
H
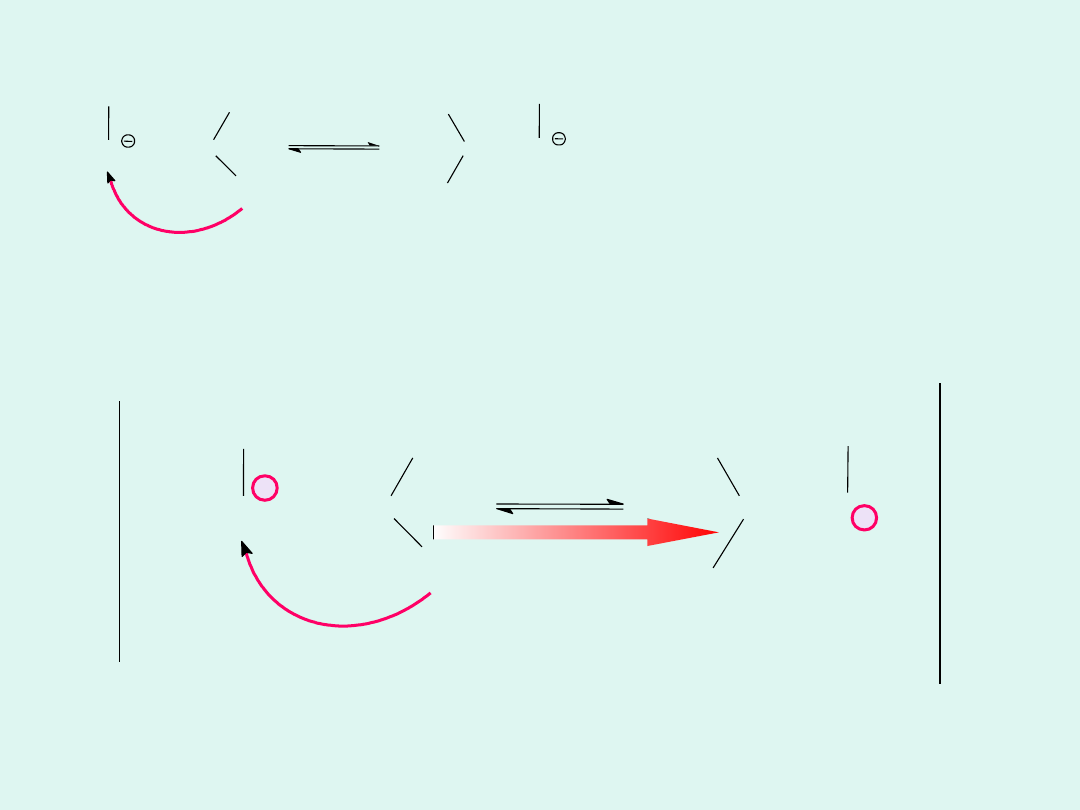
+
O
H
H
H
+
O
H
O
H
+
O
H
H
+
_
+
O
H
H
H
+
O
H
O
H
+
O
H
H
-
-
Mechanizm
transportu
jonów
wodorotlenowyc
h w wodzie

Liczby przenoszenia jonów
Liczby przenoszenia jonu mówią, jaki ułamek
ładunku został przeniesiony przez jony danego
znaku.
Znajomość liczb przenoszenia jest niezbędna do
wyznaczenia
przewodnictw
molowych
(równoważnikowych) jonów.
+
Q
Q
t
t
t
t
1
Q
Q
+
-
+
-
-
=
=
+ =
eqv,
eqv,
eqv
eqv
t
t
t
t
+
-
+
-
+ +
- -
+
-
l
l
=
=
L
L
n l
n l
=
=
L
L
Metody wyznaczania liczb przenoszenia :
Metoda Hittorfa
Metoda ruchomej granicy
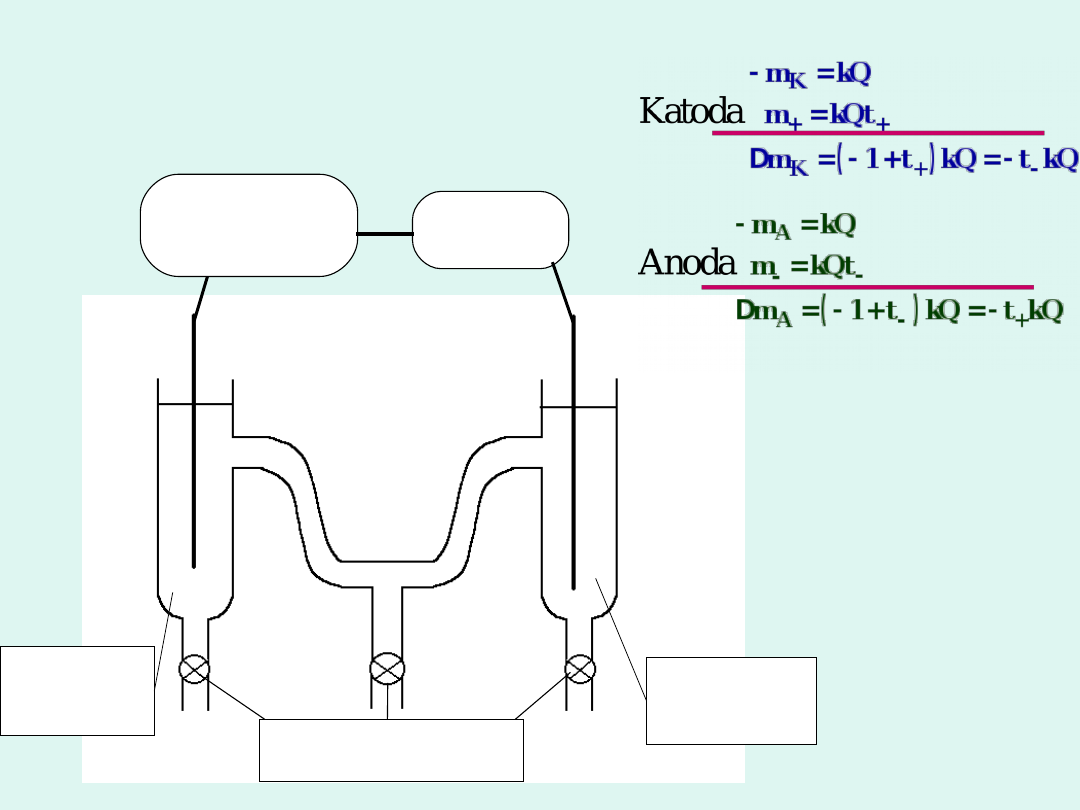
zasilanie
prąd
stały
kulome
tr
+
-
przestrz
eń
anodow
a
przestrz
eń
katodow
a
krany
Metoda Hittorfa
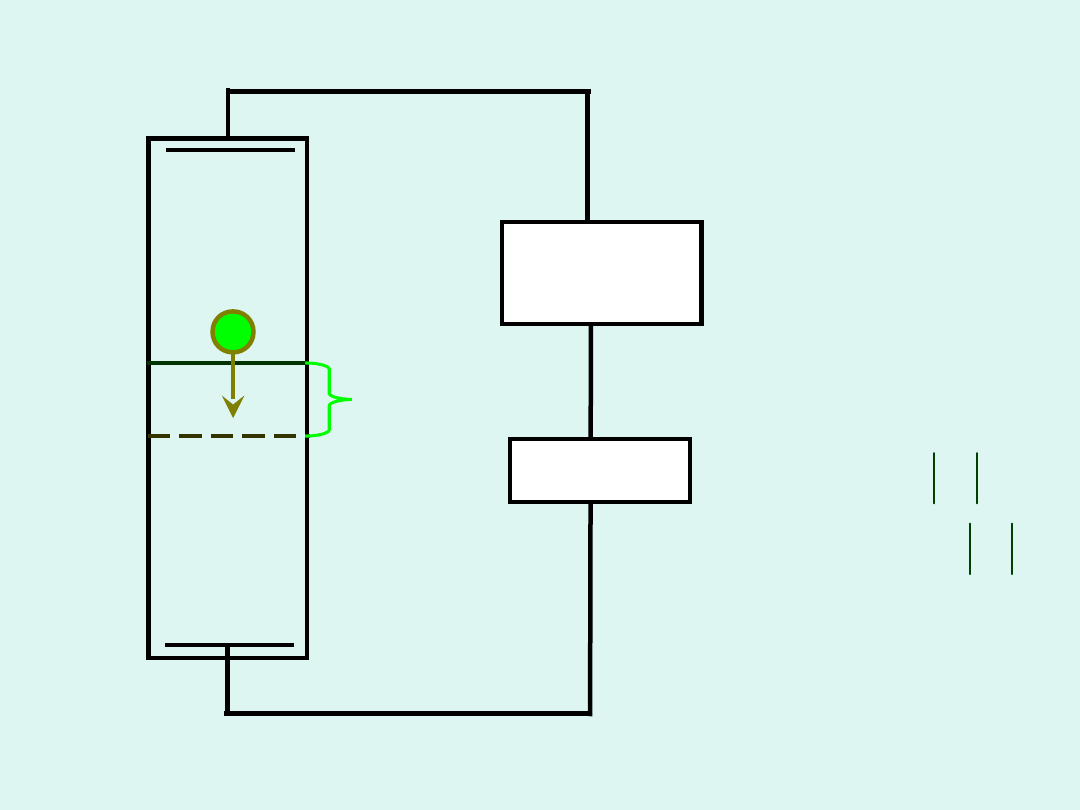
M
+
l
r
NX >
r
MX
kulomet
r
zasilanie
prąd
stały
+
_
Metoda ruchomej granicy
MX
NX
i
i
Q
V c z F
l A c z F
+
= ��
=
= � ��
Ładunek
przeniesiony
przez kationy M
+
:
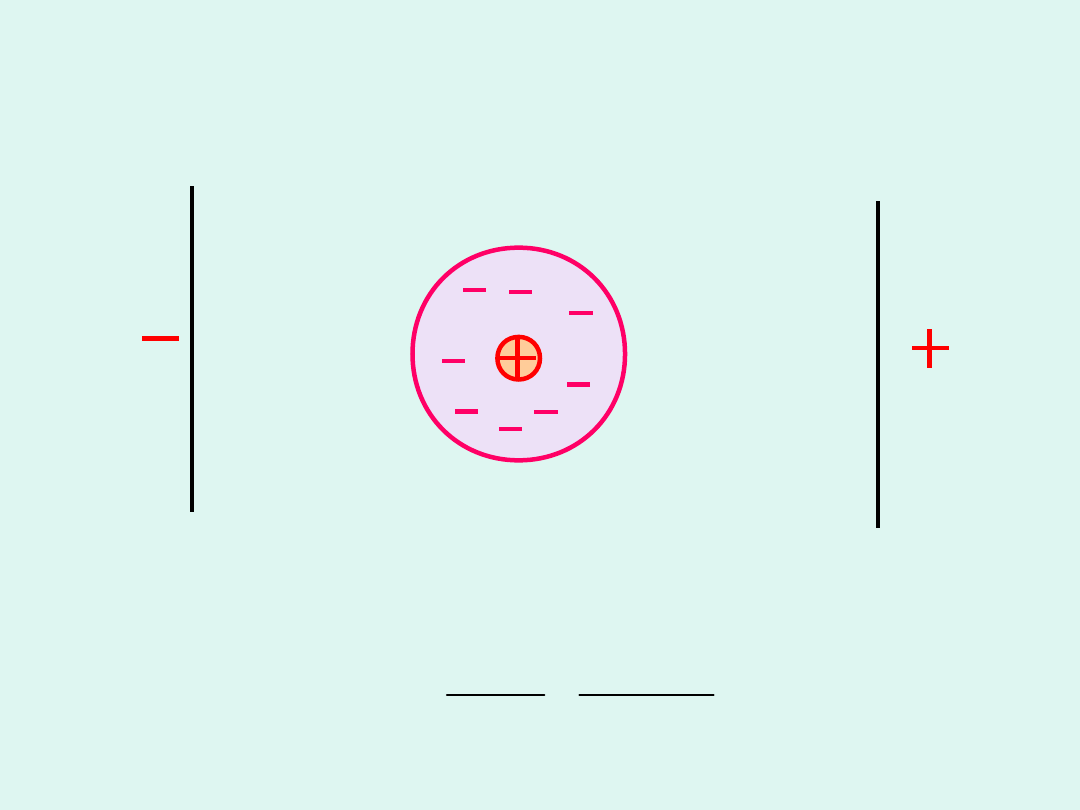
Efekt elektroforetyczny
Ruch atmosfery jonowej hamuje ruch jonu.
jonu
atmosfery
i
i
i
atm
u u
u
z e
z e
u
6
r
6
r
=
-
=
-
Ph
Ph
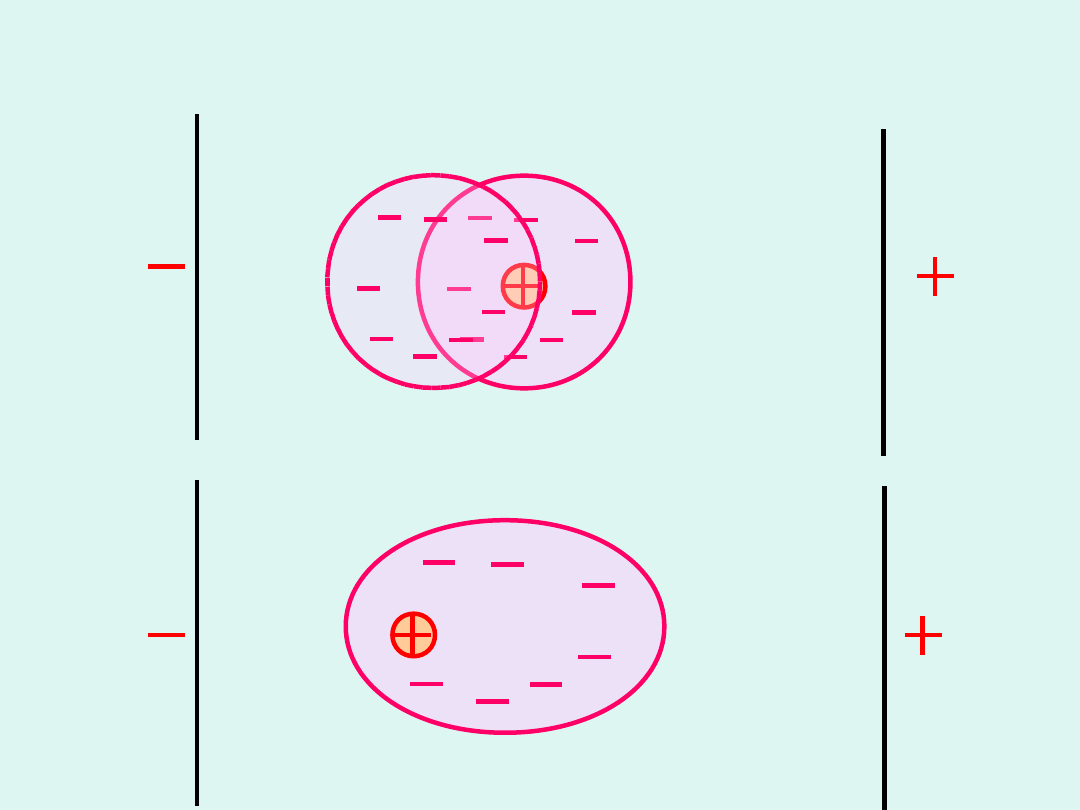
Efekt relaksacyjny
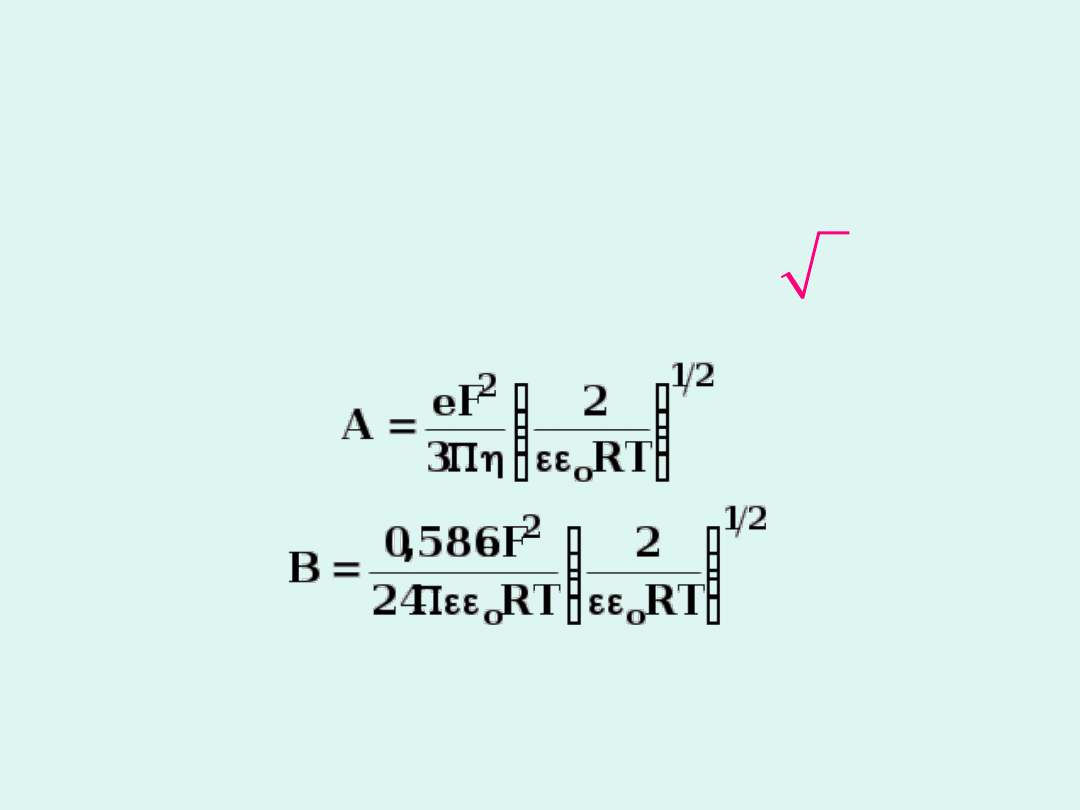
Z teorii
Debye'a-Hückla-Onsagera
wynika ostatecznie, że w roztworach
rozcieńczonych przewodnictwo molowe
jest opisane wzorem :
(
)
o
o
A B
c
L =L -
+ �
L
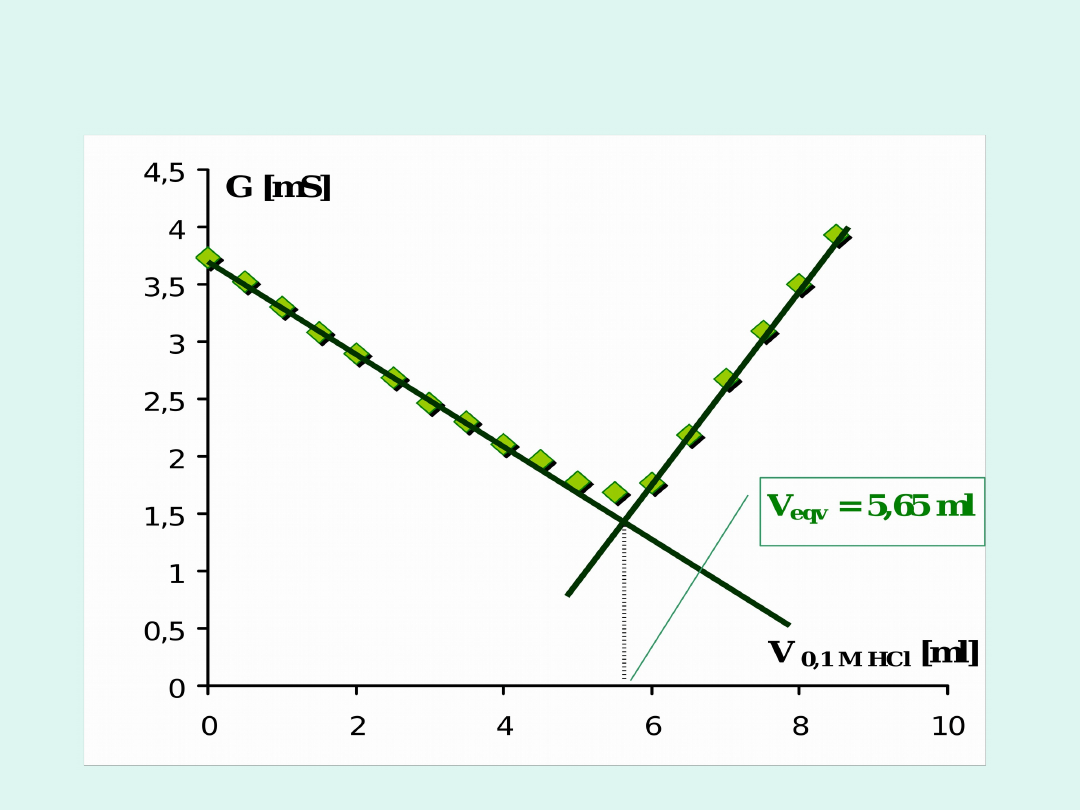
Miareczkowanie konduktometryczne
Miareczkowanie mocnej zasady (NaOH) mocnym
kwasem (HCl)
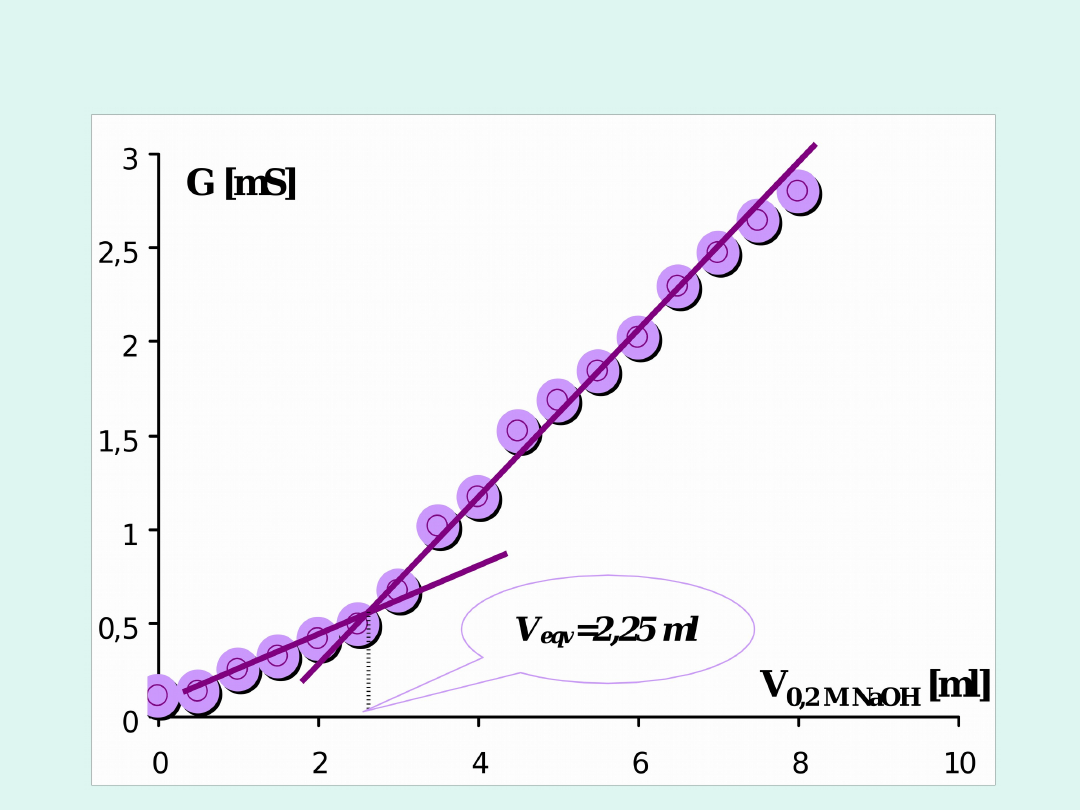
Miareczkowanie konduktometryczne
Miareczkowanie słabego kwasu (CH
3
COOH) mocną
zasadą (NaOH)
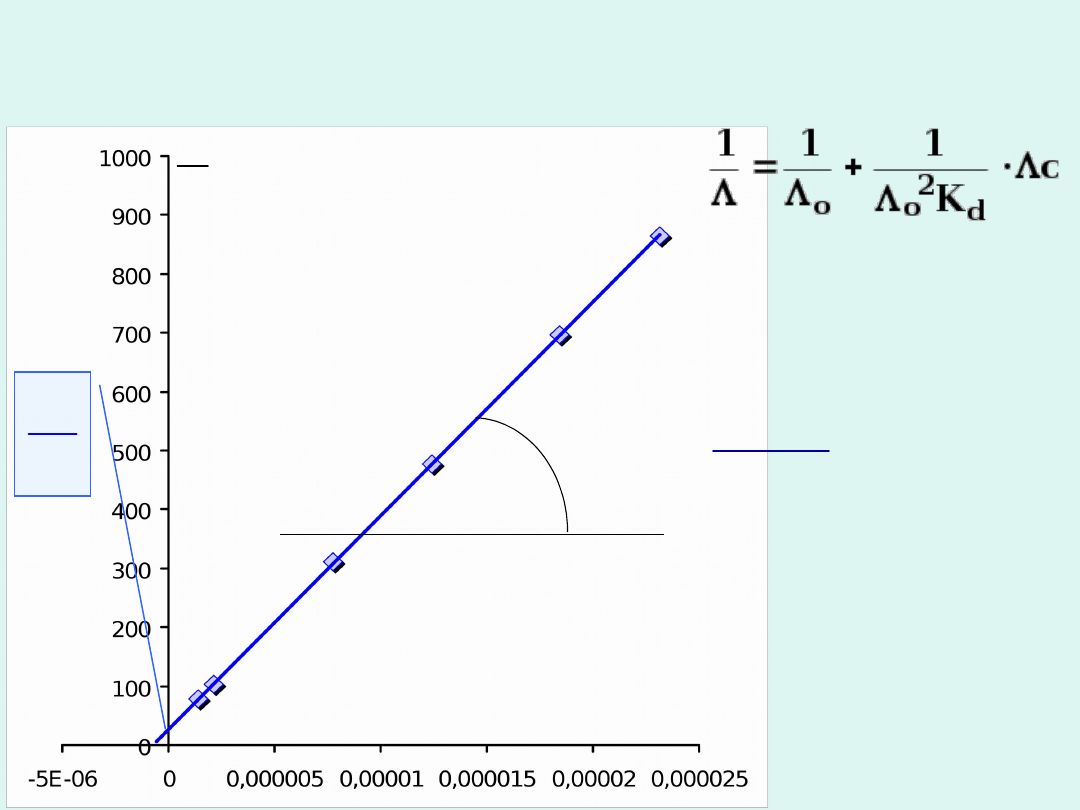
1
L
c
L �
o
1
L
2
o
d
1
a tg
K
= a =
L
Wyznaczanie stałej dysocjacji słabego
elektrolitu metodą Kraussa
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
Wyszukiwarka
Podobne podstrony:
Wykład Ch F wielkości kol
Wykład Ch F I zasada
Wykład Ch F potencjometria
5 Wykład Ch F II zasada1
10 Wykład Ch F wielkości koligatywne
Wykład Ch F gazy
6 Wykład Ch F fazy wstęp
2 Wykład Ch F gazy1 2id 20950 ppt
więcej podobnych podstron