
CHEMIA
ORGANICZNA
WYKŁAD 6
Typy reakcji.
Właściwości
węglowodorów.

Vis vitalis – siła witalna (XVI w – Jan Babtista van
Helmont)
Friedrich Wöhler
Początek
chemii
organicznej
.
W
1828
otrzymał mocznik z kwasu
cyjanowego i amoniaku.
Alchemik w laboratorium

Typy reakcji związków organicznych
W chemii związków organicznych wyróżnia się trzy
zasadnicze typy reakcji chemicznych:
reakcje podstawienia, substytucji - oznaczone
symbolem S
R-X + Y → R-Y + X
reakcje przyłączenia, addycji - oznaczone symbolem A
A + B → C
reakcje eliminacji - oznaczone symbolem E.
A → B + C
reakcje przegrupowania
A → B

Mechanizmy reakcji związków organicznych
Mechanizmy reakcji związków organicznych
Każdy z wymienionych wyżej typów reakcji, może zajść według:
• mechanizmu jonowego
• mechanizmu wolnorodnikowego.
Mechanizm reakcji zależy od środowiska w jakim przebiega
reakcja chemiczna.
Jeżeli wyobrazimy sobie cząsteczkę o ogólnym wzorze A:B,
gdzie (:) - przedstawia parę elektronową wiążącą składniki A i
B.
to właśnie ta para elektronowa może ulec:
- rozparowaniu
rozparowaniu
, wówczas każdy ze składników zatrzyma jeden
niesparowany elektron, czyli utworzy wolny rodnik
A
:
B → A
.
+
.
B
Mówimy wówczas o
homolitycznym
(rodnikowym) rozerwaniu
wiązania
przesunięciu
przesunięciu
do jednego ze składników (do składnika
bardziej elektroujemnego, a tym samym posiadającego
większe powinowactwo do elektronów).
W przypadku, gdy B jest bardziej elektroujemny to B staje się
jonem ujemnym; jeżeli A jest bardziej elektrododatnie to A
staje się jonem dodatnim
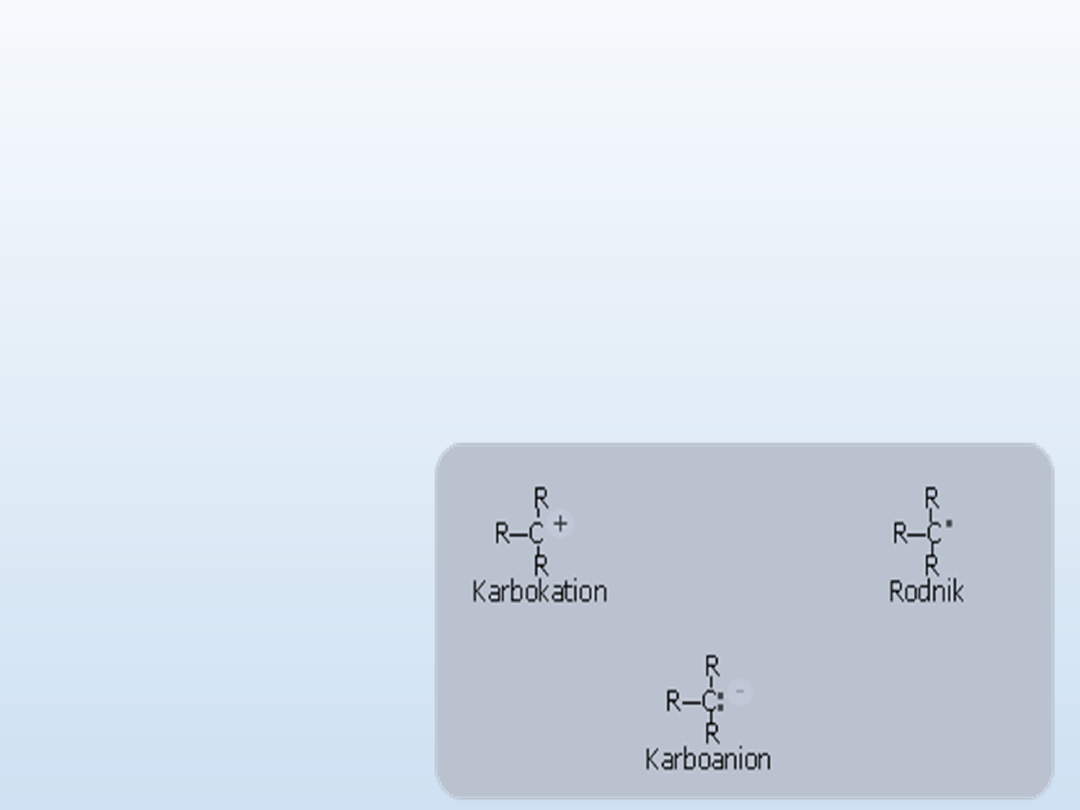
Dla związków
organicznych
rozparowanie oraz
przesuniecie pary
elektronowej spowoduje
powstanie:
•karbokationu
•karboanionu
•rodnika
A
:
B → A
+
+
:
B
-
Mówimy wówczas o
heterolitycznym (jonowym)
rozerwaniu
wiązania
elektrofil nukleofil

R
odniki
odniki
najczęściej powstają w wyniku reakcji oderwania
atomu wodoru od cząsteczki związku organicznego. Jeżeli
następuje oderwanie pierwszorzędowego atomu wodoru, to
powstanie
pierwszorzędowy
rodnik,
oderwanie
drugorzędowego atomu wodoru powoduje utworzenie rodnika
drugorzędowego itd. Otóż zauważono, że względna łatwość
odrywania się atomu wodoru, przedstawia się następująco.
3
o
> 2
o
> 1
o
> CH
3
*
I odpowiednio, trwałość wolnych rodników jest następująca
3
o
> 2
o
> 1
o
> CH
3
*
Z tego wynika, że im trwalszy jest wolny rodnik, tym łatwiej
im trwalszy jest wolny rodnik, tym łatwiej
się tworzy
się tworzy
. Takie uogólnienie jest szczególnie użyteczne, ponieważ
trwałość rodników decyduje o orientacji i reaktywności podczas
wielu reakcji, w których powstają wolne rodniki.
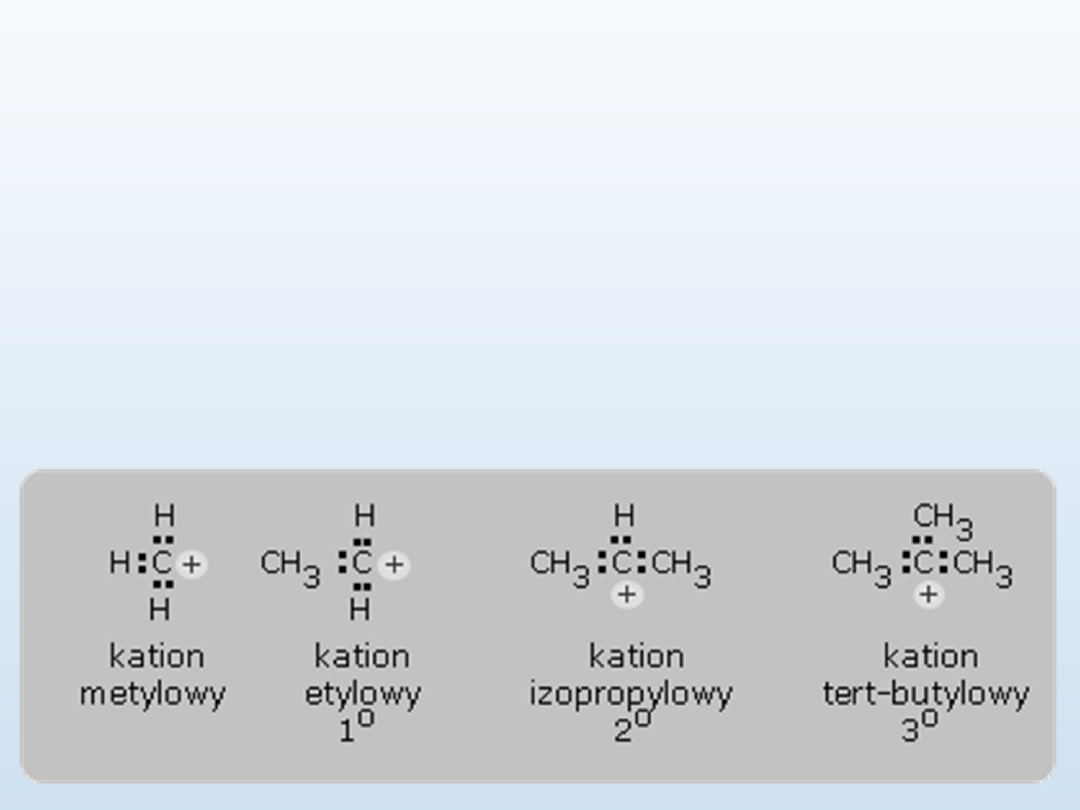
Karbokationem
jest grupa atomów zawierających atom
węgla jedynie z sześcioma elektronami. Podobnie jak w
wolnych rodnikach, rozróżnia się karbokationy:
• pierwszorzędowe
• drugorzędowe
• trzeciorzędowe

Karbokation, podobnie jak wolny rodnik, jest reaktywną cząsteczką.
Jest to spowodowane wynikiem deficytu elektronów i tendencją
atomu węgla do uzupełnienia oktetu elektronowego.O trwałości
karbokationów decydują czynniki sprzyjające rozproszeniu dodatniego
ładunku w atomie węgla, w którym występuje deficyt elektronów. Tym
czynnnikiem jest rodzaj podstawnika (Z) przyłączony do tego atomu
węgla, który może oddawać lub przyciągać elektrony.
Z→C
+
- Z oddaje elektrony (obserwujemy stabilizację kationu)
Z←C
+
- Z przyjmuje elektrony (obserwujemy destabilizację kationu)
Podstawnik oddający elektrony przyczynia się do zmniejszenia
dodatniego ładunku węgla z deficytem elektronów, przez co sam
staje się w pewnym stopniu dodatni. To rozproszenie ładunku
stabilizuje karbokation.
Podstawnik przyciągający elektrony przyczynia się do zwiększenia
dodatniego ładunku atomu węgla z niedoborem elektronów i w ten
sposób powoduje zmniejszenie trwałości karbokationu
.

Im większa liczba grup alkilowych, tym karbokation jest
Im większa liczba grup alkilowych, tym karbokation jest
trwalszy, oddawanie elektronów przez te grupy powoduje
trwalszy, oddawanie elektronów przez te grupy powoduje
rozproszenie ładunku i stabilizację jonu.
rozproszenie ładunku i stabilizację jonu.
Alkany w których występują tylko wiązania C-C i C-H, ulegają
rozpadowi wolnorodnikowemu. Szczególnie dotyczy to
wiązania C-H.
CH
4
+ Cl
2
→ CH
3
Cl + HCl
Alkeny i alkiny ze względu na obecność wiązań wielokrotnych
ulegają przede wszystkim reakcjom przyłączenia i to zarówno
według mechanizmu jonowego, jak i wolnorodnikowego o
czym decydują warunki reakcji.
H
2
C=CH
2
+ HCl → H
3
C-CH
2
-Cl
chlorek etylu

Reakcje substytucji, addycji i eliminacji
Reakcje substytucji, addycji i eliminacji
Mając na uwadze rodzaj i sposób zachodzenia zmian
w budowie cząsteczek substratów, reakcje związków
organicznych można sklasyfikować jako reakcje:
S
R
- substytucji rodnikowej
A
R
- addycji rodnikowej
E
R
- eliminacji rodnikowej
S
J
- substytucji jonowej
A
J
- addycji jonowej
E
J
- eliminacji jonowej

Reakcje substytucji
Reakcje substytucji
Substytucja rodnikowa (S
R
), to reakcja przebiegająca z udziałem wolnych
rodników, które powstają stale w wyniku reakcji łańcuchowej.
Substytucja jonowa, może przebiegać jako reakcja elektrofilowa S
E
lub jako
reakcja nukleofilowa S
N
.
Substytucja elektrofilowa S
E
: jest to substytucja, w której cząsteczka
elektrofilowa łączy się ze związekiem nukleofilowym. Takimi substancjami
elektrofilowymi są cząsteczki albo jony odznaczające się niedoborem
elektronów (H
+
, AlCl
3
, biegun dodatni wiązań atomowych spolaryzowanych).
Substytucja nukleofilowa S
N
, jest to reakcja substytucji, która zachodzi w
wyniku łączenia się czynnika nukleofilowego z elektronowym centrum
związku chemicznego. Czynnikami nukleofilowymi są cząsteczki lub jony
odznaczające się nadmiarem elektronów (OH
-
,Cl
-
, cząsteczki z wolnymi
parami elektronów (NH
3
), cząsteczki z niepolarnym wiązaniem π (eten,
benzen). Sama reakcja może przebiegać według kinetyki pierwszego lub
drugiego rzędu. Odpowiednio wtedy dla reakcji pierwszego rzędu (szybkość
reakcji zależy tylko od stężenia jednego substratu), mechanizm reakcji
określa się symbolem S
N1
i odpowiednio dla reakcji drugiego rzędu (szybkość
reakcji zależy od stężenia dwóch substratów) mechanizm reakcji określa się
symbolem S
N2
.
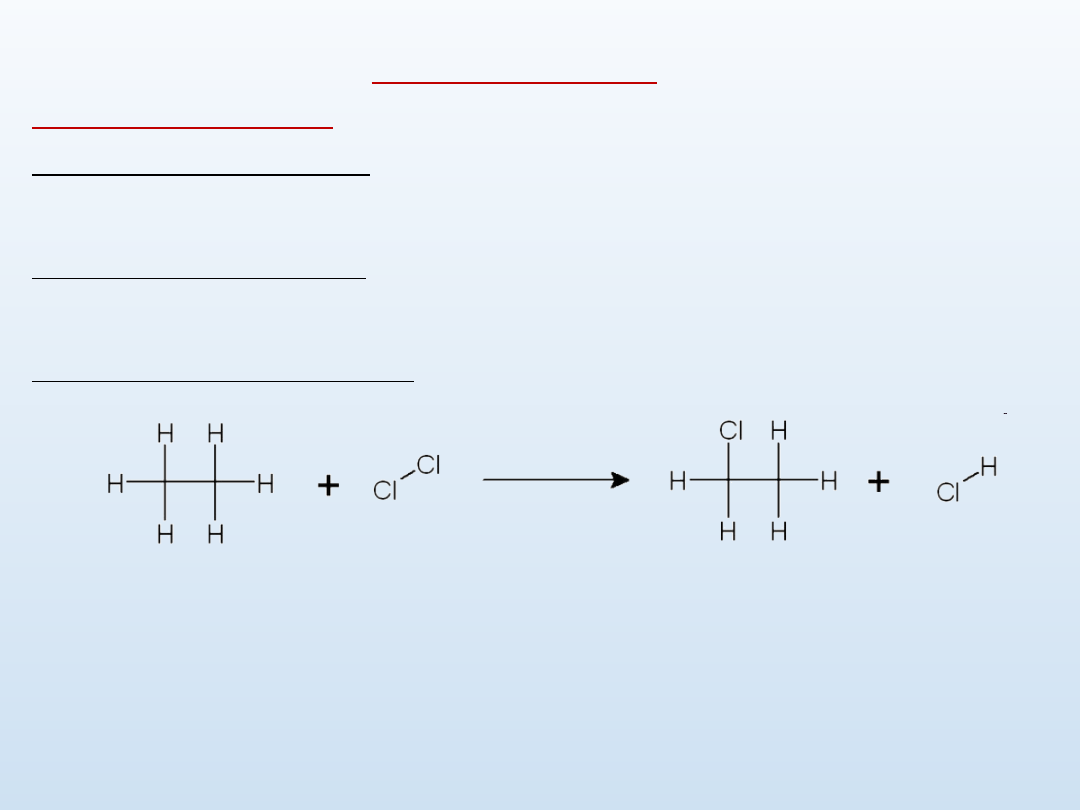
Schemat prostej reakcji substytucji etanu chlorem, zachodzącej wg
ogólnego schematu:
C
2
H
6
+ Cl
2
→ C
2
H
5
Cl + HCl
Reakcje substytucji w chemii organicznej w oparciu o ich
mechanizmy reakcji dzieli się na:
substytucja elektrofilowa – jednocząsteczkowa (S
E1
) i dwucząsteczkowa
(S
E2
)
substytucja nukleofilowa – jednocząsteczkowa (S
N1
) i dwucząsteczkowa
(S
N2
)
substytucja wolnorodnikowa (S
R
)
Schemat prostej reakcji substytucji:
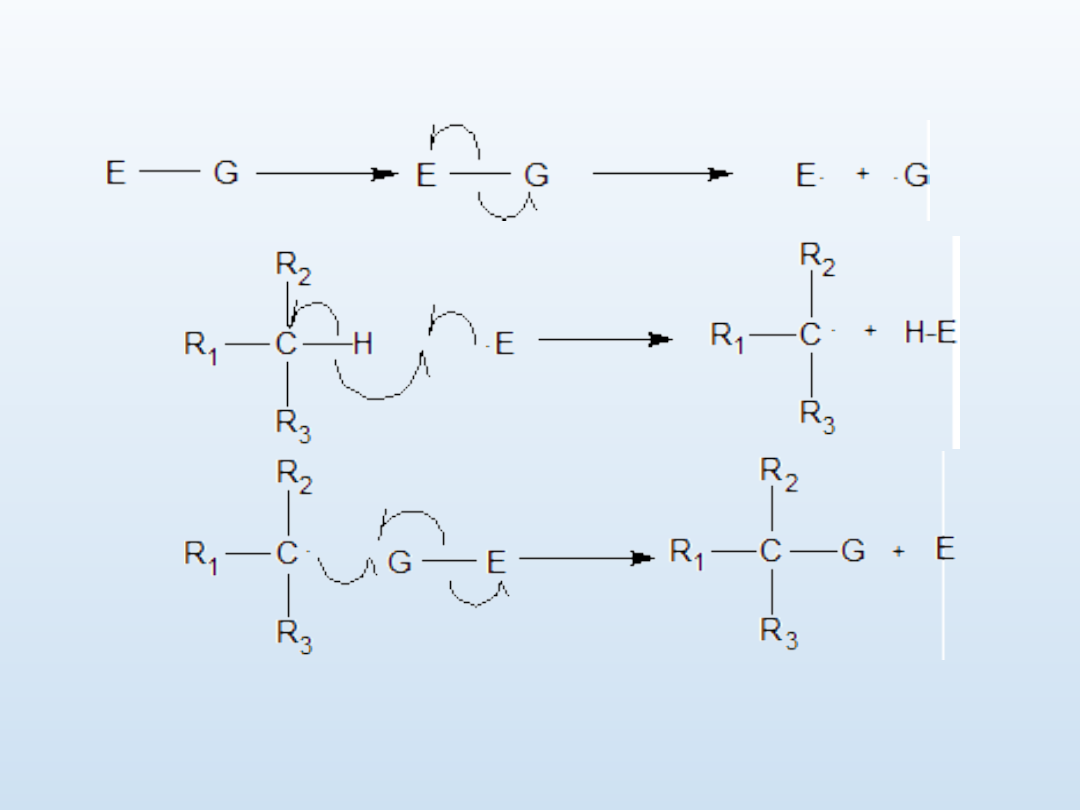
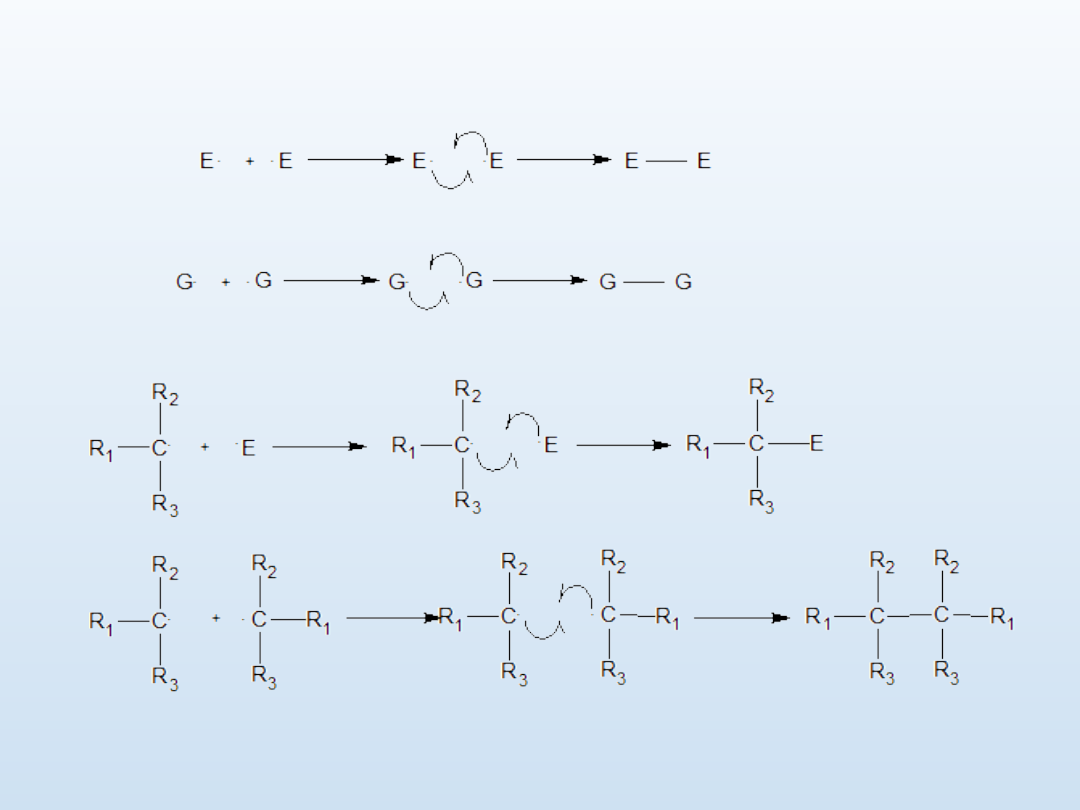
Substytucja rodnikowa
1. Inicjacja
2. Propagacja
Powstały w środowisku rodnik E. eliminuje z cząsteczki alkanu wodór wytwarzając
karborodnik, który wywołuje homolityczny rozpad następnej cząsteczki E-G co
pozwala na homogeniczne utworzenie wiązania C-G i odtworzenie rodnika E. Proces
powtarza się aż do wyczerpania reagentów
.
Substytucja rodnikowa
3. Terminacja
Według powyższego schematu zachodzą reakcje halogenowania,
nitrowania i sulfonowania alkanów
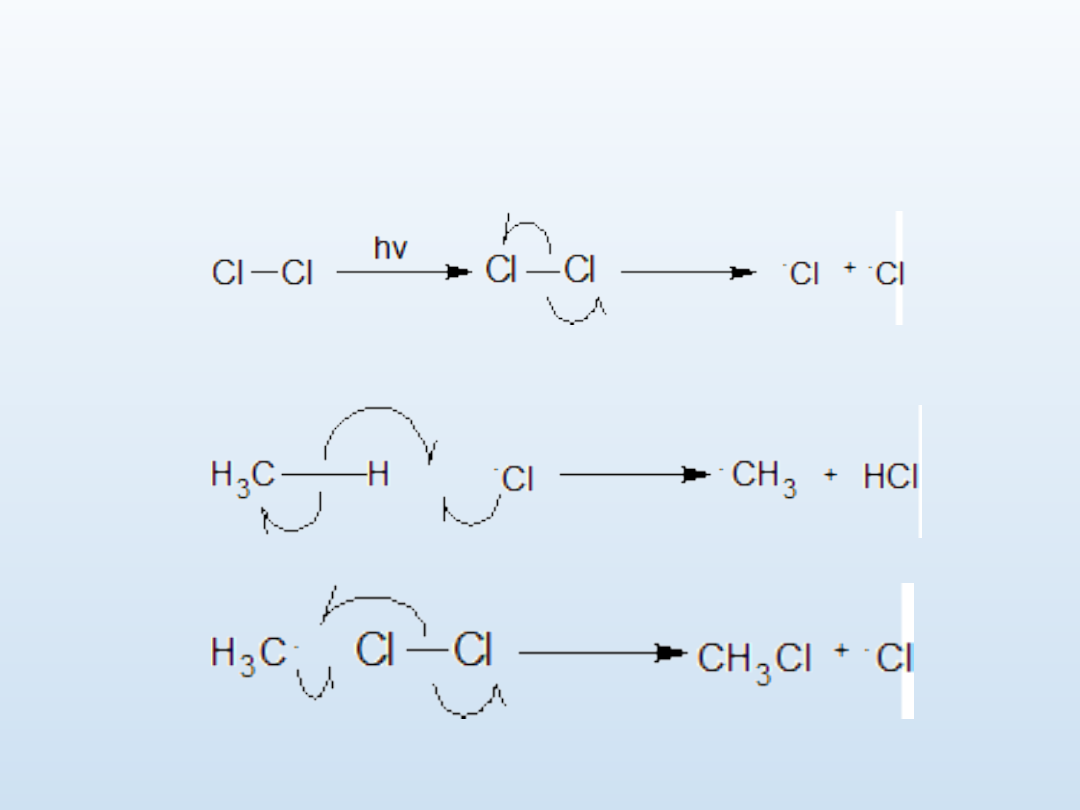
1. Inicjacja
2. Propagacja
Chlorowanie metanu
3. Terminacja
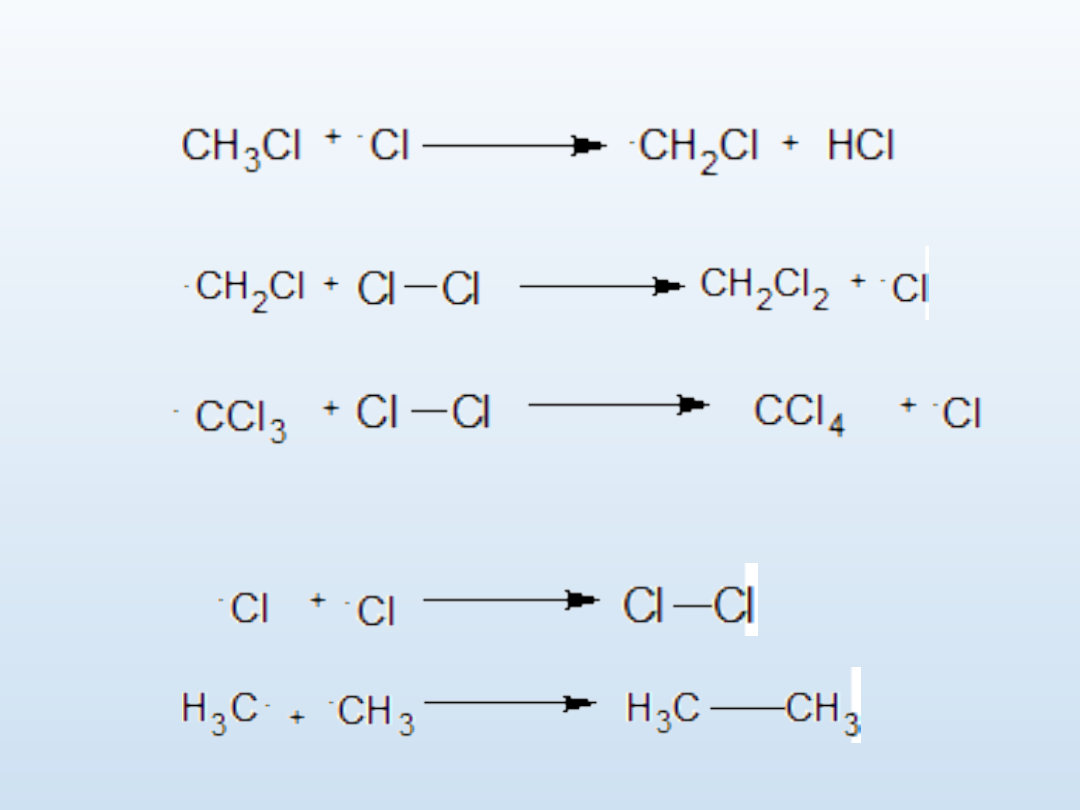
Chlorowanie metanu
itd.
itd.
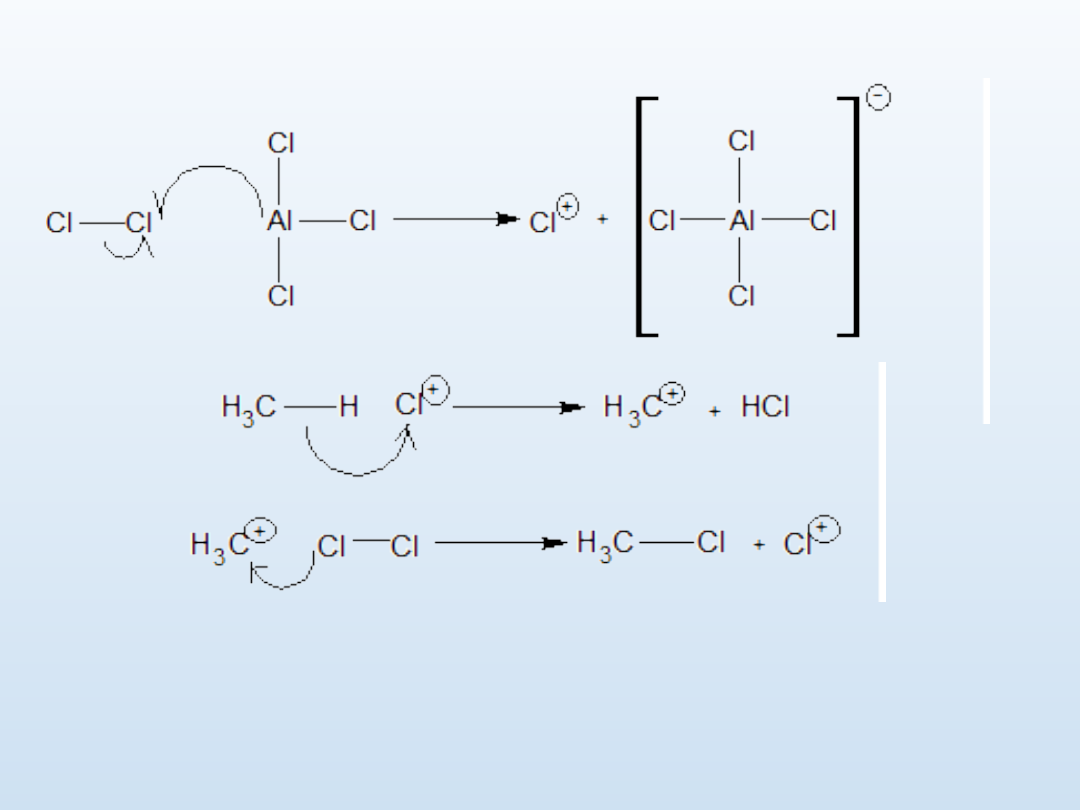
Substytucja elektrofilowa
Chlorek glinu (katalizator) reaguje z cząsteczką chloru – powstaje nietrwały i
bardzo reaktywny kation chloroniowy. Kation ten zrywa wiązanie C-H w
metanie i wiąże anion wodorkowy. Powstaje karbokation CH
3
, który reaguje z
następną cząsteczką chloru dając chlorometan i odtwarzający się kation
chloroniowy.

Addycja
(przyłączanie) - rodzaj reakcji chemicznej, polegającej
na przyłączeniu jednej cząsteczki do drugiej w wyniku czego
powstaje tylko jeden produkt, bez żadnych produktów
ubocznych. W chemii organicznej addycja przebiega zwykle z
rozerwaniem wiązania wielokrotnego węgiel-węgiel lub węgiel-
heteroatom.
H H H H
\ / | |
C=C + Cl-Cl H— C – C —H
/ \ | |
H H Cl Cl
eten chlor 1,2-
dichloroetan

Reakcje addycji
Reakcje addycji
Addycja rodnikowa A
R
- jest to reakcja przyłączenia
przebiegająca w postaci łańcuchowej z udziałem wolnych rodników.
Addycja jonowa, podobnie jak substytucja jonowa może
przebiegać jako reakcja elektrofilowa A
E
lub jako reakcja
nukleofilowa A
N
Addycja elektrofilowa A
E
- jest to reakcja przyłączenia, która
przebiega w wyniku łączenia się czynnika elektrofilowego z
cząsteczką nukleofilową.
Addycja nukleofilowa A
N
- jest to reakcja przyłączania, która
przebiega w wyniku łączenia się czynnika nukleofilowego z
elektronowym centrum związku chemicznego.
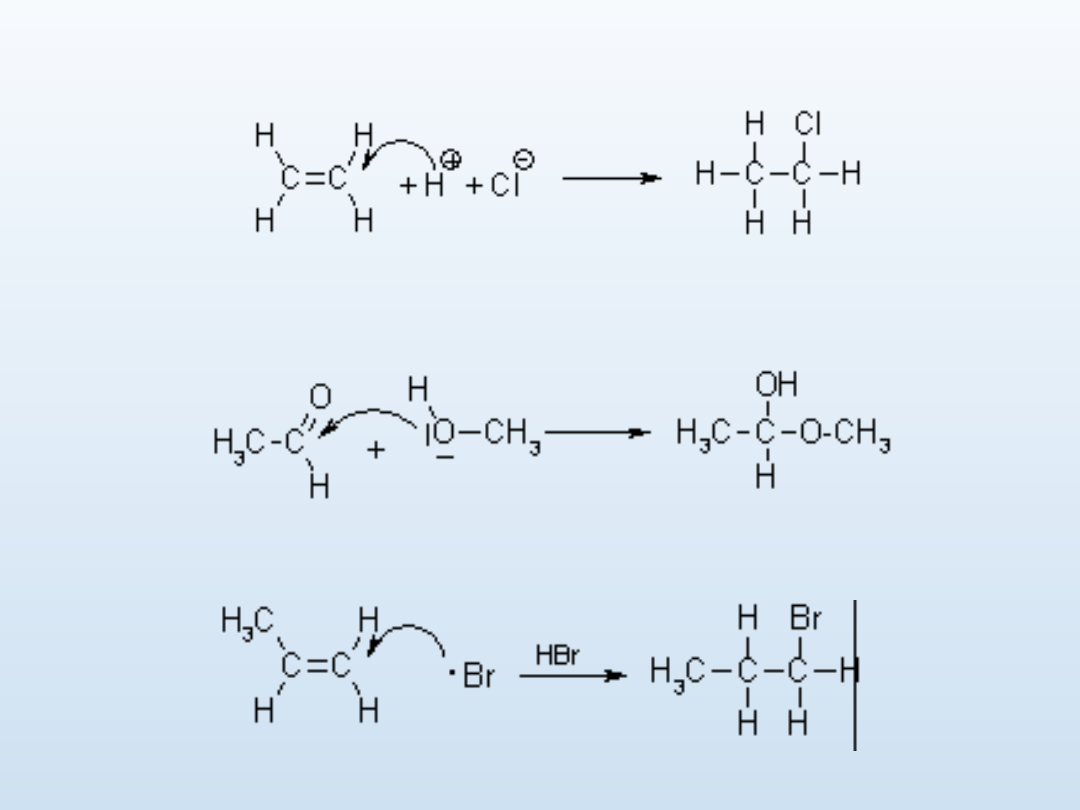
•Addycja elektrofilowa A
E
•Addycja nukleofilowa A
N
•Addycja rodnikowa A
R
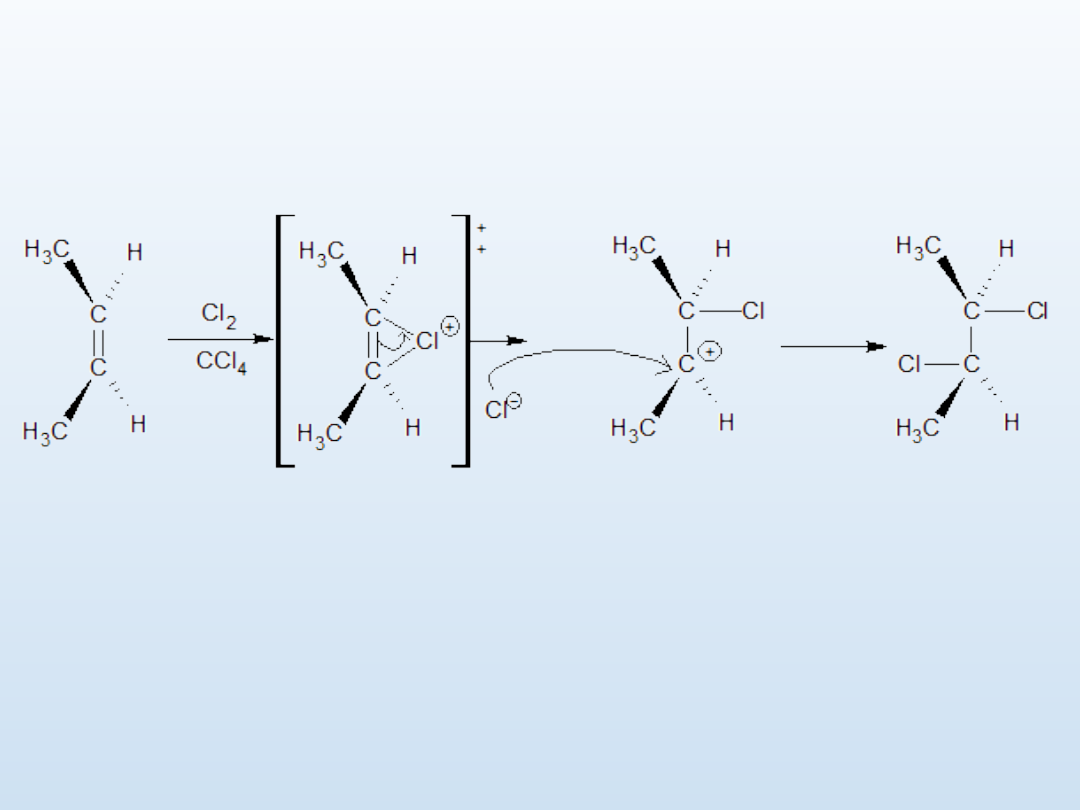
Addycja
elektrofilowa
Utworzenie karbokationu poprzedza wchodzący w skład stanu
przejściowego kation halogenoniowy
.
Kompleks halogenoniowy
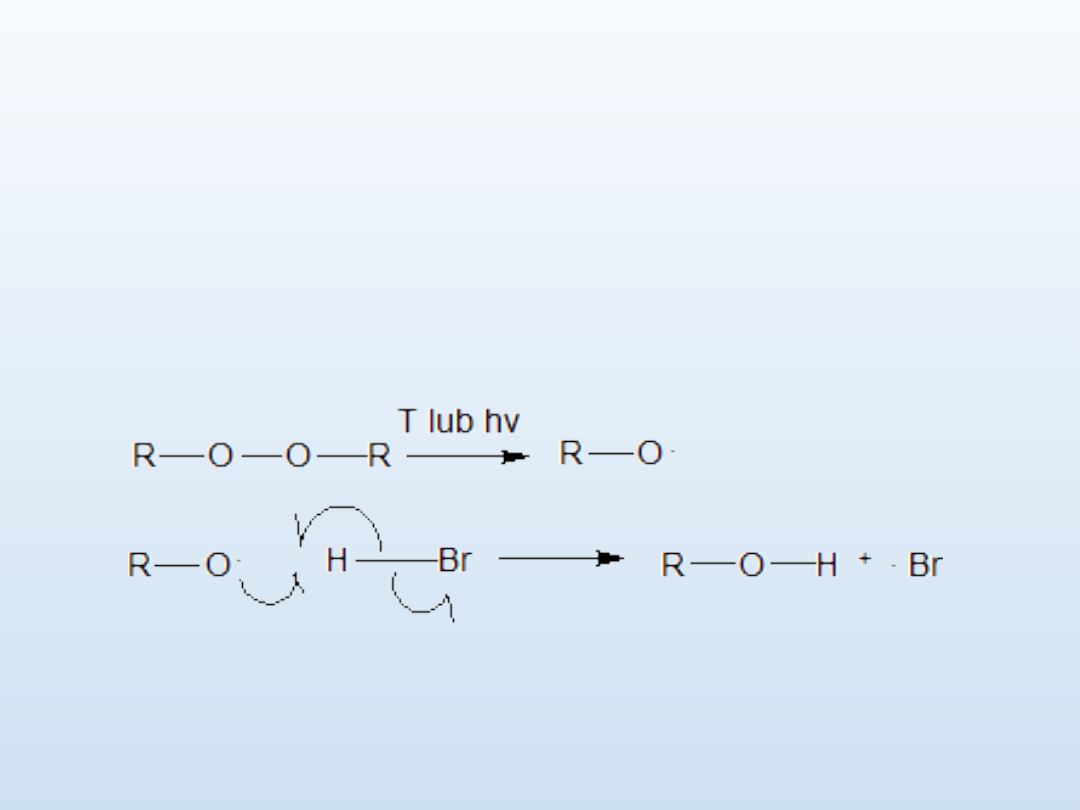
Addycja rodnikowa
Gdy w środowisku reakcji nie ma nadtlenków, addycja HBr do
alkenu zachodzi w sposób jonowy (z udziałem karbokationu),
zgodnie z regułą Markownikowa. Jeżeli w mieszaninie znajdują się
nadtlenki to proces przebiega rodnikowo (poprzez karborodnik w
stanie przejściowym) i orientacja cząsteczki HBr jest niezgodna z
regułą Markownikowa.
1. Inicjacja
Nadtlenek ulega rozkładowi homolitycznemu pod wpływem ogrzewania
lub promieniowania UV. Powstałe rodniki reagują z cząsteczką HBr
powodując jej rozpad rodnikowy na rodniki
.
H i
.
Br. Powinowactwo
rodników
.
RO jest większe względem
.
H niż
.
Br, dlatego powstają
elektroobojętne cząsteczki R-OH i rodniki
.
Br.
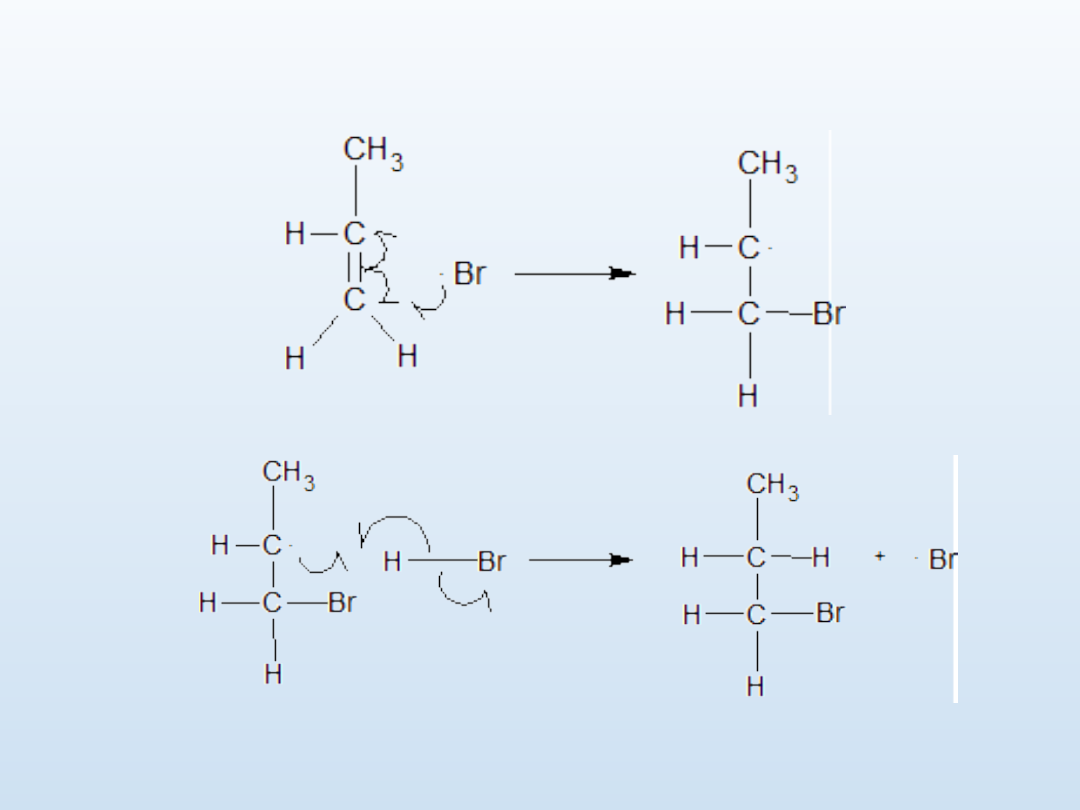
Addycja rodnikowa
2.
Propagacja
a
b
Procesy a i b powtarzają się cyklicznie, dając produkt reakcji i odtwarzając
rodnik bromowy. W etapie
3. Terminacji
, reakcja ulega wygaszeniu wskutek
wyczerpania substratów lub koligacji rodników.

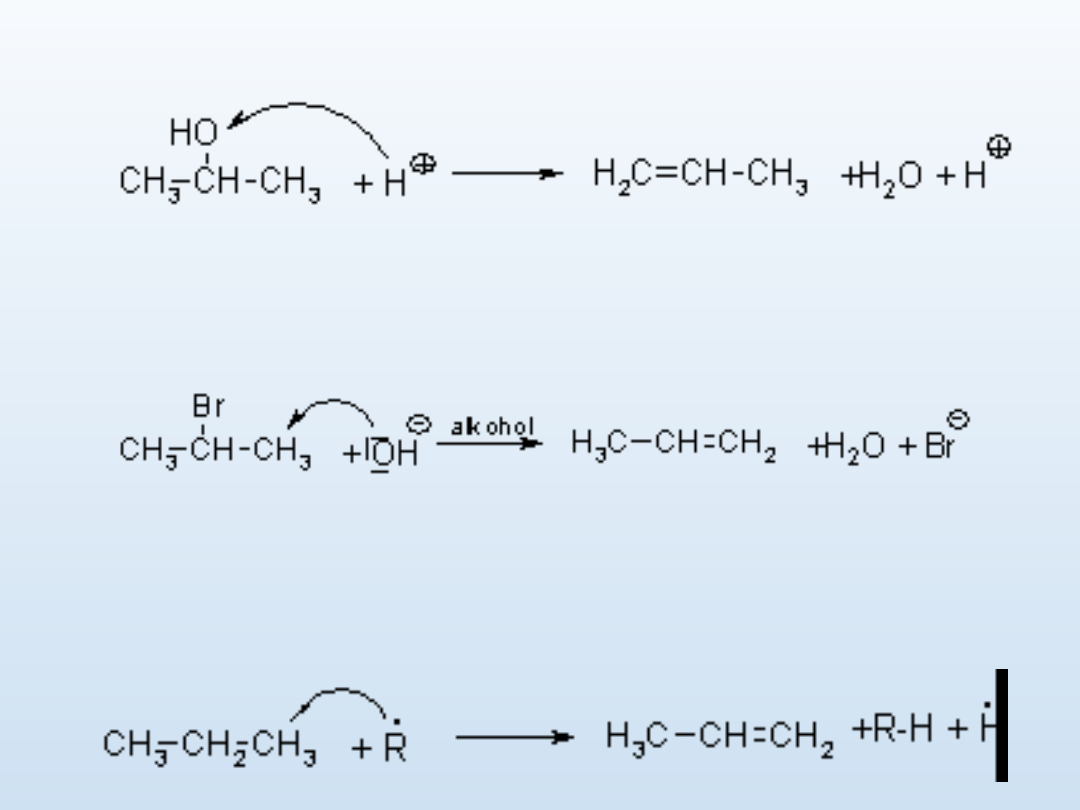
Reakcja eliminacji
Reakcja eliminacji
Jest to reakcja chemiczna, w której od jednej cząsteczki substratu
oddzielają się dwa atomy albo grupy atomów i nie są zastępowane
innymi. Otrzymane produkty zwierają wiązania wielokrotne.
Przykładami reakcji eliminacji są reakcje odwodornienia i
odwodnienia. Reakcje eliminacji mogą przebiegać zgodnie z
kinetyką pierwszego rzędu E
1
lub z kinetyką drugiego rzędu E
2
•Eliminacja elektrofilowa E
E
•Eliminacja nukleofilowa E
N
•Eliminacja rodnikowa E
R

Reakcjom wolnorodnikowym sprzyjają następujące warunki:
Reakcjom wolnorodnikowym sprzyjają następujące warunki:
środowisko niepolarne
wysoka temperatura
obecność substancji łatwo ulegajacych rozpadowi na wolne
rodniki,
np. nadtlenki R-O-OR-, 2R-O.
Światło
Natomiast reakcje jonowe mają przede wszystkim miejsce
Natomiast reakcje jonowe mają przede wszystkim miejsce
w następujących warunkach:
w następujących warunkach:
środowisko polarne
niska temperatura
obecność substancji (katalizatorów) ułatwiających rozpad jonowy,
powiększających polarność środowiska, najczęściej stosuje się
kwasy Lewisa, np. AlCl
3
, BF
3
, FeCl
3
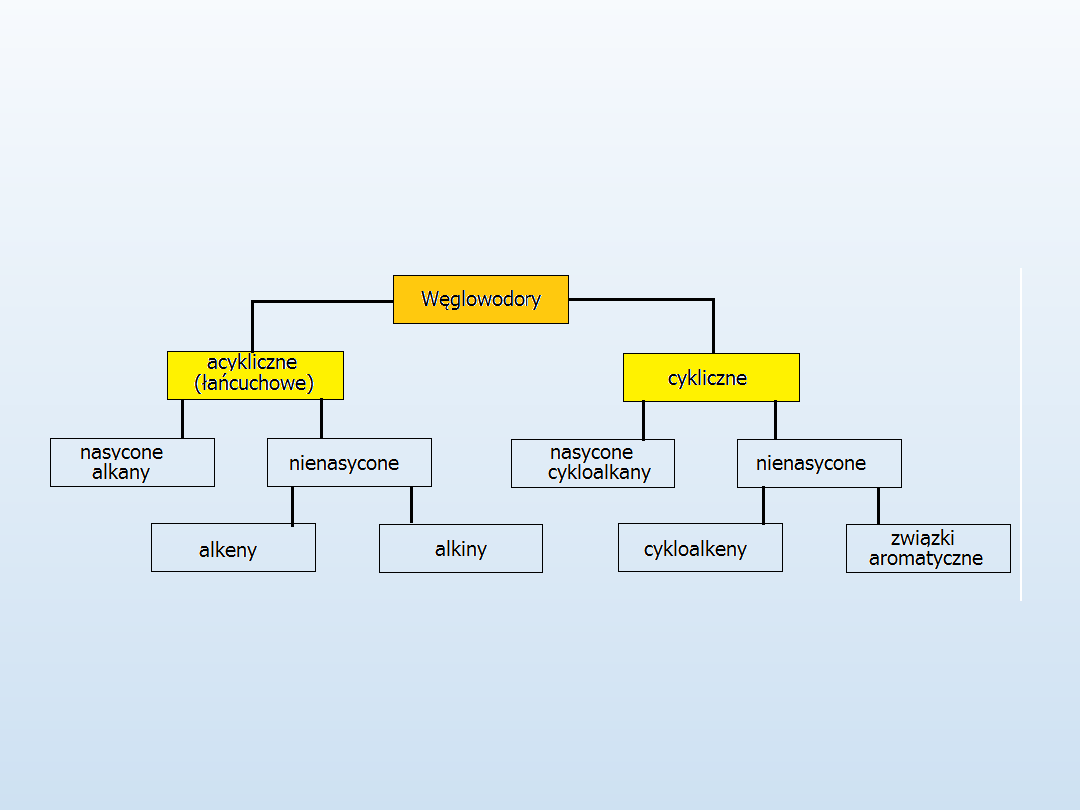
Podział
węglowodorów

Alkany są grupą węglowodorów noszących nazwę
węglowdorów nasyconych
węglowdorów nasyconych
lub węglowdorów parafinowych (parafin).
Symbol alkanów - RH (R - grupa alkilowa).
Wzór ogólny - C
Wzór ogólny - C
n
n
H
H
2n+2
2n+2
.
Hybrydyzacja atomów węgla - sp
3
.
Podstawowe wiązanie - σ

n=
wzór cząsteczkowy
wzór
konstytucyjny
nazwa
1
CH
4
CH
4
metan
2
C
2
H
6
CH
3
CH
3
etan
3
C
3
H
8
CH
3
CH
2
CH
3
propan
4
C
4
H
10
CH
3
CH
2
CH
2
CH
3
butan
5
C
5
H
12
CH
3
(CH
2
)
3
CH
3
pentan
6
C
6
H
14
CH
3
(CH
2
)
4
CH
3
heksan
7
C
7
H
16
CH
3
(CH
2
)
5
CH
3
heptan
8
C
8
H
18
CH
3
(CH
2
)
6
CH
3
oktan
9
C
9
H
20
CH
3
(CH
2
)
7
CH
3
nonan
10
C
10
H
22
CH
3
(CH
2
)
8
CH
3
dekan
11
C
11
H
24
CH
3
(CH
2
)
9
CH
3
undekan
12
C
12
H
26
CH
3
(CH
2
)
10
CH
3
dodekan
13
C
13
H
28
CH
3
(CH
2
)
11
CH
3
tridekan
20
C
20
H
42
CH
3
(CH
2
)
18
CH
3
ejkozan
30
C
30
H
62
CH
3
(CH
2
)
28
CH
3
triakontan
Do celów laboratoryjnych metan można otrzymać w wyniku
prażenia octanu sodu z wodorotlenkiem sodu:
CH
3
COONa + NaOH → CH
4
+ Na
2
CO
3
Inną metodą jest hydroliza węgliku glinu:
Al
4
C
3
+12H
2
O → 3CH
4
+ 4Al(OH)
3
Metan
CH
4

Propan
C
3
H
8
butan
C
4
H
10
heksan
C
6
H
14

W przypadku węglowodorów o budowie rozgałęzionej przyjmuje się
następujące reguły nazewnictwa systematycznego:
jako strukturę podstawową wybiera się najdłuższy łańcuch
atomy węgla w łańcuchu podstawowym numeruje się tak, aby atom
węgla, przy którym znajduje się podstawnik, oznaczony był możliwie
najmniejszą liczbą; jeżeli kilka łańcuchów ma jednakową długość, to
za podstawę przyjmuje się łańcuch o największej liczbie
podstawników
jeżeli takie same grupy alkilowe występują w cząsteczce kilka razy
jako łańcuchy boczne, to liczbę tych grup określa się przedrostkiem
>di-, tri-, tetra-,
pozycje każdego podstawnika wskazuje się za pomocą
odpowiednich liczb
jeżeli do łańcucha podstawowego dołączonych jest kilka różnych
grup alkilowych to wymienia się je kolejno w porządku alfabetycznym
nazwy podstawników (rodniki jednowartościowe powstałe w wyniku
odszczepienia jednego atomu wodoru z cząsteczki węglowodoru)
tworzy się z nazwy węglowodoru przez zamianę końcóki -an na -yl -
patrz wykład I z chemii organicznej
. Po spółgłoskach g, k, l piszemy
-il). Podstawniki oznacza się dużą literą R i noszą ogólną nazwę
alkilów. Wzór ogólny -C
n
H
2n+1
. Wyjątkiem jest nazwa alkilu
pochodnego od pentanu - C
5
H
11
. Nazwa tego alkilu to -
amyl
.
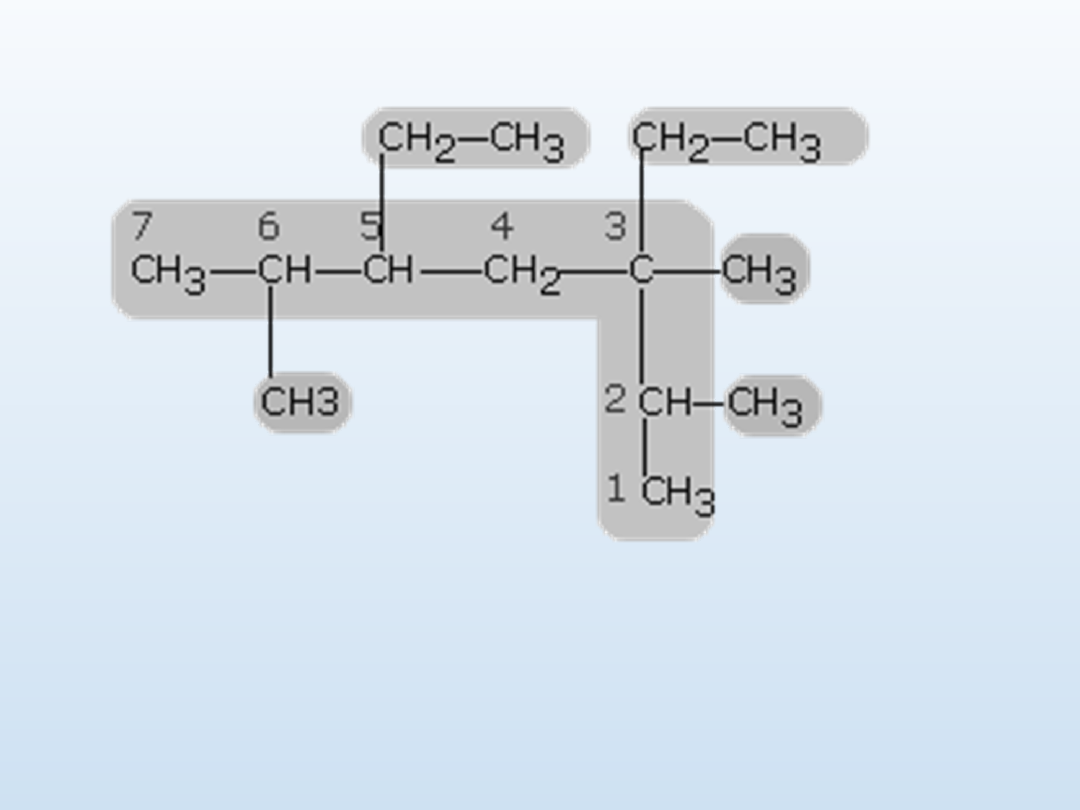
Najdłuższy jest łańcuch siedmiowęglowy, który numerujemy jak we
wzorze.
Nazwa węglowodoru jest następująca 3,5-dietylo- 2,3,6-
trimetyloheptan
W niektórych przypadkach dopuszczalne jest stosowanie nazw z
przedrostkiem izo dla podkreślenia budowy rozgałęzionej, na
przykład:
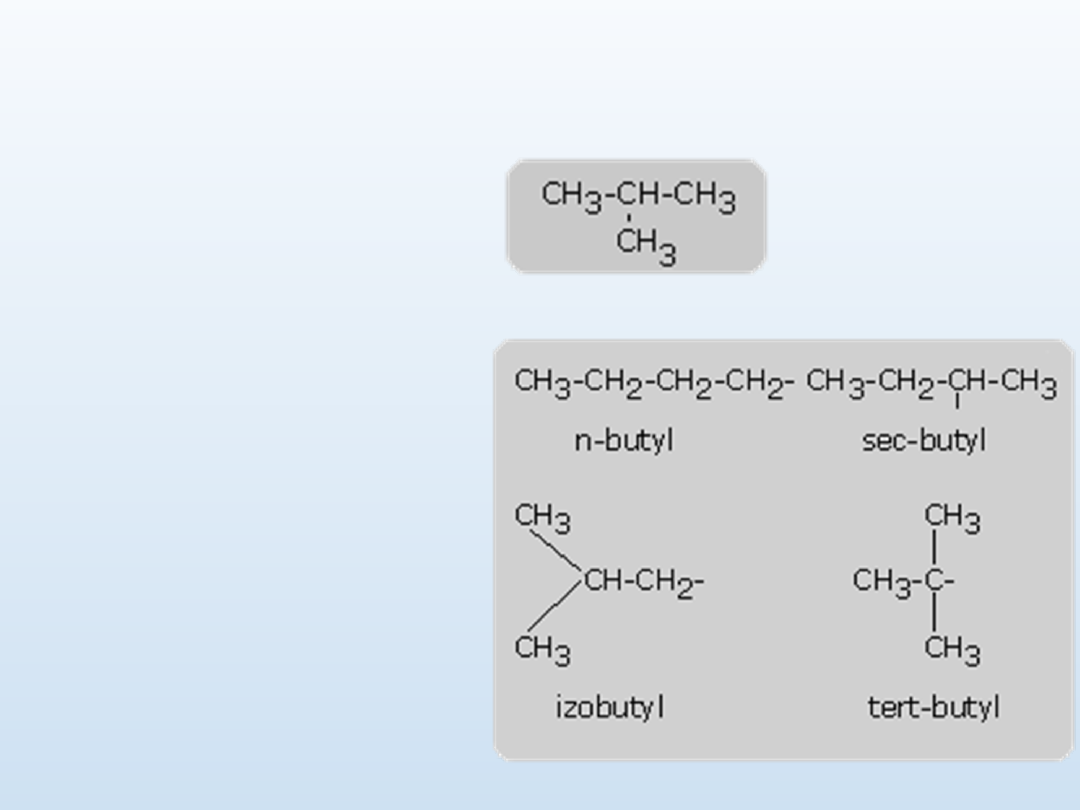
2-metylopropan , izobutan
W przypadku butanu istnieją
cztery odmiany izomeryczne -
dwie pochodzące od n-butanu i
dwie wywodzące się z izobutanu
o rozgałęzionym łańcuchu. Jak
pokazano
niżej,
są
one
oznaczone przedrostkami;
n -(normalny),
sec (drugorzędowy),
izo- i tert- (trzeciorzędowy).
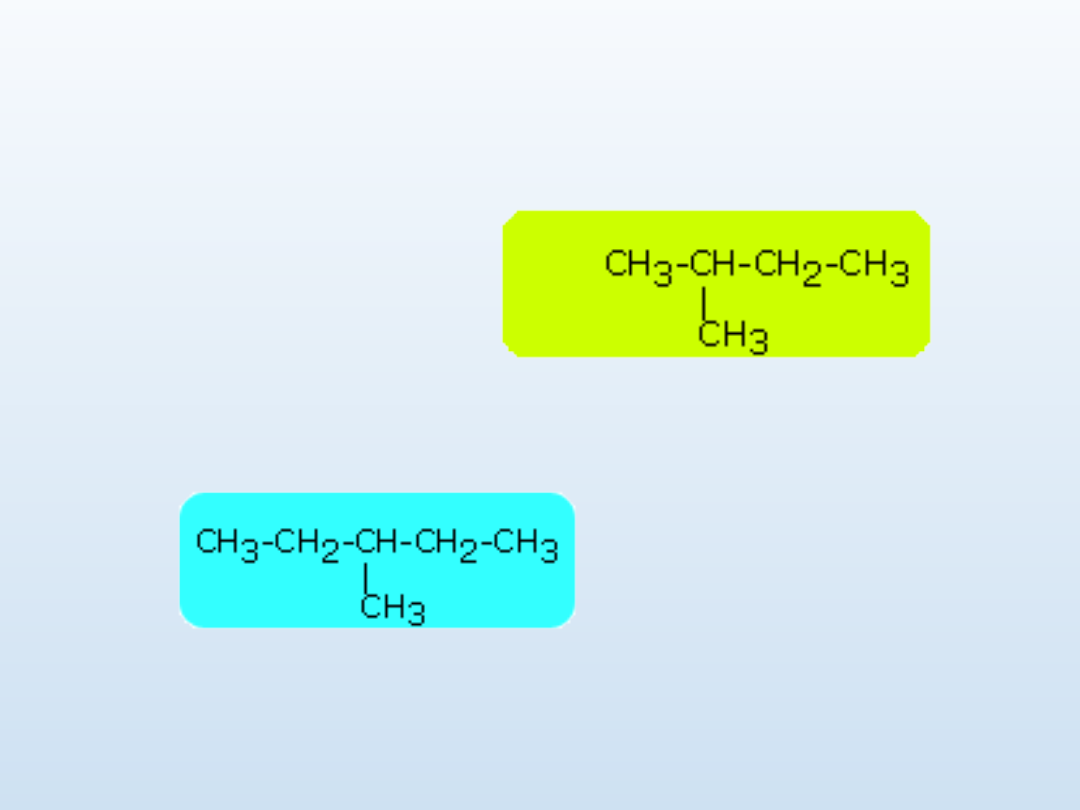
Można przyjąć, że nazwy z przedrostkiem izo, są jedynie
dopuszczalne, gdy rozgałęzienie w postaci grupy metylowej
występuje przy drugim atomie węgla w łańcuchu, na przykład:
2-metylobutan lub izopentan
ale
dla:
mamy tylko 3-
metylopentan
CH
3
CH
2
CH CH CH CH
3
CH
3
CH
2
CH
3
CH
3
CH
3
CH
2
CH CH
CH CH
3
CH
3
CH
2
CH
3
CH
3
w tym łańcuchu jest więcej podstawników
CH
3
CH
2
CH
2
CH CH
CH
3
CH
3
CH
2
CH
3
1
2
3
4
5
6
7
1
2
3
4
5
6
7
3,4 lub 4,5
Przykła
dy

CH
3
CH CH CH
2
CH CH
2
CH CH
3
CH
3
CH
3
CH
3
CH
3
CH
3
CH CH CH
2
CH CH
2
C CH
2
CH CH CH
3
CH
3
CH
2
CH
3
CH
3
CH
3
CH
3
CH
3
CH
3
1
2
3
5
7
9
1
2
3
5
7
10
1
2
4
6
7
9
1
2
3
5
7
10
5
7
2,3,5,7 lub 2,4,6,7
2,3,5,5,7,9,10 lub 2,3,5,7,7,9,10
CH
3
CH
2
CH CH CH
2
CH CH
2
CH CH
2
C
CH
2
C
H
CH
CH
3
CH
3
CH
3
CH
3
C
H
3
CH
2
CH
2
CH
3
CH
2
CH
3
CH
3
CH
3
1
3
4
6
8
10
10
1
2
6-(1,2-dimetylopropylo)-4,10-dietylo-3,8,10-
trimetylotridekan
Przykła
dy
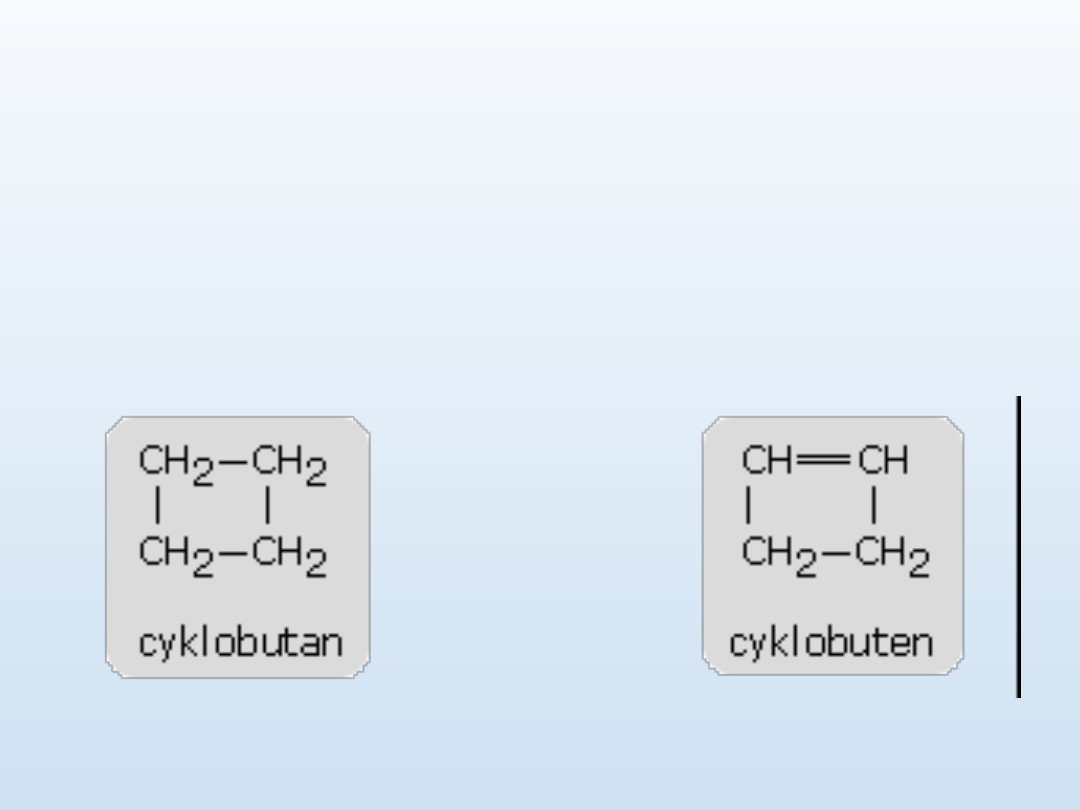
Nazewnictwo cykloalkanów
Węglowodory cykliczne - nazwy tworzy się przez dodanie
przedrostka cyklo- do nazwy odpowiedniego węglowodoru
łańcuchowego o tej samej liczbie atomów węgla.
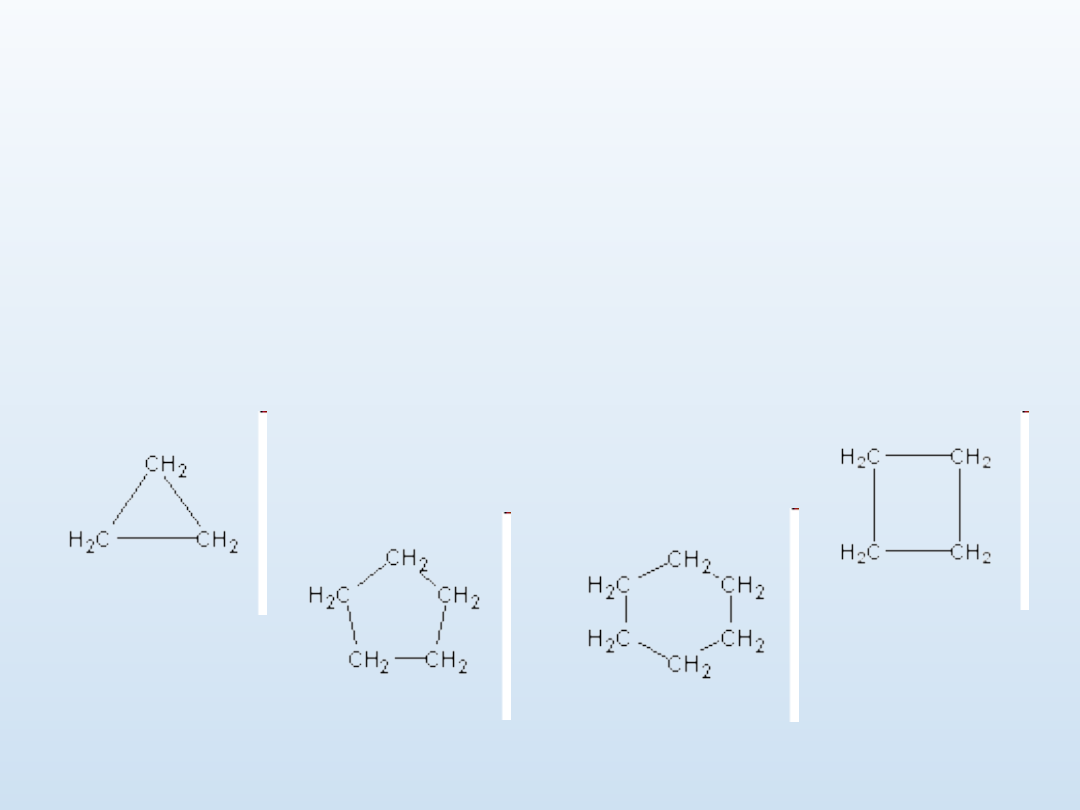
Cykloalkany posiadają podobne własności chemiczne do alkanów
nie-cyklicznych, za wyjątkiem cyklopropanu i cyklobutanu, które
ze względu na silne naprężenia kątowe wiązań chemicznych
węgiel-węgiel łatwo ulegają rozkładowi z wytworzeniem
odpowiednich rodników. Cyklopropan i cyklobutan nie występują
naturalnie. Pozostałe cykloalkany występują w produktach
rafinacji ropy naftowej, zwłaszcza w benzynie ekstrakcyjnej i
eterze naftowym. Czysty cykloheksan jest czasami stosowany
jako rozpuszczalnik
.

Właściwości fizyczne
Właściwości fizyczne alkanów zależne są od liczby atomów węgla w
cząsteczce.
Pierwsze człony szeregu homologicznego C
3
– C
5
są gazami, C
6
- C
16
cieczami a wyższe ciałami stałymi.
Nie rozpuszczają się w wodzie, rozpuszczają się w eterze, benzenie
i innych rozpuszczalnikach organicznych.
Temperatura wrzenia i topnienia zależy od budowy łańcucha.

Otrzymywanie
Poza naturalnymi źródłami takimi jak: ropa naftowa, węgiel
kamienny, gaz ziemny otrzymuje się je syntetycznie w reakcjach:
synteza z pierwiastków:
C + 2H
2
→ CH
4
uwodornienie katalizowane Pt, Pd lub Ni
CO + 3H
2
→ CH
4
+ H
2
O
CH
2
=CH
2
+ H
2
→ CH
3
-CH
3

redukcja halogenków alkilów a w tym:
reakcja Wurtza
ma zastosowanie tylko do syntezy symetrycznych alkanów
schemat:
R
1
X + Na + XR
1
→ R
1
-R
1
+ 2NaX
przykład:
C
2
H
5
-Br + 2Na + Br-C
2
H
5
→ C
2
H
5
-C
2
H
5
+ 2NaBr
Hydroliza odczynnika Grignarda
schemat:
RX + Mg → RMgX
przykład:
CH
3
-CH
2
-CH
2
Cl + Mg → CH
3
-CH
2
-CH
2
MgCl
(w środowisku
eteru)
z wodą
CH
3
-CH
2
-CH
2
MgCl + HOH → CH
3
-CH
2
-CH
2
H + Mg(OH)Cl
lub innym słabym kwasem
Redukcja z metalem w środowisku kwasowym
RX + Zn + H
+
→ RH + Zn
2+
+ X
-

reakcja halogenków alkilów ze związkami
metaloorganicznymi
RX + Li → RLi (alkilolit)
RLi + CuX → R
2
CuLi (dialkilomiedzian)
R
2
CuLi + R'X → R-R'
w reakcji R może być I-szo, II-go lub III-cio rzędowy
natomiast R' może być tylko I-szo rzędowy
Przykład:
CH
3
Br + Li → CH
3
Li (metylolit)
CH
3
Li + CuI → (CH
3
)
2
CuLi (dimetylomiedzian litu)
(CH
3
)
2
CuLi + CH
3
(CH
2
)
7
I → CH
3
(CH
2
)
7
CH
3
nonan

Właściwości chemiczne
Cząsteczki węglowodorów nasyconych o prostych łańcuchach są
niepolarne i dlatego alkany nie rozpuszczają się w polarnych
rozpuszczalnikach, np. w wodzie, natomiast dobrze rozpuszczają się
w niepolarnych rozpuszczalnikach organicznych np. w benzenie.
Niepolarność alkanów oraz trwałość wiązania C-H jest m. in.
Przyczyną ich małej reaktywności chemicznej. Alkany w temp.
pokojowej nie reagują z wodnymi roztworami kwasów i utleniaczy,
jak: KMnO
4
, K
2
CrO
4
oraz HNO
3
.
Dopiero takie czynniki, jak wysoka temperatura albo promieniowanie
UV mogą zapoczątkować reakcje chlorowania lub nitrowania.
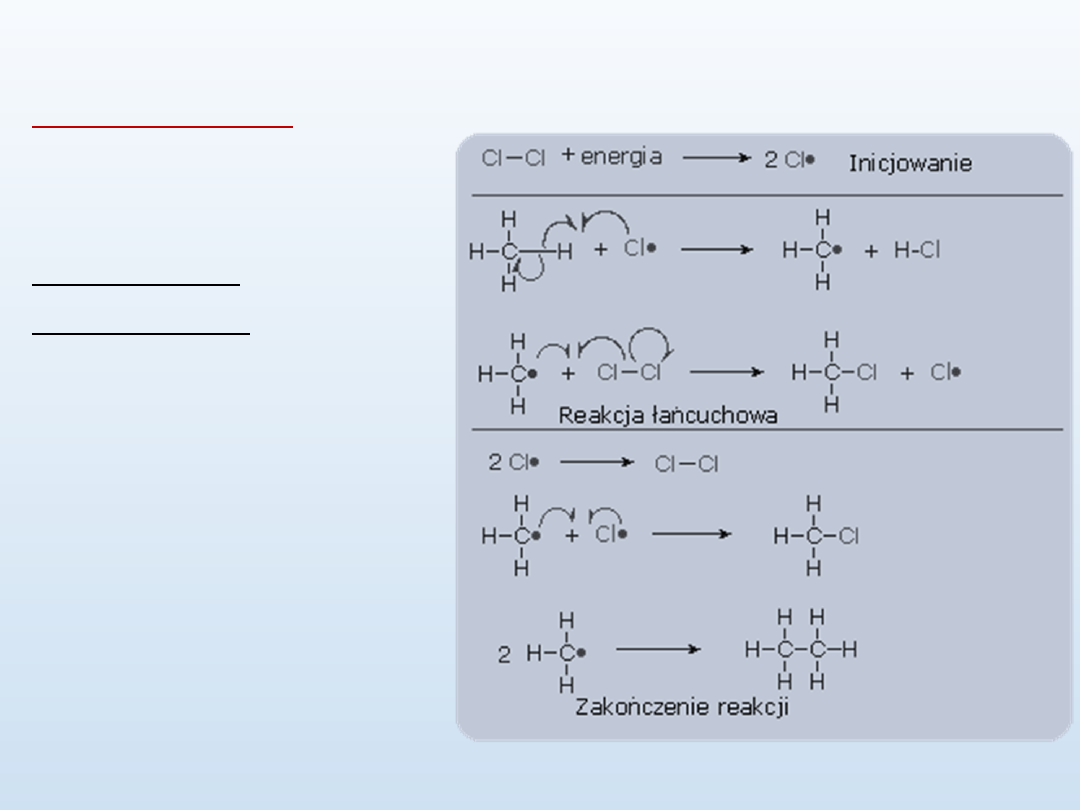
Halogenowanie
R-H + X
2
--> R-X + H-X
Halogenowanie
wolnorodnikowe (substytucja)
- powstają dzięki niej
pochodne alkanów np.
CH
4
+ Cl
2
→ CH
3
Cl + HCl
reakcja metanu z
chlorem, w wyniku której
powstaje chlorometan i
chlorowodór

Reakcja spalania alkanów
spalanie całkowite – produkty spalania to dwutlenek węgla i
para wodna (woda); na przykładzie :
butanu 2 C
4
H
10
+ 13 O
2
→ 8 CO
2
+ 10 H
2
O
pentanu
C
5
H
12
+ 8O
2
→ 5CO
2
+ 6H
2
O
półspalanie – produkty spalania to tlenek węgla i para wodna
(woda); na przykładzie etanu:
2 C
2
H
6
+ 5 O
2
→ 4 CO + 6 H
2
O
spalanie niecałkowite – produkty spalania to para wodna
(woda), sadza (węgiel); na przykładzie metanu:
CH
4
+ O
2
→ C + 2 H
2
O
Reakcja pirolizy (kraking)
Jest to reakcja mająca na celu rozkład cząsteczek węglowodorów na
mniejsze cząsteczki. Piroliza (kraking) przebiega w temperaturze 400-
600°C i w obecności katalizatora. Piroliza prowadzi do zmniejszenia
długości łańcuchów węgla w cząsteczkach oraz do ich izomeryzacji.
Reakcje te mają duże znaczenie praktyczne przy produkcji paliw ciekłych
(→ kraking, reforming).
alkan → H
2
+ alkany o mniejszych cząsteczkach + alkeny
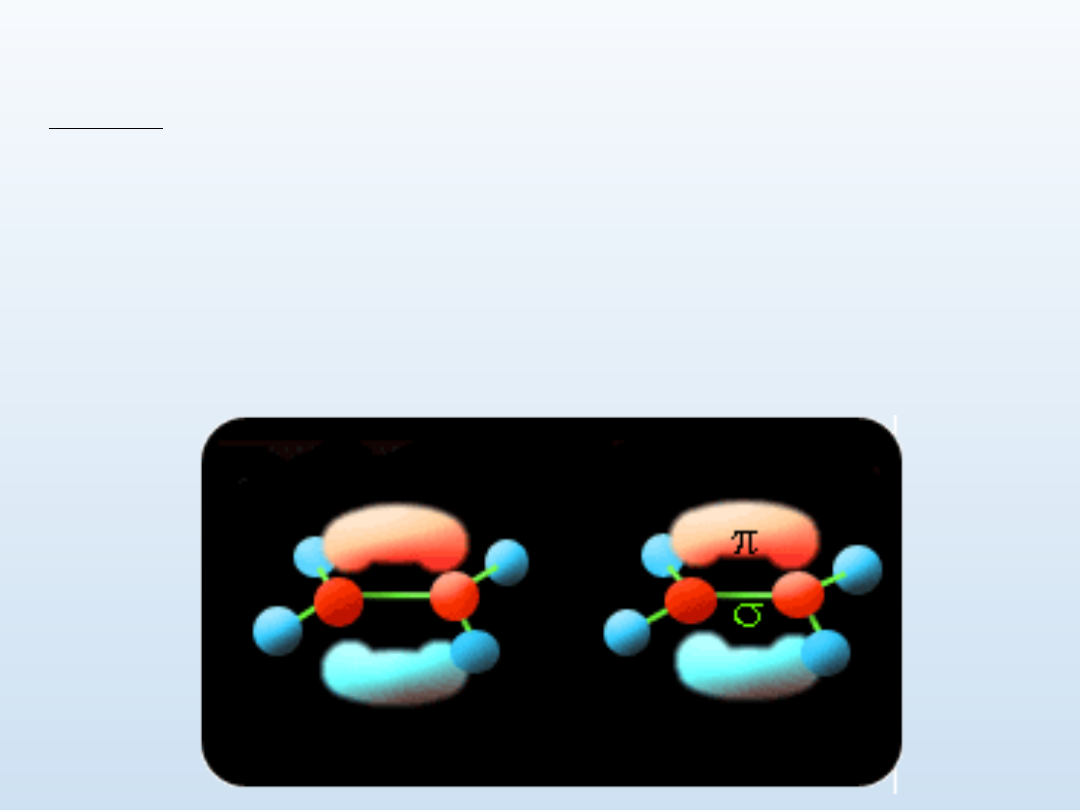
Węglowodory nienasycone - alkeny i
alkiny
Alkeny
Alkeny są grupą węglowodorów noszących nazwę węglowodorów
nienasyconych lub olefin.
Wzór ogólny - C
n
H
2n
.
Hybrydyzacja atomów węgla - sp
2
.
Podstawowe wiązanie między atomami węgla- σ oraz π
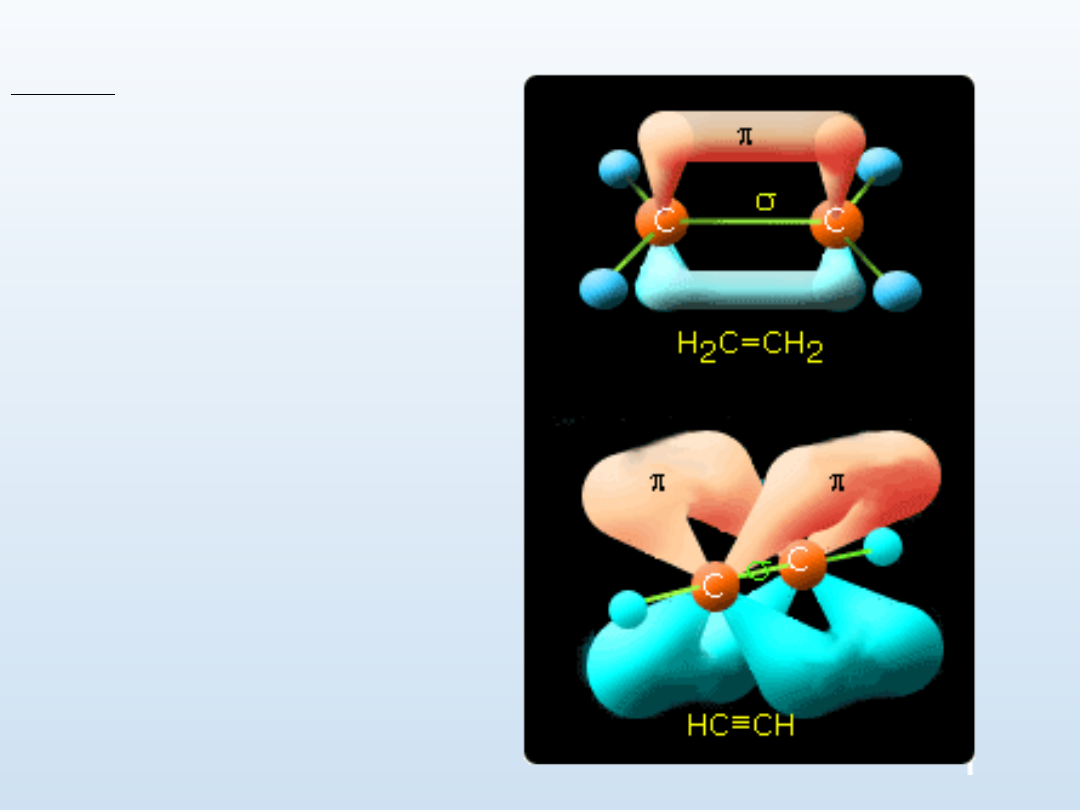
Alkiny
Alkiny są grupą węglowodorów
noszących nazwę węglowdorów
nienasyconych lub acetyli.
Wzór ogólny - C
n
H
2n-2
Hybrydyzacja atomów węgla -
sp.
Podstawowe wiązanie między
atomami węgla- σ oraz 2 x π
Przykład
Alken - eten
Alkin - etyn

Nazewnictwo
Ogólną nazwę dla węglowodorów nienasyconych tworzy się przez zmianę
końcówki:
-an na końcówkę -en dla węglowodorów o wiązaniu podwójnym (alkeny,
weglowodory nienasycone, olefiny)
-an na końcówkę - yn (-in) dla węglowodorów o wiązaniu potrójnym (alkiny,
węglowodory nienasycone, acetyleny).
Tworzenie nazw węglowodorów jest następujące:
jako strukturę podstawową wybiera się najdłuższy ciągły łańcuch, który
zawiera wiązanie nienasycone
położenie wiązania nienasyconego w podstawowym łańcuchu oznacza się
odpowiednią cyfrą umieszczoną na końcu nazwy wyjściowej struktury
numerację łańcucha rozpoczyna się od tego końca, bliżej którego znajduje
się wiązanie nienasycone.
położenie grup alkilowych przyłączonych do łańcucha podstawowego
oznacza się odpowiednimi cyframi
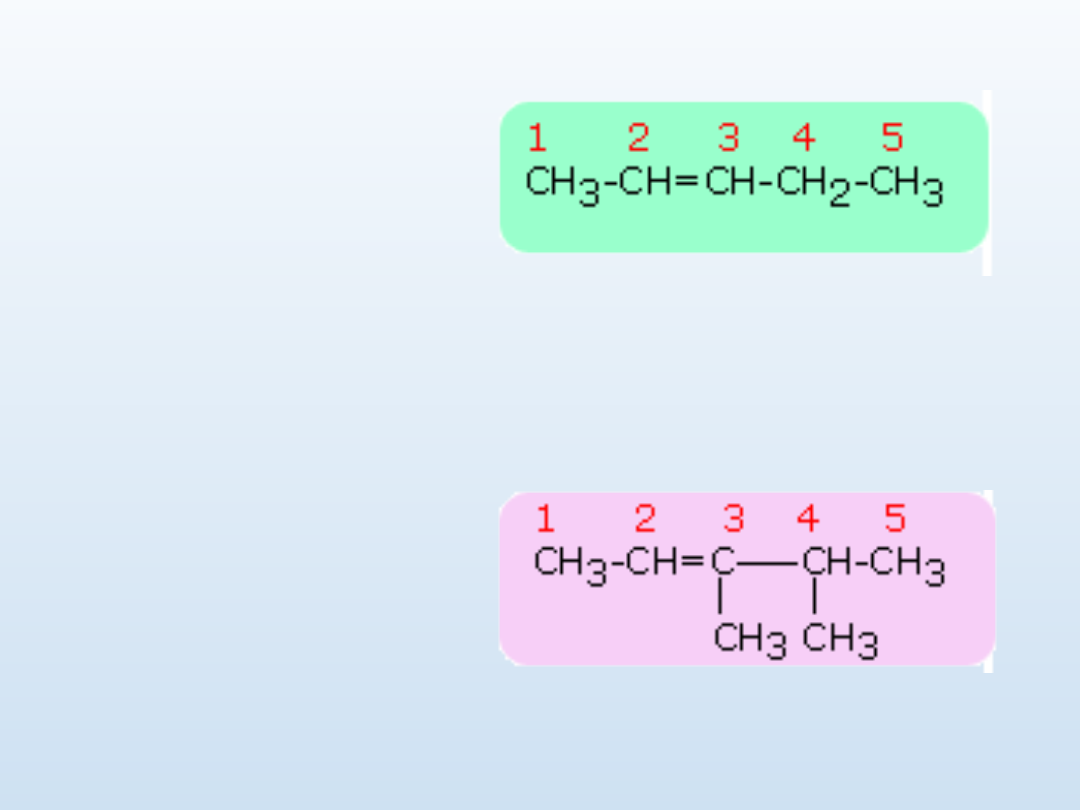
Przykłady
pent-2-en
3,4-dimetylopent-2-
en
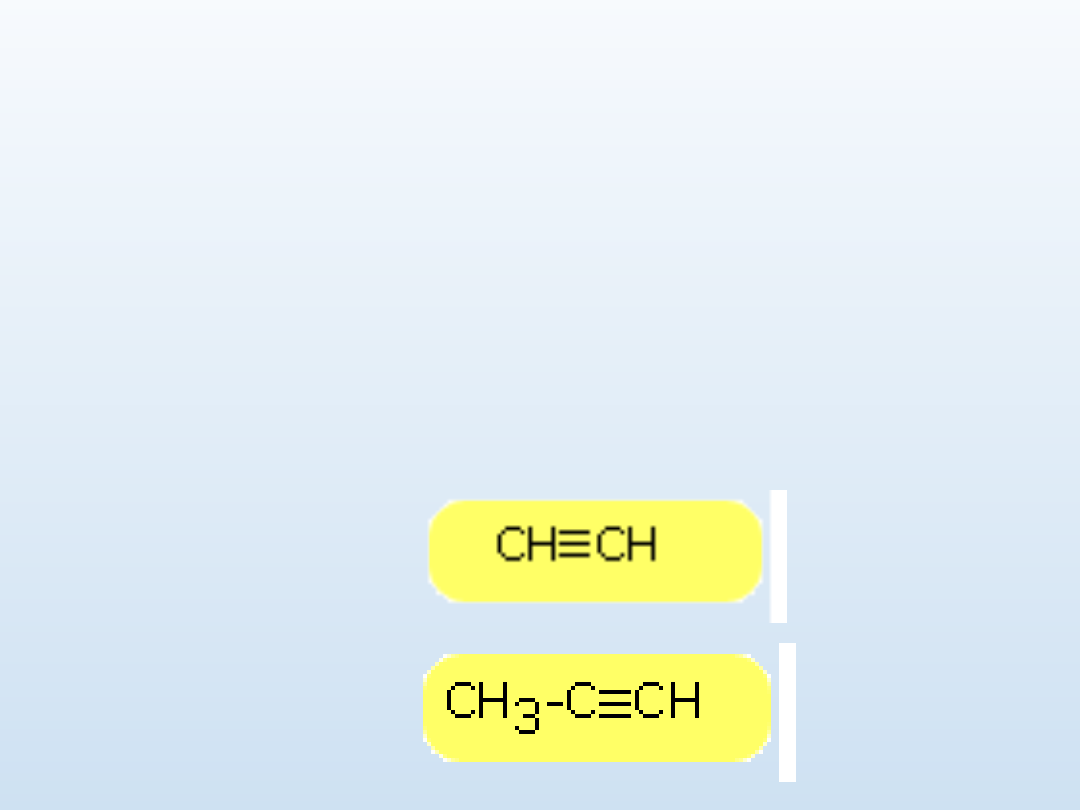
Obok nazw systematycznych spotyka się nazwy zwyczajowe z końcówką
-ylen
H
2
C=CH
2
eten, etylen
H
2
C=CH-CH
2
-CH
3
but-1-en, butylen
Nazwy rodników pochodnych alkenów tworzy się przez dodanie końcówki
-yl do nazwy weglowodoru ALKENYL.
H
2
C=CH- etenyl (zwyczajowo winyl)
H
2
C=CH-CH
2
- prop-2-yl, allil
Przykłady dla węglowodorów z wiązaniem potrójnym
etyn, acetylen
propyn,
metyloacetylen

Jeżeli w cząsteczce występuje większa liczba wiązań
nienasyconych, wtedy liczbę wiązań wielokrotnych określa się
liczebnikiem greckim umieszczonym przed końcówką
oznaczającą rodzaj wiązania:
alkadien, alkatrien..., alkapolien
alkadiin, alkatriin..., alkapoliin
Przykład:
CH
2
=CH-CH=CH
2
but-1,3-dien
(dwuwinyl)
W obecności wiązań podwójnych i potrójnych w nazwie dajemy
pierwszeństwo wiązaniu podwójnemu: heksa-1,5-dien-3-in
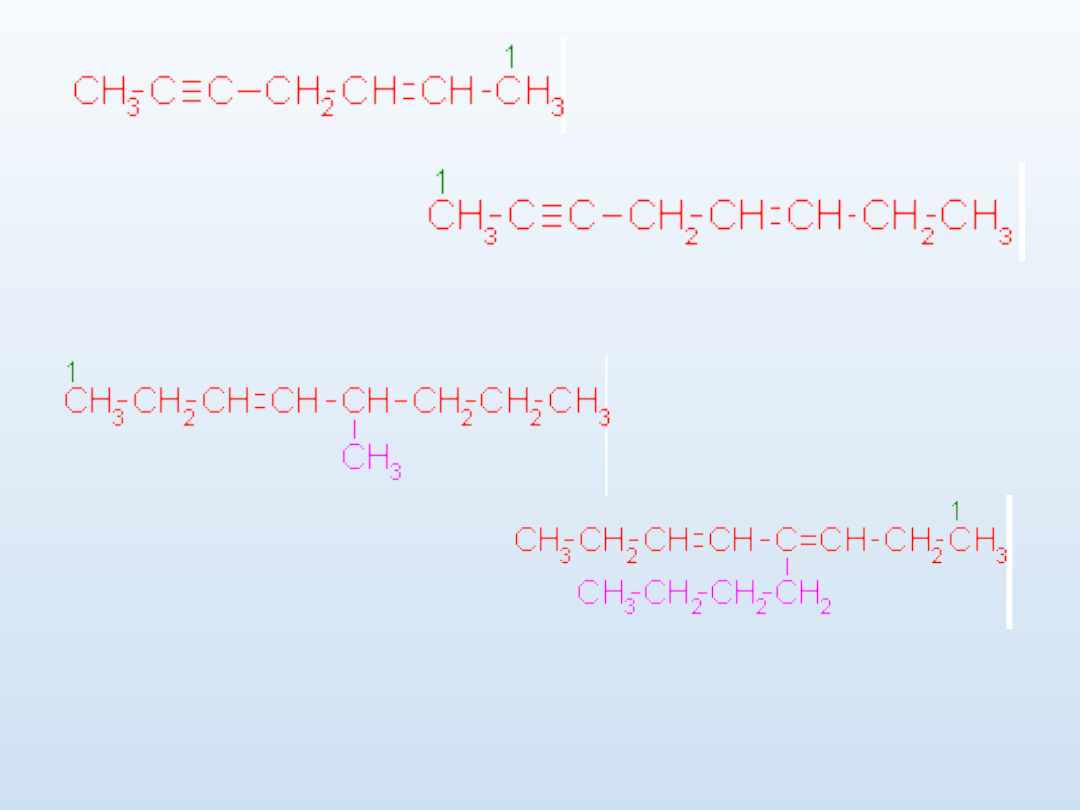
hept-2-en-5-yn
okt-5-en-2-
yn
5-metylookta-3-en
4-butylookta-3,5-dien

Właściwości fizyczne
Właściwości fizyczne alkenów (podobnie jak alkanów) zależne
są od liczby atomów węgla w cząsteczce:
nie rozpuszczaja się w wodzie, rozpuszczają się w eterze,
benzenie i innych rozpuszczalnikach organicznych.
temperatura wrzenia i topnienia zależy od budowy łańcucha;
węglowodory o łańcuchu rozgałęzionym mają niższe
temperatury wrzenia a wyższe temperatury topnienia od
izomerycznych węglowodorów.
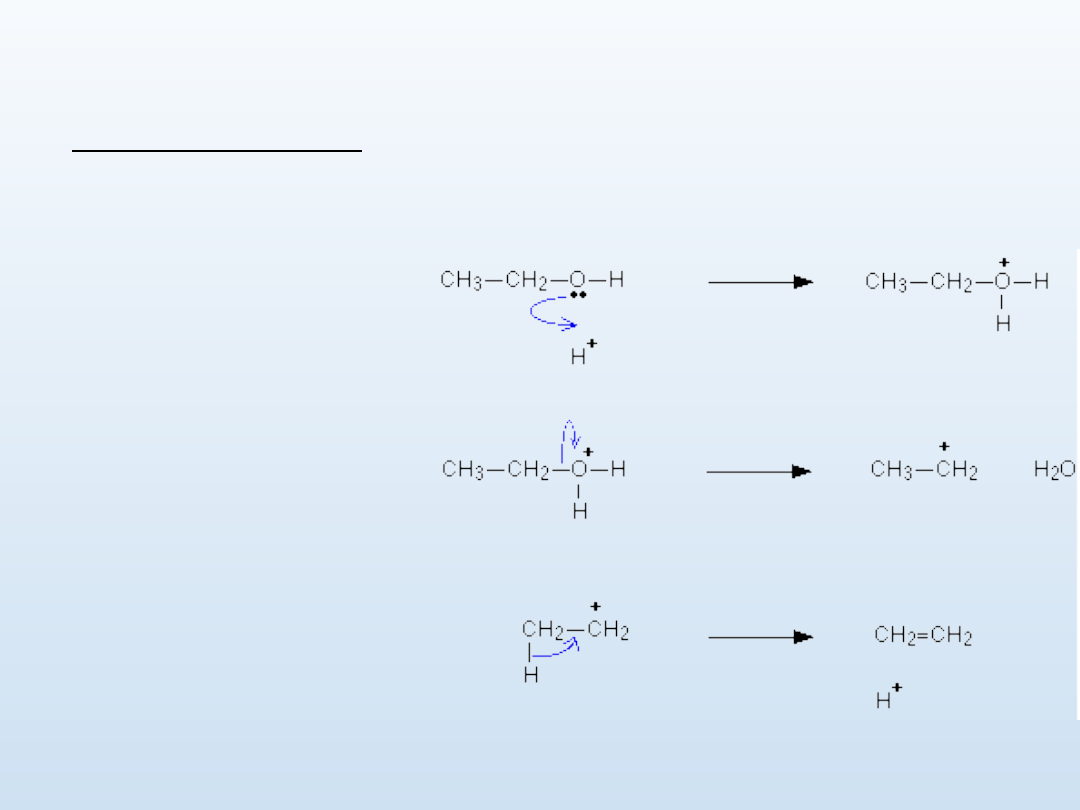
Otrzymywanie
Otrzymywanie alkenów opiera się przede wszystkim na reakcji
eliminacji.
1. Odwodnienie alkoholi
reakcja wymaga obecności kwasu i ciepła
CH
3
-CH
2
-OH → CH
2
=CH
2
+ H
2
O
Mechanizm:
łatwość odwodniania jest następująca:
III rzędowy alkohol > II rzędowy alkohol > I rzędowy alkohol
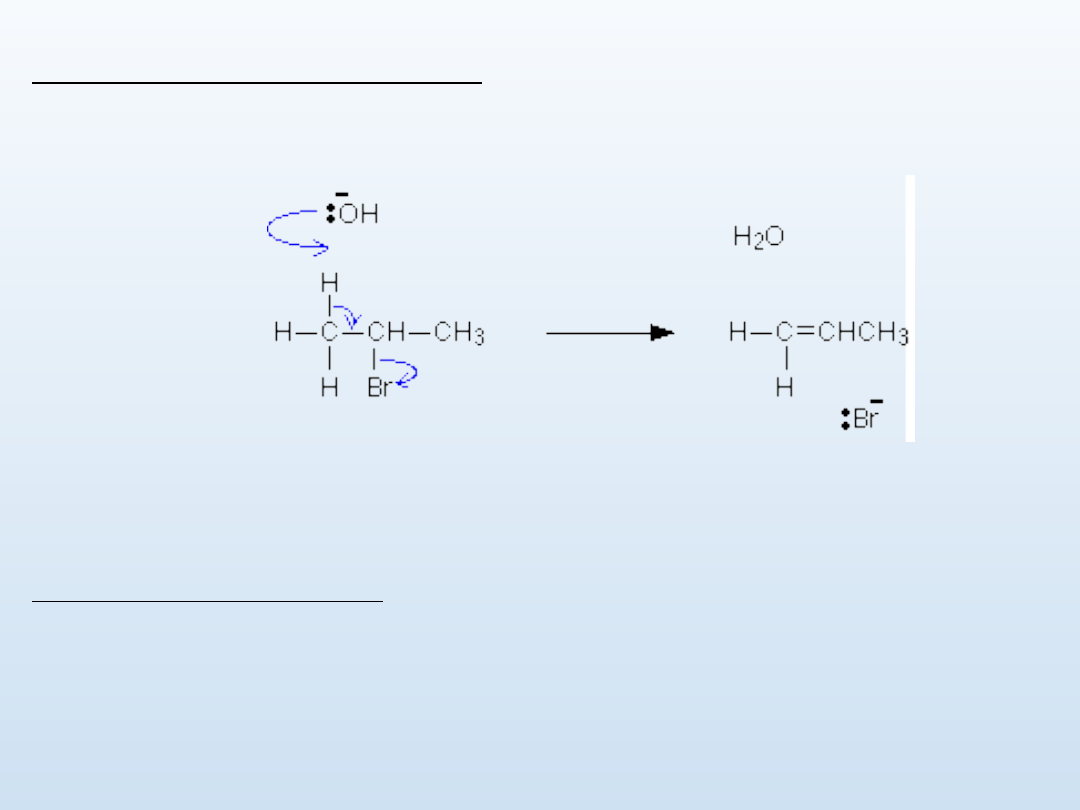
2. Odłączenie chlorowcowodorów
Mechanizm:
3. Odłączenie chlorowców
CH
3
-CHBr-CH
2
Br + Zn --> CH
3
-CH=CH
2
+ ZnBr
2

Addycja wodoru i halogenu
Alkeny pod wpływem wodoru, chloru i bromu przekształcają się łatwo w
związki nasycone, gdzie atomy wodoru i odpowiedniego halogenu
przyłączane są do sąsiednich atomów węgla
addycja wodoru (katalizator Pt, Pd lub Ni)
CH
2
=CH
2
+ H
2
→ CH
3
-CH
3
addycja halogenu (przykład - otrzymywanie 1,2-dibromopropanu)
CH
3
CH=CH
2
+ Br
2
→ CH
3
CHBr-CH
2
Br
Reakcje alkenów
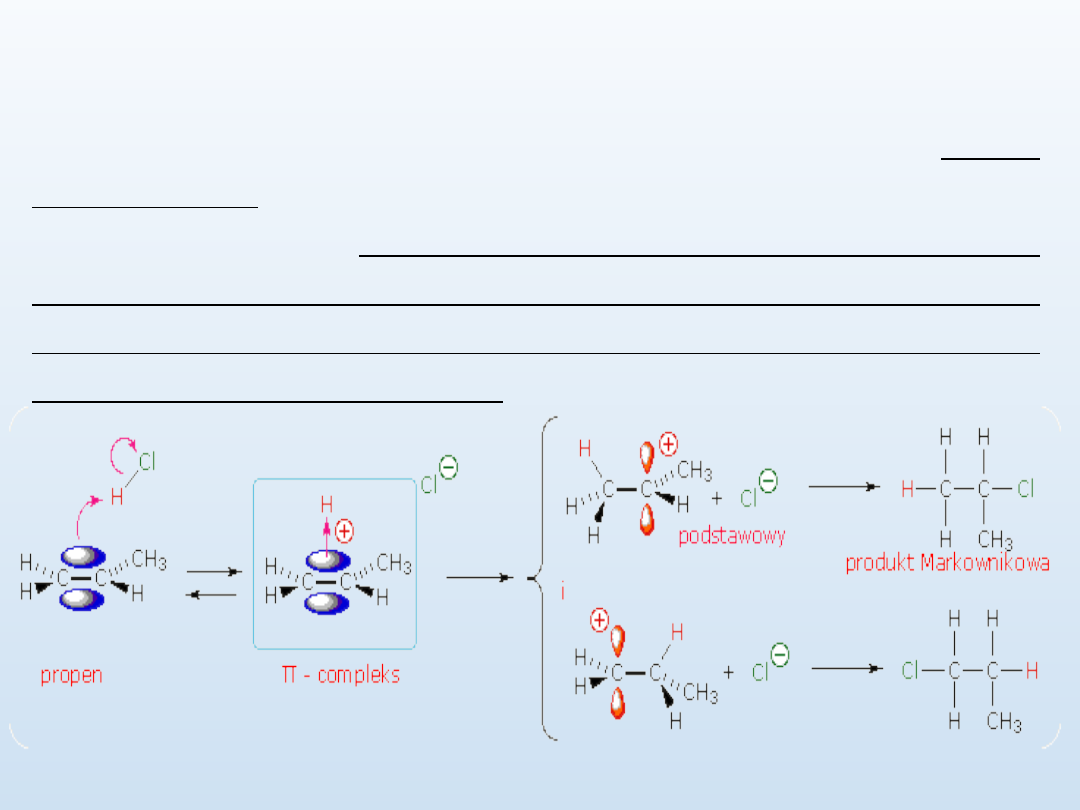
Addycja halogenowodoru
Reakcja przyłączania halogenowodoru przebiega zgodnie z regułą
Markownikowa
w następujący sposób: podczas jonowej addycji kwasu do wiązania
podwójnego węgiel-węgiel alkenu, atom wodoru cząsteczki kwasu
przyłącza się do tego atomu węgla, z którym połączona jest już
większa liczba atomów wodoru.
Przykłady
1. Otrzymywanie 2-jodopropanu
CH
3
-CH=CH
2
+ HI --> CH
3
-CHI-CH
3
2. Otrzymywanie 2-bromopropanu
CH
3
-CH=CH
2
+ HBr --> CH
3
-CHBr-CH
3
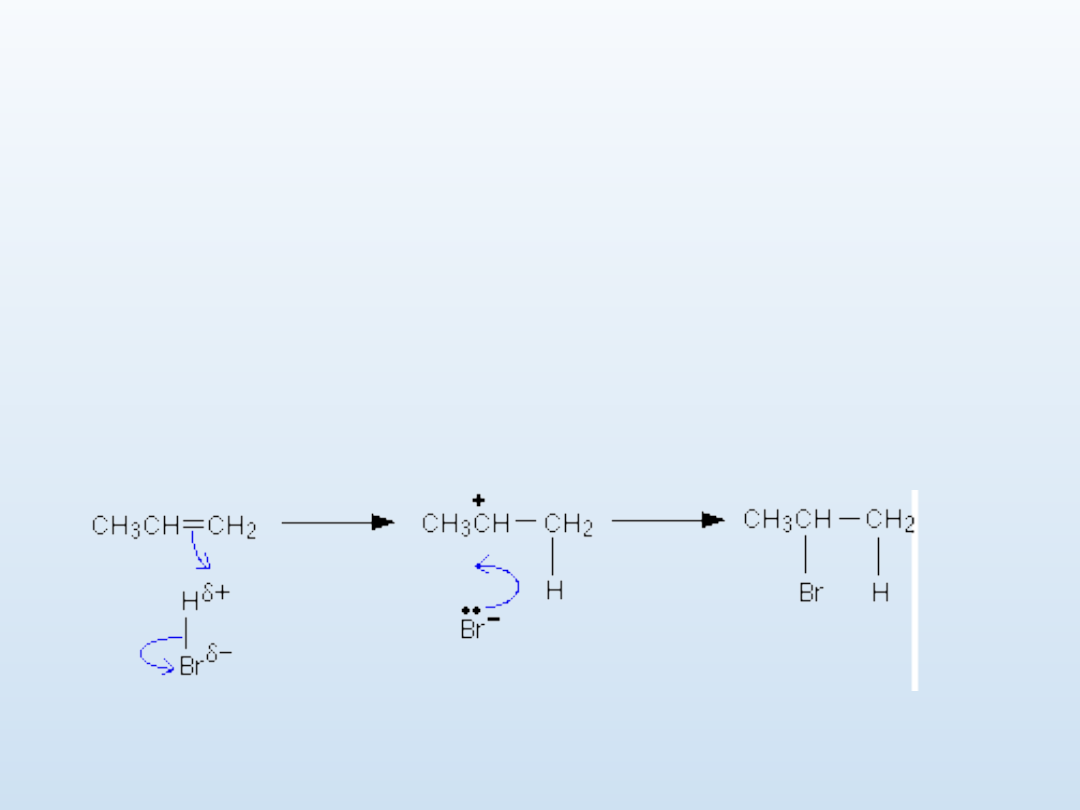
W obecności nadtlenków reakcja przyłączenia halogenowodoru przebiega
niezgodnie z regułą Markownikowa:
CH
3
CH=CH
2
+ HBr → CH
3
CH
2
-CH
2
Br
Addycja wody
Woda przyłącza się do bardziej reaktywnych alkenów, w obecności kwasów
tworząc alkohole. Również i ta reakcja przebiega zgodnie z regułą
Markownikowa.
CH
3
CH=CH
2
+ H
2
O → CH
3
CH(OH)-CH
3
Addycja alkenów.
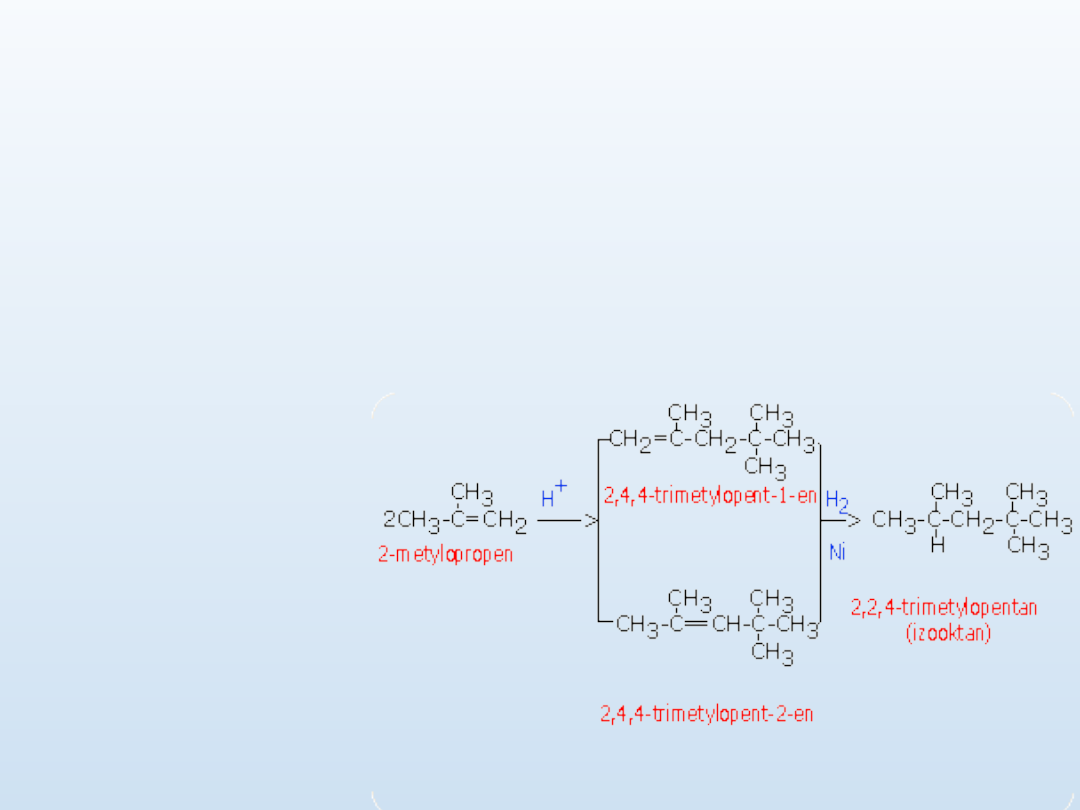
Dimeryzacja
Reakcja dimeryzacji
wymaga obecności kwasu
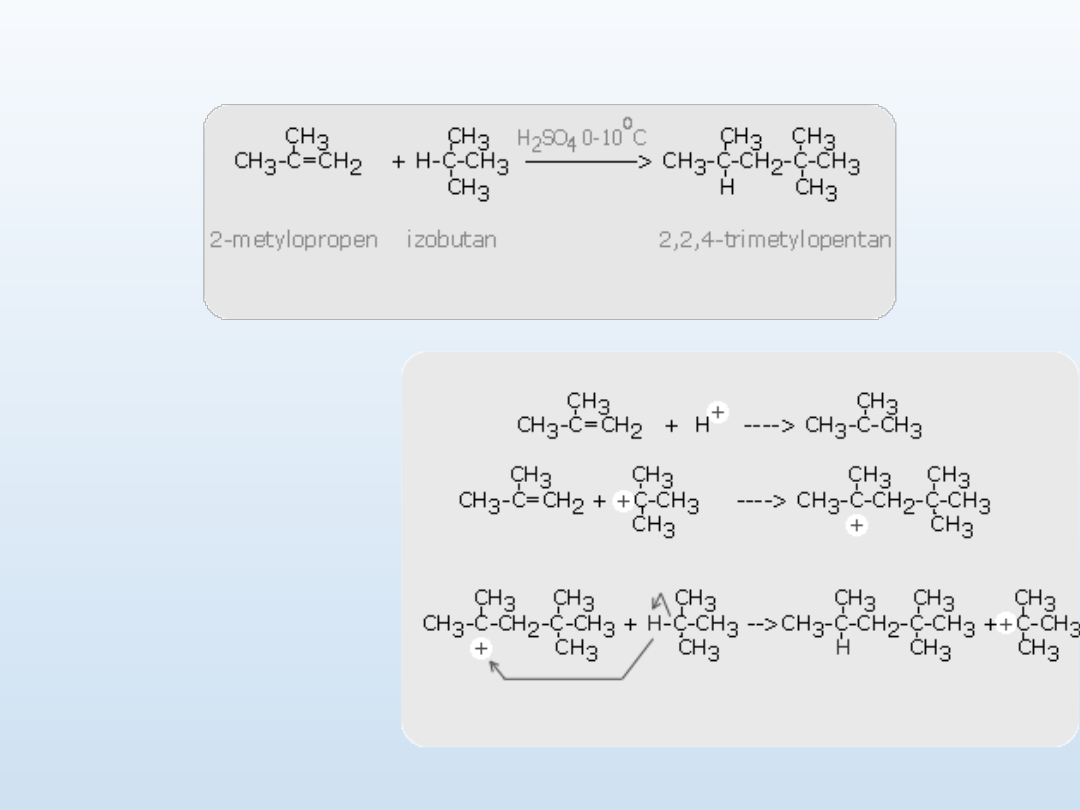
Addycja alkanów. Alkilowanie
Ogólnie
przyjęty
mechanizm tej reakcji
alkilowania jest oparty
na
wcześniej
już
przedstawionych
mechanizmach
i
obejmuje
utworzenie
karbokationu

Polimeryzacja
Polimeryzacja jest to proces łączenia się małych cząsteczek w bardzo
duże. Związek składający się z dużych cząsteczek nazywa się
polimerem. Proste związki, z których tworzą się polimery, nazywane
są
monomerami.
Polimeryzacja wymaga obecności małych ilości inicjatora.
nCH
2
=CH
2
→[ -CH
2
-CH
2
-CH
2
-CH
2
-CH
2
-CH
2
-]
n
lub nCH
2
=CH
2
→ (-CH
2
-CH
2
-)n
CH
3
CH CH
2
CH
3
CH
CH
3
CH
2
CH
CH
3
n
nadtlenki
polipropylen
CH
2
CH CH
C
H
3
CH
3
CH
2
C
H
3
COOH
CH
3
HOOC
+ KMnO
4
H
+
+
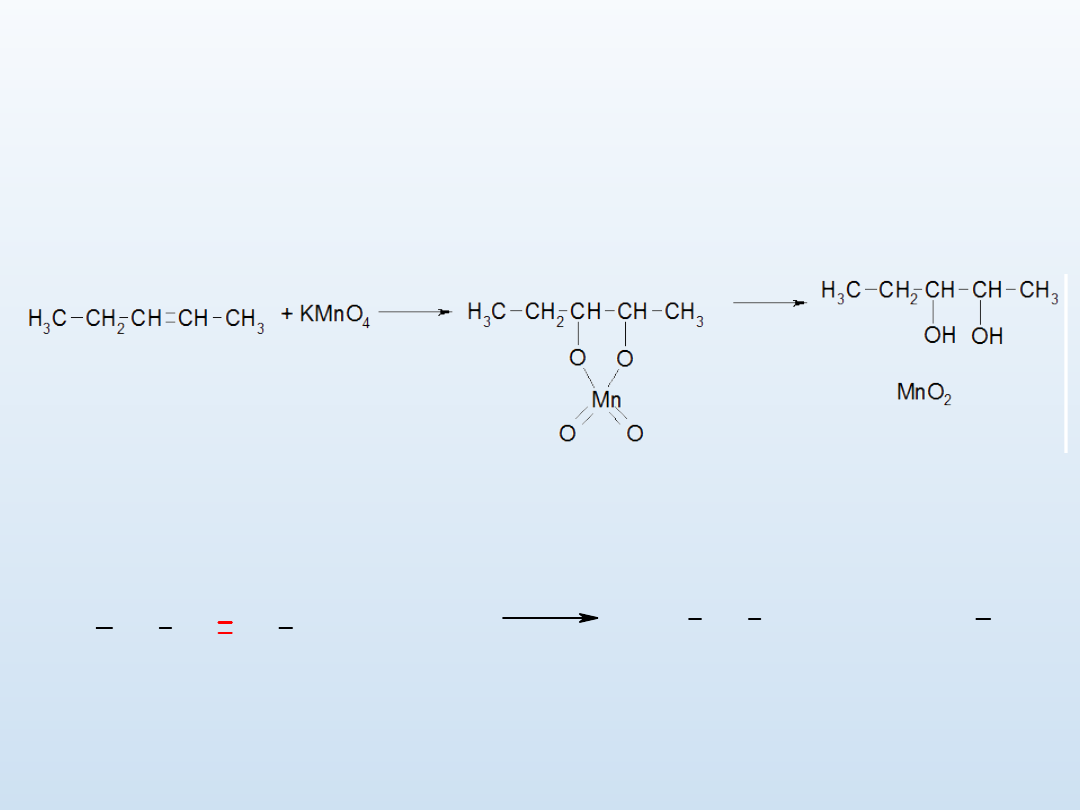
Utlenianie
alkenów
pozwala
na
otrzymywanie
alkoholi
dihydroksylowych.
W czasie tej reakcji alkeny ulegają redukcji.
pent-2-en
pent-2,3-diol
Utlenianie w środowisku kwaśnym.
pent-2-en kwas
kwas
propionowy
octowy

Węglowodory nienasycone (alkiny)
Potrójne wiązanie jest charakterystyczną cechą struktury alkinów.
Najprostszym przedstawicielem alkinów jest acetylen C
2
H
2
Acetylen C
2
H
2
na skalę przemysłową otrzymuje się w reakcji:
- hydrolizy węgliku wapnia (karbidu):
CaC
2
+ 2H
2
O → C
2
H
2
+ Ca(OH)
2
- reakcji syntezy z pierwiastków:
2C + H
2
<=> C
2
H
2
reakcja silnie egzotermiczna, H = + 54,9 kcal/mol, temperatura
reakcji: 3000°C
- z metanu (temperatura 1500 °C)
2CH
4
→ C
2
H
2
+ 3H
2
Acetylen jest bardzo ważnym produktem. Ulega wielu reakcjom,
przede wszystkim reakcji addycji i polimeryzacji.

Addycja wodoru
C
2
H
2
+ 2H
2
→ CH
3
-CH
3
Addycja halogenowodorów HX
C
2
H
2
+ HX → CH
2
=CHX
CH
2
=CHX + HX → CH
3
-CHX
2
Addycja wody
Katalizowana H
2
SO
4
, HgSO
4
C
2
H
2
+ HOH → CH
3
-CHO
Polimeryzacja
3C
2
H
2
→ C
6
H
6

C
H
CH
CH
3
CHO
C
H
CH
C
H
2
CH
Cl
C
H
CH
C
H
2
CH
CN
C
H
CH
C
H
2
CH
OCOCH
3
+ H
2
O
H
+
/HgSO
4
+ HCl
+ HCN
+ CH
3
COOH
chlorek winylu
akrylonitryl
octan winylu

Węglowodory aromatyczne
Węglowodorami aromatycznymi
są związki, posiadające wspólną cechę
nazywaną
aromatycznością.
Aby związki wykazywały charakter aromatyczny jego cząsteczka musi:
mieć budowę cykliczną (atomy C oraz ewentualnie O, N, S muszą tworzyć
zamknięty
pierścień)
być płaska
każdy z atomów tworzących pierścień musi mieć niezhybrydyzowany orbital
typu p
sumaryczna liczba elektronów obsadzających orbitale typu p (elektronów
typu p) musi
być równa 4n + 2, gdzie n = 1, 2, 3,...., N ( jest to tzw. reguła Huckela).
Oznacza to, że
charakter aromatyczny mają płaskie pierścienie zawierające: 2, 6, 10, 14,
18...
elektronów.
Najbardziej znanym węglowodorem aromatycznym jest benzen.
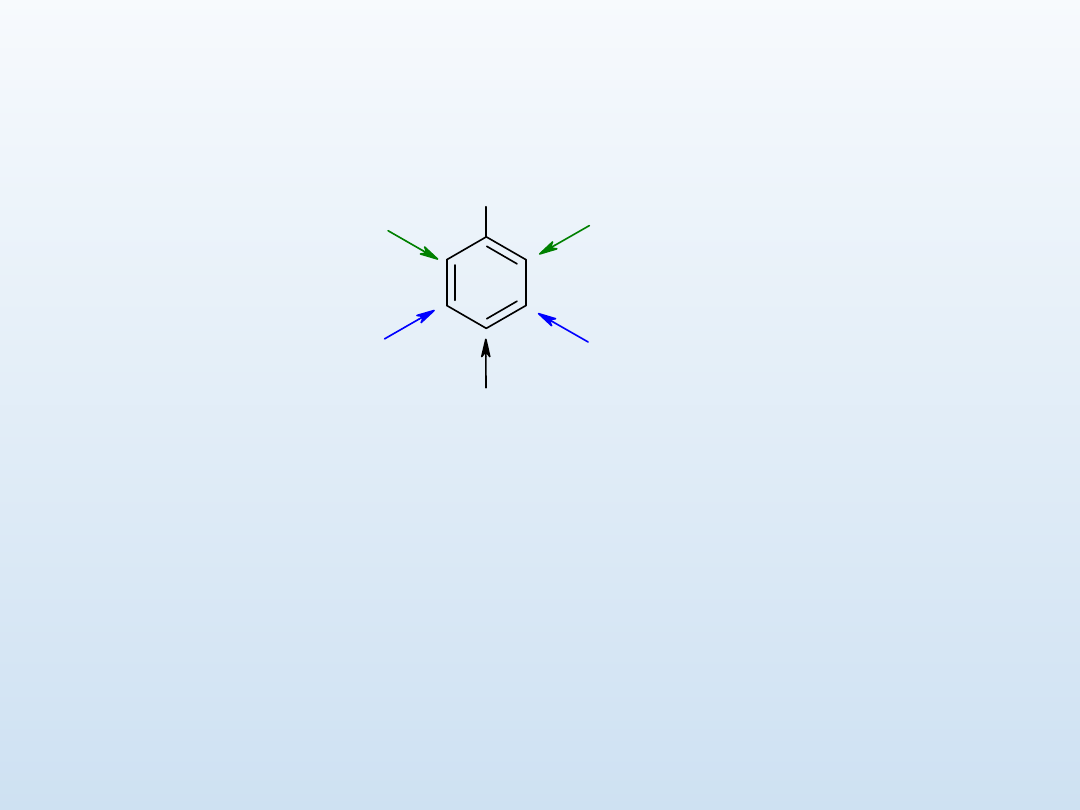
Oznaczenia pozycji podstawników benzenu
orto (o) - którymi są pozycje 1 i 2,
1 i 6
meta (m) - którymi są pozycje 1 i
3, 1 i 5
para (p) - którymi są pozycje 1 i 4
A
orto (o-)
meta (m-)
para (p-)
orto (o-)
meta (m-)
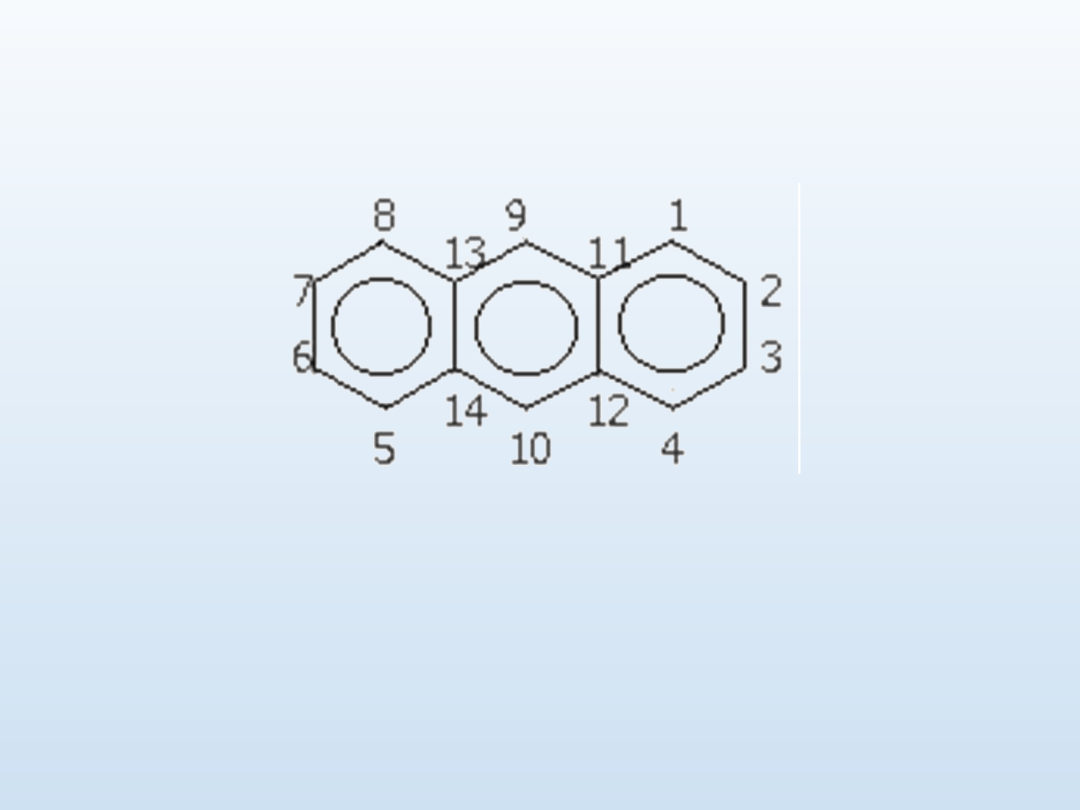
Oznaczenia pozycji podstawników dla antracenu
alfa (
) - którymi są pozycje 1, 4, 5 i 8
beta (
) - którymi są pozycje 2, 3, 6 i 7
gamma (
) - którymi są pozycje 9 i 10
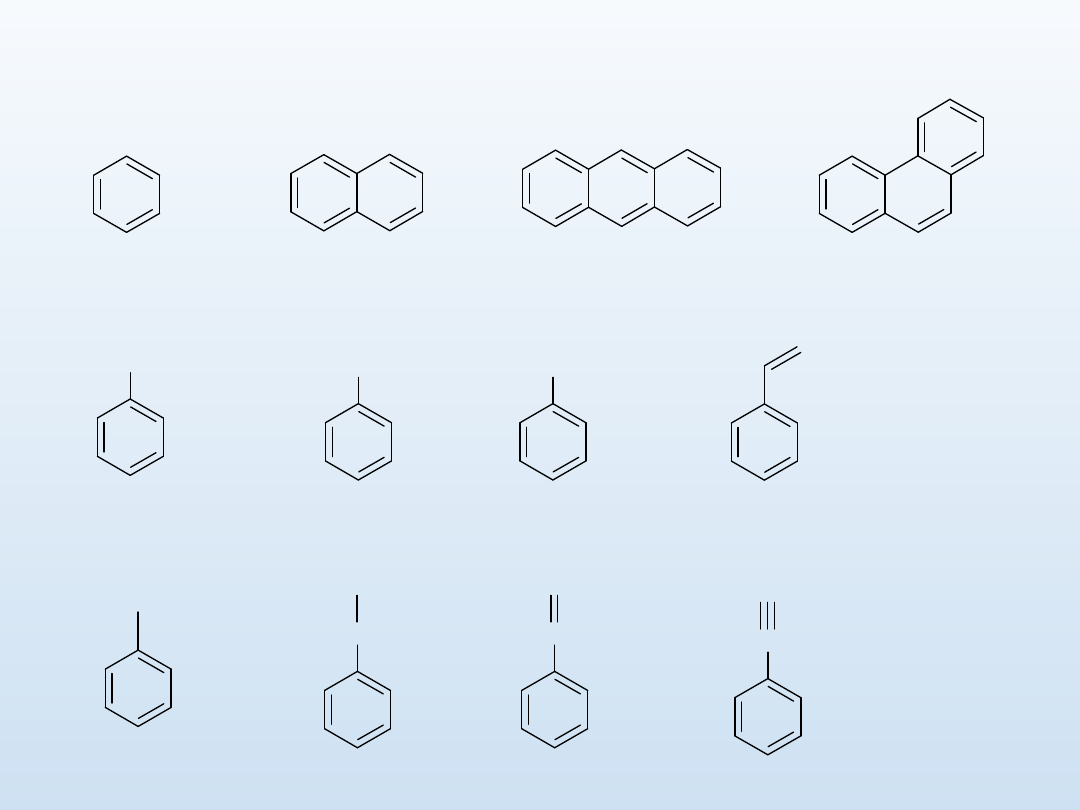
NH
2
OH
CH
3
CH
2
CH
C
benzen
naftalen
1
2
3
4
5
6
7
8
1
2
3
4
5
6
7
8
9
10
1
2
3
4
5
6
7
8
9
10
antracen
fenantren
toluen
fenol
anilina
styren
fenyl
benzyl
benzyliden
benzylidyn
Wybrane węglowodory aromatyczne oraz pochodne
węglowodorów aromatycznych
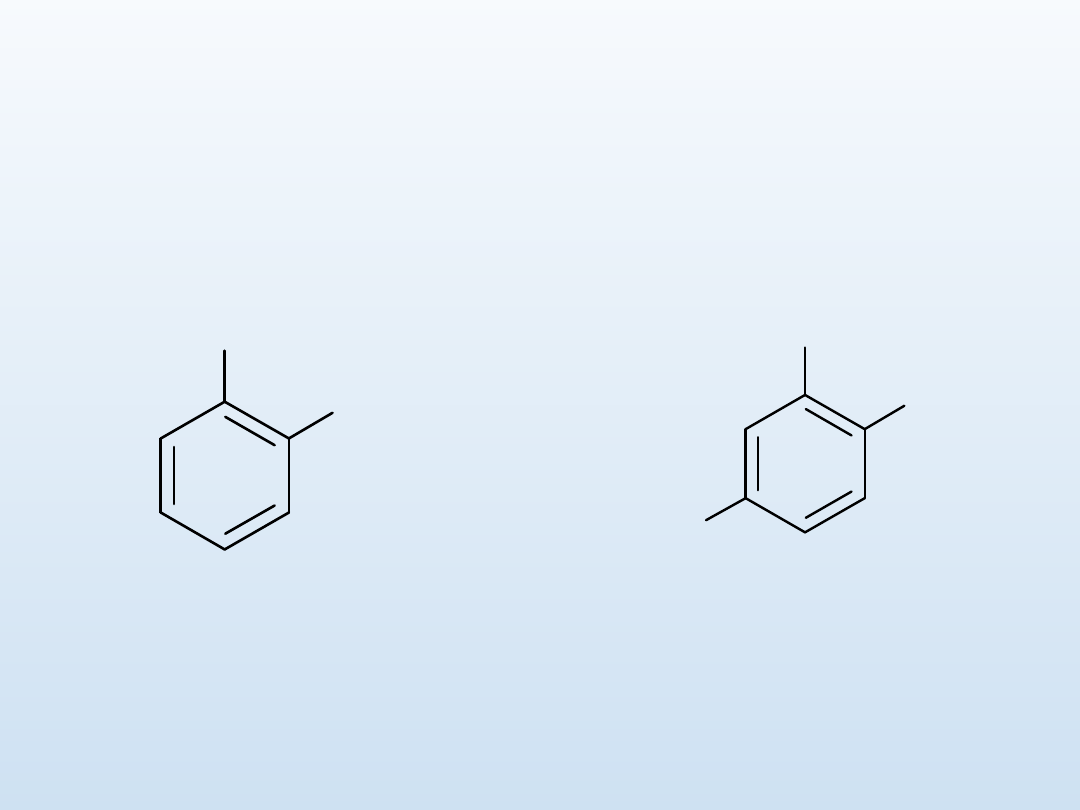
Nazewnictwo związków
aromatycznych
Cl
Br
1. Pierścień numeruje się w taki sposób, by uzyskać jak
najmniejszy zbiór lokantów. Jeżli to możliwe, podstawnik którego
pierwsza litera w nazwie jest bliżej początku alfabetu uzyskuje
mniejszy lokant
.
1-bromo-2-
chlorobenzen o-
chlorobromobenzen
Br
Cl
O
2
N
3-bromo-4-chloronitrobenzen
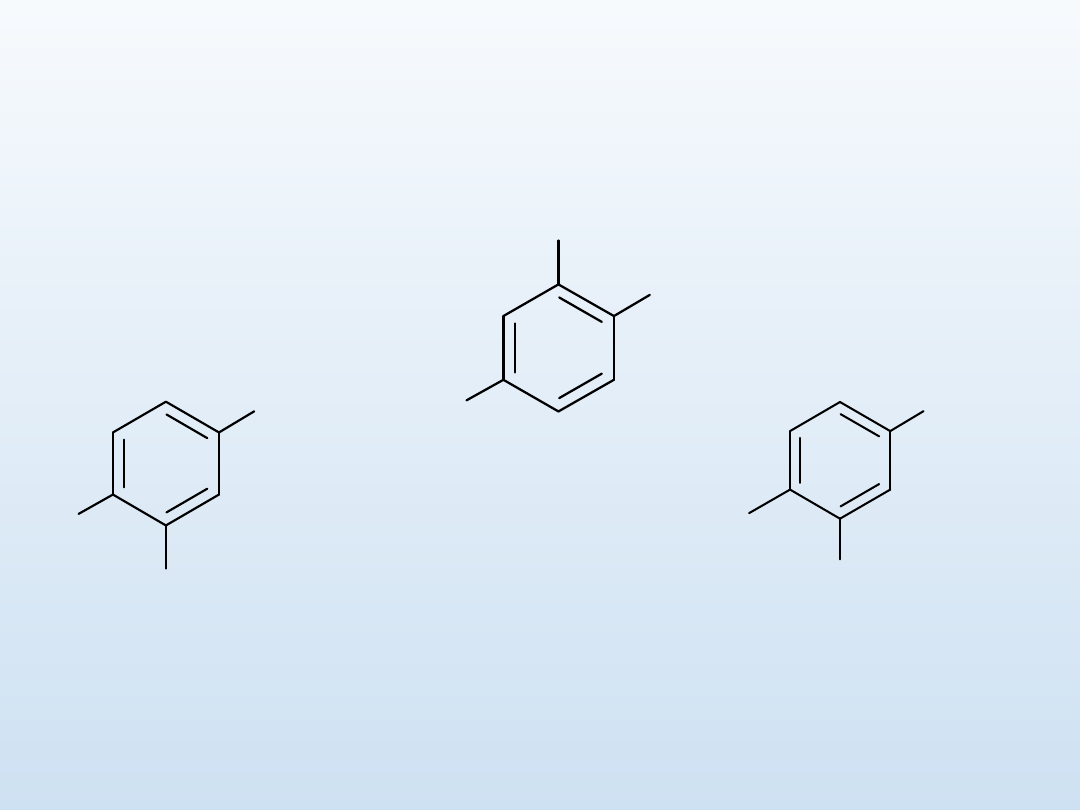
Nazewnictwo związków
aromatycznych
2. Jeżeli w związku rozpoznamy układ kwasu benzoesowego,
benzonitrylu, aldehydu benzoesowego, fenolu, aniliny, styrenu,
toluenu, to nazwę związku tworzymy od tego układu
*
Br
OH
O
2
N
2-bromo-4-
nitrofenol
Br
CH
3
NH
2
4-bromo-3-
metyloanilina
Grupy podane w kolejności malejącej ważności
O
H
CH
3
NH
2
4-amino-2-metylofenol
Przykłady
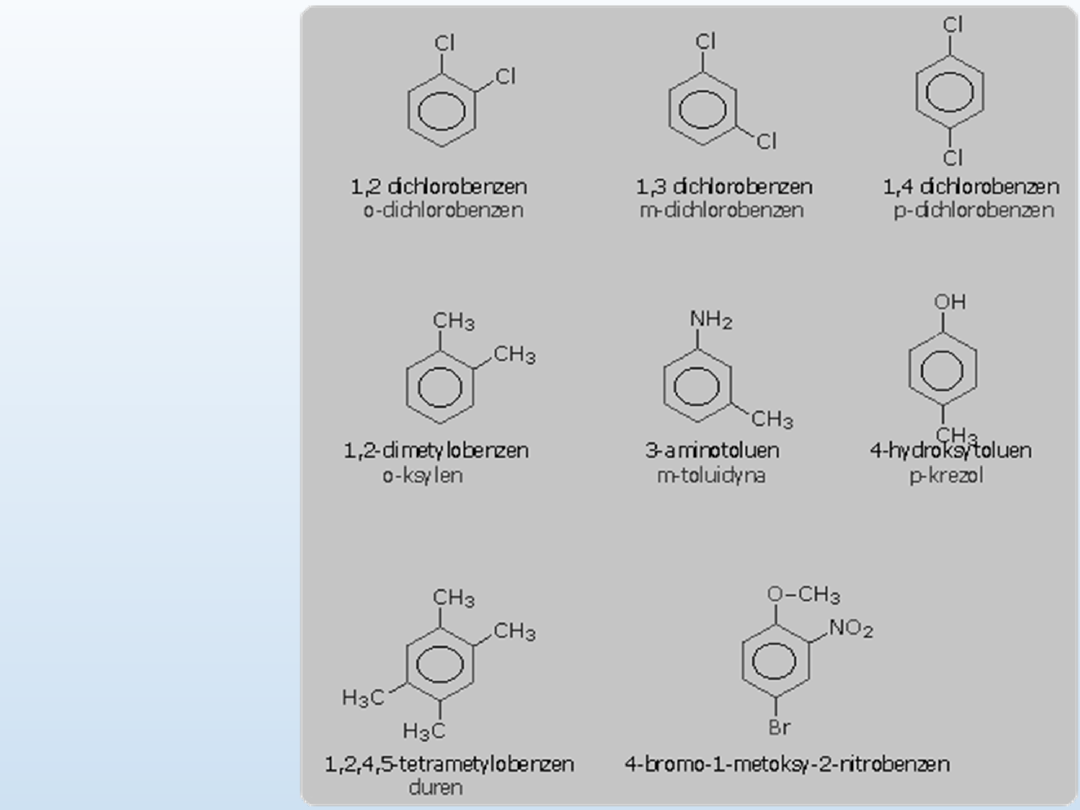
przy wielu
podstawnikac
h

Właściwości fizyczne benzenu
W temperaturze pokojowej benzen jest bezbarwną cieczą. Jak
wszystkie węglowodory jest nierozpuszczalny w wodzie, sam zaś
jest doskonałym rozpuszczalnikiem substancji hydrofobowych. Jako
substancja wykazuje właściwości toksyczne - jest niebezpieczny
zarówno w wypadku wdychania par, jak i w zetknięciu ze skórą.
Właściwości chemiczne benzenu
Benzen łatwiej ulega reakcjom substytucji niż addycji.
Najważniejsze reakcje to:
nitrowanie
sulfonowanie
halogenowanie
alkilowanie metodą Friedla-Craftsa
acylowanie metodą Friedla-Craftsa - obecność H
2
SO
4
, produkt -
nitrobenzen)

Typ reakcji
Równanie chemiczne reakcji
Elektro
fil E
(+)
Halogenowani
e
C
6
H
6
+ Cl
2
i temp
FeCl
3
katalizator
→
C
6
H
5
Cl + HCl
Chlorobenzen
Cl
(+)
lub
Br
(+)
Nitrowanie
C
6
H
6
+ HNO
3
i temp
H
2
SO
4
katalizator
→
C
6
H
5
NO
2
+ H
2
O
Nitrobenzen
NO
2
(+)
Sulfonowanie
C
6
H
6
+ H
2
SO
4
+ SO
3
i temp
→
C
6
H
5
SO
3
H + H
2
O
Kwas
benzenosulfonowy
SO
3
H
(+)
Alkilowanie
metodą
Friedel-
Craftsa
C
6
H
6
+ R-Cl i temp
AlCl
3
katalizator
→
C
6
H
5
-R + HCl
An Areny
R
(+)
Acylowanie
metodą:
Friedel-
Craftsa
C
6
H
6
+ RCOCl i temp
AlCl
3
katalizator
→
C
6
H
5
COR + HCl
An Aryl ketonowy
RCO
(+)
Reakcje benzenu
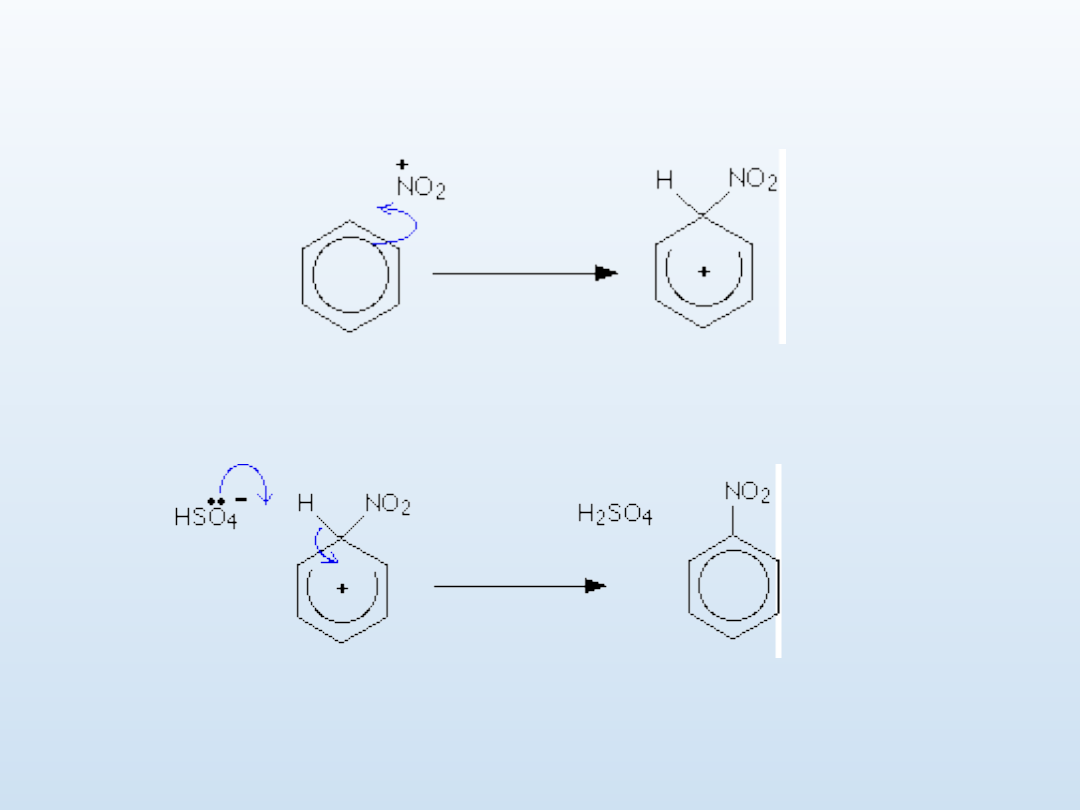
Nitrowanie - mechanizm
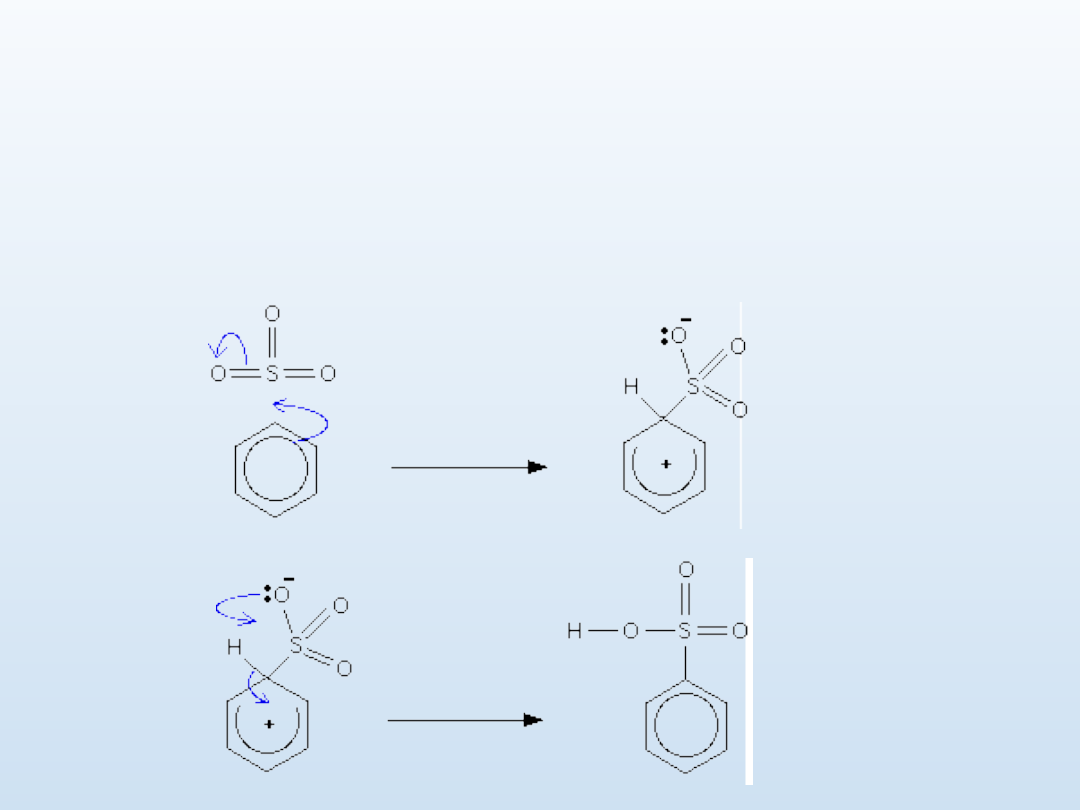
Sulfonowanie - mechanizm
C
6
H
6
+ HOSO
3
H → C
6
H
5
SO
3
H + H
2
O
mechanizm
H
2
SO
4
<=> H
2
O + SO
3
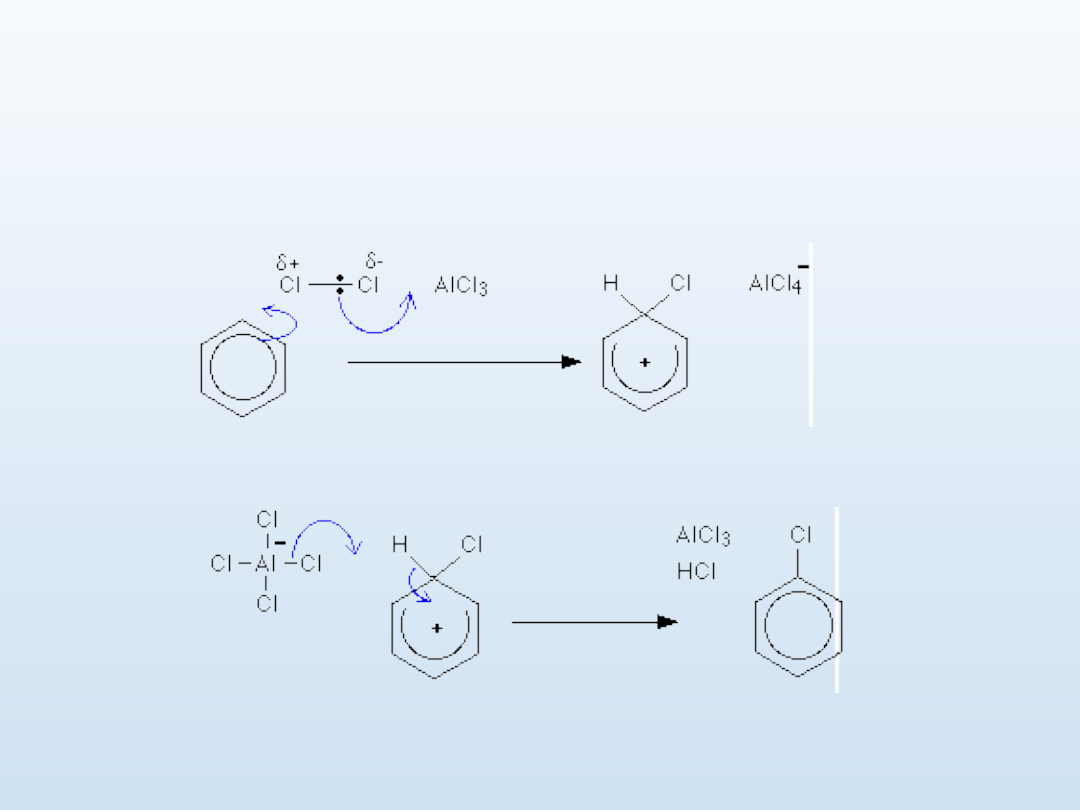
Halogenowanie - mechanizm
katalizowane AlCl
3
C
6
H
6
+ Cl
2
--> C
6
H
5
Cl + HCl
mechanizm
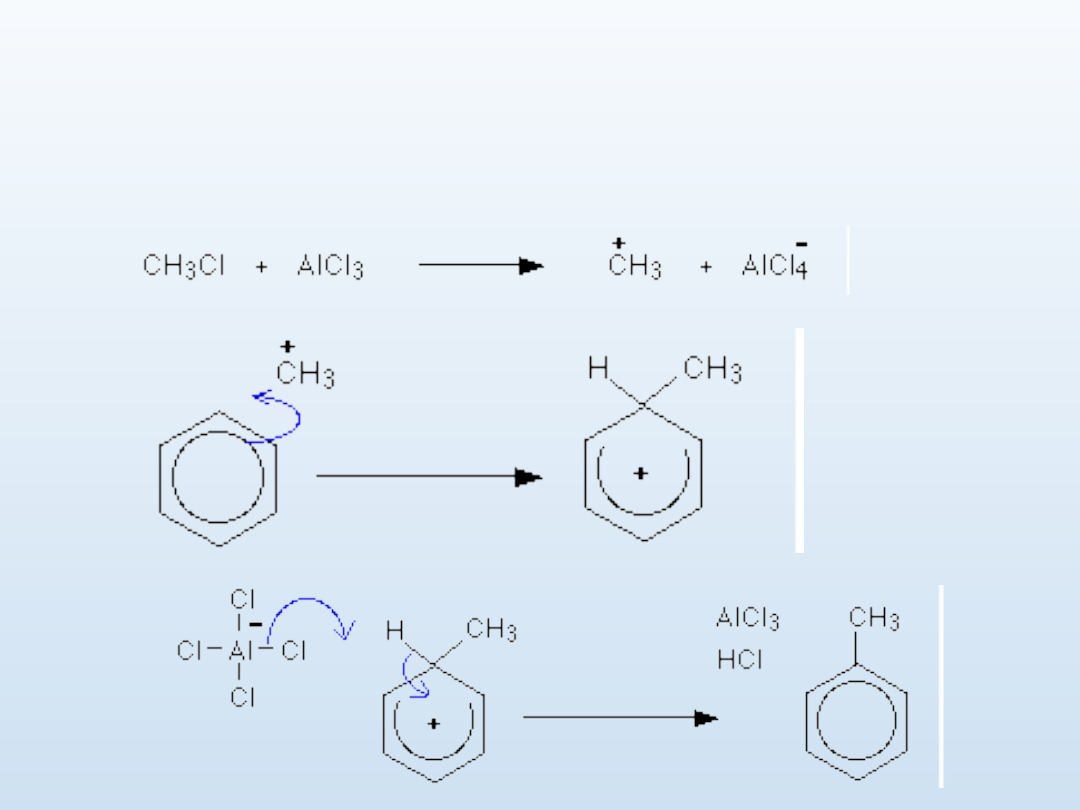
Alkilowanie metodą Friedla-Craftsa,
katalizowana AlCl
3
C
6
H
6
+ RCl --> C
6
H
5
R + HCl
mechanizm
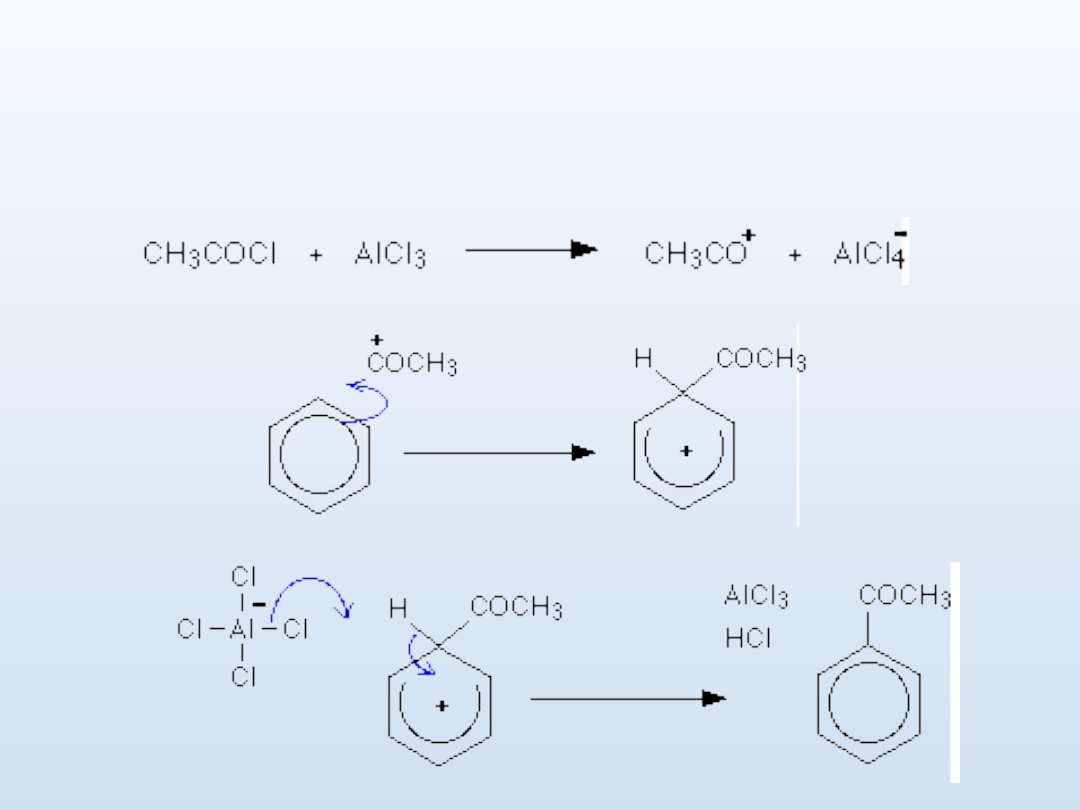
Acylowanie metodą Friedla-Craftsa, katalizowana
AlCl
3
, produkt keton
C
6
H
6
+ RCOCl --> C
6
H
5
COR + HCl
mechanizm
+ Cl
2
h
H Cl
H
Cl
H
Cl
H
Cl
H
Cl
H
Cl
CH
2
-CH
3
+ X
2
h
CHX-CH
3
+HX
X +
C
H
3
C
H
CH
3
C
H
2
X
Na
C
H
2
C
H
CH
3
CH
3
COOH
KMnO
4
/ H
+
+ CH
3
-CH
2
-CH
2
-COOH
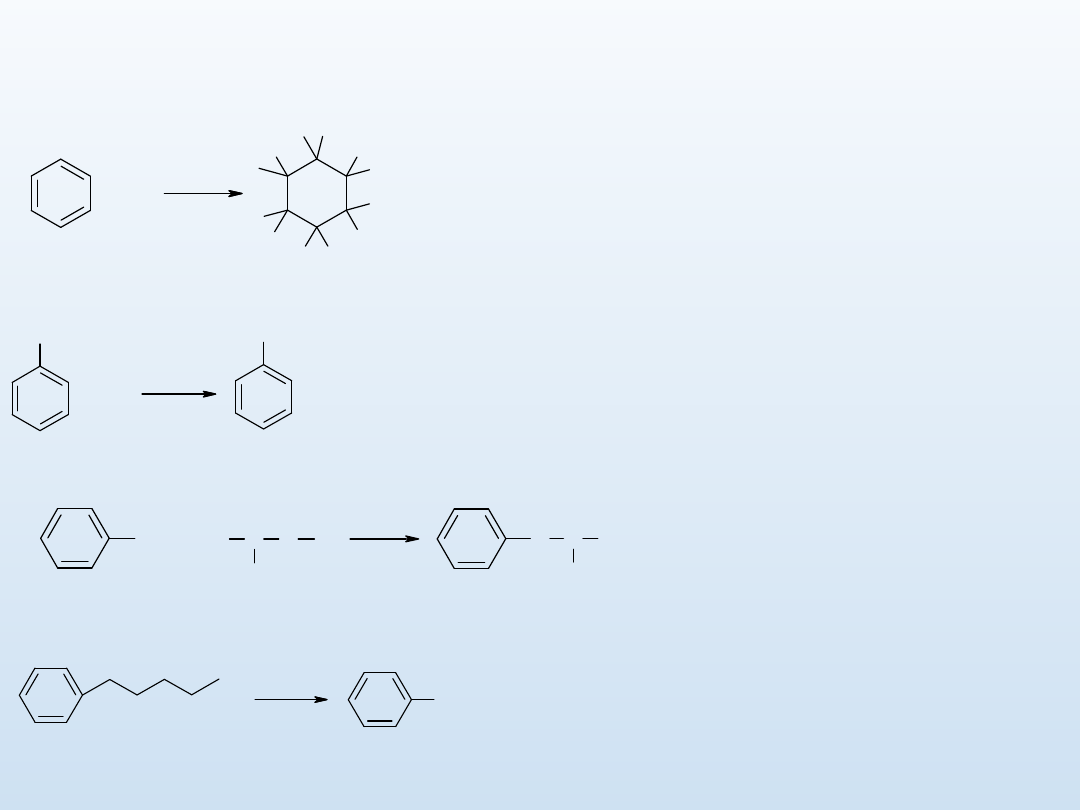
Inne reakcje
arenów
Jeżeli
w
pierścieniu
obecny
jest
podstawnik alkilowy, to na świetle lub w
obecności
nadtlenków
następuje
wolnorodnikowa substy tycja fluorowca w
pozycji benzylowej. X = Cl, Br
Areny w ciemności nie reagują z
fluorowcami. Jednak na świetle, lub w
obecności
nadtlenków
następuje
wolnorodni kowa addycja do wiązań C=C.
Reakcja
Wurtza
Fittiga
syntezy
alkiloarenów
Silne
utleniacze
utleniają
alkiloareny
do
kwasów.
Rozerwaniu
ulega
zawsze
wiązanie C-C w pozycji C1‑C2.

Literatura
1. Mechanizmy reakcji organicznych, W. Majewski,
Wydawnictwo UMCS, Lublin 2012.
2. Chemia organiczna, J. McMurry, Wydawnictwo Naukowe
PWN, Warszawa, 2009.
3. Chemia organiczna, R.T. Morrison, R.N. Boyd,
Wydawnictwo Naukowe PWN, Warszawa, 1998.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
- Slide 72
- Slide 73
- Slide 74
- Slide 75
- Slide 76
- Slide 77
- Slide 78
- Slide 79
- Slide 80
- Slide 81
- Slide 82
- Slide 83
Wyszukiwarka
Podobne podstrony:
Chemia organiczna wykłady całość(1)
dyd k3a r, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna -
Instrukcja do prób barwnych I (alkohole, Studia, Biotechnologia, Chemia, Chemia organiczna, Wykłady
Chemia organiczna wykłady
dyd e2b, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna - w
Ćwiczenia – węglowodory alifatyczne, Studia, Biotechnologia, Chemia, Chemia organiczna, Wykłady II
Chemia organiczna wykład 8
dyd k2a r, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna -
CHEMIA ORGANICZNA REAKCJE sciaga 111, Technologia chemiczna, 3 semestr, Chemia organiczna, wykłady
Instrukcja do zmydlania tłuszczów, Studia, Biotechnologia, Chemia, Chemia organiczna, Wykłady II
dyd kzb, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna - w
dyd kza r, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna -
dyd e1c, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna - w
Chemia organiczna wykład 14
Chemia organiczna wykład 9
Instrukcja do prób barwnych II (kwasy, Studia, Biotechnologia, Chemia, Chemia organiczna, Wykłady II
Instrukcja do chromatografii, Studia, Biotechnologia, Chemia, Chemia organiczna, Wykłady II
więcej podobnych podstron