
Równowaga reakcji
chemicznych
Jednym z kryteriów podziału reakcji jest :
nieodwracalność reakcji oraz odwracalność reakcji
BaCl
2
+ K
2
SO
4
BaSO
4
↓ +
2KCl
Strzałka skierowana w stronę
produktów oznacza, iż w wyniku
łączenia się BaCl
2
i K
2
SO
4
powstają
produkty :BaSO
4
i KCl, ale z
otrzymanych produktów nie możemy
wrócić do substratów .
Z mąki i wody można otrzymać ciasto,
ale już z otrzymanego ciasta nie
można z powrotem otrzymać mąki i
wody – czyli proces pieczenia ciasta
jest nieodwracalny
N
2
+ 3H
2
2NH
3
Strzałki skierowane w dwie strony,
oznaczają
1) z substratów możemy otrzymać
produkty !!!!
Oraz
2) z produktów mogę otrzymać substrat !!!!
Wniosek :
1) r. jest odwracalna
N
2
+ 3H
2
2NH
3
Stan równowagi
2. (r. do tyłu) N
2
+ 3H
2
2NH
3
lub 2NH
3
N
2
+
3H
2
Substratem jest NH
3
a produktem N
2
i H
2
Oznacza to :
1. (r. do przodu) N
2
+ 3H
2
2NH
3
substraty to
N
2
i H
2
a produkt
NH
3
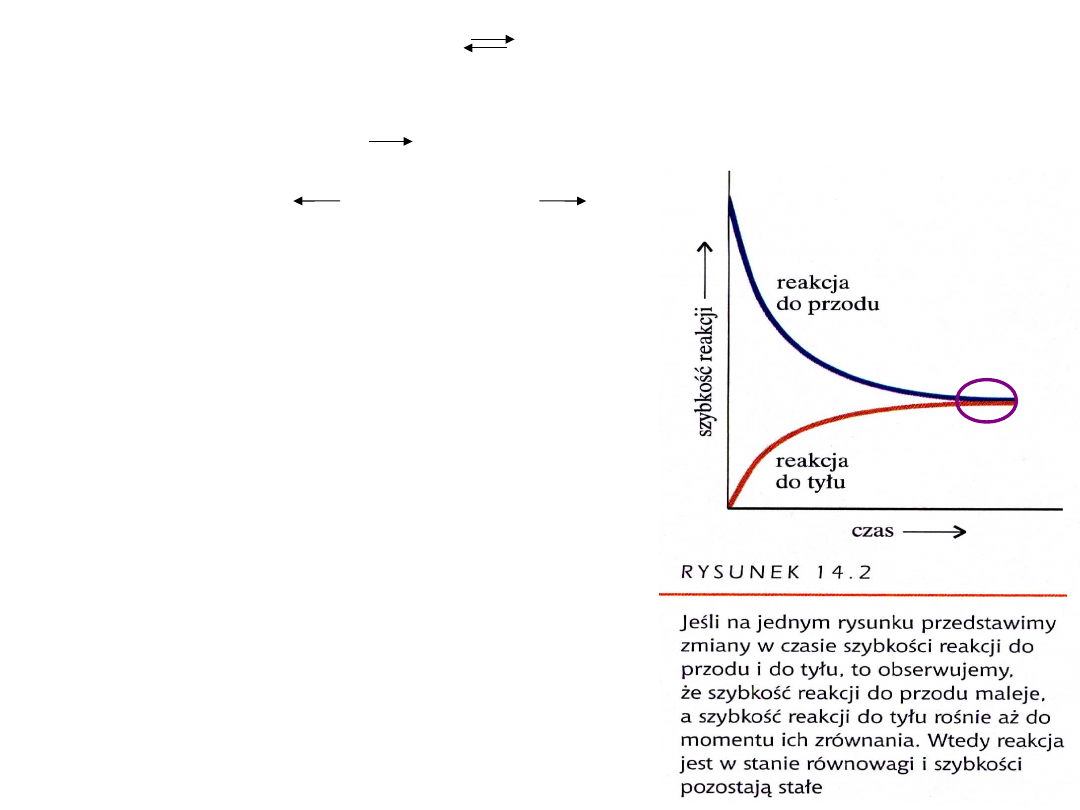
Jeśli szybkość reakcji 1 jest równa szybkości
reakcji 2
to oznacza to, iż układ osiągnął stan równowagi
V
1
=V
2
V
1=
V
2
Stan
równowagi
Analiza r. do przodu :
Cząsteczka NH
3
tworzy się w
wyniku zderzeń cząsteczek H
2
i N
2
.
Analiza r. do tyłu :
Powstałe cząsteczki NH
3
zderzają
się ze sobą oraz z innymi cząsteczkami N
2
i H
2
–
ciągle obecnymi w mieszaninie. W wyniku tych
zderzeń cząsteczki NH
3
rozkładają się z powrotem
na azot i wodór.

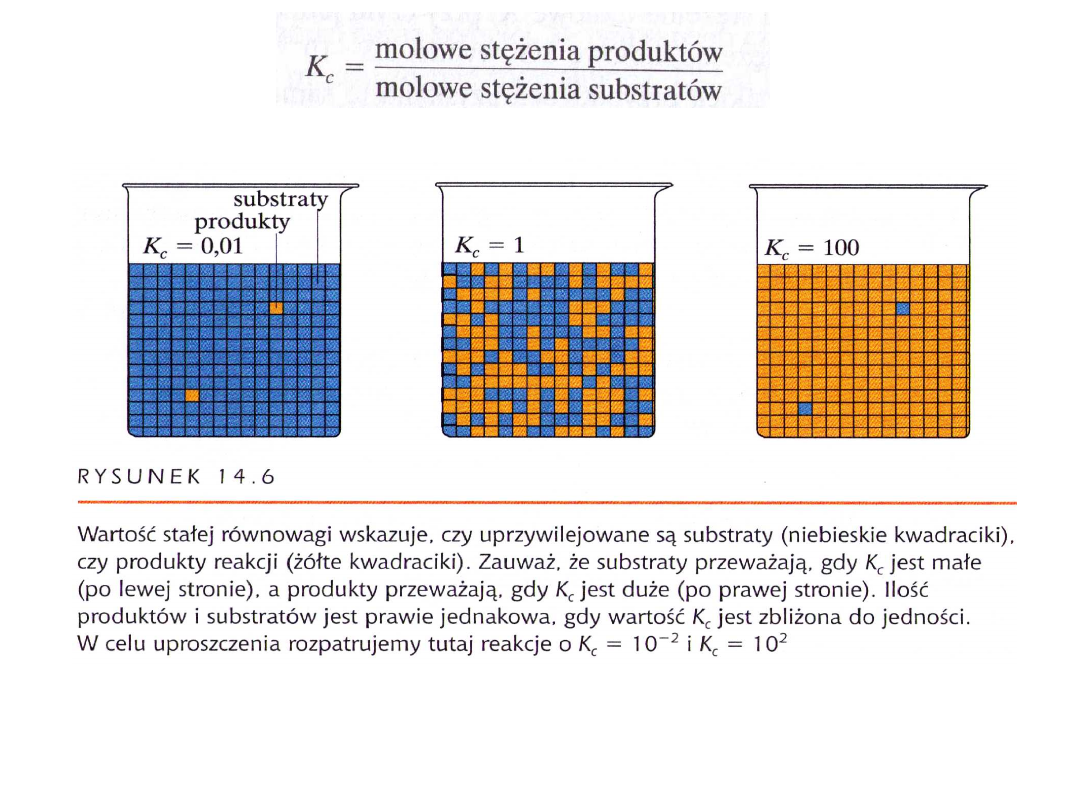
Matematyczna zależność skład mieszaniny
reakcyjne w stanie równowagi to stała
równowagi K

Wpływ zmian warunków na równowagi
chemiczne
Warunki :
a) zmiana liczność reagentów w mieszaninie -
dodanie lub usunięcie
reagentów;
b) zmiana ciśnienia - sprężanie lub rozprężanie mieszaniny reakcyjnej;
c) zmiana temperatury.
Henri Le Chatelier – sformułował ogólną zasadę, która umożliwia
przewidywanie, w jaki sposób zmieni się skład mieszaniny równowagowej
pod wpływem zmiany warunków (stężenia, ciśnienia, temperatury
Reguła Le Chateliera mówi
:
Jeżeli na układ w stanie równowagi dynamicznej
działa jakiś czynnik zewnętrzny to powoduje on taka
zmianę stanu równowagi, która minimalizuje działanie
tego czynnika.
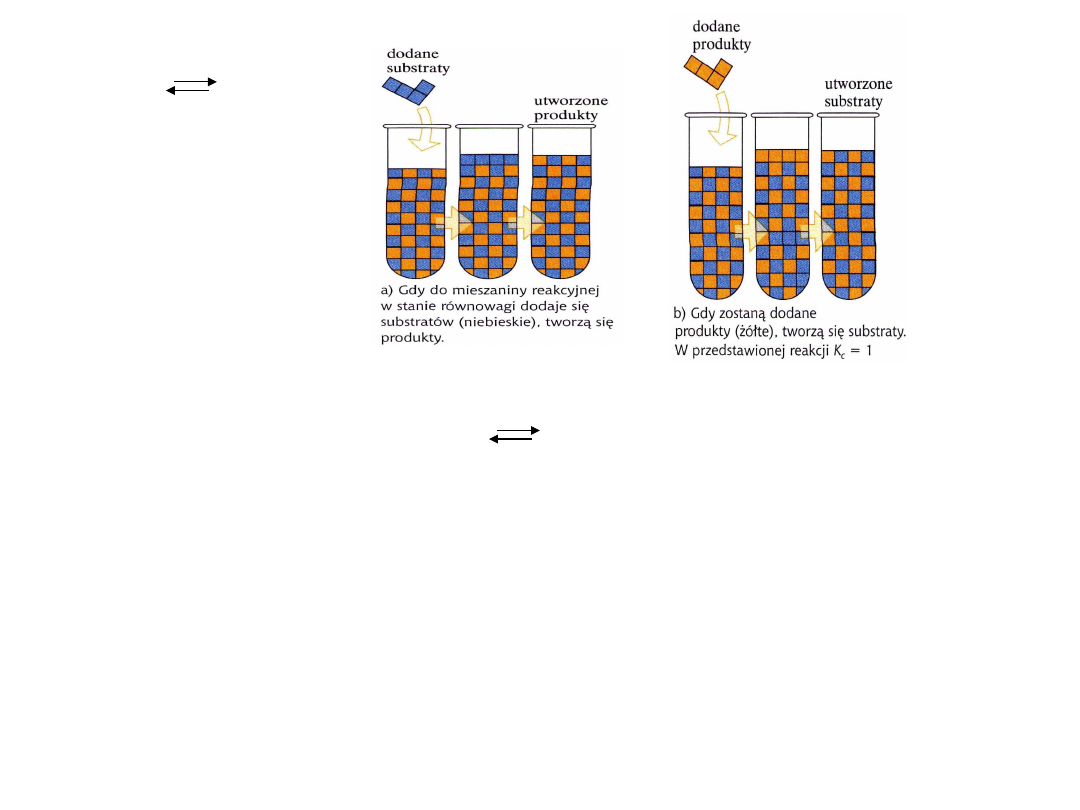
Ad.a. Wprowadzanie i usuwanie
reagentów
N
2
+ 3H
2
2NH
3
Ad. B. wpływ sprężania i rozprężania czyli zmniejszanie i zwiększanie
objętości mieszaniny reakcyjnej
N
2
+ 3H
2
2NH
3
-Sprężanie (kompresja) czyli wzrasta
ciśnienie, wzrost ciśnienia zostaje
ograniczony gdy reakcja zachodzi w kierunku
zapewniającym tworzenie mniejszej liczby
moli cząsteczek gazów-substratów, czyli
wzrost liczby produktów, reakcja ma przebieg
do przodu
- Rozprężanie (dekompresja)
produkt się rozkłada, czyli
zwiększa się ilość substratów
tzn. reakcja przebiega do tyłu
Ad.c. wpływ
temperatury
Wartość stałej K jest zależna od
temperatury
- Dla reakcji endotermicznej tworzeniu się produktów sprzyja
podwyższenie temperatury
-Dla reakcji egzotermicznej tworzeniu się produktów sprzyja obniżenie
temperatury

2.
Reakcja uwalniania jonów z sieci krystalicznej, zachodzące w trakcie
rozpuszczania związków o budowie jonowej, np.. soli
Np.: NaCl → Na
+
+ Cl
-
Na
3
PO
4
→ 3Na
+
+ PO
4
3-
Elektrolit – substancja ulegająca
dysocjacji
1. Dysocjacja
1.
Reakcje rozpadu na jony pewnej liczby cząsteczek rozpuszczalnika
np. wody (autoprotoliza wody) ,
Prostym przykładem stwierdzenia zachodzącej dysocjacji jest
pomiar przewodnictwa elektrycznego – roztwory wodne elektrolitów
przewodzą prąd elektryczny, ponieważ jony powstałe po rozpadnie
związku poruszają się.
Dysocjacją elektrolityczną
nazywamy :
Równowagi w roztworach wodnych :
1. dysocjacja elektrolityczna :
a) dysocjacja cząsteczek wody - iloczyn jonowy wody,
b) dysocjacja słabych kwasów i zasad
2. Hydroliza jonów soli w wodzie
3. Iloczyn rozpuszczalności dla wodorotlenków i soli trudnorozpuszczalnych w
wodzie
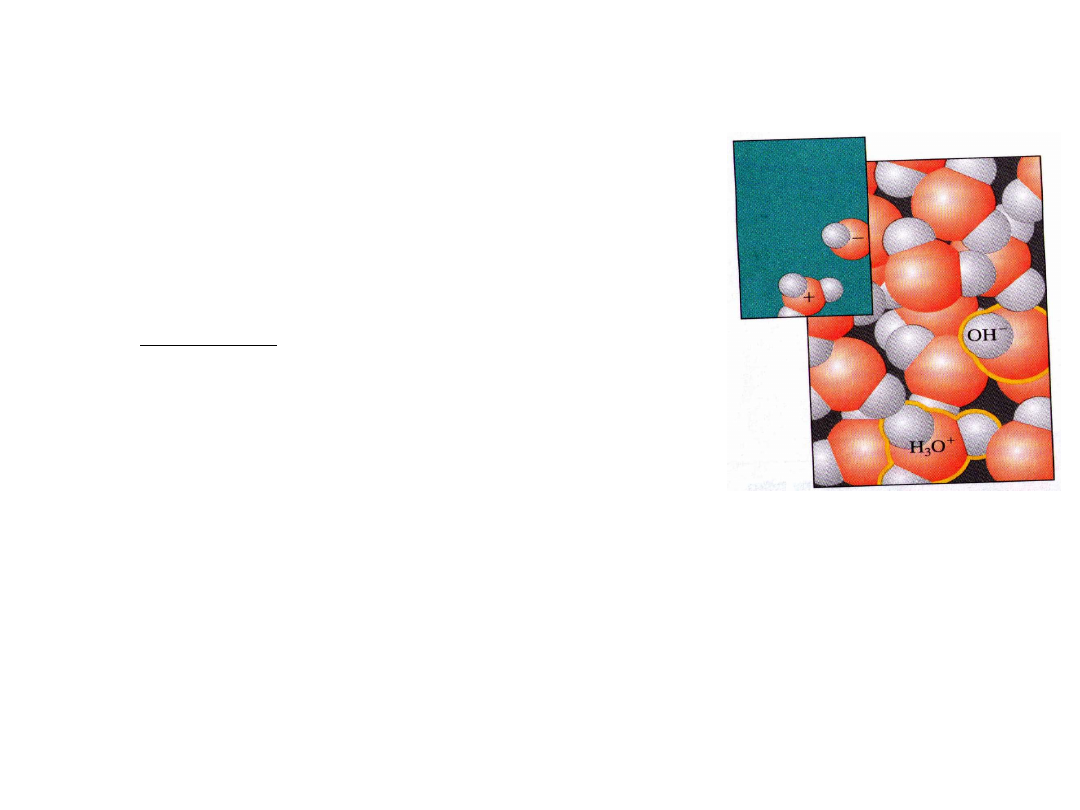
Dysocjacja wody - iloczyn jonowy wody – autoprotoliza wody
Gdzie : H
3
O
+
- kation oksoniowy
H
+
- kation wodoru
OH
-
- anion
wodorotlenkowy
2H
2
O H
3
O
+
+
OH
-
K
c
=
[H
+
]
[OH
-
]
[H
2
O]
W samej wodzie stężenie jest
molowe jest uznane za stałe i
włączone do K
c
K
c
[H
2
O] =
K
w
czyli K
w
= [H
+
]
[OH
-
]
Stężenia jonów [H
+
] i [OH
-
] są sobie równe, w czystej wodzie w
temperaturze 25
o
C zostały wyznaczone doświadczalnie i wynoszą 1,0 10
-7
mol/dm
3
, czyli są bardzo małe co wyjaśnia dlaczego woda jest słabym
przewodnikiem.
K
w
= 1 10
-7
1 10
-7
=
10
-14
Uproszczony zapis H
2
O H
+
+ OH
-
Jon H
3
O
+
powstał z przyłączenia jonu H
+
do
cząsteczki wody. Występowanie jonów H
3
O
+
w wodzie
zostało dowiedzione, jednak ze względów
tradycyjnych i w celu uproszczenia przyjęto pisać H
+
Gdzie K
w
– to stała autoprotolizy wody czyli
iloczyn jonowy wody
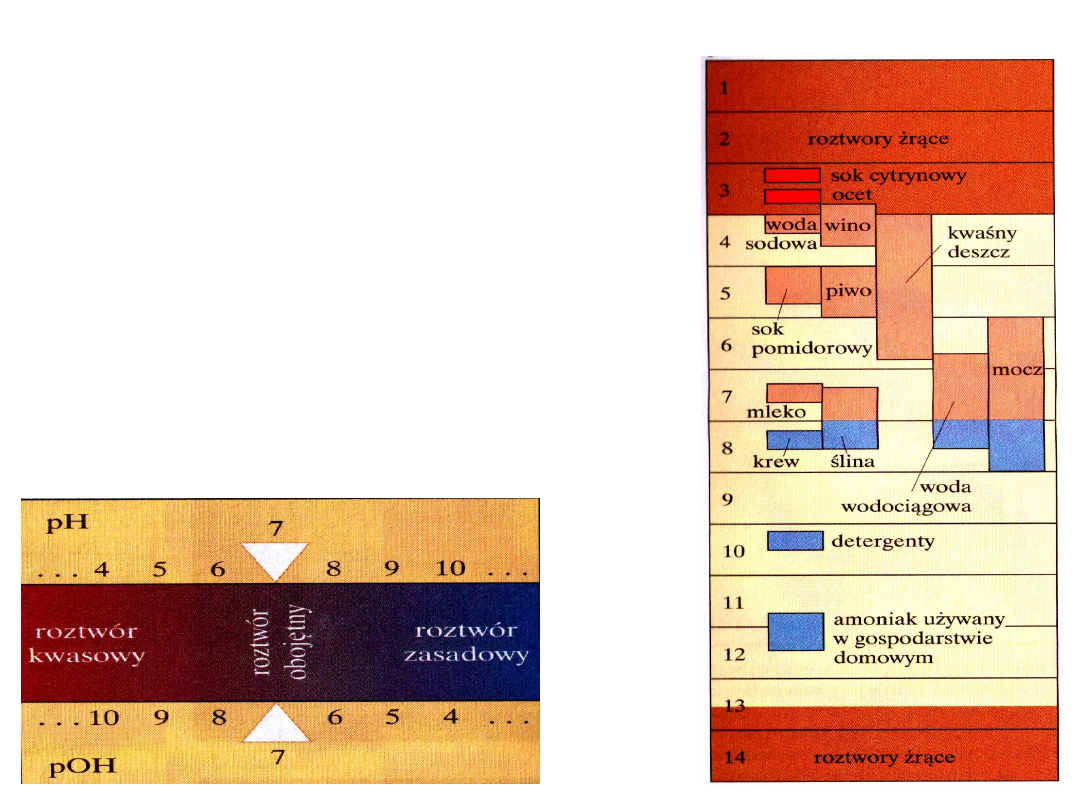
Wartość K
w
czyli iloczynu jonowego wody jest stała zarówno dla wody
jak i dla wszystkich roztworów w których występuje woda.
W czystej wodzie stężenie molowe jonów
wodorowych i wodorotlenkowych są sobie
równe [H
+
] = [OH
-
] = 10
-7
mol/dm
3
Po zlogarytmowaniu zależności K
w
= [H
+
] •
[OH
-
]
10
-14
=10
-7
•
10
-7
otrzymujemy pK
w
= pH + pOH czyli pH +
pOH=14
Jeśli pH= 7 to pOH= 14 – 7= 7
czyli roztwór ma odczyn
obojętny.
Jeśli :
Document Outline
Wyszukiwarka
Podobne podstrony:
Teoretycznie wszystkie reakcje chemiczne osiągają stan równowagi o ile pozostawi się je, Studia Biol
dr Wawrzyniak, chemia nieorganiczna, sprawodzanie Szybkość reakcji chemicznych i równowaga chemiczna
w5 wzor reakcja chemiczna ilościowo
Ćw.1 Wybrane reakcje chemiczne przebiegające w roztworach wodnych ćwiczenie 1, Chemia ogólna i żywno
04 Kinetyka reakcji chemicznych i kataliza
STAŁA RÓWNOWAGI REAKCJI
BADANIE WP YWU ST ENIA NA SZYBKO REAKCJI CHEMICZNYCH
Jak w prosty sposób zapisać przebieg reakcji chemicznych
Jak uzgadniać równania reakcji chemicznych
Ad 8 Zależność stałej równowagi reakcji od temperatury
Wykład 3. Reakcje chemiczne, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Efekty cieplne reakcji chemicznych
Aminokwasy i ich reakcje chemiczne NOTATKI Z WYKŁADÓW, Biochemia, Biochemia, aminokwasy
Równowagi reakcji [finalna] (2)
biochemia słowniczek, ENZYMY- to białka, ich funkcja to katalizatory, powodujące złożone reakcje che
REAKCJA CHEMICZNA, REAKCJA CHEMICZNA, przemiana chemiczna, przemiana jednych substancji, zw
reakcje chemicznew roztworach wodnych zadania
więcej podobnych podstron