I zasada termodynamiki
W układzie zamkniętym zawierającym ciało proste zmiana energii wewnętrznej równa jest sumie algebraicznej pracy oraz ciepła wymienianego z otoczeniem, o ile nie występuje zmiana energii kinetycznej oraz energii położenia układu. Pierwsza zasada termodynamiki stwierdza możliwość zamiany ciepła na pracę.
Matematyczna forma zapisu I zasady termodynamiki ma postać:
dQ = dU + dL = dU + pdV [J] (7)
gdzie dU – różniczka zupełna, dQ i dL – różniczkowe wyrażenia liniowe
Ciepło dostarczane z zewnątrz do układu zamkniętego jest zużyte na przyrost jego energii wewnętrznej U oraz na wykonanie pracy zewnętrznej L.
Całkując równanie (7) otrzymuje się:
Q1,2
=
U2
– U1
+ L1,2
= U2
– U1
+
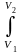 p(V)dV
(8)
p(V)dV
(8)
Wprowadzono ekstensywną funkcję stanu zwaną entalpią oznaczoną przez I . Jest ona zdefiniowana następującym wzorem:
I = U + pV (9)
Entalpia jest sumą energii wewnętrznej układu i pracy zewnętrznej
Jeżeli w równaniu (2), wyrażającym pierwszą zasadę termodynamiki dla układu
zamkniętego, wstawimy w miejsce energii wewnętrznej entalpię, wówczas
praca zewnętrzna zamieni się na pracę techniczną i dla przemian odwracalnych
równanie to przyjmie postać:
Q1,2
= I2
– I1
+ Lt1,2
= I2
– I1
-
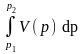 (10)
(10)
czyli ciepło doprowadzone do czynnika powoduje przyrost entalpii oraz wykonanie pracy technicznej (rys. 2). Praca techniczna jest dodatnia przy rozprężaniu (dp<0) i ujemna przy sprężaniu (dp>0)
wzór na pracę techniczną
Lt1,2
=
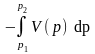 (11)
(11)
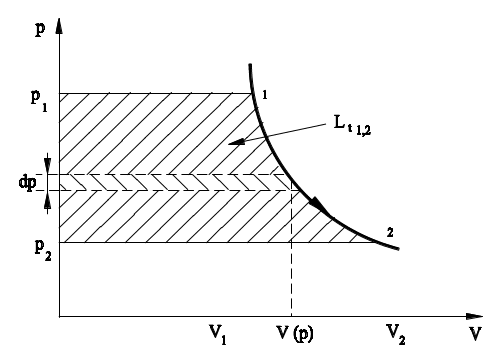
Rys. 2. Interpretacja graficzna pracy technicznej na wykresie p-V
Podczas przemiany przy stałym ciśnieniu i ogrzewaniu na podstawie równania (10) i (8) mamy:
Q1,2
= I1,2
– 0 = U1,2
+
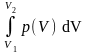 (12)
(12)
Ponieważ Q1,2 = Mcp T1,2 , gdzie cp – ciepło właściwe przy stałym ciśnieniu,
M – masa układu, to równania (10) i (8) można zapisać następująco:
Q1,2
= Mcp
T1,2
-
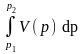 =
McvT1,2
+
=
McvT1,2
+
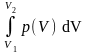 (13)
(13)
Równanie (13) w postaci różniczkowej ma postać:
dQ = Mcp dT – Vdp = Mcv dT + p dV (14)
Po podzieleniu równania (14) przez T (przy T>0) i wykorzystaniu równania
stanu gazu doskonałego po odpowiednich przekształceniach przyjmie ono postać:
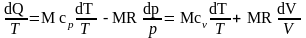 (15)
(15)
Funkcja stojąca po lewej stronie równania została oznaczona przez dS
czyli:
dS
=
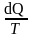 (16)
(16)
i jest nazywana entropią układu [J/K]. Funkcja dS stanowi różniczkę zupełną
i jest ekstensywną funkcją stanu.
Wyszukiwarka
Podobne podstrony:
więcej podobnych podstron