LABORATORIUM KONWERSJI ENERGII
Ćwiczenie 1 |
ELEKTROLIZA WODY |
SPRAWOZDANIE |
||
Nr zespołu: |
Wydział, rok, grupa: WEiP, III, 2 |
Data: 19.11.2011 r. |
||
Nazwisko i Imię: |
Ocena: |
|||
|
Teoria |
Wykonanie ćwiczenia |
Końcowa z ćwiczenia |
|
1. Musiał Michał |
|
|
|
|
2. Nowak Mateusz |
|
|
|
|
3. Mateusz Rachwał |
|
|
|
|
Cel ćwiczenia.
Celem wykonania ćwiczenia było zapoznanie się z prawami Faraday'a oraz potwierdzenie ich na podstawie wyników pomiarów przy elektrolizie wody w elektrolizerze polimerowym.
W pierwszej części ćwiczenia wykonywaliśmy pomiary napięcia ogniwa i natężenia prądu (przy zmieniającym się oporze), aby wykreślić charakterystykę prądowo-napięciową elektrolizera i wyznaczyć napięcie rozkładu.
W drugiej części przy zadanym natężeniu prądu i napięciu ogniwa, w równych odstępach czasu (co minutę) mierzyliśmy objętości wydzielonych gazów (tlenu i wodoru). Na podstawie tych danych wyznaczyliśmy zależności VH2=f(t) oraz VO2=f(t).
W części trzeciej zmieniając natężenie płynącego prądu (poprzez zmianę oporu), w stałym odcinku czasowym, mierzyliśmy objętości wydzielonych gazów (tlenu i wodoru), by na podstawie otrzymanych danych wyznaczyć charakterystyki VH2=f(I) oraz VO2=f(I).
Opracowanie wyników.
Zależność prądu płynącego przez elektrolizer od napięcia elektrolizera I=f(U)
Opór [Ω] |
Napięcie ogniwa U[V] |
Natężenie prądu I[A] |
∞ |
0 |
0 |
33000 |
0,45 |
0 |
10000 |
0,517 |
0 |
5000 |
0,64 |
0 |
1200 |
1,216 |
0,01 |
100 |
1,515 |
0,04 |
47 |
1,545 |
0,08 |
10 |
1,671 |
0,33 |
8,2 |
1,708 |
0,4 |
6,2 |
1,759 |
0,5 |
3,9 |
1,98 |
0,72 |
Odczytanie napięcia rozkładowego wody dla badanego układu elektrolizera.
Napięcie rozkładowe (Urokł) jako punkt, od którego przykładanie większego napięcia powoduję znaczący przyrost prądu płynącego w elektrolizerze można odczytać z wykresu. Dla naszego elektrolizera Urokł = 1,515 [V].
Wykres zależności objętości wodoru i tlenu w funkcji czasu elektrolizy VH2=f(t) oraz VO2=f(t).
Czas [s] |
Objętość H2 [ml] |
Objętość O2 [ml] |
Napięcie U [V] |
Natężenie I [A] |
0 |
0,0 |
0,0 |
1,669 |
0,33 |
60 |
4,0 |
2,0 |
1,647 |
|
120 |
6,0 |
3,0 |
1,648 |
|
180 |
8,0 |
4,0 |
1,648 |
|
240 |
11,0 |
5,5 |
1,648 |
|
300 |
14,0 |
7,0 |
1,648 |
|
360 |
16,0 |
8,0 |
1,648 |
|
420 |
18,5 |
9,25 |
1,648 |
|
450 |
20,0 |
10,0 |
1,648 |
|
Współczynniki regresji liniowej V=at dla wodoru i tlenu. Współczynniki korelacji.
Wartości współczynników regresji liniowej a odpowiednio dla wodoru i tlenu wynoszą aH2=0,0430 ( u(a)=0,001) oraz aO2=0,0215 ( u(a)=0,0005).
Współczynnik korelacji dla V(O2) i V(H2) wynosi 1 co oznacza, że zmienne te są wielce współzależne.
Zależność objętości wodoru i tlenu w funkcji natężenia prądu elektrolizy VH2=f(I) oraz VO2=f(I).
Natężenie I[A] |
Objętość H2 [ml] |
Objętość O2 [ml] |
0,08 |
1 |
2 |
0,32 |
4 |
8 |
0,72 |
10 |
20 |
Współczynniki regresji liniowej V=bI dla wodoru i tlenu. Współczynniki korelacji.
Wartości współczynników regresji liniowej b odpowiednio dla wodoru i tlenu wynoszą bH2=27,8 ( u(b)=0,92) oraz bO2=13,9 ( u(b)=0,46).
Współczynnik korelacji dla V(O2) i V(H2) wynosi 1 co oznacza, że zmienne te są wielce współzależne.
Stosunki współczynników pochyleń otrzymane dla obydwu regresji i ich analiza.
Współczynniki regresji dla obydwu wykresów wynoszą:
aH2=0,0430 bH2=27,8
aO2=0,0215 bO2=13.9
Stosunki ![]()
oraz ![]()
wynoszą odpowiednio 2,00 oraz 2,00. Ich wartość odzwierciedla nam i potwierdza rzeczywisty stosunek objętości wydzielonego wodoru do wydzielonego tlenu podczas elektrolizy wody, który powinien być równy 2.
Sprawdzenie zgodności otrzymanych wyników z prawami Faraday'a
Korzystając z I prawa Faraday'a, które mówi:
![]()
, gdzie m to masa wydzielonej substancji, I natężenie prądu, a t czas
oraz II prawa Faraday'a:
![]()
,
gdzie ![]()
- gramorównoważnik wydzielonej substancji, a:
M - masa molowa [g] (MH2=2 [g/mol]; MO2=32[g/mol];
z - ładunek jonu względem ładunku elektronu (zH2=2; zO2=4)
otrzymujemy wzory na teoretyczną objętość wydzielonego w elektrolizie gazu:
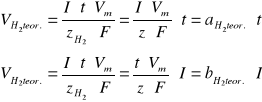
gdzie:
t - czas tworzenia wodoru [s]
Vm - objętość molowa substancji = 24000 ml; 22,4 dm3; 24 l/mol dla T=200C
F - stała Faraday'a = 96484 [C/mol] [As/mol]
Korzystając z pomiarów dokonanych w punkcie trzecim i czwartym oraz powyższych wzorów możemy wyznaczyć współczynniki aH2teor. i aO2teor oraz bH2teor. i bO2teor.
b) Współczynniki aH2teor. i aO2teor.
Obliczamy je dla stałego natężenia prądu I = 0,33 [A]
t [s] |
VH2teor. [ml] |
VH2dośw. [ml] |
0 |
0 |
0 |
60 |
2,46 |
4 |
120 |
4,93 |
6 |
180 |
7,39 |
8 |
240 |
9,85 |
11 |
300 |
12,31 |
14 |
360 |
14,78 |
16 |
420 |
17,24 |
18,5 |
450 |
18,47 |
20 |
aH2teor= 0,041
t [s] |
VO2teor. [ml] |
VO2dośw. [ml] |
0 |
0 |
0 |
60 |
1,23 |
2 |
120 |
2,46 |
3 |
180 |
3,69 |
4 |
240 |
4,93 |
5,5 |
300 |
6,16 |
7 |
360 |
7,39 |
8 |
420 |
8,62 |
9,25 |
450 |
9,23 |
10 |
aO2teor=0,0205
Po obliczeniu Vteor. dla wodoru i tlenu, dla zależności od czasu, na wykres z punktu 3 naniesiono odpowiednie funkcje, celem porównania wartości doświadczalnych z wartościami teoretycznymi. Po analizie tego wykresu można stwierdzić, że ćwiczenie zostało wykonane poprawnie, gdyż wartości doświadczalne praktycznie pokrywają się z wartościami teoretycznymi. Fakt, iż wartości doświadczalne przewyższają wartości teoretyczne może wynikać z faktu, że obliczenia przeprowadzane były dla warunków normalnych (20°C), natomiast doświadczenie odbywało się w temperaturze wyżej, co zwiększyło objętość molową gazu.
c) Współczynniki bH2teor. i bO2teor.
Obliczamy je dla stałego czasu 180s:
I [A] |
VH2teor. [ml] |
VH2dośw. [ml] |
0 |
0,00 |
0 |
0,08 |
1,79 |
2 |
0,32 |
7,16 |
8 |
0,72 |
16,12 |
20 |
bH2teor=22,39
I [A] |
VO2teor. [ml] |
VO2dośw. [ml] |
0 |
0,00 |
0 |
0,08 |
0,90 |
1 |
0,32 |
3,58 |
4 |
0,72 |
8,06 |
10 |
bO2teor=11,19
Po obliczeniu Vteor. dla wodoru i tlenu, dla zależności od natężenia prądu, na wykres z punktu 5 naniesiono odpowiednie funkcje, celem porównania wartości doświadczalnych z wartościami teoretycznymi. Po analizie tego wykresu można stwierdzić, że ćwiczenie zostało wykonane poprawnie, gdyż wartości doświadczalne są bliskie wartościom teoretycznym. Podobnie jak w poprzednim punkcie fakt, iż wartości doświadczalne są wyższe od teoretycznych można tłumaczyć wyższą temperaturą przeprowadzania doświadczenia niż temp warunków normalnych.
Sprawność faradayowska elektrolizera.
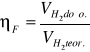
VH2teor. [ml] |
VH2dośw. [ml] |
[%] |
0 |
0 |
0 |
2,46 |
4 |
162 |
4,93 |
6 |
122 |
7,39 |
8 |
108 |
9,85 |
11 |
112 |
12,31 |
14 |
114 |
14,78 |
16 |
108 |
17,24 |
18,5 |
107 |
18,47 |
20 |
108 |
|
|
104 |
Sprawność energetyczna elektrolizera.
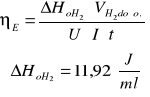
Energia dostarczona [J] |
Energia wytworzona [J] |
Sprawność
[%] |
0 |
0 |
0 |
33,20 |
29,35401 |
88,40 |
66,21 |
58,70801 |
88,67 |
99,32 |
88,06202 |
88,67 |
132,50 |
117,416 |
88,61 |
165,63 |
146,77 |
88,61 |
198,75 |
176,124 |
88,61 |
231,88 |
205,478 |
88,61 |
248,44 |
220,1551 |
88,61 |
|
|
88,60 |
Średnia sprawność energetyczna elektrolizera wynosi ![]()
.
III Wnioski
Wyniki uzyskane na drodze eksperymentalnej są bliskie wynikom uzyskanym na drodze teoretycznej wykorzystując prawa Faraday'a. Przebieg krzywej charakterystyki prądowo-napięciowej potwierdza istnienie napięcia rozkładu wody, powyżej którego natężenie prądu rośnie bardzo szybko wraz ze wzrostem przyłożonego napięcia. Obliczona sprawność elektrolizy jest bardzo wysoka. Fakt iż przekracza ona 100% może być spowodowany tym, że doświadczenie przeprowadzane było w innej temperaturze niż ta przyjęta do obliczeń. Ponadto odczyt możliwy był z dokładnością do 1 ml podczas gdy w obliczeniach teoretycznych objętości mogły przybierać również wartości pośrednie. Duży wpływ na dokładność pomiarów miał też czynnik ludzki.
Wyszukiwarka