02.03.2006
gr.10
Sprawozdanie nr 1
Temat: Alkacymetria
Nastawianie miana HCL na Na2CO3
Rozcieńczyłem 2,1 cm3 HCL w kolbie miarowej wodą destylowaną do 250 cm 3 . Do dwóch kolb stożkowych wlałem po 5 cm3 Na2CO3, po czym uzupełniłem wodą destylowaną do ok. 100 cm 3. Następnie dodałem jako wskaźnika 3 krople oranżu metylowego w celu zabarwienia roztworu na barwę żółtą. Rozpocząłem miareczkowanie kwasem solnym czekając, aż roztwór zmieni barwę na żółtopomarańczową.
Otrzymałem następujące wyniki:
I miareczkowanie: 9,8[cm3],
II miareczkowanie: 9,7[cm3].
Średnia wynosi: 9,75[cm3]
Dane:
m(Na2CO3)=50[mg],
V(HCl)=9,75 [cm3]
![]()
![]()
Nastawianie miana NaOH na roztwór HCL
W kolbie miarowej o poj. 250 cm3 z wodą destylowaną rozpuściłem 1g NaOH. Następnie 10 cm3 roztworu NaOH rozcieńczyłem w dwóch kolbach miarowych wodą destylowaną do 100 cm3.Dodałem 3 krople oranżu metylowego i rozpocząłem miareczkowanie roztworem HCL do zauważenia zmiany barwy z żółtej na żółtopomarańczową.
Otrzymałem następujący wynik:
I miareczkowanie: 10,3 [cm3],
Na polecenie prowadzącego zajęcia nie robiłem 2 miareczkowania.
Przyjmuje więc wartość: 10,3 [cm3]
Dane:
V1(HCl)= 10,3[cm3],
V2(NaOH)=10[cm3],
N(HCl)=0,0967 [mval*cm-3]
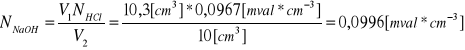
Oznaczanie H2SO4. Zadanie nr 20.
Próbkę o nieznanym stężeniu H2SO4 rozcieńczyłem do 100 cm3 wodą destylowaną. Pobrałem 25 cm3 roztworu H2SO4 do kolby stożkowej i dopełniłem wodą destylowaną do 100 cm3.. Dodałem 3 krople oranżu metylowego jako wskaźnika i zacząłem miareczkowanie tej próbki zasadą sodową, aż do uzyskania zmiany barwy z różowej na żółtą.
Otrzymałem następujące wyniki:
I miareczkowanie: 19,4 [cm3],
II miareczkowanie: 19,3 [cm3],
Przyjmuje więc wartość średnia:19,35[cm3]
Dane:
N(NaOH)=0,0996[mval*cm-3],
V(NaOH)=19,35[cm3],
a=4(bo wlałem 25 cm3 na 100 cm3)
![]()

Wyszukiwarka