WYZNACZANIE REFRAKCJI MOLOWEJ CIECZY ORGANICZNEJ
Na granicy dwóch ośrodków izotropowych 1 i 2, w których światło rozchodzi się z różnymi prędkościami v1 i v2, promień świetlny wchodząc z ośrodka 1 do ośrodka 2 zmienia kierunek swego biegu. Część promieni ulega odbiciu, a część przechodzi przez ośrodek 2 tworząc tzw. wiązkę załamaną.
Jeżeli ośrodek 1 jest optycznie rzadszy od ośrodka 2, wówczas kąt załamania β jest mniejszy od kąta padania α oraz v1 > v2. Gdy zaś ośrodek 1 jest optycznie gęstszy od ośrodka 2, promień załamuje się od prostopadłej i wówczas α < β oraz v1 < v2.
W obu przypadkach promień padający, promień załamany i prostopadła do powierzchni granicznej leżą w jednej płaszczyźnie, przy czym oba promienie tworzą takie kąty α i β z prostopadłą, że :
![]()
![]()
![]()
lub n1sinα = n2sinβ
Związek ten wyraża prawo załamania. Stałą wartość stosunku sinusów kąta padania i kąta załamania, równą stosunkowi prędkości rozchodzenia się światła w ośrodkach 1 i 2, nazywamy współczynnikiem załamania ośrodka 2 względem ośrodka 1 i oznaczymy przez n2,1.
Dla próżni współczynnik załamania n0 = 1 ⇒ sinα = n*sinβ , n nazywamy bezwzględnym współczynnikiem załamania.
Kąt α, dla którego kąt załamania jest kątem prostym (β = 90°), nazywamy kątem granicznym (α = αgr). Dla kątów padania większych od kąta granicznego zachodzi tzw. całkowite odbicie. Wszystkie promienie świetlne wracają wówczas do ośrodka gęstszego, odbijając się od powierzchni odgraniczającej ten ośrodek od ośrodka rzadszego.
Refrakcja właściwa: ![]()
![]()
![]()
,
Refrakcja molowa: ![]()
![]()
gdzie : n - współczynnik załamania światła,
M - masa molowa badanej substancji [g/mol],
d - gęstość badanej substancji [g/cm3].
Refrakcja molowa jest dla związków o wiązaniach kowalencyjnych wielkością addytywną, tak że można ją wyrazić w postaci sumy refrakcji atomowych, odpowiadających poszczególnym atomom w cząsteczce. Refrakcja molowa zależy również od struktury cząsteczki, dlatego też przy dodawaniu do siebie refrakcji atomowych poszczególnych wolnych atomów, należy uwzględniać przy tym typ wiązania. W przypadku związków o wiązaniach jonowych, refrakcja nie jest addytywna. Związane jest to z tym, że w związkach jonowych jony polaryzują się wzajemnie, w wyniku czego tzw. refrakcje jonowe ulegają znacznym zmianom. Addytywność refrakcji jonowych wykazują jedynie bardzo rozcieńczone roztwory elektrolitów, w których wzajemna polaryzacja jonów nie jest możliwa. Refrakcję molową można zatem wyznaczyć drogą ekstrapolacji do rozcieńczenia nieskończenie dużego.
WYKONANIE ĆWICZENIA I ZESTAWIENIE WYNIKÓW
Część doświadczalna :
Aparatura :
refraktometr Abbego,
lampa żarowa,
naczyńka wagowe,
pipety.
Odczynniki:
substancja 1 o wzorze sumarycznym C5H12O,
substancja 2 o wzorze sumarycznym C7H8O,
aceton,
mieszanina substancji 1 i 2 w stosunku 1:1.
2. Celem ćwiczenia było wyznaczenie wzorów strukturalnych badanych substancji i obliczenie refrakcji właściwych i molowych w oparciu o pomiar ich współczynnika załamania światła, wzór sumaryczny i gęstość.
Ponadto dla mieszaniny wyznaczenie składu ilościowego na podstawie pomiaru jej współczynnika załamania światła.
Obliczenia :
Refrakcje molowe obliczono w oparciu o Tabelę II.13 zawierającą wartości refrakcji atomowych oraz refrakcji wiązań chemicznych.
Obliczenia przedstawiono w tabeli :
Badana substancja |
Gęstość [g/cm3] w t = 25 [°C] |
Współczynnik załamania n |
Mrlit. [cm3/mol] |
pentan-1-ol |
0,8115 |
1,4079 |
26,815 |
2-metylobutan-1-ol |
0,8152 |
1,4087 |
26,815 |
3-metylobutan-1-ol |
0,8071 |
1,4052 |
26,815 |
1-metylobutan-2-ol |
0,8054 |
1,4044 |
26,815 |
2,3-dimetylo-propanol |
0,8138 |
1,4075 |
26,815 |
2-metylobutan-2-ol |
0,805 |
1,4024 |
26,815 |
pentan-3-ol |
0,816 |
1,4079 |
26,815 |
eter etylowo-propylowy |
0,7330 |
1,3695 |
26,933 |
eter metylowo-butylowy |
0,7443 |
1,3736 |
26,933 |
|
|||
alkohol benzylowy |
1,0454 |
1,5403 |
32,45 |
anizol |
0,9893 |
1,5143 |
32,568 |
o-krezol |
1,1350 |
1,5442 |
23,45 |
m-krezol |
1,0302 |
1,5396 |
32,45 |
p-krezol |
1,0178 |
1,5311 |
32,45 |
Wartości zaznaczone kolorem żółtym są najbardziej zbliżone do wartości charakteryzujących badane substancje.
Wartości ułamków molowych poszczególnych substancji w mieszaninie obliczono ze wzorów :
![]()
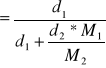
i ![]()
![]()
i ![]()
Dyskusja wyników i wnioski :
Na podstawie pomiarów i obliczeń ustalono wzory strukturalne związków :
pentan-1-ol
CH3 _ CH2 _ CH2 _ CH2 _ CH2 _ OH
alkohol benzylowy
_ CH2 _ OH
Refrakcja molowa dla substancji 1 wyznaczona przez komputer wynosi 27,5163. W celu wyznaczenia struktury związku rozpatrywano Mr izomerów alkoholu pentylowego (Mr = 26,815) i eterów o wzorze sumarycznym C5H12O (Mr = 26,933). Refrakcja molowa eterów jest bliższa refrakcji poszukiwanej substancji, sugerując się zatem tą wartością, przypuszczamy, że naszym związkiem jest eter. Ponieważ wartość współczynnika załamania eterów odbiega od wartości n badanej substancji, należy zatem odrzucić powyższą hipotezę. Kryterium rozstrzygającym, więc w tym przypadku jest gęstość, w oparciu o wartość której, jako substancję poszukiwaną uznano pentan-1-ol, którego d = 0,8115 g/cm3 (d badanej substancji wynosi 0,8120 g/cm3).
W rozważaniach pominięto etery: metylowo-sec-butylowy, metylowo-tert-butylowy, etylowo-izopropylowy, metylowo-izobutylowy ze względu na brak danych fizykochemicznych w literaturze.
W przypadku drugiej substancji wartości refrakcji alkoholu benzylowego i izomerów krezolu są zbliżone do obliczonej przez komputer. Współczynniki załamania światła alkoholu benzylowego i m-krezolu niewiele różnią się od wartości n substancji poszukiwanej, gęstość jednak wskazuje, że badanym związkiem jest pierwsza z wymienionych możliwości (alkohol benzylowy).
Skład ilościowy mieszaniny obliczony przez komputer nie zgadza się z wartościami wyznaczonymi ze wzorów na ułamki molowe. Ta znaczna różnica świadczy o dużym zanieczyszczeniu mieszaniny innymi substancjami.
W celu wyznaczenia składu ilościowego mieszaniny za pomocą refrakcji molowej należy stosować substancje, których współczynniki załamania światła znacznie się różnią - w przypadku naszej mieszaniny różnica ta była niewielka.
W oparciu o tę metodę nie można wyznaczyć ze 100 % dokładnością wzorów strukturalnych badanych związków, co wiąże się z zanieczyszczeniem próbek (śladowe ilości wody znacznie zmieniają wartość n), a w konsekwencji z różnymi od literaturowych wartości współczynników załamania światła i refrakcji molowych.
Wzory strukturalne substancji chemicznych można wyznaczyć innymi metodami z większą dokładnością np. spektroskopia w zakresie nadfioletu i widzialnym, spektroskopia w podczerwieni, spektroskopia magnetycznego rezonansu jądrowego czy analiza jakościowa w chemii organicznej.
Wyniki obarczone są błędem, który wynika z :
- zanieczyszczenia próbek,
niedokładności odczytu wartości współczynnika załamania światła,
złego oświetlenia pryzmatów,
trudności ustawienia ostrej granicy cienia tak, aby przecięła punkt skrzyżowania nitek w lunecie,
błędu pomiaru refraktometru Abbego.
![]()
![]()
![]()
![]()
![]()
![]()
Wyszukiwarka