3.11.2010 |
Mateusz Kaniewski Marcin Górski |
Gr.V
|
Ćwiczenie 5 |
Prawo podziału Nernsta |
|
Celem ćwiczenia jest wyznaczenie współczynnika podziału Nernsta kwasu octowego między dwa nie mieszające się rozpuszczalniki - wodę i chloroform.
Wykonanie ćwiczenia:
Rozcieńczyliśmy odpowiednio 1 M wodny roztwór kwasu octowego, przygotowaliśmy w kolbkach miarowych o poj. 50 cm3, roztwory o stężeniach: 1,0; 0,75; 0,5; 0,25 M.
Do rozdzielaczy odpipetowaliśmy z każdej kolby po 20 cm3 roztworu, dodaliśmy po 20 cm3 chloroformu i tak przygotowane mieszaniny wytrząsaliśmy przez ok. 5 minut następnie odstawialiśmy do rozdzielenia.
Z pozostałych w kolbach miarowych wyjściowych roztworów kwasu octowego odpipetowaliśmy po 2 cm3 i miareczkowalismy 0,1 M roztworem zasady NaOH wobec fenoloftaleiny.
Analogiczne miareczkowania wykonalismy dla warstwy wodnej kwasu octowego z rozdzielaczy.
II Opracowanie Wyników:
Przybliżone stężenie CH3COOH w sporządzonych przez nas wodnych roztworów, [mol/dm3] |
Pomiar |
Objętość zużytej zasady na określanie stężenia sporządzonych przez nas roztworów wodnych CH3COOH, [cm3] |
Objętość zużytej zasady na określenie stężenia CH3COOH w warstwach wodnych z rozdzielaczy, [cm3] |
1 |
1 2 |
21,9 22 |
18,1 18,1 |
0,75 |
1 2 |
16,1 16,4 |
15 15,2 |
0,5 |
1 2 |
11,1 11 |
10 10,4 |
0,25 |
1 2 |
5,6 5,5 |
5,1 5,3 |
Tabela 1. Wyniki pomiarów.
Obliczanie stężeń roztworów kwasu octowego przez nas sporządzonych:
-Dla roztworów przed ekstrakcją.
Dokonujemy tego na podstawie równania reakcji:
CH3COOH + NaOH → CH3COONa + H2O
Ze stechiometrii reakcji wynika nam, że 1 mol kwasu octowego, reaguje nam z 1 molem wodorotlenku sodu. Dzięki temu możemy zapisać:
1 mol CH3COOH - 1 mol NaOH
Ilość moli kwasu i zasady możemy zapisać Odpowiednio:
![]()
= ![]()
Po przekształceniach otrzymujemy wzór z którego obliczamy stężenie wodnego roztworu CH3COOH:
wzór 1.
gdzie:
![]()
- stężenie roztworu kwasu octowego[mol/dm3],
![]()
- stężenie roztworu wodorotlenku sodu [mol/dm3] (korzystaliśmy z 0,1 molowego roztworu, wiec takie we wszystkich obliczeniach przyjmujemy),
![]()
- średnia objętość roztworu wodorotlenku sodu [cm3] (średnie objętości są zawarte w Tabeli 2,)
![]()
- objętość roztworu kwasu octowego użytego do miareczkowania [cm3] (przyjmujemy 2 cm3)
Średnie objętości obliczamy na podstawie wzoru:
![]()
wzór 2.
Gdzie:
![]()
- średnia objętość wodnego roztworu zasady,
![]()
- pierwsza objętość zużytej przy miareczkowaniu wodnego roztworu zasady,
![]()
- druga objętość zużytej przy miareczkowaniu wodnego roztworu zasady.
Wyniki obliczeń średniej objętości (obliczone na podstawie wzoru 2. i wynikow z tabeli 1.) i stężenia wodnego roztworu kwasu octowego (obliczone na podstawie wzoru 1.) zamieszczono w tabeli poniżej:
Przybliżone stężenie CH3COOH w sporządzonych przez nas wodnych roztworów, [mol/dm3] |
|
Stężenie obliczone wodnych roztworów kwasu przed ekstrakcją ckw [mol/dm3] |
1 |
21,95 |
1,0975 |
0,75 |
16,25 |
0,8125 |
0,5 |
11,05 |
0,5525 |
0,25 |
5,55 |
0,2775 |
Tablea 2.
- Dla wodnej warstwy z rozdzielaczy:
Obliczamy bardzo podobnie jak w powyższym podpunkcie tyle, że korzystamy z innych objętości zużytych do miareczkowania wodnych roztworów wodorotlenku sodu(We wzorze 1 ckw zamieniamy na cw, a we wzorze 2 ![]()
na![]()
) .
|
Stęzenie kwasu obliczone dla warstwy wodnej cw [mol/dm3] |
18,1 |
0,9050 |
15,1 |
0,7550 |
10,2 |
0,5100 |
5,2 |
0,2600 |
Tabela 3.
- Dla warstwy chloroformowej:
Obliczamy z różnicy między stężeniami kwasu octowego wodnych roztworów przez nas sporządzonych, a stężeniami kwasu octowego w warstwie wodnej pobranej po ekstrakcji. Stosujemy to uproszczenie, ponieważ stężenia w każdym przypadku są wprost proporcjonalne do ilości moli.
co = ckw - cw
wzór 3.
Stężenie kwasu w warstwie chloroformowej co [mol/dm3] |
0,1925 |
0,0575 |
0,0425 |
0,0175 |
Tabela 4.
Obliczanie stałej K.
Obliczamy go na podstawie wzoru:
wzór 4. (źródło- „Chemia Analityczna” t.2 J.Minczewski Z. Marczenko wzór nr 2.7 str. 72 Wydanie 2009 rok)
gdzie:
![]()
- stała podziału Ernsta,
![]()
- stężenie substancji w warstwie organicznej(w tym ćwiczeniu kwasu octowego w chloroformie)
![]()
- stężenie substancji w warstwie wodnej (w tym ćwiczeniu kwasu octowego)
Korzystajmy ze stężeń w tabelach 3 i 4. obliczamy stałą K. (wyniki zamieszczono w tabeli 5.)
Wartość stałej K dla tego układu znajdujemy na podstawie wykresu zlogarytmowanej postaci równania Nernsta:
logco = logK + logcw
wzór 5.
Z racji tego, że wykres logco = f(logcw) (Rys 1.) nie przedstawia prostej, dlatego postanowiliśmy zastosować regresję liniową. Obliczenia dokonaliśmy w programie Excel, dlatego nie zamieszczamy sposobu jego wykonania, lecz podajemy same wyniki (również błędy względne które są umieszczone w IV punkcie sprawozdania):
współczynnik a = 1,6552
współczynnik b = -0,8396
Na podstawie równania prostej y = ax + b gdzie:
y = log co
x = log cw
Stwierdzamy że współczynnik b odpowiada stałej logK dla tego układu (odtąd K dla tego układu będziemy oznaczać jako Kgraf.). Stąd:
![]()
Wzór 6.
![]()
cw [mol/dm3] |
co [mol/dm3] |
logcw |
logco |
|
Kgraf. |
0,9050 |
0,1925 |
-0,0434 |
-0,7156 |
0,2127 |
0,1447 |
0,7550 |
0,0575 |
-0,1221 |
-1,2403 |
0,0762 |
|
0,5100 |
0,0425 |
-0,2924 |
-1,3716 |
0,0833 |
|
0,2600 |
0,0175 |
-0,5850 |
-1,7570 |
0,0673 |
|
Tabela 5.
Cześć graficzna:
Rys 1.
Wykres sporządziliśmy na podstawie danych z tabeli 5.
IV. Oszacowanie błędów
Błędy zostały oszacowane na podstawie metody różniczki zupełnej.
![]()
obliczamy na podstawie wzoru 1.
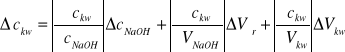
[mol/dm3] wzór 7.
Po przekształceniach:
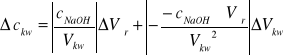
[mol/dm3] wzór 8.
Gdzie:
![]()
= 0,4 cm3
![]()
= 0,2 cm3
![]()
obliczamy na podstawie wzoru 1.
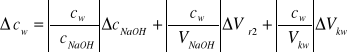
[mol/dm3] wzór 9.
Po przekształceniach:
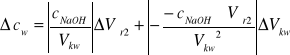
[mol/dm3] wzór 10.
![]()
obliczamy na podstawie wzoru 3.
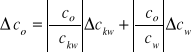
[mol/dm3] wzór 11.
Po przekształceniach:
![]()
[mol/dm3] wzór 12.
![]()
obliczamy na podstawie wzoru 4.
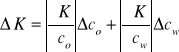
wzór 13.
Po przekształceniach:

wzór 14.
Wyniki zamieściliśmy pod spodem, w tabeli:
[mol/dm3] |
[mol/dm3] |
[mol/dm3] |
|
Względny błąd [%] |
Względny błąd [%] |
Względny błąd [%] |
Względny błąd [%] |
0,1298 |
0,1105 |
0,2403 |
0,1786 |
11,82 |
12,21 |
124,81 |
83,95 |
0,1013 |
0,0955 |
0,1968 |
0,1463 |
12,46 |
12,65 |
342,17 |
192,15 |
0,0753 |
0,0710 |
0,1463 |
0,1631 |
13,61 |
13,92 |
344,12 |
195,74 |
0,0478 |
0,0460 |
0,0938 |
0,2011 |
17,21 |
17,69 |
535,71 |
298,91 |
Tabela 6.
Błędy współczynników regresji liniowej na podstawie programu Excel:
![]()
= 0,4894
![]()
= 0,1632
Z racji tego, że ![]()
obliczaliśmy na podstawie współczynnika b, to podobną operacje wykonujemy dla jego błędu, stąd:
![]()
wzór 15.
![]()
Błąd względny ![]()
[%]= 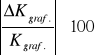
wzór 16.
Błąd względny ![]()
[%]= 1006,37
V. Wnioski:
Wyznaczyliśmy współczynnik podziału Nernsta kwasu octowego dla wody z chloroformem. Przy ![]()
otrzymaliśmy bardzo duży błąd z powodu zastosowania przez nas metody regresji liniowej.
![]()
![]()
logco=f(logcw)
-2
-1,5
-1
-0,5
0
-0,7
-0,6
-0,5
-0,4
-0,3
-0,2
-0,1
0
logcw
logco
Wyszukiwarka