

Tytuł oryginału: Chemistry For Dummies®, 2 edition
Tłumaczenie: Joanna Sugiero
ISBN: 978-83-283-0145-0
Original English language edition Copyright © 2011 by Wiley Publishing, Inc., Indianapolis, Indiana.
All rights reserved including the right of reproduction in whole or in part in any form.
This translation published by arrangement with Wiley Publishing, Inc.
Oryginalne angielskie wydanie © 2011 by Wiley Publishing, Inc., Indianapolis, Indiana.
Wszelkie prawa, włączając prawo do reprodukcji całości lub części w jakiejkolwiek formie,
zarezerwowane. Tłumaczenie opublikowane na mocy porozumienia z Wiley Publishing, Inc.
Translation copyright © 2015 by Helion S.A.
Wiley, the Wiley Publishing logo, For Dummies, the Dummies Man logo, A Reference for the Rest of Us!,
The Dummies Way, Dummies Daily, The Fun and Easy Way, Dummies.com, Making Everything Easier
and related trade dress are trademarks or registered trademarks of John Wiley and Sons, Inc. and/or its
affiliates in the United States and/or other countries. Used under license.
Wiley, the Wiley Publishing logo, For Dummies, the Dummies Man logo, A Reference for the Rest of Us!,
The Dummies Way, Dummies Daily, The Fun and Easy Way, Dummies.com, Making Everything Easier
i związana z tym szata graficzna są markami handlowymi John Wiley and Sons, Inc. i/lub firm
stowarzyszonych w Stanach Zjednoczonych i/lub innych krajach. Wykorzystywane na podstawie licencji.
Polish language edition published by Helion S.A.
Copyright © 2015.
Wszystkie znaki występujące w tekście są zastrzeżonymi znakami firmowymi bądź towarowymi ich
właścicieli.
Autor oraz Wydawnictwo HELION dołożyli wszelkich starań, by zawarte w tej książce informacje były
kompletne i rzetelne. Nie biorą jednak żadnej odpowiedzialności ani za ich wykorzystanie, ani za związane
z tym ewentualne naruszenie praw patentowych lub autorskich. Autor oraz Wydawnictwo HELION nie
ponoszą również żadnej odpowiedzialności za ewentualne szkody wynikłe z wykorzystania informacji
zawartych w książce.
Wydawnictwo HELION
ul. Kościuszki 1c, 44-100 GLIWICE
tel. 32 231 22 19, 32 230 98 63
e-mail: dlabystrzakow@dlabystrzakow.pl
WWW: http://dlabystrzakow.pl (księgarnia internetowa, katalog książek)
Drogi Czytelniku!
Jeżeli chcesz ocenić tę książkę, zajrzyj pod adres
http://dlabystrzakow.pl/user/opinie/chemb2
Możesz tam wpisać swoje uwagi, spostrzeżenia, recenzję.
Printed in Poland.

Spis treĂci
O autorze .......................................................................................................................15
PodziÚkowania od autora ..............................................................................................17
WstÚp ............................................................................................................................19
O ksiÈĝce .........................................................................................................................................20
Naiwne zaïoĝenia ..............................................................................................................................20
Czego nie czytaÊ ...............................................................................................................................21
Jak podzielona jest ksiÈĝka .................................................................................................................21
CzÚĂÊ I. Podstawowe pojÚcia chemiczne .........................................................................................21
CzÚĂÊ II. ObfitoĂÊ koncepcji chemicznych .......................................................................................22
CzÚĂÊ III. Cudowna moc wiÈzañ.....................................................................................................22
CzÚĂÊ IV. Chemia Ărodowiskowa — korzyĂci i problemy .................................................................23
CzÚĂÊ V. Dekalogi ........................................................................................................................23
Ikony uĝyte w ksiÈĝce ........................................................................................................................23
Co dalej ...........................................................................................................................................24
CzÚĂÊ I: Podstawowe pojÚcia chemiczne ................... 25
Rozdziaï 1: Czym jest chemia i dlaczego trzeba jÈ poznaÊ? ..........................................27
Czym jest chemia? ............................................................................................................................27
Rozróĝnienie miÚdzy naukÈ a technologiÈ ...........................................................................................28
Odszyfrowanie metody naukowej .......................................................................................................29
Jak dziaïa metoda naukowa? ..........................................................................................................29
Jak stosowaÊ metodÚ naukowÈ? ......................................................................................................31
Krótki opis dyscyplin chemicznych .....................................................................................................32
PodejĂcie makroskopowe kontra mikroskopowe ...............................................................................34
Chemia czysta kontra chemia stosowana .........................................................................................34
Krótki rzut oka na to, czego bÚdziesz siÚ uczyÊ na zajÚciach z chemii ....................................................35
Rozdziaï 2: Rozwaĝania na temat obliczeñ chemicznych ..............................................37
Ukïad jednostek miar SI ....................................................................................................................37
Podstawowe przedrostki ukïadu SI ................................................................................................38
Jednostki dïugoĂci .........................................................................................................................38
Jednostki masy ..............................................................................................................................39
Jednostki objÚtoĂci .........................................................................................................................39

6
Chemia dla bystrzaków
Jednostki temperatury ....................................................................................................................39
Jednostki ciĂnienia .........................................................................................................................40
Jednostki energii ...........................................................................................................................40
Jak sobie radziÊ z bardzo duĝymi i bardzo maïymi liczbami? ................................................................40
PostaÊ wykïadnicza i notacja naukowa ............................................................................................41
Dodawanie i odejmowanie .............................................................................................................41
Mnoĝenie i dzielenie .....................................................................................................................42
Podnoszenie liczby do potÚgi .........................................................................................................42
Korzystanie z kalkulatora ..............................................................................................................42
Róĝnica miÚdzy dokïadnoĂciÈ a precyzjÈ .............................................................................................43
Wykorzystywanie metody zamiany jednostek do rozwiÈzywania zadañ ..................................................44
Posïugiwanie siÚ cyframi znaczÈcymi ..................................................................................................47
Porównywanie liczb: dokïadne i liczone kontra mierzone .................................................................47
OkreĂlenie liczby cyfr znaczÈcych w liczbie pomiarowej ...................................................................47
Podawanie odpowiedniej liczby cyfr znaczÈcych ..............................................................................48
ZaokrÈglanie liczb ........................................................................................................................49
Rozdziaï 3: Materia i energia ........................................................................................ 51
Fakty na temat materii .......................................................................................................................51
Ciaïa staïe ....................................................................................................................................52
Ciecze ..........................................................................................................................................52
Gazy ...........................................................................................................................................53
Skupmy siÚ na zmianie stanu skupienia ...............................................................................................53
TopiÚ siÚ! Co za Ăwiat! .................................................................................................................53
Temperatura wrzenia ....................................................................................................................54
Temperatura krzepniÚcia ...............................................................................................................54
Przesublimuj to! ...........................................................................................................................55
Klasyfikowanie czystych substancji i mieszanin ....................................................................................55
Prosta sprawa z czystymi substancjami ...........................................................................................56
Zamieszane w mieszaniny .............................................................................................................57
Masz niezïe wïaĂciwoĂci ....................................................................................................................57
Identyfikacja substancji za pomocÈ gÚstoĂci .....................................................................................58
Jak gÚsty jesteĂ? Mierzenie gÚstoĂci ................................................................................................58
¥wiat w ruchu: energia ......................................................................................................................60
Przejděmy dalej: energia kinetyczna ...............................................................................................60
RozsiÈdě siÚ wygodnie: energia potencjalna ....................................................................................61
Pomiar energii ..................................................................................................................................61
Rzut oka na temperaturÚ ...............................................................................................................62
Poczuj ten ĝar ..............................................................................................................................63
Rozdziaï 4: CoĂ mniejszego niĝ atom? Struktura atomu ............................................... 65
Spojrzenie z bliska na atom, czyli czÈstki elementarne ..........................................................................65
Scena gïówna, czyli jÈdro ..................................................................................................................67
Umiejscowienie elektronów w atomie ..................................................................................................71
Model Bohra ...............................................................................................................................71
Model kwantowo-mechaniczny ......................................................................................................72

Spis treĂci
7
Konfiguracja elektronowa ..................................................................................................................76
Badanie diagramu poziomów energetycznych .................................................................................76
Rzut oka na konfiguracje elektronowe .............................................................................................79
¿ycie na krawÚdzi, czyli elektrony walencyjne .................................................................................79
Izotopy i jony ....................................................................................................................................80
Izotopy .........................................................................................................................................80
Jony .............................................................................................................................................81
Rozdziaï 5: Ukïad okresowy pierwiastków ....................................................................83
Powtarzanie schematów okresowoĂci ..................................................................................................83
Rozmieszczenie pierwiastków w ukïadzie okresowym ...........................................................................86
Klasyfikacja metali, niemetali i póïmetali ........................................................................................86
UporzÈdkowanie pierwiastków wedïug okresów i grup .....................................................................89
Rozdziaï 6: Balony, opony i butle do nurkowania, czyli cudowny Ăwiat gazów .............95
Gazy na poziomie mikroskopowym — teoria kinetyczno-molekularna ...................................................95
CzuÊ ciĂnienie — atmosferyczne, rzecz jasna .......................................................................................98
Mierzenie ciĂnienia atmosferycznego za pomocÈ barometru ..............................................................98
Mierzenie ciĂnienia gazu za pomocÈ manometru .............................................................................99
Róĝne prawa gazowe ......................................................................................................................100
Prawo Boyle’a-Mariotte’a ...........................................................................................................100
Prawo Charles’a .........................................................................................................................102
Prawo Gay-Lussaca ...................................................................................................................103
PoïÈczone prawa gazowe .............................................................................................................105
Prawo Avogadra ........................................................................................................................106
Równanie stanu gazu doskonaïego ...............................................................................................107
Równanie van der Waalsa ...........................................................................................................109
Zastosowanie praw gazowych w stechiometrii ...................................................................................109
Zabieramy siÚ za prawo Daltona i prawo Grahama ...........................................................................110
Prawo Daltona ...........................................................................................................................110
Prawo Grahama .........................................................................................................................111
CzÚĂÊ II: ObfitoĂÊ koncepcji chemicznych ............... 113
Rozdziaï 7: Chemia od kuchni, czyli reakcje chemiczne .............................................115
To, co masz, i to, co uzyskasz, czyli substraty i produkty ....................................................................115
Jak zachodzÈ reakcje? Teoria zderzeñ ...............................................................................................117
Przykïad zderzenia prostego ........................................................................................................117
Przykïad egzotermiczny ...............................................................................................................118
Przykïad endotermiczny ..............................................................................................................119
Rozpoznawanie róĝnych rodzajów reakcji .........................................................................................120
Reakcje syntezy ..........................................................................................................................120
Reakcje analizy ..........................................................................................................................120
Reakcje wymiany pojedynczej ......................................................................................................121
Reakcje wymiany podwójnej ........................................................................................................122
Reakcje spalania .........................................................................................................................123
Reakcje utleniania i redukcji ........................................................................................................124

8
Chemia dla bystrzaków
Bilansowanie reakcji chemicznych ....................................................................................................124
Bilansowanie produkcji amoniaku ................................................................................................124
Zapalanie zapalniczki .................................................................................................................126
Rozdziaï 8: Mole — dasz radÚ siÚ w to wgryěÊ? ....................................................... 129
Liczenie przez waĝenie ....................................................................................................................129
Wykorzystywanie moli w obliczeniach ...............................................................................................130
Liczba Avogadra ........................................................................................................................130
Wykorzystywanie moli w pracy ....................................................................................................131
Obliczanie wzorów empirycznych ................................................................................................132
Rola moli w reakcjach chemicznych ..................................................................................................133
Wykonywanie obliczeñ ................................................................................................................133
Czego potrzebujesz i co uzyskasz? Stechiometria reakcji ................................................................135
Poznaj swojÈ wartoĂÊ, czyli wydajnoĂÊ reakcji chemicznej ..............................................................137
Wyczerpanie zapasów i porzucanie dóbr, czyli substraty ograniczajÈce ...........................................137
Rozdziaï 9: Zamieszanie w materii, czyli roztwory ..................................................... 139
Podstawowe pojÚcia: substancja rozpuszczona, rozpuszczalnik i roztwór .............................................139
Kilka uwag na temat rozpuszczalnoĂci: ile substancji ulegnie rozpuszczeniu? ...................................140
Badanie nasycenia ......................................................................................................................140
Jednostki okreĂlajÈce stÚĝenie roztworu ..............................................................................................141
StÚĝenie procentowe — trzy róĝne proporcje ................................................................................141
StÚĝenie molowe — numer jeden! ................................................................................................144
StÚĝenie molalne — kolejne zastosowanie mola .............................................................................146
CzÚĂci na milion — jednostka zanieczyszczenia ............................................................................147
WïaĂciwoĂci koligatywne roztworów .................................................................................................147
Niĝsze ciĂnienie, czyli obniĝenie prÚĝnoĂci par ..............................................................................148
Zimowy pïyn do chïodnicy w lecie, czyli ebulioskopia ....................................................................148
KrÚcenie lodów, czyli krioskopia ..................................................................................................149
Caïe i zdrowe krwinki, czyli ciĂnienie osmotyczne ..........................................................................151
PrzejĂcia z koloidami .......................................................................................................................153
Rozdziaï 10: Termochemia — gorÈcy temat .............................................................. 155
Obserwowanie reakcji i zmian energii ...............................................................................................155
Ukïad i otoczenie ........................................................................................................................156
Ciepïo ........................................................................................................................................156
Jednostki energii .........................................................................................................................156
PojemnoĂÊ cieplna ......................................................................................................................157
Kalorymetria ..............................................................................................................................158
Zrozumienie zmian entalpii .............................................................................................................161
OkreĂlenie ciepïa reakcji ..................................................................................................................162
Zrób to sam ...............................................................................................................................163
Korzystanie z tabel .....................................................................................................................163
Zastosowanie prawa Hessa .........................................................................................................163
Uĝywanie standardowych ciepeï tworzenia ...................................................................................164
Zrozumienie entalpii i przemian fazowych ........................................................................................166

Spis treĂci
9
Rozdziaï 11: KwaĂne i gorzkie, czyli kwasy i zasady ...................................................169
WïaĂciwoĂci kwasów i zasad — poziom makroskopowy .....................................................................169
Kwasy i zasady — poziom mikroskopowy .........................................................................................171
Teoria Arrheniusa, czyli potrzebujesz wody ..................................................................................171
Teoria kwasów i zasad Brønsteda-Lowry’ego, czyli dawanie i przyjmowanie ...................................172
Róĝnice miÚdzy mocnymi a sïabymi kwasami i zasadami ....................................................................173
Caïkowita dysocjacja — mocne kwasy ..........................................................................................173
RozpaĂÊ siÚ na kawaïki — mocne zasady .....................................................................................174
CzÚĂciowa jonizacja — sïabe kwasy .............................................................................................174
OkreĂlenie stanu równowagi dla wody — sïabe zasady ..................................................................176
Reakcje miÚdzy kwasami a zasadami wedïug Brønsteda-Lowry’ego, czyli rywalizowanie o protony .....176
Gra na dwa fronty, czyli amfoteryczna woda .................................................................................177
Rozpoznawanie kwasów i zasad dziÚki wskaěnikom ...........................................................................178
Papierek lakmusowy prawdÚ Ci powie .........................................................................................178
Miareczkowanie fenoloftaleinÈ .....................................................................................................179
Kawa i inne substancje na skali pH ..................................................................................................180
Kontrolowanie pH za pomocÈ buforów ............................................................................................183
CzÚĂÊ III: Cudowna moc wiÈzañ ............................ 185
Rozdziaï 12: Gdzie ja poïoĝyïem ten elektron? Teoria kwantowa ...............................187
Koncepcje dotyczÈce materii i Ăwiatïa ...............................................................................................187
Podstawowe pojÚcia ....................................................................................................................187
Spektroskopia .............................................................................................................................189
Model atomu Bohra ........................................................................................................................191
Wkïad de Broglie’a .....................................................................................................................191
Wkïad Heisenberga ....................................................................................................................192
Model kwantowo-mechaniczny .........................................................................................................192
Rozdziaï 13: Przeciwieñstwa naprawdÚ siÚ przyciÈgajÈ, czyli wiÈzania jonowe ........195
Magicznie zwiÈzane jony, czyli sód + chlor = sól kuchenna ..............................................................195
Spotkanie skïadników .................................................................................................................196
Przebieg reakcji ..........................................................................................................................197
Tworzenie wiÈzania ....................................................................................................................198
Rozpoznawanie jonów dodatnich i jonów ujemnych — kationy i aniony ..............................................199
Jony wieloatomowe (zïoĝone) ...........................................................................................................202
Èczenie siÚ jonów w zwiÈzki jonowe ................................................................................................203
PoïÈczenie magnezu z bromem ....................................................................................................203
Stosowanie reguïy krzyĝowej ........................................................................................................204
Nazewnictwo zwiÈzków jonowych ....................................................................................................205
Porównanie elektrolitów i nieelektrolitów ..........................................................................................206
Rozdziaï 14: PiÚkne wspóïdzielenie, czyli wiÈzania kowalencyjne .............................209
Podstawowe informacje na temat wiÈzañ kowalencyjnych ...................................................................209
WiÈzania kowalencyjne na przykïadzie wodoru .............................................................................210
Porównanie wiÈzañ kowalencyjnych z innymi wiÈzaniami ..............................................................211
WiÈzania wielokrotne ..................................................................................................................212

10
Chemia dla bystrzaków
Nazewnictwo dwupierwiastkowych zwiÈzków kowalencyjnych ............................................................213
Nauczenie siÚ wielu wzorów w krótkim czasie ....................................................................................214
Wzór empiryczny — tylko pierwiastki ..........................................................................................215
Wzór rzeczywisty sumaryczny lub czÈsteczkowy — wewnÈtrz liczb .................................................215
Wzór strukturalny — dodatkowe informacje na temat wiÈzañ ........................................................216
Uwspólnianie par elektronowych — nie zawsze po równo ..................................................................220
PrzyciÈganie elektronów, czyli elektroujemnoĂÊ .............................................................................220
WiÈzanie kowalencyjne spolaryzowane .........................................................................................222
Woda — naprawdÚ dziwna czÈsteczka .........................................................................................223
Rozdziaï 15: Jak naprawdÚ wyglÈdajÈ czÈsteczki?
Geometria czÈsteczek i hybrydyzacja ......................................................................... 227
Dlaczego ksztaït ma znaczenie? ........................................................................................................228
Naïadowanie polarnoĂciÈ ............................................................................................................228
Przewidywanie polarnoĂci ...........................................................................................................229
Geometria elektronów i czÈsteczek (VSEPR) ..................................................................................230
Teoria wiÈzañ walencyjnych (hybrydyzacji) ......................................................................................233
Teoria orbitali molekularnych (MO) ................................................................................................235
Rozdziaï 16: Trendy w ukïadzie okresowym pierwiastków ........................................ 239
Jakie znaczenie ma wielkoĂÊ? ...........................................................................................................239
Czym jest efektywny ïadunek jÈdra? .............................................................................................240
Zmiany w promieniu atomowym ..................................................................................................240
¥ledzenie tendencji promieni jonowych ........................................................................................241
Trendy w energii jonizacji ................................................................................................................242
Wzrost kolejnych energii .............................................................................................................242
UwzglÚdnienie stabilnoĂci ...........................................................................................................243
Kilka wyjÈtków od reguïy ............................................................................................................244
Trendy w powinowactwie elektronowym ...........................................................................................244
Rozdziaï 17: Analiza powiÈzañ miÚdzy oddziaïywaniem
miÚdzyczÈsteczkowym a materiÈ skondensowanÈ .................................................... 247
Rodzaje oddziaïywañ miÚdzyczÈsteczkowych ....................................................................................247
PoïÈczenie jonów z dipolami .......................................................................................................248
Wzajemne przyciÈganie siÚ dipoli ................................................................................................248
Zmierzanie do wodoru ................................................................................................................249
Èczenie siÚ przez chmurÚ ...........................................................................................................249
Tworzenie tymczasowych wiÈzañ przy udziale siï (dyspersyjnych) Londona ...................................249
WïaĂciwoĂci cieczy ..........................................................................................................................249
Opór przeciw powiÚkszaniu, czyli napiÚcie powierzchniowe ...........................................................250
Opór przeciw pïyniÚciu, czyli lepkoĂÊ ...........................................................................................250
Wspinanie siÚ po Ăcianach, czyli zjawiska kapilarne .......................................................................251
Rozgrzewka, czyli pojemnoĂÊ cieplna ...........................................................................................251
Ciaïa staïe ......................................................................................................................................252
Odczytywanie wykresów fazowych ....................................................................................................253

Spis treĂci
11
CzÚĂÊ IV: Chemia Ărodowiskowa
— korzyĂci i problemy ......................................... 257
Rozdziaï 18: Ehe, ehe! Zanieczyszczenie powietrza ....................................................259
Wpïyw cywilizacji na atmosferÚ ........................................................................................................259
Bliĝsze spojrzenie na atmosferÚ Ziemi ..............................................................................................260
Troposfera — najbliĝsza i najbardziej naraĝona ............................................................................260
Stratosfera — ochronna warstwa ozonowa ....................................................................................260
Co warto wiedzieÊ o warstwie ozonowej? ..........................................................................................261
Jak warstwa ozonowa reaguje na gazy? .........................................................................................261
Jak freony niszczÈ warstwÚ ozonowÈ? ...........................................................................................262
Problem efektu cieplarnianego .........................................................................................................262
Oddychanie brÈzowym powietrzem, czyli smog fotochemiczny ............................................................264
Smog londyñski ..........................................................................................................................264
Smog fotochemiczny ...................................................................................................................264
Rozpuszczam siÚ! KwaĂne deszcze ...................................................................................................266
Nie pij tej wody! Z czego siÚ skïadajÈ kwaĂne deszcze? .................................................................266
Naïaduj i wyrzuÊ, czyli elektrofiltry ..............................................................................................268
Mycie wody, czyli pïuczki ............................................................................................................268
Rozdziaï 19: Wszystko na temat zanieczyszczenia wody ............................................271
SkÈd siÚ bierze woda i gdzie znika? ..................................................................................................271
Parowanie, skraplanie… I tak w kóïko .........................................................................................272
¥ledzenie wody ..........................................................................................................................272
Woda — najbardziej niezwykïa substancja ........................................................................................273
Lista najczÚĂciej wystÚpujÈcych zanieczyszczeñ wód ...........................................................................275
Problem z oïowiem — zanieczyszczenie metalami ciÚĝkimi ............................................................276
Kwas, który spada na nas z nieba ................................................................................................277
Drobnoustroje chorobotwórcze .....................................................................................................277
Wycieki ze skïadowisk odpadów i lotne zwiÈzki organiczne ............................................................278
Zanieczyszczenia z gospodarstw rolnych ......................................................................................279
Zanieczyszczenia termiczne .........................................................................................................279
Zuĝywanie tlenu — BZT ..........................................................................................................280
UsuniÚcie smrodu ze Ăcieków ...........................................................................................................280
Pierwszy stopieñ oczyszczania .....................................................................................................280
Drugi stopieñ oczyszczania ..........................................................................................................281
Trzeci stopieñ oczyszczania .........................................................................................................282
Oczyszczanie wody pitnej ................................................................................................................282
Rozdziaï 20: Chemia jÈdrowa — nauka, która sprawi, ĝe siÚ rozpromienisz .............285
Podstawowa struktura atomowa — wszystko zaczyna siÚ od atomu .....................................................286
PromieniotwórczoĂÊ i rozpad promieniotwórczy wywoïany przez czïowieka .........................................286
Naturalny rozpad promieniotwórczy .................................................................................................288
Rozpad alfa ...............................................................................................................................288
Rozpad beta ...............................................................................................................................289
Emisja gamma ............................................................................................................................290
Emisja pozytonu .........................................................................................................................290
Wychwyt elektronu .....................................................................................................................290

12
Chemia dla bystrzaków
Kiedy dochodzi do rozpadu promieniotwórczego? Czas poïowicznego rozpadu ...................................291
Obliczanie czasu poïowicznego rozpadu .......................................................................................292
Bezpieczne korzystanie z materiaïu promieniotwórczego ................................................................294
Datowanie izotopowe ..................................................................................................................294
Inicjowanie reakcji, czyli rozszczepienie jÈdra ....................................................................................295
Obliczanie reakcji ïañcuchowych i masy krytycznej ........................................................................295
Reakcje kontrolowane, czyli elektrownie jÈdrowe ...........................................................................297
Wytwarzanie plutonu w reaktorach powielajÈcych .........................................................................299
Reakcje termojÈdrowe — nasza nadzieja na energiÚ ..........................................................................300
Problemy z opanowaniem energii .................................................................................................300
Co niesie przyszïoĂÊ? ..................................................................................................................301
Skutki promieniowania ....................................................................................................................302
CzÚĂÊ V: Dekalogi .................................................303
Rozdziaï 21: DziesiÚÊ przypadkowych odkryÊ chemicznych ....................................... 305
Zmierzenie objÚtoĂci .......................................................................................................................305
Nadanie gumie trwaïej formy staïej ...................................................................................................306
CzÈsteczki praworÚczne i leworÚczne ................................................................................................306
Sztuczny barwnik — droga na skróty do koloru .................................................................................306
WyĂnienie budowy pierĂcieniowej .....................................................................................................307
Odkrycie promieniotwórczoĂci .........................................................................................................307
Wynalezienie niezwykle Ăliskiej substancji — teflonu .........................................................................307
Karteczki samoprzylepne .................................................................................................................308
Odrastanie wïosów ..........................................................................................................................308
Sïodkie co nieco ..............................................................................................................................308
Rozdziaï 22: DziesiÚciu (plus jeden) wybitnych chemików ........................................ 309
Amedeo Avogadro ..........................................................................................................................309
Niels Bohr ......................................................................................................................................309
Maria Skïodowska-Curie .................................................................................................................310
John Dalton ....................................................................................................................................310
Michael Faraday .............................................................................................................................310
Antoine Lavoisier ...........................................................................................................................310
Dmitrij Mendelejew ........................................................................................................................311
Linus Pauling .................................................................................................................................311
Ernest Rutherford ...........................................................................................................................311
Glenn Seaborg ...............................................................................................................................312
Trzecioklasistka eksperymentujÈca z octem i proszkiem do pieczenia ...................................................312
Rozdziaï 23: DziesiÚÊ wspaniaïych porad, które pomogÈ Ci zdaÊ egzamin z chemii ......... 313
Ucz siÚ systematycznie ....................................................................................................................313
Staraj siÚ zrozumieÊ tekst, a nie tylko go zapamiÚtaÊ ..........................................................................314
Wyrób sobie nawyk odrabiania zadañ domowych ..............................................................................314
Szukaj wiedzy w innych ěródïach .....................................................................................................314

Spis treĂci
13
Przed zajÚciami przeczytaj nowÈ lekcjÚ .............................................................................................315
Rób notatki ....................................................................................................................................315
Przepisz swoje notatki z lekcji albo wykïadu ......................................................................................316
Zadawaj pytania .............................................................................................................................316
WyĂpij siÚ dobrze przed egzaminem .................................................................................................316
Zwracaj uwagÚ na szczegóïy ............................................................................................................317
Rozdziaï 24: DziesiÚÊ najwaĝniejszych substancji chemicznych w przemyĂle ...........319
Kwas siarkowy (H
2
SO
4
) .................................................................................................................319
Azot (N
2
) ......................................................................................................................................320
Etylen (C
2
H
4
) ................................................................................................................................320
Tlen (O
2
) ......................................................................................................................................321
Propylen (C
3
H
6
) ............................................................................................................................321
Chlor (Cl
2
) .....................................................................................................................................322
1,2-dwuchloroetylen (C
2
H
2
Cl
2
) .......................................................................................................322
Kwas fosforowy (H
3
PO
4
) ...............................................................................................................322
Amoniak (NH
3
) .............................................................................................................................323
Wodorotlenek sodu (NaOH) ..........................................................................................................323
Sïownik .......................................................................................................................325
Skorowidz ....................................................................................................................337

Rozdziaï 4
CoĂ mniejszego niĝ atom?
Struktura atomu
W tym rozdziale:
Ź
poznasz czÈstki, które tworzÈ atom;
Ź
przeanalizujesz budowÚ jÈdra;
Ź
dowiesz siÚ co nieco o elektronach;
Ź
zaczniesz rozumieÊ konfiguracje elektronów;
Ź
odkryjesz izotopy i jony.
amiÚtam, jak uczyïem siÚ w szkole podstawowej o atomach. Moi nauczyciele
nazywali je elementami budulcowymi i uĝywali klocków, ĝeby nam lepiej przybliĝyÊ
to zagadnienie. PamiÚtam równieĝ, jak mówiono mi, ĝe atomy sÈ tak maïe, iĝ nikt
nigdy ich nie widziaï. Wyobraě sobie moje zdziwienie wiele lat póěniej, gdy zobaczyïem
pierwsze zdjÚcia atomów. Nie byïy zbyt szczegóïowe, ale sprawiïy, ĝe zaczÈïem siÚ
zastanawiaÊ nad postÚpem nauki. Do dziĂ zdjÚcia atomów budzÈ we mnie zachwyt.
W tym rozdziale opowiem Ci o atomach ʊ najwaĝniejszym budulcu w caïym
wszechĂwiecie. PrzedstawiÚ Ci trzy podstawowe czÈstki atomu — protony, neutrony
i elektrony — i pokaĝÚ, gdzie siÚ znajdujÈ. PoĂwiÚcÚ takĝe kilka stron samym elektronom,
poniewaĝ reakcje chemiczne (te, w których dzieje siÚ prawdziwa chemia) zaleĝÈ od utraty,
pozyskania lub uwspólniania elektronów.
Spojrzenie z bliska na atom,
czyli czÈstki elementarne
Atom to najmniejsza czÚĂÊ materii, która reprezentuje okreĂlony pierwiastek. Przez jakiĂ
czas uwaĝano, ĝe atom jest najmniejszÈ czÈstkÈ materii, jaka istnieje. W drugiej poïowie
XIX wieku i na poczÈtku XX wieku naukowcy odkryli jednak, ĝe atomy skïadajÈ siÚ
z okreĂlonych czÈstek elementarnych, które wystÚpujÈ we wszystkich atomach, bez
wzglÚdu na pierwiastek. Jedyna róĝnica sprowadza siÚ do liczby poszczególnych
czÈstek elementarnych.
P

66
CzÚĂÊ I: Podstawowe pojÚcia chemiczne
Naukowcy wiedzÈ juĝ dzisiaj, ĝe istnieje wiele czÈstek elementarnych (jest to temat,
który budzi szczególne zainteresowanie fizyków). Na potrzeby chemii wystarczy
jednak, ĝe bÚdziesz znaÊ trzy najwaĝniejsze czÈstki elementarne:
9
protony — czÈstki elementarne o ïadunku dodatnim, które znajdujÈ siÚ w jÈdrze
atomowym;
9
neutrony — czÈstki elementarne nieposiadajÈce ïadunku, które znajdujÈ siÚ
w jÈdrze atomowym;
9
elektrony — czÈstki elementarne o ïadunku ujemnym, które znajdujÈ siÚ
poza jÈdrem atomowym.
W tabeli 4.1 podsumowujÚ cechy tych trzech czÈstek elementarnych.
Tabela 4.1. Trzy gïówne czÈstki elementarne
Nazwa
Symbol
adunek
Masa (g)
Masa (u)
Lokalizacja
Proton
p
+
+1
1,673 · 10
–24
1
JÈdro
Neutron
n
0
0
1,675 · 10
–24
1
JÈdro
Elektron
e
–
–1
9,109 · 10
–28
0,0005
Poza jÈdrem
W tabeli 4.1 przedstawiam masy czÈstek elementarnych na dwa róĝne sposoby: w gramach
i w unitach, czyli jednostkach masy atomowej. Wyraĝanie masy w unitach jest duĝo ïatwiejsze
niĝ w gramach.
Jednostki masy atomowej sÈ oparte na skali wÚgla
12
C. Jest to stosowany na caïym Ăwiecie
standard okreĂlania wagi atomów. Zgodnie z miÚdzynarodowÈ umowÈ waga atomowa
jednego atomu wÚgla, który zawiera 6 protonów i 6 neutronów, wynosi dokïadnie 12 u,
a zatem 1 u to
1
12
tego atomu wÚgla. (Co majÈ z tym wszystkim wspólnego atomy wÚgla
i liczba 12? Po prostu mi zaufaj). Poniewaĝ masa protonów i neutronów wyraĝona
w gramach jest prawie taka sama, obie te czÈstki elementarne majÈ masÚ 1 u. Zauwaĝ,
ĝe masa elektronu jest duĝo mniejsza niĝ masa protonu lub neutronu. Potrzeba prawie
2000 elektronów, ĝeby osiÈgnÈÊ masÚ równÈ masie pojedynczego protonu.
Tabela 4.1 przedstawia równieĝ, jaki ïadunek elektryczny majÈ poszczególne czÈstki
elementarne. Materia moĝe byÊ elektrycznie naïadowana na jeden z dwóch sposobów:
dodatnio lub ujemnie. Proton ma jednÈ jednostkÚ ïadunku dodatniego, elektron
ma jednÈ jednostkÚ ïadunku ujemnego, a neutron nie ma ĝadnego ïadunku — jest
elektrycznie obojÚtny.
Naukowcy odkryli dziÚki obserwacji, ĝe obiekty, które majÈ takie same ïadunki (czy
to dodatnie, czy ujemne), odpychajÈ siÚ, a obiekty o przeciwnych ïadunkach siÚ przyciÈgajÈ.
Atom sam w sobie nie ma ĝadnego ïadunku — jest elektrycznie obojÚtny. (A tak naprawdÚ,
jak wyjaĂniÚ w dalszej czÚĂci tego rozdziaïu oraz póěniej w rozdziale 13., niektóre atomy
mogÈ pozyskiwaÊ lub traciÊ elektrony, a co za tym idzie, równieĝ ïadunek. Atomy
obdarzone ïadunkiem — dodatnim lub ujemnym — nazywamy jonami). Ale jak atom

Rozdziaï 4: CoĂ mniejszego niĝ atom? Struktura atomu
67
moĝe byÊ elektrycznie obojÚtny, skoro zawiera dodatnio naïadowane protony i ujemnie
naïadowane elektrony? To dobre pytanie. Otóĝ atom ma równÈ liczbÚ protonów
i elektronów, a równe ïadunki dodatnie i ujemne siÚ znoszÈ.
Ostatnia kolumna w tabeli 4.1 mówi o lokalizacji kaĝdej z trzech czÈstek elementarnych.
Protony i neutrony znajdujÈ siÚ w jÈdrze — zwartym rdzeniu poĂrodku atomu
— a elektrony sÈ umiejscowione poza jÈdrem (zobacz podrozdziaï „Umiejscowienie
elektronów w atomie” w dalszej czÚĂci tego rozdziaïu).
Scena gïówna, czyli jÈdro
W 1911 roku Ernest Rutherford odkryï, ĝe atomy majÈ jÈdro — Ărodek — w którym
znajdujÈ siÚ protony. Póěniej naukowcy odkryli, ĝe jÈdro zawiera równieĝ neutrony.
JÈdro jest bardzo, bardzo maïe i bardzo, bardzo gÚste w porównaniu z resztÈ atomu.
PrzeciÚtna Ărednica atomu ma okoïo 10
–10
metra (to bardzo maïo!). JÈdra majÈ ĂrednicÚ
okoïo 10
–15
(a to naprawdÚ bardzo maïo!). Gdyby powiÚkszyÊ atom wodoru do wielkoĂci
Superdome w Nowym Orleanie — drugiej co do wielkoĂci hali sportowej na Ăwiecie
— to jego jÈdro miaïoby wielkoĂÊ ziarna grochu.
Protony w atomie sÈ upchane wewnÈtrz jÈdra. Niektórzy czytelnicy mogÈ teraz pomyĂleÊ:
„Przecieĝ kaĝdy proton ma ïadunek dodatni, a takie same ïadunki siÚ odpychajÈ. Skoro
wiÚc wszystkie protony siÚ odpychajÈ, dlaczego jÈdro po prostu siÚ nie rozleci na kawaïki?”.
To wïaĂnie jest moc, Luke. Siïy w jÈdrze przeciwdziaïajÈ temu odpychaniu i utrzymujÈ
jÈdro w caïoĂci. (Fizycy nazywajÈ te siïy jÈdrowym klejem. Czasami jednak ten klej nie
jest wystarczajÈco mocny — wtedy jÈdro rozpada siÚ na kawaïki. Ten proces nazywa siÚ
promieniotwórczoĂciÈ).
JÈdro nie tylko jest bardzo maïe, ale równieĝ zawiera wiÚkszoĂÊ masy atomu. Ze wzglÚdów
praktycznych za masÚ atomu uznaje siÚ sumÚ mas protonów i neutronów. (Ja teĝ
zazwyczaj pomijam masÚ elektronów, chyba ĝe dokonujÚ bardzo, bardzo dokïadnych
obliczeñ).
Suma protonów i neutronów w atomie to jego liczba masowa. Natomiast samÈ liczbÚ
protonów w atomie okreĂlamy mianem liczby atomowej. Chemicy czÚsto stosujÈ
symbolikÚ przedstawionÈ na rysunku 4.1 do opisywania tych liczb dla konkretnych
pierwiastków.
Rysunek 4.1.
Opis
pierwiastka

68
CzÚĂÊ I: Podstawowe pojÚcia chemiczne
Na rysunku 4.1 litera X oznacza symbol chemiczny. Symbole chemiczne poszczególnych
pierwiastków znajdziesz w ukïadzie okresowym. (Zajrzyj do tabeli 4.2, aby poznaÊ listÚ
pierwiastków. Nie zawiera ona wszystkich pierwiastków, a jedynie te, które moĝesz
omawiaÊ na chemii). Litera Z oznacza liczbÚ atomowÈ, czyli liczbÚ protonów w jÈdrze.
Natomiast A oznacza liczbÚ masowÈ, czyli sumÚ protonów i neutronów. Liczba masowa
jest wyraĝona w unitach.
Tabela 4.2. Pierwiastki
Nazwa
Symbol
Liczba atomowa
Liczba masowa
Aktyn
Ac
89
227,028
Ameryk
Am
95
243
Antymon
Sb
51
121,76
Argon
Ar
18
39,948
Arsen
As
33
74,922
Astat
At
85
210
Azot
N
7
14,007
Bar
Ba
56
137,327
Berkel
Bk
97
247
Beryl
Be
4
9,012
Bizmut
Bi
83
208,980
Bohr
Bh
107
262
Bor
B
5
10,811
Brom
Br
35
79,904
Cer
Ce
58
140,115
Cez
Cs
55
132,905
Chlor
Cl
17
35,453
Chrom
Cr
24
51,996
Cyna
Sn
50
118,71
Cynk
Zn
30
65,39
Cyrkon
Zr
40
91,224
Dubn
Db
105
262
Dysproz
Dy
66
162,5
Einstein
Es
99
252
Erb
Er
68
167,26
Europ
Eu
63
151,964
Ferm
Fm
100
257
Fluor
F
9
18,998
Fosfor
P
15
30,974
Frans
Fr
87
223
Gadolin
Gd
64
157,25
Gal
Ga
31
69,723
German
Ge
32
72,61
Glin
Al
13
26,982
Hafn
Hf
72
178,49

Rozdziaï 4: CoĂ mniejszego niĝ atom? Struktura atomu
69
Tabela 4.2. Pierwiastki — ciÈg dalszy
Nazwa
Symbol
Liczba atomowa
Liczba masowa
Has
Hs
108
265
Hel
He
2
4,003
Holm
Ho
67
164,93
Ind
In
49
114,82
Iryd
Ir
77
192,22
Iterb
Yb
70
173,04
Itr
Y
39
88,906
Jod
I
53
126,905
Kadm
Cd
48
112,411
Kaliforn
Cf
98
251
Kiur
Cm
96
247
Kobalt
Co
27
58,933
Krypton
Kr
36
83,8
Krzem
Si
14
28,086
Ksenon
Xe
54
131,29
Lantan
La
57
138,906
Lit
Li
3
6,941
Lorens
Lr
103
262
Lutet
Lu
71
174,967
Magnez
Mg
12
24,305
Mangan
Mn
25
54,938
Meitner
Mt
109
266
Mendelew
Md
101
258
Miedě
Cu
29
63,546
Molibden
Mo
42
95,94
Neodym
Nd
60
144,24
Neon
Ne
10
20,180
Neptun
Np
93
237,048
Nikiel
Ni
28
58,69
Niob
Nb
41
92,906
Nobel
No
102
259
Oïów
Pb
82
207,2
Osm
Os
76
190,23
Pallad
Pd
46
106,42
Platyna
Pt
78
195,08
Pluton
Pu
94
244
Polon
Po
84
209
Potas
K
19
39,098
Prazeodym
Pr
59
140,908
Promet
Pm
61
145
Protaktyn
Pa
91
231,036

70
CzÚĂÊ I: Podstawowe pojÚcia chemiczne
Tabela 4.2. Pierwiastki — ciÈg dalszy
Nazwa
Symbol
Liczba atomowa
Liczba masowa
Rad
Ra
88
226,025
Radon
Rn
86
222
Ren
Re
75
186,207
Rod
Rh
45
102,906
RtÚÊ
Hg
80
200,59
Rubid
Rb
37
85,468
Ruten
Ru
44
101,07
Rutherford
Rf
104
261
Samar
Sm
62
150,36
Seaborg
Sg
106
263
Selen
Se
34
78,96
Siarka
S
16
32,066
Skand
Sc
21
44,956
Sód
Na
11
22,990
Srebro
Ag
47
107,868
Stront
Sr
38
87,62
Tal
Tl
81
204,383
Tantal
Ta
73
180,948
Technet
Tc
43
98
Tellur
Te
52
127,60
Terb
Tb
65
158,925
Tlen
O
8
15,999
Tor
Th
90
242,038
Tul
Tm
69
168,934
Tytan
Ti
22
47,88
Uran
U
92
238,029
Wanad
V
23
50,942
Wapñ
Ca
20
40,078
WÚgiel
C
6
12,011
Wodór
H
1
1,0079
Wolfram
W
74
183,84
Zïoto
Au
79
196,967
¿elazo
Fe
26
55,845
PrzypuĂÊmy, ĝe chcesz przedstawiÊ uran. W ukïadzie okresowym nie ma informacji
na temat jego liczby masowej. Moĝesz tylko wyczytaÊ ĂredniÈ masÚ atomowÈ albo ciÚĝar
atomowy wszystkich postaci danego pierwiastka wystÚpujÈcych w naturze. A zatem
moĝesz przedstawiÊ uran tak, jak na rysunku 4.2.
Rysunek 4.2.
Uran

Rozdziaï 4: CoĂ mniejszego niĝ atom? Struktura atomu
71
Wiesz, ĝe uran ma liczbÚ atomowÈ 92 (liczbÚ protonów) i liczbÚ masowÈ 238 (sumÚ
protonów i neutronów). Dlatego jeĂli chcesz poznaÊ liczbÚ neutronów w uranie,
wystarczy odjÈÊ liczbÚ atomowÈ (92 protony) od liczby masowej (238 protonów
i neutronów).W rezultacie dowiesz siÚ, ĝe uran ma 146 neutronów.
Ile jednak ma elektronów? Poniewaĝ atom jest elektrycznie obojÚtny (nie ma ïadunku
elektrycznego), musi on zawieraÊ takÈ samÈ liczbÚ ïadunków dodatnich i ujemnych
(protonów i elektronów). Wynika stÈd, ĝe atom uranu ma 92 elektrony.
Umiejscowienie elektronów w atomie
W pierwszych modelach atomu elektrony krÚciïy siÚ wokóï jÈdra w doĂÊ przypadkowy
sposób albo tak, jak planety krÈĝÈ wokóï Sïoñca. Gdy jednak naukowcy lepiej poznali
budowÚ atomu, odkryli, ĝe te modele nie sÈ zbyt dokïadne. Dzisiaj uĝywa siÚ dwóch
modeli struktury atomowej: model Bohra i model kwantowo-mechaniczny. Model
Bohra jest prosty i doĂÊ zrozumiaïy. Natomiast model kwantowo-mechaniczny jest
oparty na matematyce i duĝo trudniej jest go zrozumieÊ. Oba modele pomagajÈ nam
w zrozumieniu istoty atomu, wiÚc przedstawiÚ je w nastÚpnych punktach (starajÈc siÚ
ograniczyÊ obliczenia matematyczne do minimum).
Model jest przydatny, poniewaĝ pomaga zrozumieÊ to, co obserwujemy w naturze.
Nie ma nic niezwykïego w objaĂnianiu danego tematu za pomocÈ wiÚcej niĝ jednego
modelu.
Model Bohra
WidziaïeĂ kiedyĂ kolorowe krysztaïy do kominka, które sprawiajÈ, ĝe pïomienie zmieniajÈ
kolor? A moĝe zastanawiaïeĂ siÚ kiedyĂ, skÈd siÚ biorÈ kolory w sztucznych ogniach?
Kolory pochodzÈ z róĝnych pierwiastków. Jeĝeli wrzucisz szczyptÚ soli kuchennej
do ognia (albo dowolnÈ innÈ sól zawierajÈcÈ sód), to otrzymasz ĝóïty kolor pïomienia.
Z kolei sole zawierajÈce miedě barwiÈ pïomieñ na kolor niebieskozielony. A jeĂli
przyjrzysz siÚ pïomieniom przez spektroskop (przyrzÈd, który wykorzystuje pryzmat
to rozszczepiania Ăwiatïa na jego poszczególne czÚĂci), zobaczysz wiele linii róĝnych
kolorów. Te róĝnokolorowe linie tworzÈ razem widmo liniowe.
Niels Bohr, duñski naukowiec, wyjaĂniï to widmo liniowe, gdy pracowaï nad modelem
atomu. W modelu Bohra elektrony atomu znajdujÈ siÚ na orbitach wokóï jÈdra,
reprezentujÈcych róĝne poziomy energii. Bohr uĝyï pojÚcia poziomy energetyczne (albo
powïoki elektronowe) do opisania tych orbit o róĝnej energii. Stwierdziï on, ĝe energia
elektronu jest skwantowana — to oznacza, ĝe elektrony mogÈ siÚ znajdowaÊ na jednym
poziomie energetycznym lub na innym, ale nigdy pomiÚdzy nimi.
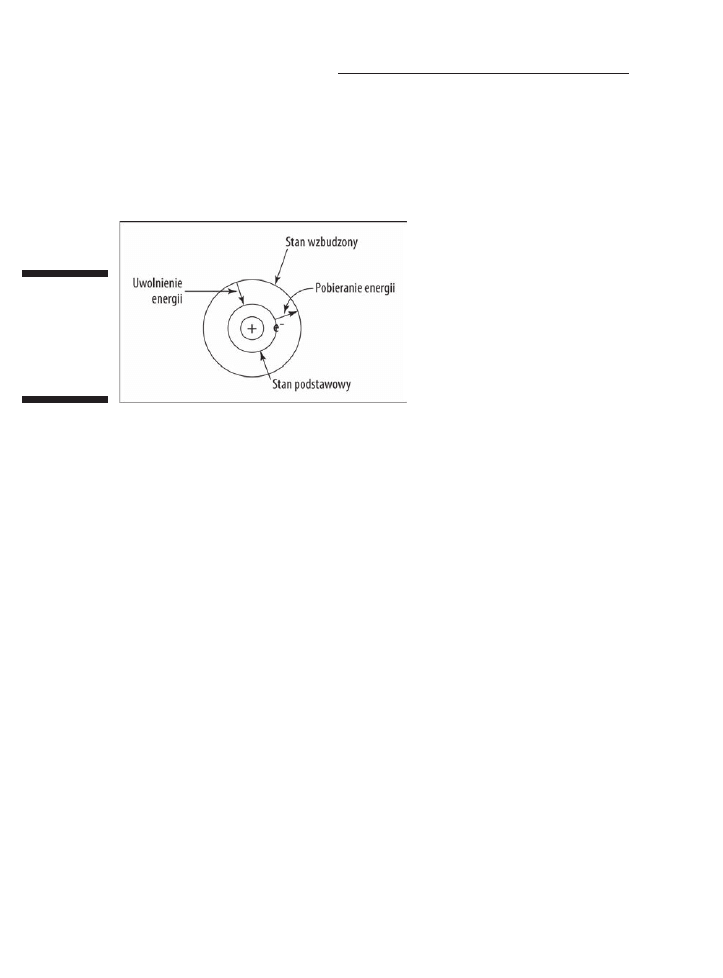
Poziom energetyczny, na jakim normalnie znajduje siÚ elektron, nosi nazwÚ stanu
podstawowego. Elektron moĝe siÚ przenieĂÊ na wyĝszy, mniej stabilny poziom
(lub powïokÚ), pobierajÈc energiÚ. Ten mniej stabilny stan o wyĝszym poziomie
energetycznym nazywamy stanem wzbudzonym.
72
CzÚĂÊ I: Podstawowe pojÚcia chemiczne
Elektron, który znajduje siÚ w stanie wzbudzonym, moĝe powróciÊ do stanu
podstawowego, emitujÈc energiÚ, którÈ pobraï (zobacz rysunek 4.3). W tym miejscu
naleĝy dokïadniej wyjaĂniÊ, czym jest widmo liniowe. Czasami energia uwalniana
przez elektrony zajmuje czÚĂÊ widma fal elektromagnetycznych (jest to pewien zakres
dïugoĂci fali energii), które ludzkie oko odbiera jako widoczne Ăwiatïo. Delikatne
róĝnice w iloĂci energii przekïadajÈ siÚ na róĝne kolory Ăwiatïa.
Rysunek 4.3.
Stan
podstawowy
i stan
wzbudzony
w modelu
Bohra
Bohr odkryï, ĝe im bliĝej jÈdra znajduje siÚ elektron, tym mniej energii on posiada —
i na odwrót: im dalej jest od jÈdra, tym wiÚcej ma energii. Dlatego Bohr ponumerowaï
poziomy energetyczne elektronu. Im wyĝszy poziom, tym dalej elektron siÚ znajduje
od jÈdra — i tym wiÚksza jest jego energia.
Bohr odkryï równieĝ, ĝe na róĝnych poziomach energetycznych mogÈ siÚ znajdowaÊ
róĝne liczby elektronów. Moĝe na przykïad byÊ tak, ĝe poziom 1 mieĂci dwa elektrony,
a poziom 2 mieĂci ich aĝ osiem — i tak dalej.
Model Bohra Ăwietnie siÚ sprawdzaï przy bardzo prostych atomach, takich jak wodór
(który ma jeden elektron). Duĝo gorzej byïo z bardziej zïoĝonymi atomami. Mimo
ĝe model ten jest stosowany do dzisiaj i moĝna go znaleěÊ w wiÚkszoĂci podrÚczników
chemii, duĝo czÚĂciej uĝywa siÚ bardziej skomplikowanego (i zïoĝonego) modelu:
modelu kwantowo-mechanicznego.
Model kwantowo-mechaniczny
Prosty model Bohra nie byï w stanie wyjaĂniÊ zjawisk obserwowanych w bardziej
zïoĝonych atomach, dlatego konieczne byïo stworzenie innego, bardziej zïoĝonego i ĂciĂle
matematycznego modelu struktury atomowej — modelu kwantowo-mechanicznego.
Model ten jest oparty na teorii kwantowej, która mówi, ĝe materia ma równieĝ wïaĂciwoĂci
falowe. Zgodnie z teoriÈ kwantowÈ niemoĝliwe jest poznanie jednoczeĂnie dokïadnej
pozycji elektronu i jego pÚdu (prÚdkoĂci i kierunku). Ten fakt jest znany jako zasada
nieoznaczonoĂci. Dlatego naukowcy musieli zastÈpiÊ orbity Bohra orbitalami (nazywanymi
czasami chmurami elektronowymi). SÈ to okreĂlone punkty przestrzeni, w których
elektron prawdopodobnie siÚ znajduje. Innymi sïowy: pewnoĂÊ zostaïa zastÈpiona przez
prawdopodobieñstwo.
Model kwantowo-mechaniczny budowy atomu wykorzystuje zïoĝone ksztaïty orbitali,
a nie proste okrÈgïe orbity Bohra. OgraniczajÈc obliczenia matematyczne do minimum
(nie ma za co), pokaĝÚ Ci niektóre aspekty tego najnowszego modelu atomu.

Rozdziaï 4: CoĂ mniejszego niĝ atom? Struktura atomu
73
Do opisania wïaĂciwoĂci elektronów i ich orbitali uĝywa siÚ czterech liczb nazywanych
liczbami kwantowymi. Trudno oprzeÊ siÚ wraĝeniu, ĝe ich nazwy to dzieïo jajogïowych
technomaniaków:
9
gïówna liczba kwantowa n,
9
poboczna liczba kwantowa l,
9
magnetyczna liczba kwantowa m
l
,
9
magnetyczna spinowa liczba kwantowa m
s
.
W tabeli 4.3 podsumowujÚ cztery liczby kwantowe. Zestawienie wszystkich czterech
liczb pozwala chemikom teoretykom na stworzenie caïkiem niezïego opisu wïaĂciwoĂci
danego elektronu.
Tabela 4.3. Podsumowanie liczb kwantowych
Nazwa
Symbol
Opis
Moĝliwe wartoĂci
gïówna
n
energia orbitalu
liczby caïkowite dodatnie (1, 2, 3 itd.)
poboczna
l
ksztaït orbitalu
liczby caïkowite od 0 do n – 1
magnetyczna
m
l
ustawienie
liczby caïkowite od –l przez 0 do +l
magnetyczna spinowa
m
s
spin elektronu
+½ lub –½
Gïówna liczba kwantowa n
Gïówna liczba kwantowa n opisuje ĂredniÈ odlegïoĂÊ orbitalu od jÈdra — i energiÚ
elektronu w atomie. Jest to praktycznie to samo co poziomy energetyczne Bohra.
Moĝe ona przyjmowaÊ wartoĂci ze zbioru dodatnich liczb caïkowitych: 1, 2, 3, 4 itd.
Im wiÚksza jest wartoĂÊ n, tym wyĝszy jest poziom energii i tym wiÚkszy jest orbital.
Chemicy czasami nazywajÈ orbitale powïokami elektronowymi.
Poboczna liczba kwantowa l
Poboczna liczba kwantowa l opisuje ksztaït orbitalu, który jest ograniczony przez
gïównÈ liczbÚ kwantowÈ n. Poboczna liczba kwantowa l moĝe przyjmowaÊ wartoĂci
caïkowite od 0 do n – 1. JeĂli na przykïad wartoĂÊ n wynosi 3, to l moĝe mieÊ jednÈ
z trzech wartoĂci: 0, 1 lub 2.
WartoĂÊ l okreĂla ksztaït orbitalu, a wartoĂÊ n okreĂla jego wielkoĂÊ. Orbitale, które
majÈ tÚ samÈ wartoĂÊ n, ale róĝne wartoĂci l, sÈ nazywane podpowïokami. Przypisuje siÚ
im róĝne litery, aby ïatwiej byïo je rozróĝniÊ. Tabela 4.4 przedstawia litery odpowiadajÈce
róĝnym wartoĂciom l.
Gdy chemicy opisujÈ jednÈ konkretnÈ podpowïokÚ w atomie, mogÈ uĝywaÊ zarówno
wartoĂci n, jak i litery odpowiadajÈcej danej podpowïoce — 2p, 3d itd. Zasadniczo wartoĂÊ
podpowïoki 4 jest najwiÚkszÈ wartoĂciÈ potrzebnÈ do opisania okreĂlonej podpowïoki.
Jeĝeli chemik potrzebuje wiÚkszej wartoĂci, moĝe sam okreĂliÊ liczby podpowïok
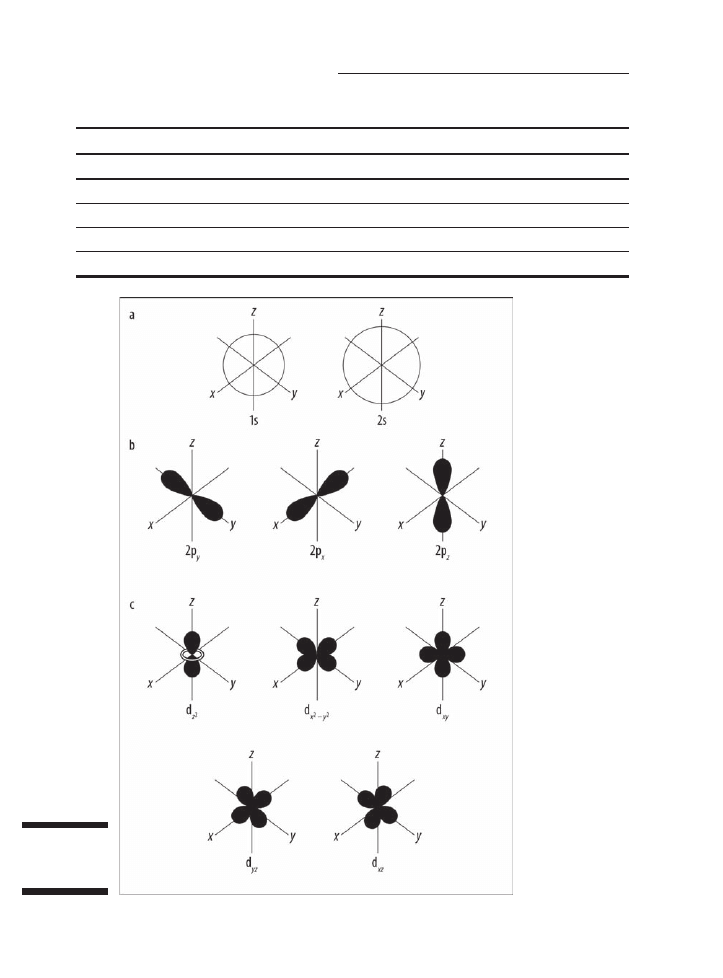
i przypisaÊ im wybrane litery. Rysunek 4.4 przedstawia ksztaïty orbitali s, p i d.
74
CzÚĂÊ I: Podstawowe pojÚcia chemiczne
Tabela 4.4. Litery przypisane poszczególnym podpowïokom
WartoĂÊ l (podpowïoki)
Litera
0
s
1
p
2
d
3
f
4
g
Rysunek 4.4.
Ksztaïty orbitali
s (a), p (b) i d (c)

Rozdziaï 4: CoĂ mniejszego niĝ atom? Struktura atomu
75
Na rysunku 4.4a widaÊ dwa orbitale s — jeden dla poziomu energetycznego 1 (1s)
i drugi dla poziomu energetycznego 2 (2s). Orbitale s majÈ ksztaït kulisty, a w Ărodku
znajduje siÚ jÈdro. Zauwaĝ, ĝe orbital 2s ma wiÚkszÈ ĂrednicÚ niĝ orbital 1s. W duĝych
atomach orbital 1s jest zagnieĝdĝony wewnÈtrz 2s, podobnie jak 2p jest zagnieĝdĝony
wewnÈtrz 3p.
Rysunek 4.4b przedstawia ksztaïty orbitali p, a rysunek 4.4c — orbitali d. Zauwaĝ,
ĝe ksztaïty te stajÈ siÚ coraz bardziej zïoĝone.
Magnetyczna liczba kwantowa m
l
Magnetyczna liczba kwantowa m
l
opisuje orientacjÚ przestrzennÈ róĝnych orbitali.
WartoĂÊ m
l
zaleĝy od wartoĂci l. WartoĂci, jakie moĝe przyjmowaÊ m
l
, to liczby caïkowite
od –l przez 0 do +1. Jeĝeli na przykïad wartoĂÊ l = 1 (orbital p — zajrzyj do tabeli 4.4),
moĝesz podaÊ trzy wartoĂci dla m
l
: –1, 0 i +1. To oznacza, ĝe dla danego orbitalu
istniejÈ trzy róĝne podpowïoki p. Podpowïoki majÈ takÈ samÈ energiÚ, ale róĝni je
orientacja przestrzenna.
Rysunek 4.4b przedstawia orientacjÚ przestrzennÈ orbitali p. ZwróÊ uwagÚ, ĝe trzy
orbitale p, które odpowiadajÈ wartoĂciom m
l
–1, 0 i +1, sÈ uïoĝone wzdïuĝ osi x, y i z.
Magnetyczna spinowa liczba kwantowa m
s
Czwarta i ostatnia (wiem, ĝe CiÚ to cieszy — to trochÚ ciÚĝki temat, nie?) liczba
kwantowa to magnetyczna spinowa liczba kwantowa m
s
. Opisuje ona kierunek,
w którym elektron obraca siÚ w polu magnetycznym — albo zgodny, albo niezgodny
z ruchem wskazówek zegara. Liczba m
s
moĝe przyjmowaÊ tylko dwie wartoĂci: +½
albo –½. Kaĝda podpowïoka moĝe mieÊ tylko dwa elektrony, jeden o spinie +½,
a drugi o spinie –½.
Co otrzymasz, jak zbierzesz te wszystkie informacje razem?
(PiÚknÈ tabelkÚ)
Wiem, wiem. Zagadnienia zwiÈzane z liczbami kwantowymi wywoïujÈ Ălinotok
u naukowców pasjonatów, a u normalnych ludzi — odruch ziewania. JeĂli jednak
kiedyĂ zepsuje Ci siÚ telewizor i nagle bÚdziesz mieÊ trochÚ wolnego czasu, zajrzyj
do tabeli 4.5. Znajdziesz w niej liczby kwantowe kaĝdego elektronu na dwóch
pierwszych poziomach energetycznych (ojej, ojej, ojej).
Tabela 4.5. Liczby kwantowe dla dwóch pierwszych poziomów energetycznych
n
l
oznaczenie podpowïoki
ml
ms
1
0
1s
0
+½, –½
2
0
2s
0
+½, –½
1
2p
–1
+½, –½
0
+½, –½
+1
+½, –½

76
CzÚĂÊ I: Podstawowe pojÚcia chemiczne
Tabela 4.5 pokazuje, ĝe poziom energetyczny 1 (n = 1) ma tylko jeden orbital s.
Nie ma on orbitalu p, poniewaĝ wartoĂÊ l dla 1 (orbitalu p) nie jest dozwolona.
ZwróÊ uwagÚ, ĝe orbital 1s moĝe mieÊ tylko dwa elektrony (o wartoĂci m
s
= +½ i –½).
To samo dotyczy wszystkich innych orbitali s, zarówno 1s, jak i 5s — kaĝdy z nich
moĝe pomieĂciÊ maksymalnie dwa elektrony.
Gdy przejdziesz z poziomu energetycznego 1 do poziomu energetycznego 2 (n = 2),
obecne mogÈ byÊ oba orbitale: s i p. JeĂli wypiszesz liczby kwantowe dla poziomu
energetycznego 3, zobaczysz orbitale s, p i d. Za kaĝdym razem, gdy bÚdziesz przechodziÊ
na wyĝszy gïówny poziom energetyczny, bÚdziesz dodawaÊ jeden typ orbitalu.
Zauwaĝ równieĝ, ĝe orbital 2p ma trzy podpowïoki (m
l
ʊ zobacz rysunek 4.4b) i ĝe
kaĝda z nich mieĂci maksymalnie dwa elektrony. Trzy podpowïoki 2p mogÈ pomieĂciÊ
maksymalnie szeĂÊ elektronów.
Gïówne poziomy energetyczne róĝniÈ siÚ energiÈ (poziom energetyczny 2 ma wiÚkszÈ
energiÚ niĝ poziom 1). Podobnie w ramach jednego poziomu energetycznego róĝne
orbitale majÈ róĝnÈ energiÚ. Na poziomie energetycznym 2 obecny jest zarówno orbital
s, jak i p. Jednak 2s ma nieco mniejszÈ energiÚ niĝ 2p. Trzy podpowïoki orbitalu 2p
majÈ tÚ samÈ energiÚ. I podobnie piÚÊ podpowïok orbitali d (wróÊ do rysunku 4.4c)
ma takÈ samÈ energiÚ.
Konfiguracja elektronowa
Dla chemików liczby kwantowe sÈ przydatne podczas obserwacji reakcji chemicznych
i wiÈzañ (a sÈ to rzeczy, które wielu chemików lubi badaÊ). IstniejÈ jednak dwa inne
sposoby przedstawiania elektronów, które sÈ ïatwiejsze i przydatniejsze.
9
diagramy poziomów energetycznych,
9
konfiguracje elektronowe.
Chemicy (i studenci chemii) uĝywajÈ obu tych metod, aby pokazaÊ, który poziom
energetyczny, podpowïoka i orbital sÈ zajmowane przez elektrony w danym atomie.
Chemicy (i osoby uczÈce siÚ chemii) odwoïujÈ siÚ do tych informacji, gdy chcÈ przewidzieÊ,
jaki rodzaj wiÈzania wytworzy siÚ w danym pierwiastku i które dokïadnie elektrony
zostanÈ w nim wykorzystane. Te sposoby przedstawienia pomagajÈ równieĝ stwierdziÊ,
dlaczego okreĂlone pierwiastki zachowujÈ siÚ w podobny sposób.
W tym podrozdziale pokaĝÚ, jak uĝywaÊ diagramu poziomów energetycznych i jak pisaÊ
konfiguracje elektronowe.
Badanie diagramu poziomów energetycznych
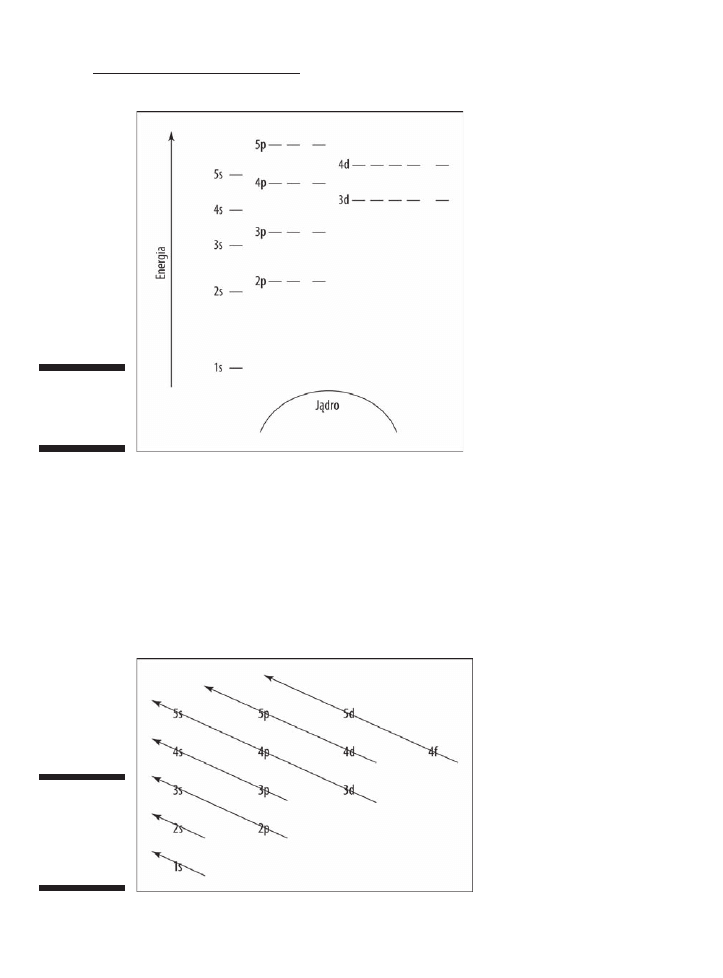
Rysunek 4.5 to pusty diagram poziomów energetycznych, którego moĝesz uĝyÊ
do przedstawienia elektronów w dowolnym atomie. Nie widaÊ na nim wszystkich
znanych orbitali i podpowïok. Ale na tym diagramie powinieneĂ byÊ w stanie zrobiÊ
wszystko, czego potrzebujesz. (JeĂli nie masz pojÚcia, czym sÈ orbitale i podpowïoki,
a takĝe co oznaczajÈ te wszystkie liczby i litery, zajrzyj do podrozdziaïu „Model
kwantowo-mechaniczny”. Przyjemna lektura, zarÚczam).
Rozdziaï 4: CoĂ mniejszego niĝ atom? Struktura atomu
77
Rysunek 4.5.
Diagram
poziomów
energetycznych
Przedstawiïem orbitale w postaci kresek — na kaĝdej z nich moĝesz umieĂciÊ
maksymalnie dwa elektrony. Orbital 1s znajduje siÚ najbliĝej jÈdra i ma najniĝszy
poziom energii. Jest to równieĝ jedyny orbital o poziomie energetycznym 1 (zajrzyj
do tabeli 4.5). Na poziomie energetycznym 2 znajdujÈ siÚ orbitale s i p, przy czym 2s
ma mniejszÈ energiÚ niĝ 2p. Trzy podpowïoki 2p sÈ przedstawione w postaci trzech
kresek. MajÈ taki sam poziom energii. Na rysunku widaÊ takĝe poziomy energetyczne
3, 4 i 5. ZwróÊ uwagÚ, ĝe 4s ma mniejszÈ energiÚ niĝ 3d. Moĝe to nie byÊ zgodne z tym,
co podpowiada Ci intuicja, ale to wïaĂnie zaobserwowano w naturze. Zastanów siÚ,
dlaczego. A skoro juĝ o tym mowa, rysunek 4.6 przedstawia kolejnoĂÊ zapeïniania orbitali.
Uïatwi Ci on zapamiÚtanie kolejnoĂci, w której orbitale wypeïniajÈ puste poziomy
energetyczne.
Rysunek 4.6.
Wykres
przedstawiajÈcy
kolejnoĂÊ
zapeïniania
orbitali

78
CzÚĂÊ I: Podstawowe pojÚcia chemiczne
Gdy korzystasz z diagramu poziomów energetycznych (rysunek 4.5), musisz pamiÚtaÊ
o dwóch rzeczach:
9
Elektrony najpierw wypeïniajÈ najniĝsze puste poziomy energetyczne.
9
Gdy na danym poziomie energetycznym znajduje siÚ wiÚcej niĝ jedna podpowïoka,
tak jak na poziomie 3p albo 4d (zobacz rysunek 4.5), to podpowïoki sÈ zapeïniane
po jednym elektronie, aĝ wszystkie bÚdÈ miaïy po jednym elektronie. NastÚpne
elektrony doïÈczajÈ do tych, które juĝ siÚ znajdujÈ na podpowïokach, tworzÈc
z nimi pary. Ta reguïa nosi nazwÚ reguïy Hunda.
PrzypuĂÊmy, ĝe chcesz narysowaÊ diagram poziomów energetycznych dla tlenu.
ZaglÈdasz do ukïadu okresowego albo do listy pierwiastków i sprawdzasz liczbÚ
atomowÈ tlenu: 8. Ta liczba oznacza, ĝe tlen ma 8 protonów w jÈdrze i 8 elektronów,
dlatego na diagramie umieszczasz 8 elektronów. Moĝesz je przedstawiÊ za pomocÈ
strzaïek (zobacz rysunek 4.7). Zauwaĝ, ĝe gdy na jednym orbitalu znajdujÈ siÚ dwa
elektrony, jedna strzaïka jest skierowana w górÚ, a druga w dóï. (To ustawienie nazywa
siÚ parowaniem elektronów. Odwoïuje siÚ do wartoĂci m
s
: +½ i –½ — zobacz punkt
„Magnetyczna spinowa liczba kwantowa m
s
” wczeĂniej w tym rozdziale).
Pierwszy elektron zajmuje orbital 1s, wypeïniajÈc najniĝszy poziom energetyczny.
Drugi paruje siÚ z pierwszym. Elektrony 3 i 4 parujÈ siÚ na nastÚpnym najniĝszym
wolnym orbitalu, 2s. Elektron 5 zajmuje jednÈ z podpowïok 2p (nie, nie ma znaczenia
którÈ — wszystkie majÈ takÈ samÈ energiÚ), a elektrony 6 i 7 zajmujÈ kolejne puste
orbitale 2p (zgodnie z reguïÈ Hunda). Ostatni elektron ïÈczy siÚ w parÚ z jednym
z elektronów zajmujÈcych podpowïoki 2p (i znów bez znaczenia jest to, z którym
z nich siÚ poïÈczy). Rysunek 4.7 pokazuje gotowy diagram poziomów energetycznych
dla tlenu.
Rysunek 4.7.
Diagram
poziomów
energetycznych
dla tlenu

Rozdziaï 4: CoĂ mniejszego niĝ atom? Struktura atomu
79
Rzut oka na konfiguracje elektronowe
Diagramy poziomów energetycznych sÈ przydatne, gdy chcemy lepiej zrozumieÊ
reakcje chemiczne i wiÈzania, ale niewygodnie siÚ na nich pracuje. Czy nie byïoby miïo,
gdyby istniaï jakiĂ inny sposób przedstawienia, który zawieraïaby dokïadnie te same
informacje, lecz w duĝo prostszej i Ăcisïej formie? Otóĝ istnieje. Nosi on nazwÚ
konfiguracji elektronowej.
Konfiguracja elektronowa tlenu to 1s
2
2s
2
2p
4
. Porównaj ten zapis z diagramem poziomów
energetycznych dla tlenu z rysunku 4.7. Czy taki opis elektronu nie zajmuje duĝo
mniej miejsca? Moĝesz opisaÊ konfiguracjÚ elektronu, korzystajÈc z diagramu poziomów
energetycznych. Pierwsze dwa elektrony w atomie tlenu wypeïniajÈ orbital 1s,
co w konfiguracji elektronowej przedstawiamy jako 1s
2
. Liczba 1 oznacza poziom
energetyczny, s reprezentuje typ orbitalu, a indeks górny 2 oznacza liczbÚ elektronów
na tym orbitalu. NastÚpne dwa elektrony wypeïniajÈ orbital 2s, dlatego piszemy 2s
2
.
I wreszcie cztery ostatnie elektrony na orbitalu 2p zapisujemy pod postaciÈ 2p
4
.
Jeĝeli poïÈczymy to wszystko razem, otrzymamy 1s
2
2s
2
2p
4
.
Niektórzy uĝywajÈ rozszerzonej formy, która umoĝliwia pokazanie, w jaki sposób
poszczególne orbitale p
x
, p
y
i p
z
sÈ uïoĝone wzdïuĝ osi x, y i z, a takĝe podanie liczby
elektronów na kaĝdym orbitalu. (W podpunkcie „Magnetyczna liczba kwantowa m
l
”
wyjaĂniïem orientacjÚ orbitali w przestrzeni). Rozszerzona postaÊ sprawdza siÚ wtedy,
gdy chcemy mieÊ wglÈd we wszystkie szczegóïy, ale w wiÚkszoĂci przypadków nie
potrzebujemy ich do tego, aby przedstawiÊ okreĂlone wiÈzanie, dlatego nie bÚdÚ jej
tutaj przedstawiaï.
Suma liczb w indeksach górnych to liczba atomowa albo liczba elektronów w atomie.
Oto dwie konfiguracje elektronowe, które moĝesz spróbowaÊ przeksztaïciÊ na diagramy
poziomów energetycznych:
Chlor (Cl): 1s
2
2s
2
2p
6
3 s
2
3p
5
¿elazo (Fe): 1s
2
2s
2
2p
6
3 s
2
3p
6
4s
2
3d
6
Wiesz juĝ, jak uĝywaÊ diagramu poziomów energetycznych do przedstawiania
konfiguracji elektronowych. Jeĝeli trochÚ poÊwiczysz pisanie takich konfiguracji,
bÚdziesz mógï ominÈÊ etap rysowania diagramu poziomów energetycznych i od razu
pisaÊ konfiguracjÚ elektronowÈ, pamiÚtajÈc o liczbie elektronów i kolejnoĂci
zapeïniania orbitali. Zawsze warto szukaÊ rozwiÈzañ, które pomogÈ nam oszczÚdziÊ
trochÚ czasu, prawda?
¿ycie na krawÚdzi, czyli elektrony walencyjne
Gdy chemicy badajÈ reakcje chemiczne, analizujÈ przechodzenie lub uwspólnianie
elektronów. Elektrony, które sÈ sïabiej przyciÈgane przez jÈdro — te na najwyĝszym
poziomie energetycznym — sÈ pozyskiwane, tracone lub wspóïdzielone.
Elektrony sÈ naïadowane ujemnie, a jÈdro ma ïadunek dodatni ze wzglÚdu na obecnoĂÊ
protonów. Protony przyciÈgajÈ elektrony i utrzymujÈ je na miejscu, ale im dalej znajdujÈ
siÚ te elektrony, tym mniejsza jest siïa przyciÈgania.
80
CzÚĂÊ I: Podstawowe pojÚcia chemiczne
Elektrony znajdujÈce siÚ na najwyĝszym poziomie energetycznym sÈ zwykle nazywane
elektronami walencyjnymi. Chemicy analizujÈ zachowanie tylko tych elektronów, które
znajdujÈ siÚ na orbitalach s i p poziomu energetycznego zapeïnionego elektrami
walencyjnymi. W konfiguracji elektronowej tlenu1s
2
2s
2
2p
4
pierwszy poziom energetyczny
jest zapeïniony, na poziomie drugim zaĂ dwa elektrony znajdujÈ siÚ na orbitalu 2s, a cztery
pozostaïe na orbitalu 2p — i te szeĂÊ elektronów to wïaĂnie elektrony walencyjne.
To one sÈ oddawane, przyjmowane albo uwspólniane.
ZnajomoĂÊ liczby elektronów walencyjnych w danym atomie pomaga przewidzieÊ,
jak bÚdzie on reagowaï. W rozdziale 5., który zawiera omówienie ukïadu okresowego,
pokaĝÚ Ci szybki sposób na obliczenie liczby elektronów walencyjnych bez koniecznoĂci
rozpisywania konfiguracji elektronowej atomu.
Izotopy i jony
Atomy danego pierwiastka majÈ identycznÈ liczbÚ protonów i elektronów, ale mogÈ
róĝniÊ siÚ liczbÈ neutronów. Jeĝeli majÈ róĝnÈ liczbÚ neutronów, to nazywamy je
izotopami. Gdy elektrycznie obojÚtny atom przyjmuje lub oddaje elektrony, to powstaïy
w rezultacie naïadowany atom jest nazywany jonem. W nastÚpnych punktach omówiÚ
szerzej zagadnienia izotopów i jonów.
Izotopy
Wodór jest pierwiastkiem powszechnie wystÚpujÈcym na Ziemi. Jego liczba atomowa
to 1, gdyĝ jego jÈdro zawiera jeden proton. Atom wodoru ma równieĝ jeden elektron.
Poniewaĝ ma takÈ samÈ liczbÚ protonów i elektronów — podobnie jak wszystkie inne
atomy — jest on elektrycznie obojÚtny (ïadunek dodatni i ujemny wzajemnie siÚ znoszÈ).
WiÚkszoĂÊ atomów wodoru wystÚpujÈcych na Ziemi nie zawiera ĝadnych neutronów.
Moĝesz uĝyÊ symboliki z rysunku 4.2 do opisania atomów wodoru, które nie zawierajÈ
neutronów, tak jak pokazujÚ na rysunku 4.8a.
Rysunek 4.8.
Izotopy wodoru:
niezawierajÈcy
neutronów (a),
zawierajÈcy jeden
neutron
(b) i zawierajÈcy
dwa neutrony (c)
Jednak Ărednio jeden na 6 tysiÚcy atomów wodoru zawiera w swoim jÈdrze neutron.
Takie atomy nadal sÈ atomami wodoru, majÈ bowiem jeden proton i jeden elektron;
po prostu majÈ jeszcze neutron, którego wiÚkszoĂÊ atomów wodoru nie posiada.
Te atomy sÈ nazywane izotopami. Rysunek 4.8b przedstawia izotop wodoru, powszechnie
nazywany deuterem, który zawiera jeden neutron. Poniewaĝ zawiera on jeden proton
i jeden neutron, jego liczba masowa wynosi 2.

Rozdziaï 4: CoĂ mniejszego niĝ atom? Struktura atomu
81
Istnieje nawet taki izotop wodoru, który zawiera dwa neutrony. Nosi on nazwÚ trytu
i zostaï przedstawiony na rysunku 4.8c. Na Ziemi wystÚpuje tylko w niewielkich iloĂciach,
ale moĝna go z ïatwoĂciÈ stworzyÊ.
A teraz spójrz jeszcze raz na rysunek 4.8. Pod nazwÈ kaĝdego symbolu znajduje siÚ inna,
alternatywna reprezentacja danego izotopu: symbol pierwiastka, ïÈcznik, a potem liczba
masowa.
ByÊ moĝe zastanawiasz siÚ teraz: „JeĂli przeprowadzam obliczenia uwzglÚdniajÈce masÚ
atomowÈ wodoru, którego izotopu mam uĝyÊ?”. W takich sytuacjach bierzemy pod
uwagÚ ĂredniÈ masÚ wszystkich naturalnie wystÚpujÈcych izotopów wodoru. Nie jest
to jednak zwykïa Ărednia. (Musisz uwzglÚdniÊ to, ĝe istnieje duĝo wiÚcej H-1 niĝ H-2,
natomiast H-3 w ogóle nie naleĝy braÊ pod uwagÚ, poniewaĝ wystÚpuje w naturze zbyt
rzadko). Uĝywamy Ăredniej masy atomowej (Ăredniej waĝonej), która uwzglÚdnia liczebnoĂÊ
naturalnie wystÚpujÈcych izotopów. To dlatego masa atomowa wodoru w tabeli 4.2 nie
jest liczbÈ caïkowitÈ i wynosi 1,0079 u. Ta liczba pokazuje, ĝe na Ăwiecie istnieje duĝo
wiÚcej H-1 niĝ H-2.
Srebro istnieje w postaci dwóch izotopów. 51,830 procent caïego srebra na Ăwiecie to
Ag-107 o masie 106,905 u. Pozostaïe 48,170 procent to Ag-109 o masie 108,905 u.
Jaka bÚdzie Ărednia masa atomowa?
Aby obliczyÊ ĂredniÈ waĝonÈ, naleĝy pomnoĝyÊ udziaï procentowy (wyraĝony w liczbie
dziesiÚtnej) kaĝdego izotopu przez jego masÚ, a nastÚpnie dodaÊ do siebie oba wyniki.
Oto równanie dla naszego przykïadu ze srebrem:
(0,51830 · 106,905 u) + (0,48170 · 108,905 u) = 107,87 u
Wiele pierwiastków ma kilka izotopów. WiÚcej na ten temat przeczytasz w rozdziale 20.
Jony
Wielokrotnie powtarzam w tej ksiÈĝce, ĝe poniewaĝ atom sam w sobie jest elektrycznie
obojÚtny, liczba jego protonów i elektronów jest równa. W niektórych jednak przypadkach
atom moĝe uzyskaÊ ïadunek elektryczny. Na przykïad w zwiÈzku chlorku sodu (soli
kuchennej) atom sodu ma ïadunek dodatni, a atom chloru — ujemny. Atomy (albo ich
grupy), które nie majÈ równej liczby protonów i elektronów, to jony.
Elektrycznie obojÚtny atom sodu ma 11 protonów i 11 elektronów, co oznacza, ĝe ma
11 ïadunków dodatnich i 11 ujemnych. Ogólnie rzecz biorÈc, atom sodu jest elektrycznie
obojÚtny, a jego symbol to Na. Ale jon sodu zawiera jeden ïadunek dodatni wiÚcej, niĝ
ma ïadunków ujemnych, dlatego zapisujemy go jako Na
+
(znak
+
oznacza jego dodatni
ïadunek elektryczny).
Ta nierówna liczba ïadunków dodatnich i ujemnych moĝe mieÊ dwie przyczyny: atom
moĝe pozyskaÊ proton (ïadunek dodatni) albo straciÊ elektron (ïadunek ujemny). Który
z tych procesów jest bardziej prawdopodobny? Cóĝ, najprostsza wskazówka jest taka,
ĝe zyskanie lub utracenie elektronu jest ïatwe, natomiast zyskanie lub utracenie protonu
jest bardzo trudne. Dlatego wiÚkszoĂÊ atomów staje siÚ jonami na skutek przyjÚcia
lub utracenia elektronu.

82
CzÚĂÊ I: Podstawowe pojÚcia chemiczne
Jeĝeli jon powstaje na skutek utraty elektronu, to ma wiÚcej protonów niĝ elektronów
— czyli ma wiÚkszy ïadunek dodatni. Jony dodatnie nazywamy kationami. Ich dodatni
ïadunek oznaczamy za pomocÈ maïego znaku plusa w indeksie górnym za symbolem
atomu (na przykïad Na
+
). JeĂli atom utraci dwa elektrony zamiast jednego, to w rezultacie
powstaje równieĝ kation, ale o wiÚkszym ïadunku dodatnim (a dokïadniej —
o dwukrotnie wiÚkszym, niĝ gdyby atom utraciï tylko jeden elektron). W tym przypadku
przed znakiem plusa podajemy liczbÚ utraconych elektronów (na przykïad Mg
2+
dla
kationu, który utraciï dwa elektrony, albo Al
3+
dla glinu, który utraciï trzy elektrony).
JeĂli jon powstaje na skutek przyjÚcia elektronu, liczba jego elektronów jest wiÚksza niĝ
liczba protonów, dlatego jon ma ïadunek ujemny. Jony naïadowane ujemnie nazywamy
anionami i oznaczamy je maïym znakiem minusa w indeksie górnym (
–
). Jeĝeli atom
chloru przyjmie jeden elektron, staje siÚ on jonem chloru, poniewaĝ ma nierównÈ
liczbÚ protonów i elektronów. A dokïadnie mówiÈc: staje siÚ anionem, czyli jonem
naïadowanym ujemnie. Zapisujemy go jako Cl
–
. (JeĂli interesuje CiÚ tematyka jonów,
kationów i anionów, zajrzyj do rozdziaïu 13., w którym znajdziesz szersze omówienie
tych zagadnieñ. To, co napisaïem tutaj, to tylko zwiastun tego, co CiÚ czeka póěniej).
¿eby nieco bardziej rozbudziÊ TwojÈ ciekawoĂÊ, chciaïbym przedstawiÊ Ci kilka
ciekawostek na temat jonów:
9
Moĝna pisaÊ konfiguracje elektronowe i rysowaÊ diagramy poziomów
energetycznych dla jonów. Elektrycznie obojÚtny atom sodu (11 protonów) ma
nastÚpujÈcÈ konfiguracjÚ elektronowÈ: 1s
2
2s
2
2p
6
3s
1
. Kation sodu jest pozbawiony
jednego elektronu — elektronu walencyjnego, który znajduje siÚ najdalej od jÈdra
(w tym przypadku jest to elektron z orbitalu 3s). Konfiguracja elektronowa Na
+
to 1s
2
2s
2
2p
6
.
9
JeĂli dwie czÈstki chemiczne majÈ takÈ samÈ konfiguracjÚ elektronowÈ, to mówimy,
ĝe sÈ izoelektronowe. Na przykïad konfiguracja elektronowa jonu chloru (Cl
–
),
1s
2
2s
2
2p
6
3s
2
3p
6
, jest taka sama jak konfiguracja elektrycznie obojÚtnego atomu
argonu. A zatem anion chloru i argon sÈ izoelektronowe. Zrozumienie chemii
przypomina czasami naukÚ nowego jÚzyka, prawda?
9
W tym podrozdziale mówimy o jonach jednoatomowych. IstniejÈ jednak równieĝ
jony wieloatomowe. Jon amonowy NH
4
+
to jon wieloatomowy, a dokïadnie mówiÈc:
kation wieloatomowy. Jon azotanowy, NO
3
–
, takĝe jest jonem wieloatomowym,
a konkretnie anionem wieloatomowym.
9
Jony wystÚpujÈ powszechnie w klasie zwiÈzków nazywanych solami albo krysztaïami
jonowymi. Gdy sole zostanÈ stopione albo rozpuszczone w wodzie, powstajÈ
roztwory, które przewodzÈ prÈd elektryczny. Substancja przewodzÈca prÈd
elektryczny po stopieniu albo rozpuszczeniu w wodzie nosi nazwÚ elektrolitu.
Sole sÈ elektrolitami, ale jak siÚ przekonasz, czytajÈc rozdziaï 11., nie wszystkie
elektrolity sÈ solami. Sól stoïowa — chlorek sodu — to dobry przykïad elektrolitu.
Natomiast gdy cukier stoïowy (sacharoza) zostanie rozpuszczony w wodzie,
powstanie roztwór, który nie przewodzi prÈdu elektrycznego. Dlatego sacharoza
jest nieelektrolitem. To, czy dana substancja jest elektrolitem czy nieelektrolitem,
pomaga w poznaniu rodzaju wiÈzañ wystÚpujÈcych w danym zwiÈzku chemicznym.
JeĂli substancja jest elektrolitem, to prawdopodobnie wystÚpujÈ w niej wiÈzania
jonowe (zobacz rozdziaï 13.). Jeĝeli zaĂ jest nieelektrolitem, to prawdopodobnie
wystÚpujÈ w niej wiÈzania kowalencyjne (zobacz rozdziaï 14.).

Skorowidz
1,2-dwuchloroetylen, 322
A
aktywnoĂÊ metali, 121
amfoteryczna woda, 177
amoniak, 124, 133, 323
amplituda, 188
analiza, 120
analiza substancji, 35
aniony, 82, 199
aniony jednoatomowe, 200
aspartam, 308
atmosfera, 259
atom, 65, 187, 286
Avogadro Amedeo, 309
azot, 320
B
badanie nasycenia, 140
barometr, 98
bilansowanie
produkcji amoniaku, 124
reakcji chemicznych, 124
reakcji jÈdrowej, 287
biochemia, 33
biochemiczne zapotrzebowanie tlenu, 281
biotechnologia, 33
bïona póïprzepuszczalna, 151
Bohr Niels, 309
bomba kalorymetryczna, 160
bomby atomowe, 296
brom, 203
budowa pierĂcieniowa, 307
bufory, 183
BZT, 280, 281
C
chemia, 27
analityczna, 33
czysta, 34
fizyczna, 33
jÈdrowa, 285
nieorganiczna, 33
organiczna, 33
stosowana, 34
Ărodowiskowa, 257
chlor, 196, 198, 322
chmura, 249
chmura elektronowa, 194
chrom, 276
ciaïa staïe, 52
amorficzne, 252
krystaliczne, 252
ciecze, 52
ciepïo, 156
parowania, 275
reakcji, 162, 164
sublimacji, 167
tworzenia, 164
ciĂnienie, 148
atmosferyczne, 98
gazu, 99
osmotyczne, 151
cyfry znaczÈce, 47, 48
cykl obiegu wody, 272
czas poïowicznego rozpadu, 291, 293
czÈsteczka, 210, 213, 227
polarna, 229
wody, 216
czÈsteczki
leworÚczne, 306
praworÚczne, 306

338
Chemia dla bystrzaków
czÈstka
alfa, 288
beta, 290
czÈstki
elementarne, 65
gazu, 96, 97
czÚstotliwoĂÊ, 188
D
Dalton John, 310
datowanie izotopowe, 294
diagram
energetyczny, 118
orbitali molekularnych, 236
poziomów energetycznych, 76
dipol, 229
dïugoĂÊ fali, 188
dodawanie, 41, 48
dokïadnoĂÊ, 43
drobnoustroje chorobotwórcze, 277
drugi stopieñ oczyszczania, 281
dwupierwiastkowe zwiÈzki kowalencyjne, 213
dwutlenek wÚgla, 213
dyfuzja, 112
dysocjacja, 171, 173
dziaïanie metody naukowej, 29
dzielenie, 42, 48
dĝul, 63, 156
E
ebulioskopia, 148
efekt
cieplarniany, 262
Tyndalla, 153
efektywny ïadunek jÈdra, 240
elektrofiltry, 268
elektrolity, 206
elektron, 71
elektron walencyjny, 79, 90, 210
elektroujemnoĂÊ, 220, 221
elektrownie jÈdrowe, 297
elektrycznoĂÊ, 297
emisja
gamma, 290
pozytonu, 290
energia, 51, 60
jonizacji, 242, 244
jonizacji pierwiastka, 242
kinetyczna, 60
kinetyczna czÈstek, 62
potencjalna, 61
promieniowania, 189
entalpia, 161, 166
molowa krzepniÚcia, 166
molowa parowania, 166
etylen, 320
F
fale promieniowania elektromagnetycznego, 188
Faraday Michael, 310
fenoloftaleina, 179
freony, 262, 263
funkcja falowa, 193
G
gaz, 53, 95
doskonaïy, 97, 107
elektronowy, 212
szlachetny, 90, 197
gazy
ciĂnienie a objÚtoĂÊ, 101
ciĂnienie a temperatura, 104
temperatura a objÚtoĂÊ, 102
geometria
czÈsteczek, 227, 230
par elektronowych, 230, 231
gÚstoĂÊ, 58, 59, 305
grupy, 86, 89
guma, 306
H
hemoliza, 152
hermetyzacja reakcji, 301
hipoteza de Broglie’a, 192
hybrydyzacja, 227, 233, 234
I
identyfikacja substancji, 58
izotopy, 80, 286

Skorowidz
339
J
jÈdro, 67, 187
jednostka
BTU, 157
ciĂnienia, 40
dïugoĂci, 38
energii, 40, 156
masy, 39
objÚtoĂci, 39
stÚĝenia, 144
temperatury, 39
zanieczyszczenia, 147
jon hydroniowy, 173
jonizacja, 174
jony, 81, 195, 197, 241
wieloatomowe, 202
zïoĝone, 202, 203
K
kalkulator, 42
kaloria, 63, 156
kalorymetr cieczowy, 159
kalorymetria, 158
karteczki samoprzylepne, 308
kationy, 199
kationy jednoatomowe, 200
klasyfikacja materii, 56
klasyfikowanie pierwiastków, 239
koloidy, 153
komórka
elementarna prosta, 252
powierzchniowo centrowana, 252
przestrzennie centrowana, 252
konfiguracje elektronowe pierwiastków, 76,
90–92, 244
kontrolowanie pH, 183
konwersja jednostek, 44
krioskopia, 149
krysztaïy
jonowe, 253
kowalencyjne, 253
metaliczne, 253
molekularne, 253
krzepniÚcie, 166
ksztaït, 74
ksztaïty czÈsteczek, 228, 230, 232
kwas, 169, 170
fosforowy, 322
siarkowy, 319
ĝoïÈdkowy, 183
kwasowoĂÊ roztworu, 180
kwaĂne deszcze, 184, 266, 277
L
lakmus, 178
lepkoĂÊ, 250
liczba
atomowa, 79, 83, 86
Avogadra, 130
kwantowa, 73
gïówna, 73, 193
magnetyczna, 75, 193
magnetyczna spinowa, 75, 193
poboczna, 73, 193
liczby
liczone, 47
pomiarowe, 47
lotne zwiÈzki organiczne, 278
lód, 274
M
magnez, 203
manometr, 99
masa
atomowa, 86
krytyczna, 295
materia, 51
materia skondensowana, 247
materiaïy promieniotwórcze, 294
mechanika
falowa, 192
kwantowa, 192
membrana, 151
Mendelejew Dmitrij, 311
metale, 86, 87
metale alkaliczne, 90
metaloidy, 88
metoda
Habera i Boscha, 124
naukowa, 29
otrzymywania amoniaku, 133
VSEPR, 227, 230
wiÈzañ walencyjnych, 227
zamiany jednostek, 44

340
Chemia dla bystrzaków
miejsce aktywne, 117
mierzenie
ciĂnienia atmosferycznego, 98
ciĂnienia gazu, 99
gÚstoĂci, 58
mieszaniny, 55
jednorodne, 57
niejednorodne, 57
sïabych kwasów i zasad, 183
mnoĝenie, 42, 48
mocne
kwasy, 173, 174
zasady, 174
model
atomu Bohra, 71, 191
kwantowo-mechaniczny, 72, 192
mol, 129, 130
mole w reakcjach chemicznych, 133
molowa pojemnoĂÊ cieplna, 158
moment dipolowy, 229
N
napiÚcie powierzchniowe, 250
nasycenie, 140
naturalny rozpad promieniotwórczy, 288
nauka, 28
nazewnictwo
dwupierwiastkowych zwiÈzków
kowalencyjnych, 213
zwiÈzków jonowych, 205
nieelektrolity, 206
niemetale, 86, 88
nieoznaczonoĂÊ Heisenberga, 192
normalna temperatura, 106
normalne ciĂnienie, 106
notacja naukowa, 41
O
objÚtoĂÊ ciaï staïych, 305
obkurczanie krwinek, 152
obliczanie
czasu poïowicznego rozpadu, 292
reakcji ïañcuchowych, 295
wzorów empirycznych, 132
obliczenia chemiczne, 37
obserwowanie reakcji, 155
oczyszczanie, 280, 282
oczyszczanie wody pitnej, 282
oddziaïywanie
dipol – dipol, 224
miÚdzyczÈsteczkowe, 223, 247, 250
odejmowanie, 41, 48
odkrycia chemiczne, 305
odkrycie promieniotwórczoĂci, 307
odrastanie wïosów, 308
okres, 86, 89
okresowoĂÊ, 83
okreĂlanie
wzoru, 203, 204
ciepïa reakcji, 162
oïów, 276
opanowanie energii, 300
orbital, 77
atomowy, 236
molekularny
antywiÈĝÈcy, 235
wiÈĝÈcy, 235
P
papierek lakmusowy, 178
parowanie, 272
Pauling Linus, 311
pH popularnych substancji, 182
pierwiastek, 56, 67–70
pierwszy stopieñ oczyszczania, 280
pluton, 299
pïuczki, 268
podejĂcie
makroskopowe, 34
mikroskopowe, 34
podnoszenie do potÚgi, 42
podpowïoki, 74, 76
pojemnoĂÊ cieplna, 157, 251, 274
molowa, 158
wïaĂciwa, 158
polarnoĂÊ, 228
poïÈczenie jonów z dipolami, 248
poïÈczone prawa gazowe, 105
pomiar energii, 61
porady, 313–317
porównanie
wiÈzañ kowalencyjnych, 211
liczb, 47
postaÊ wykïadnicza liczby, 41
powietrze, 259

Skorowidz
341
powinowactwo elektronowe, 244
poziom pH, 178
poziomy energetyczne, 76
póïmetale, 86–89
prawa
gazowe, 100
gazowe poïÈczone, 105
prawdopodobieñstwo, 193
prawo
Archimedesa, 59
Avogadra, 106
Boyle’a-Mariotte’a, 100
Charles’a, 102
Daltona, 110
Gay-Lussaca, 103
Grahama, 111
Hessa, 163
precyzja, 43
prÚĝnoĂÊ pary, 148
produkty, 115
produkty przejĂciowe, 118
promienie
atomowe, 240
jonowe, 241
promieniotwórczoĂÊ, 67, 286, 307
promieniowanie, 302
promieniowanie elektromagnetyczne, 187
propylen, 321
próbka, 291
przedrostki ukïadu SI, 38
przemiany fazowe, 166
przewidywanie
ksztaïtu czÈsteczki, 231
polarnoĂci, 229
przyciÈganie typu dipol – dipol, 248
R
radon, 302
reakcje
analizy, 120
chemiczne, 115
egzotermiczne, 118, 155
endotermiczne, 119, 155
Habera i Boscha, 133
jÈdrowe, 287
kontrolowane, 297
ïañcuchowe, 295
miÚdzy kwasami a zasadami, 176
spalania, 123
syntezy, 120
termojÈdrowe, 300
utleniania i redukcji, 124
wymiany podwójnej, 122
wymiany pojedynczej, 121
zobojÚtniania, 123, 171
reaktory powielajÈce, 299
redukcja, 124
reguïa
Hunda, 78
krzyĝowa, 204, 205
oktetu, 197, 215
rodzaje
lakmusu, 178
oddziaïywañ miÚdzyczÈsteczkowych, 247
reakcji, 120
rozmieszczenie pierwiastków, 86
rozpad
alfa, 288
beta, 289
promieniotwórczy, 286, 288, 291
rozpoznawanie kwasów i zasad, 178
rozpuszczalnik, 139, 275
rozpuszczalnoĂÊ, 140
rozpuszczalnoĂÊ zwiÈzków jonowych, 123
rozszczepienie jÈdra, 295
roztwory, 139
buforowe, 183
nasycone, 140
równania chemiczne, 116
równanie
Schrödingera, 192
stanu gazu doskonaïego, 107, 109
termochemiczne, 162
van der Waalsa, 109
rtÚÊ, 276
Rutherford Ernest, 311
S
sacharyna, 308
Seaborg Glenn, 312
SI, système international, 37
siïy
dyspersyjne, 224
Londona, 224

342
Chemia dla bystrzaków
skala
Celsjusza, 62
Fahrenheita, 62
Kelvina, 62, 97
pH, 181
Skïodowska-Curie Maria, 310
skraplanie, 272
sïabe
kwasy, 173, 174
zasady, 173, 176
sïownik, 325
smog
fotochemiczny, 264
londyñski, 264
sód, 196, 197
sól kuchenna, 195
spalanie, 123
spalanie butanu, 126
spektroskopia, 187, 189
stabilnoĂÊ konfiguracji elektronowych, 243
stan
równowagi dla wody, 176
wzbudzony, 191
standardowe
ciepïo tworzenia, 164
entalpie tworzenia, 164
stechiometria reakcji, 135
stÚĝenie roztworu
molalne, 146
molowe, 144
procentowe, 141
objÚtoĂciowe, 143
wagowe, 142
wagowo-objÚtoĂciowe, 142
stopieñ utlenienia, 201
stosowanie
metody naukowej, 31
reguïy krzyĝowej, 204
stratosfera, 260
struktura
atomu, 65
lodu, 225, 274
struktury Lewisa, 228
sublimacja, 166
substancja, 55, 56
substancja rozpuszczona, 139
substraty, 115
substraty ograniczajÈce, 137
syntetyza substancji, 35
synteza, 120
sztuczny barwnik, 306
¥
Ăledzenie wody, 272
Ărednia
energia kinetyczna, 97
masa atomowa, 81
Ăwiatïo widzialne, 187
T
techiometria, 109
technologia, 28
teflon, 307
temperatura, 62, 97, 251
krzepniÚcia, 54, 150
wrzenia, 54, 148, 150
teoria, 35
Arrheniusa, 171
Brønsteda-Lowry’ego, 172, 176
kinetyczno-molekularna, 95
kwantowa, 187
orbitali molekularnych, 235
Plancka, 189
VSEPR, 231
wiÈzañ walencyjnych, 233
zderzeñ, 117
termochemia, 155
tlen, 321
transmutacja, 287
troposfera, 260
trujÈce materiaïy, 278
trzeci stopieñ oczyszczania, 282
tworzenie
wiÈzañ, 198
wiÈzañ tymczasowych, 249
U
ukïad
jednostek miar SI, 37
okresowy pierwiastków, 83, 239, 241
utlenianie, 124
uwspólnianie par elektronowych, 220

Skorowidz
343
V
VSEPR, 230
W
wady elektrowni jÈdrowych, 297
walencyjny poziom energetyczny, 197
warstwa ozonowa, 261
wiÈzania
chemiczne, 61
jonowe, 195, 198, 209, 222
koordynacyjne, 172
kowalencyjne, 199, 209, 210
niespolaryzowane, 220
spolaryzowane, 220, 222
metaliczne, 212
wielokrotne, 212
wodorowe, 224, 249, 273
widma fal elektromagnetycznych, 189
absorpcyjne, 190
emisyjne, 190
liniowe, 190
wïaĂciwa pojemnoĂÊ cieplna, 158
wïaĂciwoĂci
chemiczne, 57
cieczy, 249
czÈsteczek, 228
fal, 188
fizyczne, 57
fizyczne gazów, 100
koligatywne roztworów, 139, 147
kwasów i zasad, 169
substancji, 35
Ăwiatïa, 187
wody, 223
woda, 177, 223, 255, 271, 273
wodorotlenek sodu, 323
wodór, 210
wskaěniki, 178
wspóïczynniki stechiometryczne, 116
wulkanizacja, 306
wychwyt elektronu, 290
wydajnoĂÊ
reakcji chemicznej, 137
rzeczywista, 137
teoretyczna, 137
wykorzystywanie moli, 130, 131
wykres fazowy, 253
wymiana
podwójna, 122
pojedyncza, 121
wytwarzanie plutonu, 299
wzór
chemiczny, 203
czÈsteczkowy, 215
elektronowy kropkowy, 210, 218, 219
empiryczny, 132, 215
Lewisa, 218, 232
rzeczywisty, 215
strukturalny, 216, 219
Z
zamiana jednostek, 44
zanieczyszczenia
metalami ciÚĝkimi, 276
termiczne, 279
z gospodarstw rolnych, 279
zanieczyszczenie
powietrza, 259
wody, 271
zaokrÈglanie liczb, 49
zasada rozpuszczalnoĂci, 140
zasady, 169, 171
zastosowanie
praw gazowych, 109
prawa Hessa, 163
zderzenie proste, 117
zjawiska kapilarne, 251
zmiana
energii, 155
energii termicznej, 156
entalpii, 162
stanu skupienia, 53
zuĝywanie tlenu, 280
zwiÈzki
amfoteryczne, 184
chemiczne, 56
elektrycznie obojÚtne, 203
jonowe, 203
½
ěródïa zanieczyszczeñ wód, 275


Wyszukiwarka
Podobne podstrony:
Chemia dla bystrzakow Wydanie II chemb2
Chemia dla bystrzakow Wydanie II chemb2
Chemia dla bystrzakow Wydanie II chemb2
Chemia dla bystrzakow Wydanie II chemb2
Chemia dla bystrzakow Wydanie II
Chemia dla bystrzakow Wydanie II
Elektronika dla bystrzakow Wydanie II
Instrumenty klawiszowe dla bystrzakow Wydanie II pianby
Grillowanie dla bystrzakow Wydanie II grilby
Grillowanie dla bystrzakow Wydanie II
Pilhofer M Teoria muzyki dla bystrzaków Wydanie II
Elektronika dla bystrzakow Wydanie II
Zarzadzanie dla bystrzakow Wydanie II zazbys
Efektywne zarzadzanie czasem dla bystrzakow Wydanie II
Zarzadzanie dla bystrzakow Wydanie II
Instrumenty klawiszowe dla bystrzakow Wydanie II pianby
więcej podobnych podstron

