
CHARAKTERYSTYKA SKROBI WYIZOLOWANEJ
Z ZIEMNIAKÓW I OCENA EFEKTYWNOŚCI
HYDROLIZY KWASOWEJ I ENZYMATYCZNEJ
KLEIKU SKROBIOWEGO
CHEMIA ŻYWNOŚCI
II ROK WNoŻiŻ
STUDIA NIESTACJONARNE
Autorzy opracowania:
dr D.Piasecka-Kwiatkowska
dr B. Stasińska

2
Skrobia jest roślinną substancją zapasową, odkładającą się szczególnie obficie w
nasionach (ziarniaki zbóż, groch, fasola, bób) i bulwach (ziemniaki) w postaci ziaren
skrobiowych o wielkości od 2 do 150 µm. Praktycznie wszystkie produkty mączne i kasze są
źródłem skrobi. Stanowi ona ponad połowę węglowodanów spożywanych przez człowieka.
Pod względem chemicznym skrobia składa się z reszt α-D-glukopiranozy powiązanych
ze sobą wiązaniami α-1,4-glikozydowymi. Tylko w punktach rozgałęzień występują wiązania
α-1,6-glikozydowe. Jest cukrem nieredukującym, zbudowanym z dwóch różnych strukturalnie
składników: amylozy i amylopektyny.
A
MYLOZA
stanowi na ogół 14-27% suchej masy skrobi, ma strukturę liniową, składa
się
z
licznych
(250-1000)
reszt
D-glukopiranozy,
połączonych
wiązaniami
α-1,4-glikozydowymi (ryc.1). Podstawową jednostką strukturalną jest maltoza, a pomiędzy
jednostkami maltozowymi występuje także wiązanie α-1,4-glikozydowe. Cząsteczka amylozy
nie jest rozgałęziona, lecz tworzy łańcuch skręcony śrubowo, przy czym na jeden skręt spirali
przypada 6 reszt glukozy. Strukturę przestrzenną amylozy stabilizują wiązania wodorowe
formujące się między wolnymi grupami OH. Kształt cząsteczki amylozy ma wpływ na jej
reaktywność zarówno chemiczną, jak i biochemiczną. Amyloza daje z jodem intensywne
niebieskie zabarwienie. Istota tego zjawiska polega na zagęszczaniu cząsteczek jodu w
wolnych przestrzeniach ograniczonych przez cząsteczki glukozy. Taki związek wykazuje
zmienione właściwości fizyczne (silną absorpcję światła).
Ryc.1. Fragment wzoru amylozy
A
MYLOPEKTYNA
jest rozgałęzioną formą skrobi. Do łańcucha głównego
zbudowanego z reszt glukozowych powiązanych wiązaniem α-1,4-glikozydowym są
przyłączone wiązaniem α-1,6-glikozydowym łańcuchy boczne, które mogą się również
rozgałęziać. W cząsteczce amylopektyny na jedno wiązanie α-1,6-glikozydowe przypada
około trzydzieści wiązań α-1,4-glikozydowych. Ze względu na liczne rozgałęzienia
amylopektyna przedstawia sferyczny, nieuporządkowany kłębek, w którym jedynie
zewnętrzne łańcuchy mogą wykazywać strukturę spiralną. Dlatego amylopektyna daje z
jodem zabarwienie fioletowe.
O
O
OH
OH
CH
2
OH
1
4
O
O
OH
OH
CH
2
OH
1
4

3
Ryc.2. Fragment wzoru amylopektyny
Obydwa składniki skrobi tworzą strukturę nadcząsteczkową, w której występują drobne
krystaliczne micele oraz struktury amorficzne powiązane mostkami wodorowymi.
Właściwości skrobi stanowią wypadkową właściwości obu jej składników i ich wzajemnego
stosunku ilościowego. Oprócz rdzenia węglowodanowego skrobia zawiera niewielkie ilości
białka (do 0,5%), lipidów (ok.0,9%) oraz fosforu (0,05-0,25%) i wiele innych składników
mineralnych. Zakłada się ponadto, że strukturalnym składnikiem skrobi jest woda. Jest ona
związana za pomocą wiązań wodorowych z grupami OH reszt glukozy.
Skrobia jest nierozpuszczalna w wodzie oraz w większości rozpuszczalników
organicznych. W zimnej wodzie ziarna skrobiowe pęcznieją i w określonej dla każdego
rodzaju skrobi temperaturze kleikują, tzn. tracą strukturę ziarnistą. Zachodzi wtedy
nieodwracalna dezintegracja makrocząsteczek i powstaje lepki kleik. Skrobia skleikowana
ulega retrogradacji. Zjawisko to polega na wytworzeniu pomiędzy sąsiednimi cząsteczkami
amylozy mostków wodorowych i powstaniu struktury krystalicznej. Skrobia taka jest odporna
na działanie enzymów i dlatego retrogradacja może być w pewnych przypadkach zjawiskiem
niekorzystnym. Retrogradacja skrobi jest również przyczyną czerstwienia pieczywa oraz
zmian struktury skrobiowych artykułów żywnościowych. Zjawisku temu sprzyja duża
zawartość amylozy w skrobi oraz obniżona do ok.0
o
C temperatura.
Ogrzewanie skrobi do temperatury 180-200
o
C prowadzi do depolimeryzacji
(dekstrynizacji) cząsteczki skrobiowej oraz do wytworzenia się w dekstrynach rozgałęzień
(np. powstają wiązania β-1,6-glikozydowe). Powstaje wówczas furfural i wiele substancji
lotnych, m.in. kwas octowy i mrówkowy, aldehyd octowy i inne.
W zależności od tego, czy skrobia znajduje się w postaci natywnej, tzn. w postaci
ziaren, czy też w formie rozpuszczonej (kleik skrobiowy), a więc częściowo fizycznie
zdezintegrowanej, różne są jej właściwości chemiczne. Skrobia natywna jest mniej reaktywna,
np. nie działają na nią (lub działają bardzo słabo) enzymy amylolityczne powodujące
hydrolizę skrobi.
O
O
O
O
CH
2
1
4
O
O
O
O
CH
2
O
1
4
O
O
O
O
CH
2
O
1
4
2
3
5
6

4
H
YDROLIZA SKROBI
H
YDROLIZA KWASOWA
Skrobia pod wpływem kwasów ulega stopniowej hydrolizie przez stadium dekstryn do
maltozy i małej ilości glukozy. Pośrednimi produktami są: amylodekstryny, erytrodekstryny,
achro- i maltodekstryny oraz maltoza. W miarę hydrolizy wzrastają stopniowo właściwości
redukujące.
Ryc. 3. Schemat hydrolizy kwasowej skrobi
H
YDROLIZA ENZYMATYCZNA
Hydroliza enzymatyczna skrobi przebiega przy udziale enzymów amylolitycznych. Jest
procesem, który znalazł szerokie zastosowanie w różnych gałęziach przemysłu spożywczego,
np. piekarskim, gorzelniczym, browarniczym. Amylazy należą do klasy hydrolaz, a więc
enzymów rozkładających wiązania glikozydowe przy równoczesnym włączeniu cząsteczki
wody. Enzymy amylolityczne występują w przyrodzie dość często, zarówno u roślin i
zwierząt, jak i w komórkach drobnoustrojów. Do najważniejszych enzymów należą: α- i β-
amylaza oraz α-glukozydaza.
α
α
α
α-amylaza, tzw. amylaza dekstrynująca, jest endoglikozydazą. Hydrolizuje wewnętrzne
wiązania α-1,4-glikozydowe, dając maltozę, maltotriozę (maltodekstrynę) i α-dekstrynę
(achrodekstrynę). W początkowej fazie hydrolizy α-amylaza powoduje szybki rozkład wiązań
α-1,4-glikozydowych długiego łańcucha amylozy do drobnocząsteczkowych dekstryn
(zawierających 6-7 reszt glukozy), które stopniowo podlegają dalszej degradacji do tri- i
disachrydów (maltoza) oraz w nieznacznym stopniu do glukozy. Enzym ten atakuje wiązania
glikozydowe amylozy znajdujące się w środku łańcucha, rozkładając go na coraz mniejsze
fragmenty. W wyniku działania α-amylazy na amylopektynę powstają różne rozgałęzione
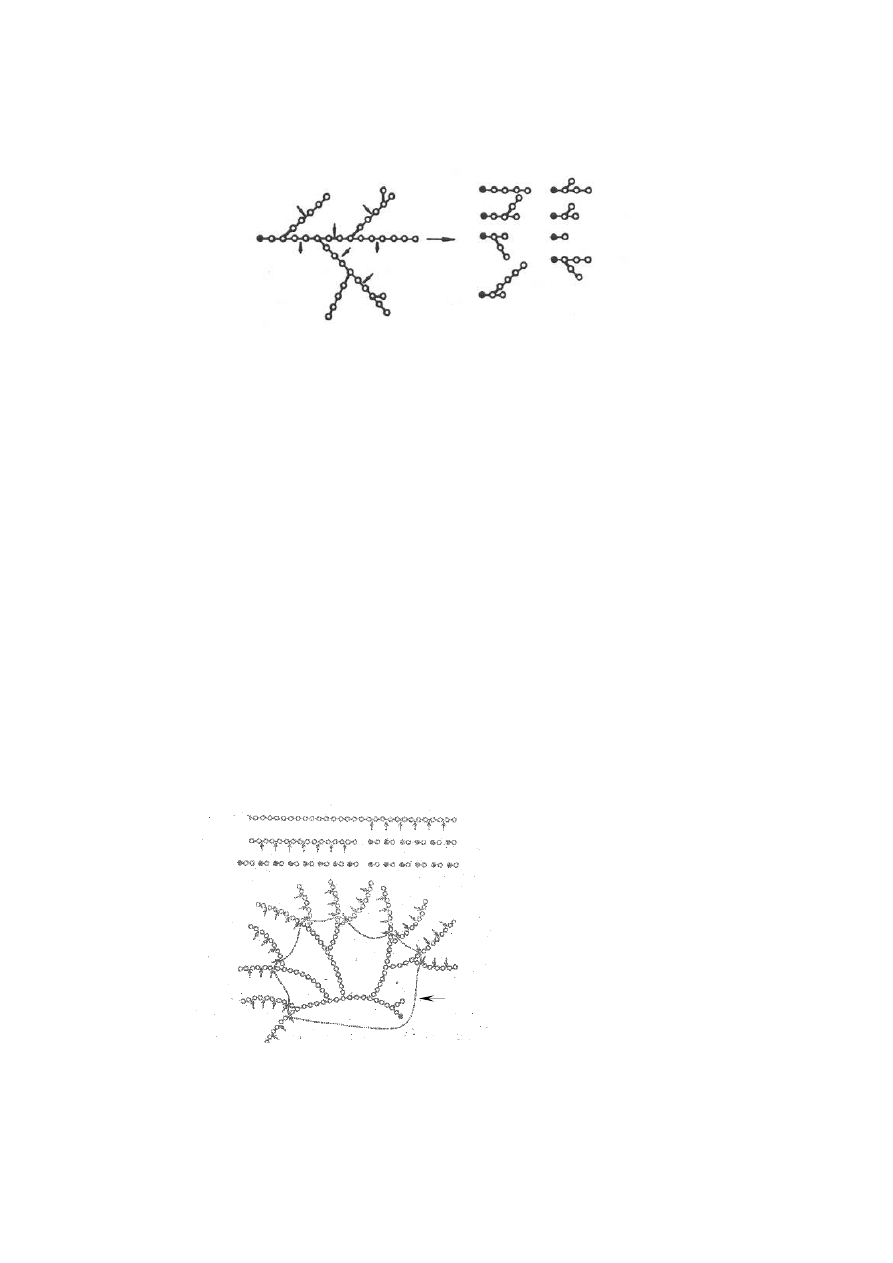
5
łańcuchy, zawierające kilka reszt glukozy. Na skutek działania α-amylazy spada lepkość
kleiku skrobiowego.
Ryc.4. Schemat działania α
α
α
α-amylaz.
β
β
β
β-amylaza, tzw. amylaza cukrująca, jest egzoglikozydazą. Hydrolizuje skrobię do
maltozy poprzez kolejne odłączanie dwóch reszt glukozy od nieredukujących końców
łańcucha
glikozydowego,
tworząc
maltozę.
Enzym
ten
nie
rozkłada
wiązań
α-1,6-glikozydowych, dlatego amylozę rozkłada całkowicie (ryc.5a), a amylopektynę tylko w
ok. 65%, pozostawiając „rdzeń” amylopektynowy, tzw. dekstrynę graniczną, zawierającą
wszystkie rozgałęzienia (ryc.5b). Enzym ten rozkłada więc tylko boczne łańcuchy
amylopektyny do maltozy, pozostawiając środkową część cząsteczki w postaci dużej
dekstryny granicznej. Dalsza hydroliza tej dekstryny jest możliwa tylko dzięki łącznemu
działaniu obu amylaz: α-amylaza rozcinając od środka nierozłożoną część amylopektyny na
rozgałęzione fragmenty, powoduje jednocześnie uwolnienie się nowych odcinków łańcuchów
prostych, które mogą być wówczas rozłożone przez β-amylazę do maltozy. Dwucukier
maltoza jest następnie rozszczepiany przez α-glukozydazę do glukozy. Na skutek działania
β-amylazy wzrasta redukcyjność kleiku skrobiowego.
Ryc.5.
Schemat działania β-amylaz: a) na amylozę b) na amylopektynę
dekstryna graniczna
a)
b)

6
R
EAKCJE SKROBI Z JODEM
Obecność skrobi w próbie można stwierdzić na podstawie próby jodowej. W obecności
skrobi występuje charakterystyczne granatowe zabarwienie. Amyloza daje z jodem
zabarwienie niebieskie, zaś amylopektyna fioletowe. Amyloza o konfiguracji liniowej nie jest
zdolna do tworzenia kompleksu z jodem. Musi istnieć konfiguracja heliksu, aby cząsteczki
jodu mogły się w niej regularnie ułożyć. Jedna cząsteczka jodu przypada na sześć reszt
glukozylowych, czyli na jeden skręt heliksu. Ogrzewanie kleiku skrobiowego powoduje
rozkręcanie się heliksu, co jest przyczyną zanikania niebieskiego zabarwienia z jodem.
Obserwując zmiany zabarwienia w trakcie wykonywania próby jodowej, można określić
stopień zhydrolizowania skrobi. W obecności amylodekstryn zabarwienie przechodzi w
fioletowe, erytrodekstryn w czerwone, achrodekstryn w pomarańczowe, natomiast
maltodekstryny, maltoza oraz glukoza nie dają z jodem barwy.
Na tworzenie barwnych kompleksów z jodem istotny wpływ ma pH środowiska. Skrobia
nie tworzy z jodem zabarwienia w środowisku zasadowym, gdyż jod przereaguje z zasadą
według równania:
I
2
+ 2NaOH NaIO + H
2
O + NaI
W środowisku kwasowym reakcja przebiega w kierunku odwrotnym:
NaIO + NaI + 2HCl 2NaCl + I
2
+ H
2
O

7
C
EL ĆWICZENIA
1. Izolacja skrobi z ziemniaków.
2. Badanie właściwości skrobi.
3. Porównanie efektywności hydrolizy kwasowej i enzymatycznej kleiku
skrobiowego.
WYKONANIE ĆWICZENIA
1. I
ZOLACJA SKROBI Z ZIEMNIAKÓW
Obrane i umyte ziemniaki (ok. 3 sztuki) utrzeć na miazgę i dodać równą objętość wody,
zmieszać i przesączyć przez kilka warstw gazy. Przesącz rozcieńczyć 2-3 krotnie wodą i
zdekantować. Zlać ciecz znad osadu, skrobię zawiesić w etanolu i powtórnie zdekantować.
Następnie skrobię wysuszyć na powietrzu.
2.
B
ADANIE ROZPUSZCZALNOŚCI SKROBI
Do około 1g skrobi dodać kilka cm
3
wody, dobrze wymieszać i przesączyć przez bibułę.
Do przesączu wprowadzić kroplę roztworu I w KI. Zinterpretować.
3.
P
RZYGOTOWANIE KLEIKU SKROBIOWEGO
W zlewce zagotować około 75 cm
3
wody. W drugiej zlewce sporządzić jednolitą
zawiesinę 1g skrobi w 15 cm
3
zimnej wody, którą wlać do wrzącej wody ciągle mieszając.
Zlewkę po zawiesinie przepłukać 10 cm
3
wody i dodać do wrzącego roztworu. Gotować do
całkowitego rozpuszczenia. Otrzymany opalizujący roztwór skrobi będzie wykorzystywany do
dalszych doświadczeń.
4.
W
YSALANIE SKROBI
Do 3 cm
3
kleiku skrobiowego dodać 5 cm
3
nasyconego roztworu (NH
4
)
2
SO
4
. Po 5 min
przesączyć i do przesączu dodać kroplę I w KI. Brak zabarwienia świadczy o całkowitym
wytrąceniu skrobi z roztworu. Zinterpretować.

8
5.
W
PŁYW WARUNKÓW ŚRODOWISKA NA PRZEBIEG REAKCJI SKROBI Z JODEM
• T
EMPERATURA
Do 2 cm
3
kleiku skrobiowego dodać kroplę roztworu I w KI. Powstaje niebieskie
zabarwienie. Probówkę ogrzać. Niebieskie zabarwienie znika. Po ochłodzeniu pod bieżącą
wodą zabarwienie powraca. Zinterpretować.
• pH
ŚRODOWISKA REAKCJI
Do 2 cm
3
kleiku skrobiowego dodać kilka kropli 1 M roztworu NaOH i kroplę roztworu I
w KI. Zabarwienie nie powstaje. Po zakwaszeniu kwasem solnym barwa pojawia się.
Zinterpretować.
6. B
ADANIE EFEKTYWNOŚCI HYDROLIZY KLEIKU SKROBIOWEGO
Przed rozpoczęciem hydrolizy w statywie umieścić dwa szeregi probówek, w każdym po
5 sztuk. Jeden szereg posłuży do wykonania próby jodowej, a drugi do wykonania reakcji
Benedicta. Do wszystkich probówek pierwszego szeregu dodać po 1 cm
3
0,002% roztworu I
w KI. Do pierwszej probówki w każdym szeregu dodać 1 cm
3
kleiku skrobiowego. Po
rozpoczęciu hydrolizy, co 3 minuty przenosić po 1 cm
3
hydrolizatu do kolejnych probówek
pierwszego i drugiego szeregu. W pierwszym szeregu obserwować zanik barwy. W drugim
szeregu probówek hydrolizat doprowadzić natychmiast roztworem NaOH do pH ok.8, dodać
3 cm
3
odczynnika Benedicta i wstawić do wrzącej łaźni wodnej na 5 min. Obserwować
powstający pomarańczowy osad Cu
2
O.
Wyniki zestawić w tabeli i zinterpretować.
H
YDROLIZA KLEIKU SKROBIOWEGO
•
KWASOWA
Do 13 cm
3
roztworu kleiku skrobiowego dodać 2 cm
3
stęż. H
2
SO
4
. Po zmieszaniu pobrać
próbkę do badania efektywności hydrolizy, a następnie ogrzewać we wrzącej łaźni wodnej. Co
3 minuty pobierać do analizy hydrolizat (patrz badanie efektywności hydrolizy).
•
ENZYMATYCZNA
Do 13 cm
3
roztworu kleiku skrobiowego dodać 2 cm
3
roztworu enzymu. Bezpośrednio po
zmieszaniu pobrać próbkę do badania efektywności hydrolizy, a następnie inkubować w łaźni
wodnej o temperaturze 37
o
C. Co 3 minuty pobierać do analizy hydrolizat (patrz badanie
efektywności hydrolizy).
Wyszukiwarka
Podobne podstrony:
więcej podobnych podstron