Metody oznaczania stężenia glukozy:
Glukozę można oznaczać ilościowo stosując metody chemiczne oparte na jej właściwościach redukujących lub metody enzymatyczne polegające na wykorzystaniu enzymów specyficznie przekształcających cząsteczkę glukozy.
Jedna z metod enzymatycznego oznaczania glukozy wykorzystuje heksokinazę i dehydrogenazę glukozo-6-fosforanu:
Heksokinaza
dehydrogenaza Glc-6-P
Glukoza
Glukozo-6-P
6-P-glukonolakton
ATP
ADP
NADP+
NADPH
Ilość
powstającego
NADPH,
proporcjonalna
do
stężenia
glukozy,
mierzona
jest
spektrofotometrycznie wykorzystując różnice w widmie absorpcyjnym formy utlenionej i zredukowanej koenzymu przy λ=340 nm.
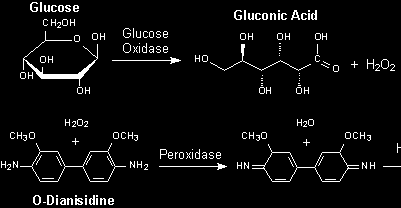
Oznaczanie glukozy w płynach ustrojowych metodą enzymatyczną z wykorzystaniem oksydazy glukozowej (Gox) opiera się na dwóch reakcjach:
Gox
glukoza + O2
g
l
ukoni
a
n
+ H2O2
peroksydaza
H2O2 + XH2
2 H2O + X
(barwny)
Metoda ta jest stosowana m.in. w testach paskowych - pozwalających na szybkie określenie poziomu glukozy we krwi. Ilościowe oznaczanie stężenia glukozy we krwi za pomocą glukometrów jest także oparte na reakcji katalizowanej przez oksydazę glukozową.
Ilościowe oznaczanie glukozy stosowane podczas ćwiczeń:
ETAP I - Utlenianie glukozy przez oksydazę glukozową (GOx) do kwasu glukonowego z równoczesną redukcją tlenu do nadtlenku wodoru.
ETAP II - Redukcja nadtlenku wodoru katalizowana przez peroksydazę chrzanową (HRP) w obecności o-dianizydyny (3,3'-dimetoksybenzydyny)* z wytworzeniem barwnego produktu (utleniona o-dianizydyna).
I.
Glukoza
Kwas glukonowy
Oksydaza
glukozowa
H O
2
2
O
2
H O
2
2
II.
Peroksydza
Oxidized o-dianisidine
o-dianizydyna
o-dianizydyna
zredukowana
utleniona
Powstający produkt jest barwny (żółto-pomarańczowy) i może być oznaczany spektrofotometrycznie przy długości fali 420 nm. Wartość absorbancji jest proporcjonalna do stężenia glukozy.
* Należy zachować szczególną ostrożność gdyż O-dianizydyna jest substancją niebezpieczną.
Wykazano jaj kancerogenne własności dla szczurów i chomików – nie stwierdzono takiego działania u ludzi (należy stosować rękawiczki).
Zestaw odczynników:
1. bufor (0,1 M bufor fosforanowy pH 7,0)
2. glukoza (0,03 M, w 0,1 M buforze fosforanowym pH 7,0) 3. IAA (6 mM jodoacetamid w 0,1 M buforze fosforanowym pH 7,0) 4. NaF (0,3 M fluorek sodu w 0,1 M buforze fosforanowym pH 7,0) 5. ekstrakt drożdży w 0,1 M KHCO3
6. HRP (peroksydaza, 2,5 mg/ml 0,1 M buforu fosforanowego pH 7,0) 7. GOx (oksydaza glukozowa, 6 mg/ml 0,1 M buforu fosforanowego pH 7,0) 8. DH2 (o-dianizydyna zredukowana, 10 mg/ml 96% etanolu) 9. Mieszanina reakcyjna z enzymami (HRP i GOx) i o-dianizydyną - sporządzić tuż przed użyciem przez zmieszanie odpowiednich objętości roztworów 1, 6, 7 i 8: 1,2 ml buforu (1) + 25 µl HRP (6) + 25 µl GOx (7) + 7,5 µl DH2 (8) Na każdą próbkę należy przygotować 1,25 ml mieszaniny reakcyjnej!
WYKONANIE
Część I
Przygotować 4 krótkie probówki szklane A1 (podwójnie), A2, A3 oraz probówkę plastikową A4.
Do każdej probówki odpipetować odpowiednio według tabeli:
0.1M bufor
Ekstrakt
6 mM IAA
03.M NaF
Numer próbki
Nazwa próbki
fosforanowy
(ml)
(ml)
(ml)
drozdży (ml)
A1 (podwójnie)
T= 37°C
1.8
0.5
0.0
0.0
A2
T=24°C
1.8
0.5
0.0
0.0
A3
IAA
1.1
0.5
0.7
0.0
A4
NaF
1.1
0.5
0.0
0.7
Próbkę nr 2 pozostawić na stole w temperaturze pokojowej. Pozostałe próbki wstawić do łaźni wodnej (37oC) na 2 minuty. Po tym czasie dodać 0,7 ml glukozy do wszystkich próbek. Próbki pozostawić do dalszej inkubacji przez 40 minut w 37oC z wyjątkiem próbki nr 2 (temperatura pokojowa).
Część II – wykonywana podczas inkubacji próbek A1-A4.
Przygotowanie krzywej wzorcowej.
a) Przygotować próbki według tabeli
Probówka
0.03M
Stężenie
bufor 1
szklana
Glukoza (2)
glukozy [mM]
S1
2,77 ml
0,230 ml
2.3
S2
2,53 ml
0,470 ml
4.7
S3
2,30 ml
0,700 ml
7.0
b) w zlewce (50 ml) przygotować mieszaninę reakcyjną (9): 12 ml bufor (1)+ 250 µl HRP (6) + 250 µl GOx (7) + 75 µl DH2 (8) Wymieszać i odpipetować po 1,25 ml do 4 szklanych probówek podpisanych C0, C1, C2 i C3.
Pozostałość mieszaniny reakcyjnej zachować do późniejszych oznaczeń!
c) Do każdej probówki z mieszaniną reakcyjną (C0, C1, C2 i C3) dodać odpowiednio: C0 - 15 µl buforu 1
C1 - 15 µl roztworu S1
C2 - 15 µl roztworu S2
C3 - 15 µl roztworu S3
Próbki (C0-C3) inkubować 20 minut w 37oC. Następnie zmierzyć absorbancję powstałego, barwnego produktu przy długości fali 420 nm względem wody destylowanej.
Część III
Oznaczanie stężenia glukozy w próbkach, w których zachodziła glikoliza.
a) Po zakończeniu inkubacji próbek A1-A4 przenieść je na chwilę do lodu (w celu schłodzenia i zatrzymania glikolizy).
Próbki odwirować: 2000 obrotów/min przez 5 minut.
b) W trakcie wirowania odpipetować po 1,25 ml mieszaniny reakcyjnej, do pięciu szklanych probówek podpisanych B1, B1!’, B2, B3 i B4.
c) Do probówek B1, B2, B3 i B4 dodać odpowiednio:
Roztwór
Su
s p
u ernatan
n tt
B1 - 15 µl supernatantu A1
B1’ - 15 µl supernatantu A1’
B2 - 15 µl supernatantu A2
B3 - 15 µl supernatantu A3
B4 - 15 µl supernatantu A4
Osad
Próbki inkubować 20 minut w łaźni wodnej w temperaturze 37oC. Następnie zmierzyć absorbancję powstałego barwnego produktu przy długości fali 420 nm względem wody destylowanej.