Zespół Fizyki, Akademia Rolnicza
Do u ytku wewn trznego
WICZENIE 34
ELEKTROLIZA
Kraków 2.02.2007
SPIS TRE CI
I. CZ
TEORETYCZNA. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 2
1. WPROWADZENIE.....................................................................................................................................................2
2. STAŁE FIZYCZNE .....................................................................................................................................................2
3. PRZEWODNICTWO ELEKTRYCZNE CIECZY. ELEKTROLITY........................................................................................3
4. TEORIA DYSOCJACJI ELEKTROLITYCZNEJ ARRHENIUSA ..........................................................................................3
5. PRAWO OHMA DLA ELEKTROLITÓW........................................................................................................................4
6. ELEKTROLIZA .........................................................................................................................................................4
7. PRAWA RZ DZ CE ELEKTROLIZ ............................................................................................................................6
8. STAŁA FARADAYA..................................................................................................................................................7
9. ZWI ZEK STAŁEJ FARADAYA Z ŁADUNKIEM ELEMENTARNYM ................................................................................8
10. ZASADA POMIARU. APARATURA ...........................................................................................................................8
11. BŁ DY SYSTEMATYCZNE PRZYRZ DÓW I METODY POMIAROWEJ..........................................................................9
II. CEL WICZENIA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 10
III. WYKONANIE WICZENIA. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .10
IV. OPRACOWANIE WYNIKÓW . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 11
VI. LITERATURA UZUPEŁNIAJ CA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 12
WYKAZ RYSUNKÓW
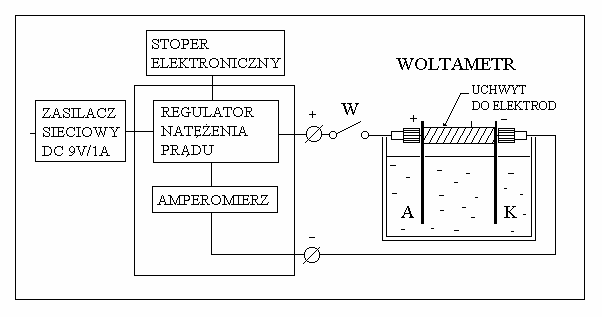
Rys. 1. Obwód pomiarowy do wyznaczenia warto ci równowa nika elektrochemicznego
WYKAZ TABEL
Tabela 1. Opór elektryczny wła ciwy wybranych substancji w temp. 20°C.
Tabela 2. Równowa niki elektrochemiczne (k) i równowa niki chemiczne (R) kilku wybranych
metali.
ZAKRES WYMAGANYCH WIADOMO CI:
Przewodnictwo elektryczne cieczy. Elektrolity. Teoria dysocjacji elektrolitycznej. Prawo Ohma
dla elektrolitów. Elektroliza. Zastosowania przemysłowe elektrolizy. Pierwsze prawo Faradaya.
Równowa nik elektrochemiczny substancji. Woltametr. Drugie prawo Faradaya. Stała Faradaya.
Zwi zek stałej Faradaya z ładunkiem elementarnym. Zasada pomiaru równowa nika
elektrochemicznego i stałej Faradaya.
-2-
I. CZ
TEORETYCZNA
1. Wprowadzenie
Podczas wykonywania wicze w Laboratorium Studenckim dokonujemy bezpo rednich i
po rednich pomiarów wielko ci fizycznych, takich jak: temperatura, wilgotno , ci nienie
atmosferyczne, przyspieszenie ziemskie i innych. Pierwsze dwie z wymienionych wielko ci
dotycz pomieszczenia laboratorium i mog w ci gu krótkiego czasu ulec zmianie. Ci nienie
atmosferyczne jest wielko ci bardziej uniwersaln , jednakow przynajmniej w obszarze naszego
miasta, lecz tak e stosunkowo szybko zmienn w czasie. Przyspieszenie ziemskie zmierzone w
laboratorium ma jeszcze bardziej ogóln rang : zmierzone raz w Krakowie mo e by uznane za
wielko stał .
2. Stałe fizyczne
Niektóre wielko ci fizyczne, zwłaszcza dotycz ce wła ciwo ci atomów i cz stek elementarnych
s wsz dzie takie same i nie ulegaj zmianom w czasie. Nazywaj si one stałymi fizycznymi i
oznacza si je ogólnie przyj tymi symbolami. Nale do nich: pr dko wiatła "c" i ładunek elektronu "e" (ładunek elementarny). Przy pomocy prostego zestawu urz dze : zasilacza napi cia stałego, dwu elektrod zanurzonych w elektrolicie, amperomierza, zegara oraz wagi mo na
zmierzy jedn z podstawowych stałych fizycznych. Jest ni stała Faradaya F. Pomiar tej stałej,
który jest tematem poni szego wiczenia, jest w pewnym sensie pomiarem ładunku elementarnego.
U yty w tym wiczeniu układ elektroniczny słu cy do pomiaru ładunku elektrycznego, który
przepłyn ł pomi dzy elektrodami został skonstruowany w naszym Zespole. Zapewnia on
dokładno pomiaru si gaj c 4 cyfr znacz cych (tzn. bł d wzgl dny jest rz du 10-4). Jest to wi c jeden z najdokładniejszych pomiarów, z którymi zetkn si mo na w naszej Pracowni. W jaki
sposób osi ga si takie i wi ksze, bo si gaj ce 10-6, dokładno ci pomiaru ładunku opisałem w
artykule w miesi czniku Elektronizacja 6/1999. Mo na tam znale tak e niektóre z uzasadnie
dlaczego pomiary stałych fizycznych przeprowadzane z najwy sz dokładno ci s wa ne.
-3-
3. Przewodnictwo elektryczne cieczy. Elektrolity
Ciecze takie jak oleje mineralne, nafta czy ciekłe powietrze s bardzo dobrymi izolatorami. Ich
opór wła ciwy jest trudny do zmierzenia, poniewa si ga 1016Ω·m. Znaczy to, e opór pomi dzy
przeciwległymi cianami sze cianu o boku 1m jest ogromny, bo równy około 1016Ω=107MΩ.
Popularne omomierze cyfrowe mog mierzy opory milion razy mniejsze (nie wi ksze od 20MΩ.
Woda destylowana jest równie złym przewodnikiem cho jej opór wła ciwy jest mniejszy.
Dobrymi przewodnikami s natomiast układy ciekłe zwane elektrolitami. Elektrolity to roztwory,
przede wszystkim wodne, kwasów, zasad i soli. Elektrolitami s tak e stopione sole, dla
przykładu NaCl w temperaturze powy ej 801°C. Opór wła ciwy wybranych cieczy i, dla
porównania, opór wła ciwy miedzi podano w Tabeli 1.
Tabela 1. Opór elektryczny wła ciwy wybranych substancji w temp. 20°C.
substancja
olej
woda
elektrolity
mied
transformatorowy destylowana
ρ [Ω⋅m]
1011÷1012
103÷105
0.1÷10
1.7⋅10-8
4. Teoria dysocjacji elektrolitycznej Arrheniusa
Woda destylowana nie jest dobrym przewodnikiem pr du elektrycznego. Dlaczego wi c wodne
roztwory soli, kwasów i zasad (elektrolity) s znacznie lepszymi przewodnikami? Ich
przewodnictwo elektryczne mo na wyja ni na gruncie teorii dysocjacji elektrolitycznej. Teoria
ta wyja nia w jaki sposób w elektrolicie pojawiaj si no niki pr du.
Po wprowadzeniu cz steczek o wi zaniach jonowych do rozpuszczalnika pod wpływem
rozpuszczalnika nast puje rozpad (dysocjacja) pewnej liczby rozpuszczalnych cz stek na
mniejsze fragmenty zwane jonami. Jony to naładowane elektrycznie atomy (np. Na+) lub grupy
atomów (np. OH-). Wi zanie jonowe polega w gruncie rzeczy na elektrostatycznym
oddziaływaniu jonów. Zgodnie z prawem Coulomba, które rz dzi oddziaływaniem
elektrostatycznym, siła F przyci gania elektrostatycznego jonów maleje je li umieszczone s one
nie w pró ni lecz w otoczeniu cz steczek rozpuszczalnika, np. wody, poniewa :
-4-
F
q1q
=
1
2
4
2
πε ε
0
r
gdzie ε oznacza bezwymiarow stał zwan wzgl dn stał dielektryczn rozpuszczalnika. Je li
rozpuszczalnikiem jest woda to ε ≈80 i osłabienie sił przyci gania jest na tyle du e, e ruchy
termiczne cz steczek wystarczaj , by podczas wzajemnych zderze cz steczek nast pował ich
rozpad. Podczas przepływu pr du przez elektrolit na elektrodach zachodz procesy zoboj tniania
jonów (oddawania elektronów lub ich pobierania). Po dotarciu do anody lub katody jony wydzielaj
si na nich w postaci elektrycznie oboj tnej.
Dysocjacj cz steczki mo na zapisa w postaci równania podobnego do równania reakcji
chemicznej. Dla przykładu dysocjacja elektrolityczna CuSO4 przebiega wg. schematu:
CuSO
+ +
− −
4 = Cu
+ SO4
5. Prawo Ohma dla elektrolitów
Stopniem dysocjacji nazywa si stosunek liczby cz steczek zdysocjowanych do ogólnej liczby
cz steczek wprowadzonych do rozpuszczalnika. Ze wzgl du na stopie dysocjacji rozró niamy
elektrolity słabe i silne. Elektrolity słabe, przy niezbyt silnych nat eniach pola elektrycznego, spełniaj prawo Ohma tzn. zachodzi proporcjonalno pomi dzy przyło onym do elektrod
napi ciem a nat eniem przepływaj cego pr du:
I ~ U
Roztwory silnych elektrolitów wykazuj du e odst pstwa od prawa Ohma.
6. Elektroliza
W przypadku metali przepływowi pr du nie towarzysz zmiany chemiczne przewodnika. Zmiany
takie s charakterystyczne dla przepływu pr du przez elektrolity. Elektroliza to proces
wydzielania si na elektrodach substancji wchodz cych w skład elektrolitu zachodz cy podczas
przepływu pr du.
-5-
Dla przykładu elektroliza wodnego roztworu CuSO4, gdy elektrody s w glowe lub
platynowe przebiega w ten sposób, e katoda (-) pokrywa si miedzi a reszta kwasowa SO4
przemieszcza si w kierunku anody (+):
CuSO
+ +
− −
4 = Cu
+ SO
( K
4
)
( A)
SO4 reaguje z wod
SO
1
4 + H 2 O = H 2 SO4 +
O2
2
powoduj c wydzielanie si tlenu na anodzie. Elektroliza roztworu CuSO4, gdy elektrody s
miedziane, przebiega podobnie jak wy ej opisana. Mied wydziela si na katodzie i masa katody
ro nie. Natomiast masa miedzianej anody maleje poniewa SO4 reaguje z miedzi :
SO4+Cu=CuSO4. W miejsce jednej rozło onej molekuły CuSO4, wydziela si wi c nowa
molekuła CuSO4 i st enie roztworu nie zmienia si . Ko cowym efektem elektrolizy jest
przenoszenie miedzi z anody do katody. Pomiar przyrostu masy katody towarzysz cego
elektrolizie roztworu CuSO4 jest przedmiotem ni ej opisanego wiczenia.
Elektroliza posiada wiele zastosowa przemysłowych. Wymieni tu nale y: trwałe
pokrycia powierzchni jednego metalu cienk warstw innego metalu (niklowanie, chromowanie,
miedziowanie) chroni ce przed korozj (galwanotechnika), oczyszczanie metali z domieszek
(otrzymywanie miedzi elektrolitycznej), otrzymywanie gazów w skali przemysłowej i
otrzymywanie cienkich powierzchni izoluj cych (wa ne w produkcji kondensatorów
elektrolitycznych).
W latach trzydziestych XIX w. Faraday odkrył wa ne prawidłowo ci rz dz ce elektroliz
- nazywamy je prawami Faradaya. Jego odkrycia zasugerowały dziewi tnastowiecznym fizykom
(G.Johnstone-Stoney 1874, H.Helmholtz 1881) hipotez o ziarnistej naturze ładunku
elektrycznego i w konsekwencji doprowadziły do odkrycia elementarnego ładunku elektrycznego
(elektronu) przez J.J.Thomsona w 1897r. Warto te pami ta , e do 1948r pomiary
elektrolityczne były podstaw definicji jednostki nat enia pr du - ampera mi dzynarodowego.
Było to mo liwe dzi ki dokładno ci si gaj cej 0.01%, z któr pomiary elektrolityczne mog by
przeprowadzane.
-6-
7. Prawa rz dz ce elektroliz
Pierwsze prawo Faradaya. Do wiadczalnie mo na pokaza , e masa m jonów wydzielonych na
elektrodzie podczas elektrolizy jest proporcjonalna do ładunku q, który przepłyn ł przez
elektrolit:
m ~ q
Oznacza to w pierwszym rz dzie, e przenoszenie ładunku elektrycznego jest zwi zane z
transportem masy. Stosunek masy wydzielonej na elektrodzie substancji do ładunku, który
przepłyn ł przez elektrolit jest dla danej substancji stały. T stał wielko nazywa si
równowa nikiem elektrochemicznym danej substancji i oznacza przez k:
k
m
= q
(1)
Liczbowo równowa nik k jest równy masie produktu wydzielonego podczas elektrolizy, gdy
przepływaj cy ładunek ma warto jednego kulomba. Warto ci równowa ników
elektrochemicznych wyra one w g/C s dla wi kszo ci substancji rz du 10-3. Podaje si je zatem
cz sto w miligramach/kulomb [mg/C]. W Tabeli 2 podano warto ci równowa ników
elektrochemicznych dla trzech wybranych metali.
Tabela 2. Równowa niki elektrochemiczne (k) i równowa niki chemiczne (R) kilku wybranych
metali [M. Je ewski, J. Kalisz, Tablice wielko ci fizycznych, PWN, Warszawa 1957, s.160]
substancja
Cu2+
Ag+
Al3+
k [mg/C]
0.32938
1.11793
0.09316
R [g]
31.773
107.88
8.9 8.99
W drugim wierszu Tabeli podano odpowiednie warto ci równowa ników chemicznych R.
Przypomnijmy, e równowa nik chemiczny R jest dla pewnej substancji równy jej masie
atomowej (cz steczkowej) m wyra onej w gramach i podzielonej przez warto ciowo w:
µ
R = w
-7-
Nietrudno sprawdzi , e równowa niki k podane w Tabeli 2 s z du dokładno ci
proporcjonalne do odpowiednich równowa ników R. Inaczej mówi c stosunki R/k dla
poszczególnych metali s (prawie) jednakowe. Stwierdzenie tego do wiadczalnego faktu nazywa
si drugim prawem Faradaya.
Ustalone do wiadczalnie przez Faradaya prawa znajduj wyja nienie w wietle teorii
dysocjacji elektrolitycznej po odkryciu, e ładunek jonów (i innych cz stek naładowanych) jest
zawsze wielokrotno ci tego samego ładunku (ładunku elementarnego). Stosunek masy jonu do
jego ładunku, dla danej substancji o okre lonym stopniu jonizacji, jest wielko ci stał .
Niezale nie wi c od liczby przeniesionych podczas elektrolizy jonów masa substancji
wydzielonej na elektrodzie jest proporcjonalna do wielko ci przeniesionego ładunku (pierwsze
prawo Faradaya). Je li natomiast porównujemy skutek przepływu tego samego ładunku przez
ró ne elektrolity to przy zało eniu jednakowego stopnia jonizacji liczba wydzielonych na
elektrodach jonów jest taka sama. Wydzielone masy s wi c proporcjonalne do mas atomowych
substancji (drugie prawo Faradaya).
Pierwsze prawo Faradaya jest podstaw pewnej metody pomiaru ładunku elektrycznego i
nat enia pr du. Przyrz dy słu ce do tego pomiaru nazywaj si woltametrami lub kulometrami.
Woltametrem nazywane jest tak e prostopadło cienne naczynie do przeprowadzania elektrolizy.
8. Stała Faradaya
Stosunek R/k ma wymiar ładunku; jego warto oznaczana jest przez F i nazywa si stał
Faradaya:
F
R
= k
(2)
Stała Faradaya jest stosunkowo du ym ładunkiem bliskim 100000 kulombów. Jej dokładna
warto uzyskana w pomiarach wykonanych w kulometrze srebrowym wynosi
9.648570(66)·104 C [Rev.Mod.Phys, 41(1969)375]. Stała Faradaya posiada prost interpretacj .
Zgodnie z równaniami (1) i (2), przepływowi przez elektrolit ładunku q=F, towarzyszy
wydzielenie si na elektrodzie jednego równowa nika chemicznego substancji, dla przykładu
około 32g Cu2+.
-8-
9. Zwi zek stałej Faradaya z ładunkiem elementarnym
Je li istnieje zwi zek pomi dzy (bardzo małym) ładunkiem elektronu "e" a stał Faradaya F, która jest ładunkiem o 24 rz dy wielko ci wi kszym, to w tym zwi zku musi pojawi si bardzo
du a liczba. Taki zwi zek rzeczywi cie istnieje a rol du ej liczby pełni liczba Avogadra NA :
e
F
= N
A
gdzie NA=(6.02252±0.00028)·1023. Dla uzasadnienia tego zwi zku wystarczy zało y , e ka dy z
NA jednowarto ciowych atomów wydzielonych na elektrodach przenosi zawsze ten sam ładunek
równy ładunkowi elementarnemu e.
10. Zasada pomiaru. Aparatura
Pomiar polega na wyznaczeniu przyrostu masy katody miedzianej podczas elektrolizy wodnego
roztworu CuSO4. Nat enie pr du I jest stałe dzi ki specjalnemu układowi elektronicznemu.
Pozwala to w łatwy sposób dokładnie okre li ładunek elektryczny q, który przepłyn ł przez
elektrolit (q=It, gdzie t - czas elektrolizy) i obliczy warto równowa nika elektrochemicznego
miedzi.
Obwód pomiarowy (rys.1) zasilany jest niestabilizowanym napi ciem stałym z zasilacza
sieciowego 9V/1A. Zło ony jest z regulatora nat enia pr du, amperomierza, wył cznika oraz
prostopadło ciennego szklanego woltametru zawieraj cego elektrolit, anod i katod .
Elektrodami s blaszki miedziane z miedzi M1E o grubo ci ok. 0.15mm i powierzchni 5x10cm
zamocowane w odległo ci 2cm od siebie. Cecha M1E oznacza mied katodow przetopion
zawieraj c nie wi cej ni 0.1% zanieczyszcze . Elektrolitem jest roztwór siarczanu
miedziowego w proporcji: 150g CuSO4·5H20 na 1dm3 lekko podgrzanej wody destylowanej. Do
przes czonego klarownego roztworu dodaje si 50g st onego H2SO4 (27cm3) i 50g (63cm3)
alkoholu etylowego.
Do pomiaru nat enia pr du u ywamy bardzo precyzyjnego cyfrowego amperomierza o
rozdzielczo ci 0.1mA na zakresie 1A. Czas elektrolizy mierzy automatycznie stoper
elektroniczny o rozdzielczo ci 0.01s. Do pomiaru masy elektrod przed i po elektrolizie stosujemy wag o dokładno ci odczytu 1mg w zakresie do 20g. Wag zaopatrzyli my w przezroczyst
plastikow osłon skutecznie chroni c wa on elektrod przed powiewami powietrza.
-9-
11. Bł dy systematyczne przyrz dów i metody pomiarowej
Bł d systematyczny okre lenia nat enia pr du w naszym pomiarze wynosi około 0.1mA (bł d
wzgl dny 10-4 przy pr dzie 1A), natomiast wzgl dny systematyczny bł d pomiaru czasu
elektrolizy przy pomocy automatycznego stopera jest rz du 10-6. Po wł czeniu klucza nat enie
pr du osi ga ustalon warto 0.5A÷0.6A w czasie krótszym ni 5·10-4s i jest stabilizowane z
dokładno ci lepsz ni 0.1mA. Przekonali my si o tym rejestruj c w momencie rozpoczynania
elektrolizy warto ci nat enia pr du cyfrowym rejestratorem danych wykonuj cym 2000
pomiarów w ci gu jednej sekundy. Zatem ładunek, który przepłyn ł przez elektrolit mo na z
dokładno ci około 10-4 wyznaczy obliczaj c iloczyn nat enia pr du i czasu jego przepływu.
Osobnego rozwa enia wymagaj ródła systematycznego bł du pomiaru masy
przeniesionej podczas elektrolizy pomi dzy anod i katod . Mas t wyznaczamy na podstawie
dwu wa e katody. Interpretuj c wyniki zakładamy, e na katodzie zachodzi wył cznie redukcja
ładunku jonów Cu++ i trwałe osadzanie atomów miedzi. Równocze nie z zasadniczymi procesami
rozpuszczania miedzianej anody z wytwarzaniem jonów dwuwarto ciowych i ich osadzaniem na
katodzie podczas elektrolizy zachodz jednak inne procesy. wiadczy o tym mi dzy innymi
obecno ciemnego nalotu na powierzchni anody po elektrolizie i wynik pomiaru zmiany jej
masy. Ta zmiana jest o kilka procent wi ksza od przyrostu masy katody. Mo liwym wyja nieniem
jest rozpuszczanie si anody z cz ciowym tworzeniem si jonów Cu+ i wytr canie si pewnej
ilo ci miedzi (w reakcji 2Cu+ →Cu+Cu2+) oraz tlenku miedziawego Cu2O jako tzw. szlamu
anodowego.
Pomiar przyrostu masy katody tak e mo e prowadzi do zawy onych lub zani onych
warto ci równowa nika elektrochemicznego. Pewne kompromisowe rozwi zanie problemu
minimalizacji bł dów systematycznych dotycz ce składu elektrolitu stanowi podana powy ej
receptura (elektrolit Oettela). Niekorzystnemu efektowi pojawiania si w elektrolicie jonów Cu+
przeciwdziała obecno kwasu siarkowego i odpowiednio du a g sto pr du a dodatek alkoholu
umo liwia utrzymanie niewielkiego bł du metody przy małych g sto ciach pr du. Do
ograniczenia bł dów systematycznych do poziomu poni ej 1% wystarczaj ce jest: przestrzeganie
sposobu sporz dzania elektrolitu i okresowa jego filtracja, zapewnienie g sto ci pr du zbli onej do 0.01A/cm2, utrzymanie temperatury elektrolitu poni ej 30°C, stosowanie oczyszczonych
elektrod, wa enie katody po uprzednim umyciu wod i wysuszeniu w strumieniu ciepłego
powietrza suszark .
-10-
II. CEL WICZENIA
Celem wiczenia jest wyznaczenie równowa nika elektrochemicznego miedzi kCu i stałej
Faradaya F.
III. WYKONANIE WICZENIA
1. Wył cznikiem sieciowym wł czy zasilanie: wagi elektronicznej, regulatora nat enia pr du i
stopera. Je li zasilanie jest wł czone – nie wył cza go.
2. Je li waga WPE 30 nie jest wł czona i skalibrowana (wskazuje wtedy 0g) dokona jej
kalibracji według punktów 1-3 opisu wagi. Podczas kalibracji na szalce wagi powinno
znajdowa si naczynie plastikowe.
3. Wyznaczy mas katody m1 umieszczaj c j w naczyniu plastikowym na szalce wagi w
poło eniu zbli onym do pionowego. Zanotowa bł d bezwzgl dny pomiaru ∆m1. Jako katody
w wiczeniu nale y u y cienkiej (ok. 0.15mm) blaszki miedzianej o masie ok. 10g. W
przypadku zaobserwowania plam na czynnej powierzchni katody mo na j przed zwa eniem
delikatnie oczy ci papierem ciernym. Przy wykonywaniu wszystkich czynno ci z katod i
anod nie nale y dotyka palcami ich powierzchni czynnej.
4. Zamontowa katod i anod w uchwycie. Zestawi obwód pomiarowy według schematu
przedstawionego na Rys.1.
5. Umie ci obie elektrody w woltametrze zanurzaj c w elektrolicie. Woltametrem nazywamy
prostopadło cienne naczynie do przeprowadzania elektrolizy. Wł czy pr d kluczem "W".
Przepuszcza pr d przez kilkana cie minut.
6. Wył czy pr d i zanotowa czas przepływu pr du zmierzony automatycznie przez stoper.
Stoper pokazuje wynik pomiaru w sekundach z bł dem nie przekraczaj cym ±0.01s. Wyj
elektrody z woltametru.
7. Wymontowa elektrody i przemy zanurzaj c w naczyniu z wod destylowan . Nast pnie
osuszy je bibułk i suszark .
8. Ponownie zwa y katod w naczyniu plastikowym (m2). Obliczy przyrost jej masy m=m2-m1.
9. Rozmontowa obwód elektryczny. Przykry woltametr. Elektrody umie ci na bibułce na
plastikowej podstawce nadal uwa aj c aby nie dotyka palcami ich powierzchni czynnej.
-11-
Rys. 1. Obwód pomiarowy do wyznaczenia warto ci równowa nika elektrochemicznego
IV. OPRACOWANIE WYNIKÓW
1. Obliczy całkowity ładunek q, który przepłyn ł przez obwód podczas trwania elektrolizy; q=I·t.
2. Obliczy równowa nik elektrochemiczny miedzi kCu korzystaj c z I prawa elektrolizy:
kCu=m/q.
3. Obliczy stał Faradaya F = RCu/kCu. Równowa nik chemiczny miedzi Cu2+,
Rcu = 31.78·10-3 kg.
4. Bł d równowa nika elektrochemicznego kCu i stałej Faradaya F obliczy metod
logarytmiczn . Bł d pomiaru przyrostu masy katody ∆m nale y obliczy metod ró niczki
zupełnej, poniewa masa m wyznaczona została jako ró nica wyników dwu wa e .
Maksymalna warto bł du pomiaru nat enia pr du wynosi ±0.0001A (±0.1 mA). Stoper
mierzy czas przepływu pr du z bł dem ±0.01 s.
5. Sprawdzi zgodno wyniku z warto ci tablicow .
6. Obliczy grubo osadzonej na katodzie warstwy miedzi zakładaj c, e została osadzona
równomiernie na powierzchni o wymiarach 5x5 cm. G sto miedzi ρ=8,6 g/cm3.
-12-
V. DODATEK. WAGA ELEKTRONICZNA WPE 30
Dane techniczne
Maksymalne obci enie ............................................................................................................ 30g Zakres tarowania........................................................................................................................ -30g Kalibracja.......................................................................................odwa nikiem kalibracyjnym 20g Dokładno odczytu.................................................................................................................. 1mg Maksymalny bł d bezwzgl dny.............................................................................................. 10mg Uruchomienie i kalibracja
1. Uruchomi zasilanie wagi naciskaj c przycisk <ON>. Na wy wietlaczu pojawi si liczba
<15.00> okre laj ca w minutach czas potrzebny do ustalenia si termicznych warunków pracy
wagi.
2. Po upływie 15 minut od wł czenia na wy wietlaczu pojawi si symbol <-88.888>, a po kilku sekundach symbol <⊂ ⊃> oznaczaj cy gotowo wagi do kalibracji.
3. Przy pomocy p sety umie ci odwa nik kalibracyjny 20g na rodku szalki wagi. Na
wy wietlaczu pojawi si symbol <∪ ∪>, a po 10 sekundach liczba <20.000> sygnalizuj ca zako czenie kalibracji. Po zdj ciu odwa nika kalibracyjnego waga jest gotowa do pomiarów
masy.
Pomiary masy
1. Poło y badane ciało na rodku szalki wagi. Po około 10s odczyta z wy wietlacza wynik
pomiaru wyra ony w gramach.
2. Je eli przy braku obci enia szalki wskazanie wagi ró ni si od zera o wi cej ni 5mg nale y
wcisn kolejno przyciski <TARA> i <F1> a po ukazaniu si symbolu <⊂ ⊃> powtórzy proces kalibracji wg. punktu 4 (uruchomienie i kalibracja).
VI. LITERATURA UZUPEŁNIAJ CA
Dry ski T., wiczenia laboratoryjne z fizyki, PWN, Warszawa 1976, s.393-400.
Encyklopedia Fizyki, Tom 3, PWN, Warszawa 1974, s.447-448.
Halaubrener M., wiczenia praktyczne z fizyki. Kurs redni, WSiP, Warszawa 1982, s.423-425.
Piech T., Fizyka dla II klasy liceum ogólnokształc cego, technikum i liceum zawodowego.
Wyd.V. PZWS, Warszawa 1973, s.168-175.
Piekara A.H., Elektryczno , materia i promieniowanie. PWN, Warszawa 1986, s.55-66.
Sawicki M., (red.). Nauczanie fizyki. Cz
II. Podr cznik dla nauczycieli fizyki klasy II liceum
ogólnokształc cego i technikum. WSiP, Warszawa 1978, s.190-202.
Szczeniowski S., Fizyka Do wiadczalna, Tom III, PWN, Warszawa 1980, s.49-53.
Turkowski P., Precyzyjne pomiary nat enia pr du stałego. Czy amper jest jeden? Elektronizacja
6/1999 s.30-31.
Zawadzki A., Hofmokl H., Laboratorium fizyczne, PWN 1966, s.414-419.