Metoda lizy alkalicznej służy do izolacji DNA plazmidowego z komórek bakteryjnych. Metoda
pozwala na otrzymanie dobrze oczyszczonego materiału. W pierwszej kolejności zachodzi liza
komórek bakteryjnych, denaturacja białek, oraz DNA. W drugim etapie "pokomórkowy gruz" jest
strącany, a w roztworze pozostają cząsteczki plazmidów. Metoda, podczas oddzielania DNA
plazmidowego, wykorzystuje różnicę w zdolności do renaturacji plazmidów i chromosomu
bakteryjnego. To pierwsze ulega szybkiej renaturacji po usunięciu czynnika denaturującego (w tym
wypadku zneutralizowaniu alkalicznego pH) i jest to trzeci etap procedury. Otrzymany plazmid
może być oczyszczany na przystosowanych do tego minikolumnach, lub precypitowany w alkoholu
w celu przechowania.
Metoda jest szybka i prosta w wykonaniu, przez co stała się popularnym sposobem uzyskiwania
oczyszczonego plazmidu z komórek bakteryjnych.
Etapy procesu:
1. Zawieszenie komórek w roztworze, który obniża wytrzymałość ścian komórkowych bakterii,
hamuje DNazy przez chelatację jonów biwalencyjnych; niektórzy wraz z roztworem GTA dodają
lizozym, trawiący ściany bakteryjne;
2. Zniszczenie komórek bakteryjnych – plazmid oraz pozostała składniki komórki są uwalniane do
roztworu. Jednocześnie zachodzi odwracalna denaturacja kwasów nukleinowych oraz
nieodwracalna denaturacja białek.
3. Renaturacja plazmidowego DNA. Oddzielenie plazmidowego DNA od białek, resztek błon i
chromosomu bakteryjnego.
Ad. 1
Komórki po zwirowaniu zostają zawieszone roztworze GTE (Glukoza/Tris/EDTA). Dodatkowo
można stosować lizozym.
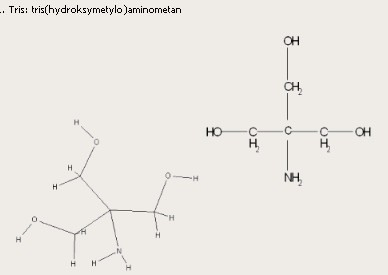
Tris jest roztworu buforowym ma za zadanie utrzymać stałe pH (lekko zasadowe). EDTA jest
związkiem chelatującym jony biwalencyjne (np. Ca2+, Mg2+). Wynikiem tego procesu są dwa
efekty:
– zmniejszona stabilność ściany komórkowej bakterii spowodowana wiązaniem jonów Ca2+ przez
EDTA; ściana komórkowa bakterii gram ujemnych składa się z jednej warstwy mureiny i
otaczającej ją warstwy lipopolisacharydów, lipidów i lipoprotein; jak się wydaje, jony wapnia są
potrzebne do zachowania stabilności warstwy lipopolisacharydowej;
– zahamowanie działania DNaz, przez jony magnezowe; bowiem te enzymy, jeśli aktywne mogły
by pociąć plazmidowe DNA;
Glukoza jest dodana w celu zachowania właściwego ciśnienia osmotycznego; jest to ważne
szczególnie podczas stosowania lizozymu, który prowadzi do powstania protoplastów, komórek
pozbawionych ściany, a przez to wrażliwych na zewnętrzne ciśnienie osmotyczne; zbyt niskie
ciśnienie osmotyczne (czyli środowisko hipotoniczne) spowodowało by pobieranie wody przez
komórki i ich pęknięcie; środowisko izoosmotyczne lub słabo hiperosmotyczne nie jest szkodliwe
dla protoplastów;
Ad. 2
W tym etapie do zawiesiny komórek bakteryjnych dodaje się alkalicznego roztworu NaOH/SDS.
W zasadowym środowisku, przy udziale SDS dochodzi do lizy komórek bakteryjnych. Uwolnione
białka są denaturowane przez SDS i NaOH. Genomowy i plazmidowy DNA ulega denaturacji pod
wpływem zasadowego pH.
Po dodaniu NaOH/SDS w probówce znajduje się mieszanina zniszczonych błon, zdenaturowanych
plazmidów, bakteryjnych chromosomów i białek, wolnych cząsteczek SDS i innych związków.
Ad. 3
Do roztworu lizatu dodawany jest octan potasu (bufor octanowy), który powoduje zmianę
obniżenie pH. W efekcie jego działania plazmidowe DNA renaturuje szybko, podczas gdy
chromosomowe DNA pozostaje zdenaturowane. Odmienna zdolność do renaturacji po obniżeniu
pH jest istotą metody lizy alkalicznej. Pozwala na późniejsze łatwe oddzielenie DNA
chromosomowego od plazmidowego. DNA genomowy wraz z białkami i fragmentami błon,
wytrąca się w postaci serowatego osadu. Następnym krokiem jest wirowanie roztworu, by oddzielić
plazmidowe DNA, które pozostaje rozpuszczone w supernatancie.
Po tym etapie otrzymana próbka może być dodatkowo odbiałczana mieszaniną fenol/chloroform,
lub oczyszczana na minikolumnach będących fragmentem zestawów sprzedawanych przez firmy
biotechnologiczne. Te czynności nie są uwzględnione w przedstawionym niżej, przykładowym
protokole.
Otrzymany, oczyszczony DNA plazmidowy można precypitować w etanolu lub izopropanolu.
Poniższy protokół uwzględnia ten proces.
Przykładowy protokół izolacji plazmidó