ZADANIA OPARTE NA
ZAGADNIENIACH NA EGZAMIN
POPRAWKOWY Z CHEMII KL. II
Zadanie 1
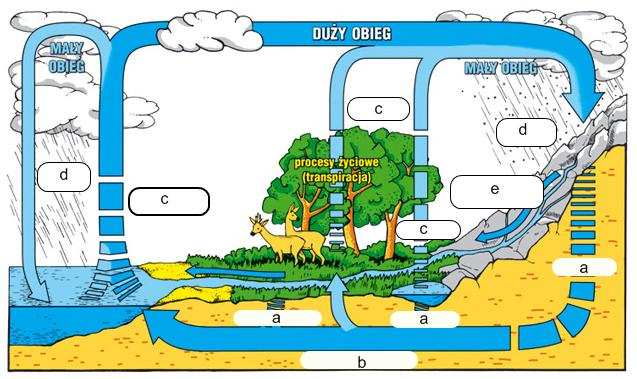
Opisz obieg wody w przyrodzie, uzupełniając podany obieg.
a) ____________________________ d) ____________________________
b) ____________________________ e) ____________________________
c) ____________________________
Zadanie 2
Wymień 5 ról wody w przyrodzie.
a) _____________________________________________________________________
b) _____________________________________________________________________
c) _____________________________________________________________________
d) _____________________________________________________________________
e) _____________________________________________________________________
Uzupełnij wykres nazywając stany skupienia i zjawiska zachodzące podczas przejścia między nimi.
STAN
STAN
__________
__________
(LÓD)
(WODA)
STAN
__________
(PARA
WODNA)
Zadanie 4
Uzupełnij wzorami wody.
a) wzór sumaryczny
b) wzór strukturalny
c) model cząsteczki wody
Zadanie 5
Podaj 2 czynniki przyspieszające rozpuszczanie substancji.
a) _________________________________________________
b) _________________________________________________
Zadanie 6
Podaj po 2 przykłady substancji dobrze i słabo rozpuszczalne.
Dobrze rozpuszczalne
Słabo rozpuszczalne
Wyjaśnij pojęcia:
a) sedymentacja - ____________________________________________________________
___________________________________________________________________________
___________________________________________________________________________
___________________________________________________________________________
b) dekantacja - ______________________________________________________________
___________________________________________________________________________
___________________________________________________________________________
___________________________________________________________________________
c) stężenie procentowe - ______________________________________________________
___________________________________________________________________________
___________________________________________________________________________
___________________________________________________________________________
Zadanie 8
Napisz wzór na obliczanie stężenia procentowego i objaśnij symbole. Następnie oblicz stężenie procentowe roztworu kwasu solnego:
a) o masie roztworu równej 200 g i masie substancji równej 30 g b) o masie roztworu równej 150 g i masie substancji równej 45 g Wzór:
a)
b)
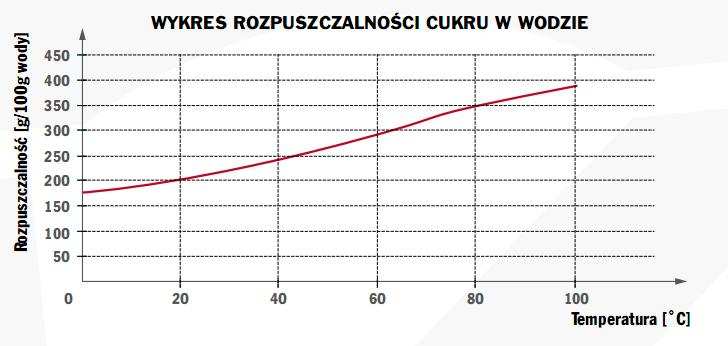
Wykres do zadań 9 i 10
Zadanie 9
Jeżeli roztwór nasycony w temperaturze 60oC zawierający 100 g wody i 294 g cukru oziębimy do temperatury 40oC to masa wykrystalizowanego cukru wyniesie: a) około 30 g
b) około 49 g
c) około 98 g
d) około 149 g
Zadanie 10
Parametry opisujące nienasycony roztwór cukru to: Temperatura
Masa rozpuszczonego cukru
A
10oC
300 g
B
20 oC
250 g
C
25 oC
245 g
D
30 oC
225 g
Zadanie 11
Podaj wzory sumaryczne i strukturalne podanych kwasów. Określ czy kwas jest tlenowy czy beztlenowy i podaj jedno zastosowanie danego kwasu.
a) k. solny (chlorowodorowy)
sumaryczny:
strukturalny:
Kwas jest: beztlenowy / tlenowy
Zastosowanie: _______________________________________________________________
sumaryczny:
strukturalny:
Kwas jest: beztlenowy / tlenowy
Zastosowanie: _______________________________________________________________
Zadanie 12
Wyjaśnij:
a) jon - _________________________________________________________________
___________________________________________________________________________
___________________________________________________________________________
b) higroskopijność - _______________________________________________________
___________________________________________________________________________
___________________________________________________________________________
c) dysocjacja - ___________________________________________________________
___________________________________________________________________________
___________________________________________________________________________
Zadanie 13
Wymień tlenki kwasowe i podaj ich wzory.
Kwas, w którym występuje Tlenek kwasowy
Zadanie 14
Nazwij podane wodorotlenki. Podkreśl spośród nich zasady.
a) KOH - _______________________________________________________
b) Al (OH)3 - ____________________________________________________
c) Ca (OH)2 - ____________________________________________________
Zadanie 15
Napisz wzory na podstawie nazwy wodorotlenku.
a) wodorotlenek sodu - ___________________
b) wodorotlenek glinu - ___________________
Podaj zastosowanie, właściwości fizyczne i nazwę systematyczną soli kuchennej.
___________________________________________________________________________
___________________________________________________________________________
___________________________________________________________________________
___________________________________________________________________________
___________________________________________________________________________
___________________________________________________________________________
Zadanie 17
Podaj wzory sumaryczne i kreskowe niżej wymienionych soli.
a) chlorek litu
b) siarczan (VI) wapnia
c) węglan ołowiu (II)
d) azotan (V) chromu (III)
Napisz reakcję dysocjacji NaCl. Nazwij jony.
Zadanie 19
Uzyskaj trzema pierwszymi sposobami otrzymywania soli fosforan (V) wapnia: Ca3(PO4)2
1)
2)
3)
Zadanie 20
Podaj po 3 przykłady soli dobrze i słabo rozpuszczalnych. Napisz ich wzory i nazwy.
a) dobrze rozpuszczalne
b) słabo rozpuszczalne