Kwasy karboksylowe – zakres podstawowy
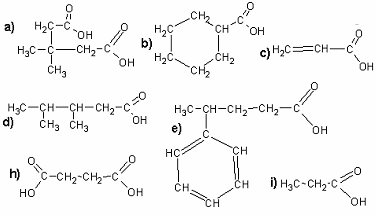
1. Podaj nazwy związków:
8. Zaproponuj doświadczenia, za pomocą których można
wykazać że:
a) kwas propenowy jest kwasem nienasyconym,
b) kwas mrówkowy jest kwasem mocniejszym od
kwasu węglowego,
c) moc kwasów karboksylowych jest odwrotnie
proporcjonalna
do
długości
łańcucha
węglowego.
Podaj schematy doświadczeń, obserwacje i wnioski oraz
zapisz
równania
zachodzących
reakcji
wzorami
półstrukturalnymi.
9. Wodny roztwór bromu ulega odbarwieniu po wprowadzeniu
do kwasu oleinowego. Wyjaśnij, dlaczego tak się dzieje.
10. Uszereguj podane kwasy w kolejności rosnącej mocy: kwas 2. Podaj wzory półstrukturalne kwasów:
stearynowy, kwas mrówkowy i kwas propionowy.
a) etanowego, e) 2,4-dimetylopentanowego, g) benzoesowego,
11. Podaj nazwy oraz wzory półstrukturalne izomerów
b) propanowego, f) 2-chlorobutanowego, h) propanodiowego,
pentanolu, które można utlenić do kwasu o wzorze C
c) α-metylobutanowego,
i) propenowego,
5H10O2.
d) 2-metylopentanodiowego.
12. Podać wzory półstrukturalne alkoholu i aldehydu, które w wyniku utlenienia dają kwas stearynowy.
3. Zapisz równania reakcji (wzorami półstrukturalnymi) kwasu mrówkowego z:
13. Napisz po jednym wzorze półstrukturalnym oraz podaj a) magnezem,
c) wodorotlenkiem wapnia,
nazwy następujących kwasów:
e) miedzią
b) tlenkiem cynku,
C2H4O2, C4H8O2, C18H34O2.
d) węglanem sodu,
f) amoniakiem
14. Zapisz sposobem jonowym uproszczonym reakcje:
lub zaznacz że reakcja nie zachodzi.
a) kwas octowy + wodorotlenek wapnia
4. Wstaw w miejsce liter A, B, C itd. wzory półstrukturalne
b) octan wapnia + kwas siarkowy(VI)
odpowiednich związków:
c) kwas szczawiowy + tlenek baru
H
2H
Cl
d) kwas stearynowy + woda amoniakalna
a) CaC O
2
/Ni
2
2 υh
,
→
2
→ A
→ B
C
e) kwas benzoesowy + tlenek sodu
KOH, H
O
CuO
Cu(OH)
C
2 → D
→ E
2 → F
15. Zapisz równania – wzorami półstrukturalnymi -
H
2H
Cl
b) CaC O
2
/Ni
2
2 υh
,
następujących reakcji chemicznych:
2
→ A
→ B
→ C
N (
a reakcja
rtza)
Br
a) kwasu octowego z cynkiem,
2
υ
h
,
C
Wu
→ D
→ (reakcja zachodzi przy 1
b) kwasu masłowego z wodorotlenkiem wapnia,
KOHH
, O
CuO
Cu(OH)
at. węgla) E
2 → F → G
2 → H
c) kwasu chlorooctowego z wodą amoniakalną,
Cl2
υ
h
,
KOH, H
O
CuO
c) toluen
→ A
2 →B
→ C
d) kwasu mrówkowego z tlenkiem wapnia
e) kwasu mrówkowego z węglanem potasu,
Cu(OH)
C
2 → D
f) kwasu stearynowego z wodorotlenkiem potasu,
Cl2
υ
h
,
KOH, a
lkohol
Cl
d) etan
→ A
→ B
2 → C
g) mrówczanu potasu z kwasem siarkowym(VI).
KOH, H
O
CuO
Ag O
h) kwas mrówkowy + wodorotlenek. miedzi(II) + temp.
C
2 →D
→ E
2 → F
Cl
KOH, H
O
CuO
Ag O
16. Napisać wszystkie możliwe wzory strukturalne kwasów
e) A
2 → B
2 →C
→ D
2 →
nienasyconych o wzorze C3H5COOH.
HOOC-COOH
17. W trzech naczyniach bez etykietek znajdują się:
5. Zaproponuj doświadczenia, pozwalające odróżnić (analiza
n-heksan, n-heksanol i kwas pentanowy. Wykaż za pomocą
organoleptyczna jest niedopuszczalna):
odpowiednich równań reakcji chemicznych, że odczynniki:
a) kwas propanowy od mrówkowego,
węglan sodu i sód metaliczny wystarczą do identyfikacji tych
b) kwas pentanowy od heksenowego,
związków.
c) wodny roztwór kwasu propanowego od propanolu,
18. Zaproponuj doświadczenia za pomocą, których można
d) wodny roztwór octanu sodu od wodnego roztworu
wykazać, że parafina i stearyna należą do różnych grup
benzoesanu sodu,
związków organicznych? Podaj schematy doświadczeń,
e) kwas octowy od wodnego roztworu glikolu etylenowego,
obserwacje i wnioski oraz zapisz równania zachodzących
f) wodny roztwór octanu sodu od wodnego roztworu kwasu
reakcji wzorami półstrukturalnymi.
octowego,
g) parafinę od stearyny.
19. Zaproponuj doświadczenia za pomocą, których można
Podaj schematy doświadczeń, obserwacje i wnioski oraz
sprawdzić, czy dana substancja jest solą kwasu szczawiowego,
zapisz równania zachodzących reakcji wzorami
czy też octowego?
półstrukturalnymi.
20. Wymień
wspólne
właściwości
chemiczne
kwasów
6. Kwas stearynowy nie rozpuszcza się w wodzie, natomiast organicznych i nieorganicznych.
stearynian sodu jest w niej rozpuszczalny. Wyjaśnij przyczynę
21. Zaproponuj doświadczenie pozwalające wykazać, że w
różnic w rozpuszczalności tych związków w wodzie.
wodny roztwór kwasu octowego zawiera jony H3O+.
7. Wyjaśnij, dlaczego podczas mycia w twardej wodzie zużywa Podaj przebieg doświadczeń, obserwacje i wnioski oraz zapisz
się do mycia więcej mydła niż w wodzie miękkiej?
równania zachodzących reakcji wzorami półstrukturalnymi.
- 1 -
Kwasy karboksylowe – zakres podstawowy
22. Zaprojektuj doświadczenie pozwalające na otrzymanie
cznych dwa sposoby otrzymywania palmitynianu sodu
kwasu benzoesowego z toluenu. Podaj schemat doświadcze-
(zastosuj wzory półstrukturalne).
nia, obserwacje i wnioski oraz zapisz równanie zachodzącej
31. (Pr.XII/2004/A1) W wodzie o dużej zawartości jonów reakcji wzorami półstrukturalnymi.
magnezowych i wapniowych mydło przestaje się pienić. Podaj
23. Zaprojektuj doświadczenie pozwalające wykazać, że kwas równanie reakcji w zapisie jonowym skróconym, wyjaśniające
octowy reaguje z metalami. Podaj schemat doświadcze-nia,
podany fakt.
obserwacje i wnioski oraz zapisz równanie zachodzącej
32. Kwasy organiczne można otrzymać następującymi
reakcji wzorami półstrukturalnymi.
sposobami:
24. Zaprojektuj doświadczenie pozwalające wykazać, że w a) utleniając alkohole, b) utleniając aldehydy,
reakcji kwasu octowego z cynkiem wydziela się wodór. Podaj
c) działając mocnymi kwasami na sole organiczne.
schemat doświadczenia, obserwacje i wnioski oraz zapisz
Ułóż po dwa równania reakcji (wzorami półstrukturalnymi)
równanie zachodzącej reakcji wzorami półstrukturalnymi.
obrazujące te metody.
25. Zaprojektuj
doświadczenie
pozwalające
wykazać,
33. Napisz równania reakcji (wzorami półstrukturalnymi) lub
że kwas mrówkowy ma własności redukujące. Podaj schemat
zaznacz i wyjaśnij, dlaczego reakcja nie zachodzi:
doświadczenia, obserwacje i wnioski oraz zapisz równanie
a) cynk + kwas octowy —>
zachodzącej reakcji wzorami półstrukturalnymi.
b) miedź + kwas mrówkowy —>
26. Zaproponuj
doświadczenie
pozwalające
wykazać,
c) tlenek miedzi(II) + kwas masłowy —>
że kwas octowy jest słabszym kwasem niż kwas solny.
d) wodorotlenek miedzi(II) + kwas octowy —>
e) węglan sodu + kwas octowy —>
27. Podaj nazwę i wzór półstrukturalny substancji, jaka f) mrówczan sodu + kwas octowy —>
powstaje w procesach kwaśnienia mleka, kiszenia ogórków
g) tlenek glinu + kwas octowy —>
i kapusty, oraz podczas wytężonej pracy mięśni.
h) stearynian sodu + kwas siarkowy(VI) —>
28. (Pr.III/2008/A1)W kolumnie I podano nazwy trzech
34. Do 100 cm3 wody dodano po 0,2 mola kwasów: mrówko-kwasów karboksylowych, a w kolumnie II – krótkie
wego, octowego, palmitynowego i stearynowego oraz lakmus.
charakterystyki czterech kwasów karboksylowych.
Podaj,
w
których
probówkach
lakmus
zmienił
I
II
zabarwienie na czerwone.
a) Nasycony kwas tłuszczowy. Jest białą
Odp.: w probówkach zawierających CH3COOH i HCOOH
substancją, bez zapachu. Stanowi składnik
1. kwas
35. Jakie związki powstaną podczas ogrzewania sodowych soli tłuszczów roślinnych i zwierzęcych. Stosuje
metanowy
kwasów: mrówkowego i propionowego ze stężonym kwasem
się go do produkcji mydeł, kremów, świec.
(mrówkowy)
siarkowym
użytym
w
nadmiarze?
Podać
równania
Duże znaczenie mają sole tego kwasu, np.
przebiegających reakcji chemicznych.
jego sól sodowa to mydło.
Odp.: W tych warunkach nastąpi wydzielenie i rozkład kwasu
b)
Najprostszy
i
najmocniejszy
kwas
mrówkowego,
co
można
przedstawić
jedną
reakcją:
2. kwas
karboksylowy. Jest bezbarwną, żrącą cieczą
2HCOONa + H2SO4
2CO + 2H2O + Na2SO4 ;
etanowy
o ostrej woni. Występuje w wydzielinach
kwas propanowy zostanie wyparty ze swojej soli wg reakcji:
(octowy)
niektórych owadów (np. pszczół i mrówek)
2CH3CH2COONa + H2SO4
2CH3CH2COOH + Na2SO4
i w roślinach (np. w pokrzywach).
36. Podaj, jakie związki powstają w wyniku ogrzewania soli c)
Najprostszy
aromatyczny
kwas
sodowych kwasów mrówkowego i masłowego ze stężonym
karboksylowy. Tworzy bezbarwne kryształy.
3. kwas
H
Otrzymywany jest przez utlenianie toluenu.
2SO4 użytym w nadmiarze.
oktadekano
Odp.: CO, C
Stosuje
się
go
w
przemyśle
3H7COOH, Na2SO4 i H2O
-wy
farmaceutycznym, spożywczym (jego sól
37. Ustal wzór jednokarboksylowego kwasu, wiedząc, że
(stearynowy)
sodowa jest konserwantem), farbiarskim,
w reakcji 3 g tego kwasu z sodem otrzymano 0,560 dm3
kosmetycznym.
wodoru (warunki normalne).
d) Alifatyczny kwas karboksylowy. Jest
Odp.: CH3COOH
bezbarwną cieczą o charakterystycznym
38. W wyniku reakcji 11 g kwasu monokarboksylowego
zapachu. W niższych temperaturach zamarza
z magnezem otrzymano 1,4 dm3 wodoru (warunki normalne).
w postaci kryształów podobnych do lodu.
Ustal wzór sumaryczny kwasu.
Jednym ze sposobów jego otrzymywania jest
Odp.: C4H8O2
utlenianie etanolu w procesie fermentacji.
39. Oblicz wzór kwasu dikarboksylowego wiedząc, że do
Stosuje się go między innymi do celów
zobojętnienia 4 g tego kwasu zużyto 30,8 cm3 2,5-molowego
spożywczych w postaci 5% lub 10%
roztworu NaOH.
roztworów wodnych.
Odp.: HOOC-CH2-COOH
Przyporządkuj każdemu kwasowi z kolumny I (cyfry od 1 do 3)
40. Oblicz wzór sumaryczny kwasu monokarboksylowego,
jedną reprezentującą go charakterystykę z kolumny II (litery wiedząc, że:
od a do d).
a) zużyto 200 cm3 0,5-molowego roztworu NaOH do
29.
Porównując budowę cząsteczek, wyjaśnij krótko
zobojętnienia roztworu zawierającego 8,6 g tego kwasu,
przyczynę różnic stanów skupienia:
b)
kwas
ten
odbarwia
roztwór
wody
bromowej.
a) kwasu octowego i stearynowego
Odp.: C
b) kwasu stearynowego i oleinowego
3H5COOH
30. (Pr.XII/2004/A1) Mydła to sole sodowe lub potasowe kwasów tłuszczowych. Zapisz równaniami reakcji chemi-
- 2 -
Kwasy karboksylowe – zakres podstawowy
41. Zbadano skład pewnego kwas karboksylowego i obliczono 54. Ile cm3 wody należy dodać do 250 cm3 10% roztworu że zawiera on wagowo 40,7% węgla, 5,1% wodoru oraz tlen.
kwasu
octowego,
aby
otrzymać
roztwór
5%.
Oblicz wzór badanego kwasu.
Odp.: 250 cm3
Odp.: C4H6O4,
55. Z iloma gramami 20% kwasu octowego przereaguje 32,7 g
42. Podczas stapiania soli sodowej kwasu organicznego
cynku?
z wodorotlenkiem sodu powstaje węglowodór nasycony.
Odp.: 300 g
Proces ten nazywamy się dekarboksylacją. Podaj, które z
56. Ile gramów lodowatego kwasu octowego przereaguje z
izomerów kwasu o wzorze C6H12O2 w wyniku dekarboksylacji
trzema molami wodorotlenku wapnia?
dadzą n-pentan.
Odp.: 360 g
Odp.: kwas heksanowy, kwas 2-etylobutanowy
57. Oblicz, jaka objętość 0,5-molowego roztworu KOH
43. Oblicz, ile dm3 chloru odmierzonego w warunkach
potrzebna jest do zobojętnienia 1 g kwasu benzoesowego?
normalnych przereaguje z 47 g kwasu oleinowego.
Odp.: 16,39 cm3
Odp.: 3,73 dm3 Cl2
58. Stosowany w medycynie spirytus mrówkowy to 2% roztwór
44. Ile gram mydła sodowego możemy otrzymać mając do
kwasu mrówkowego w C2H5OH. Oblicz, jaką ilość spirytusu
dyspozycji 35,5 g kwasu stearynowego i 25 g 40 % roztworu
mrówkowego można otrzymać z 5 g kwasu mrówkowego:
NaOH.
Odp.: 250 g
Odp.: 38,25 g
59. Oblicz objętość gazu (warunki normalne) wydzielającego 45. Podczas
ogrzewania
kwasu
salicylowego
się
podczas
rozkładu
580
g
kwasu
mrówkowego
(o-hydroksybenzoesowego) wydziela się gaz powodujący
przebiegającego z 80% wydajnością.
zmętnienie wody wapiennej. Oblicz, ile moli kwasu
Odp.: 226 dm3
salicylowego uległo rozkładowi, jeżeli powstały gaz
60. Oblicz objętość CO (warunki normalne), powstałego pod-przereagował
z
2
g
wodorotlenku
sodu?
czas rozkładu 20 g kwasu mrówkowego wiedząc, że reakcja
Odp.: 3,45g
zachodzi według schematu:
46. Utleniono 8% roztwór wodny etanolu otrzymując roztwór H SO
kwas metanowy 2
4 → tlenek węgla (II) i woda.
kwasu octowego który następnie zobojętniono węglanem
wapnia, wskutek czego otrzymano 7,9 g octanu wapnia.
Odp.: 5,84 dm3
Oblicz
ile
gramów
8%
roztworu
zużyto?
61. Oblicz,
ile
gramów
kwasu
solnego
potrzeba
do
Odp.: 57,7 g
zhydrolizowania benzoesanu sodu tak aby otrzymanego kwasu
47. Do
przeprowadzenia
500
g
kwasu
oleinowego
benzoesowego było 0,05 mola.
w stearynowy zużyto 22,4 dm3 wodoru (warunki normalne).
Odp.: 1,825 g HCl
Oblicz, jaki procent kwasu oleinowego uległ reakcji i ile
62. Oblicz ile gram octanu sodu należy użyć do reakcji, aby powstało kwasu stearynowego.
otrzymać 5,6 dm3 metanu odmierzonego w warunkach
Odp.: 56,4 % kwasu oleinowego, powstało 284 g kwasu
normalnych?
48. Do 14,1 g kwasu oleinowego dodawano roztwór wody
Odp.: 20,5 g
bromowej, zawierającej 160 g bromu w 1 dm3, aż do ukazania
63. Metan można otrzymać w procesie dekarboksylacji kwasu się trwałego zabarwienia. Oblicz, ile cm3 roztworu
octowego w obecności katalizatora niklowego. Zapisz
bromu zużyto.
równanie zachodzącej reakcji i oblicz, ile dm3 metanu
Odp.: 50 cm3
otrzymamy
ze
100
g
kwasu
octowego.
49. Stearyna jest mieszaniną kwasu stearynowego i palmi-Odp.: 39,19 g
tynowego. Oblicz, ile dm3 powietrza (warunki normalne)
64. Stężenie kwasu octowego w occie spożywczym wynosi
potrzeba do całkowitego spalenia 100 g stearyny. Przyjmij,
1,1 mol/dm3. Oblicz ile gram etanolu należy utlenić aby
że kwasy są zmieszane w stosunku molowym 1:3.
otrzymać 200 cm3 octu spożywczego.
Odp.: 963,2 dm3
Odp.: 10,12 g
50. Utleniono 86 g toluenu manganianem(VII) potasu zgodnie z 65. Jaką objętość wodoru, odmierzonego w warunkach normal-reakcją:
nych, można otrzymać w wyniku reakcji żelaza z 45 g 10%
5C
kwasu mrówkowego?
6H6CH3 + 6KMnO4 + 9H2SO4
C
Odp.: 1,12 g
6H5COOH + 3K2SO4 + 6MnSO4 + 14H2O
Oblicz, ile gramów 40-procentowego roztworu KMnO4 zużyto
66. Podczas przeprowadzania 70,5 g kwasu oleinowego
w tym procesie.
w stearynowy zużyto pewną ilość gazowego wodoru.
Odp.: 443 g
Oblicz jego
objętość
w
warunkach
normalnych.
51. Oblicz, ile gramów 5% kwasu octowego można otrzymać, Odp.: 5,6 dm3
mając
do
dyspozycji
50
g
jego
roztworu
80%?
67. W laboratorium można otrzymać tlenek węgla(II) w wyniku
Odp.: 800 g
dehydratacji
kwasu
metanowego
stężonym
kwasem
52. Oblicz, ile gramów kwasu octowego można otrzymać
siarkowym(VI) w podwyższonej temperaturze. Oblicz
z 11,2 dm3 acetylenu odmierzonego w warunkach normal-
objętość tlenku węgla(II) (warunki normalne), jaką można
nych, jeżeli całkowita wydajność procesu wynosi 80% ?
otrzymać
z
23
g
kwasu
mrówkowego.
Odp.: 24 g
Odp.: 11,2 dm3
53. Oblicz ile kg kwasu octowego otrzymamy w procesie
fermentacji octowej ze 150 kg 20% etanolu.
Odp.: 39,1 kg
- 3 -