Małgorzata Płonka, grupa poniedziałek 815
Oddychanie tlenowe roślin i wyznaczanie współczynnika oddechowego.
Oddychanie jest najbardziej powszechnym wskaźnikiem przebiegu procesów życiowych. Podczas
gdy inne procesy podstawowe dla życia rośliny wymagają specjalnych warunków i struktur (np.
asymilacja CO2, zachodząca wyłącznie w warunkach oświetlenia, w tkankach asymilacyjnych),
oddychanie przebiega stale w każdej żywej komórce, bez względu na jej stan fizjologiczny.
Zachodzi ono nawet wówczas, gdy inne procesy są zahamowane, np. w stanie anabiozy. Wszystkie
żywe organizmy wyposażone są w biochemiczny aparat oddechowy, tj. zestaw enzymów
katalizujących utlenianie substratów oddechowych.
Oddychanie jest wielostopniowym procesem utleniania substratu, związanym z wytwarzaniem
energii użytecznej metabolicznie. W przypadku najczęściej występującego substratu, glukozy,
oddychanie można podzielić na trzy główne etapy:
(1) glikolizę - częściowe utlenienie glukozy do pirogronianu z wydzieleniem niewielkiej ilości
ATP oraz redukcją dinukleotydu nikotynamidoadeninowego do NADH; przebiega
w cytoplazmie,
(2) cykl kwasów trikarboksylowych - całkowite utlenienie pirogronianu do CO2,
z wytworzeniem znacznej ilości zredukowanych nukleotydów (NADH, FADH2); zachodzi
w mitochondriach,
(3) łańcuch transportu elektronów z NADH na tlen - uwolnienie energii swobodnej, która w procesie fosforylacji oksydacyjnej bierze udział w wytworzeniu ATP z ADP i Pi.
W roślinach wymiana gazowa zachodzi dzięki systemowi przestworów międzykomórkowych, które
kontaktują się ze środowiskiem zewnętrznym przez szparki. Tlen dostarczany jest także w postaci
rozpuszczonej, w roztworze przepływającym naczyniami i soku floemu, a w komórce jego
dystrybucję ułatwia ruch cytoplazmy.
Miarą oddychania w warunkach fizjologicznych jest ilość tlenu pobieranego przez tkankę lub ilość
wydzielonego CO2. Wybór jednostek zależy od używanej metody lub typu doświadczenia,
mgCO
najcz
2
ęściej używa się
, to znaczy odnosi się ilość CO2 wydzielonego
g suchej masy⋅h
w jednostce czasu do suchej masy oddychającego obiektu, jednak lepszą podstawą do porównań
intensywności oddychania organizmów należących do różnych grup systematycznych jest natężenie
oddychania odniesione do zawartości białka w porównywanych organizmach. Określona tkanka
1
wykazuje tym większą intensywność oddychania, im szybszy jest jej wzrost i większa ogólna aktywność metaboliczna. Czynnikami wpływającymi na intensywność oddychania są też m.in.:
stężenie tlenu, temperatura, urazy mechaniczne i infekcje rośliny oraz, w niewielkim stopniu, naświetlenie.
1. Ilościowe oznaczanie natężenia oddychania metodą Pettenkofer'a.
Intensywność oddychania oznaczamy jako ilość wydzielonego CO2 przez kiełkujące nasiona,
w jednostce czasu na jednostkę świeżej lub suchej masy. W metodzie miareczkowej wydzielony
CO2 wiązany jest przez wodę barytową:
Ba(OH)2 + CO2 → BaCO3 + H2O
(COOH)2 + Ba(OH)2 → Ba(COO)2 + 2 H2O
Przesączyć 90 ml 0,02 N Ba(OH)2. Długą rurkę aparatu Pettenkofer'a przez jej prosty koniec napełnić 80 ml Ba(OH)2. Rurkę szybko i szczelnie zamknąć. Pozostałe 10 ml roztworu przelać do
małej kolby i szczelnie zamknąć. Do pierwszej płuczki odważyć 50 g kiełkujących nasion, do drugiej wlać nieprzesączony roztwór Ba(OH)2. Połączyć szczelnie wszystkie elementy tak, jak to
pokazano na rysunku.
Włączyć pompę wodną i stopniowo otwierać kran. Z pomocą kranu wyregulować szybkość
przepływu tak, aby odległość między pęcherzykami wynosiła ok. 1 cm. Po upływie 15 minut doświadczenie przerwać, zamknąć kran i wyłączyć pompę wodną. Wodę barytową w rurce
wstrząsnąć i szybko zlać do czystej kolby szklanej z doszlifowanym korkiem.
10 ml wody barytowej pobrać pipetą do małej kolbki, dodać 2 krople fenoloftaleiny i miareczkować
kwasem szczawiowym 0,045 N (1 ml zużytego kwasu odpowiada 1 mg CO2; jest to roztwór B
w tabeli). Następnie wykonać ślepą próbę, miareczkując 10 ml wyjściowego roztworu Ba(OH)2
(roztwór A). Różnica między tymi dwoma wartościami oznacza ilość CO2 związanego przez 10 ml
2
wody barytowej w aparacie Pettenkofer'a.
czas dośw. ilość Ba(OH)2 ilość nasion ilość roztworu A ilość roztworu B intensywność oddychania
[min]
[ml]
[g]
[ml]
[ml]
mg CO
[
2
]
g ś.m.⋅h
15
10
50
4,1
3,25
0,85
Całkowita intensywność oddychania (tj. intensywność oddychania 50 g kiełkujących nasion,
zmierzona wobec 80 ml Ba(OH)2 znajdujących się w aparacie Pettenkofer'a):
mg CO
80 [ml]
mg CO
0,85[
2 ] ⋅
⋅ 50[g]=340[
2
]
g ś.m.⋅h
10 [ml]
g świeżej masy⋅h
2. Pobieranie tlenu przy oddychaniu kiełkujących nasion.
Kiełkujące nasiona, umieszczone w zamkniętym naczyniu oddychają, pobierając tlen, a wydzielając
CO2. Jeżeli wydzielony CO2 zostanie pochłonięty, np. przez stężony roztwór jakiejś zasady, to wskutek zużycia tlenu w naczyniu nastąpi zniżka ciśnienia, którą można wykazać za pomocą manometru. Zużycie tlenu można wykazać także za pomocą palącego się łuczywa, które
w naczyniu z nasionami gaśnie.
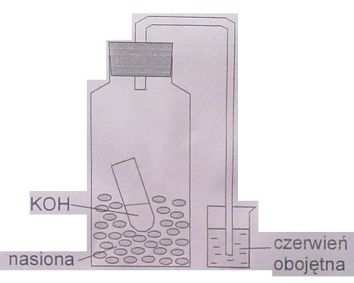
Butelkę z ciemnego szkła napełnić do połowy
kiełkującymi nasionami pszenicy. Do butelki
z nasionami wstawić probówkę ze stężonym
roztworem KOH. Szyjkę butelki szczelnie
zamknąć gumową zatyczką z rurką kapilarną
zgiętą pod kątem prostym ku dołowi, a jej
koniec zanurzyć w zlewce z barwnym
roztworem czerwieni obojętnej.
W trakcie przeprowadzania doświadczenia, ciecz w rurce kapilarnej podnosi się - jest to wynik
spadku ciśnienia gazów wewnątrz kolby, wskutek pobierania tlenu przez kiełkujące nasiona w procesie oddychania tlenowego i wydzielanie przez nie CO2, który zostaje pochłonięty przez
roztwór stężonej zasady (tworzy się podciśnienie, które zasysa barwną ciecz w rurce kapilarnej).
Literatura
1. Podstawy fizjologii roślin, pod red. Kopcewicz J., Lewak S., Wydawnictwo Naukowe PWN, 3
2. Skrypt do ćwiczeń z fizjologii roślin dla studentów III roku biologii
4