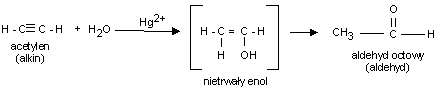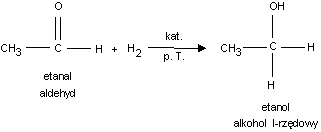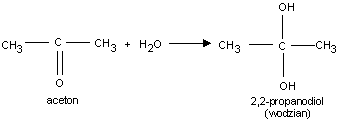Zachodniopomorski Uniwersytet Technologiczny w Szczecinie
Wydział Nauk o śywności i Rybactwa
Zakład Opakowalnictwa i Biopolimerów
I N S T R U K C J A
Ć W I C Z E N I E 8
Aldehydy i ketony
1.1 Probówki
1.2 Łaźnia wodna
1.3.Waga analityczna
1.4 Naczyńko wagowe
1.5 Palnik gazowy
1.6 Pipety
2. ODCZYNNIKI
2.1 10% NaOH –wodorotlenek sodu
2.2 NaHSO3
2.3 AgNO3 – azotan srebra
2.4 NH4OH – wodorotlenek amonu
2.5 Roztwór Fehlinga I i II
2.2 Aldehyd octowy
2.3 Aceton
2.4 Jod
3. CEL ĆWICZENIA
Celem ćwiczenia jest zapoznanie się i prawidłowe przeprowadzenie reakcji charakterystycznych aldehydów i ketonów a takŜe odróŜnianie aldehydów od ketonów.
4. ALDEHYDY I KETONY
4.1 Aldehydy
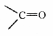
Są to związki, które w swojej cząsteczce zawierają grupę karbonylową C=O
która decyduje o ich właściwościach.
Atom węglowy grupy karbonylowej w tych związkach jest połączony z jednym atomem wodoru i jednym podstawnikiem weglowodorowym (wyjątek aldehyd mrówkowy).
Grupą funkcyjną w tych związkach jest jednowartościowa grupa aldehydowa (formylowa).
O
R
C
Wzór ogólny
H
Nazewnictwo: nazwę aldehydów tworzymy poprzez dodanie do nazwy węglowodoru końcówkę −al. np.: metanal − HCHO.
Nazewnictwo zwyczajowe tworzymy wyprowadzając nazwę aldehydu od nazwy kwasu, do którego moŜe być on utleniony.
HCHO − aldehyd mrówkowy (formaldehyd)
CH3CHO − aldehyd octowy (acetaldehyd)
4.1.1 Metody otrzymywania aldehydów
1. Odwodornienie lub utlenienie alkoholi I−rzędowych.
O
Kat.
R
CH
OH
R
C
+
2
H
T
2
H
np.
O
[O]
R
CH
OH
R
C
+ H
2
2O
H
2. Uwodnienie alkinów
O
HgSO4
CH
CH + HOH
R
C
H2SO4
H
np.
4.1.2 Właściwości fizyczne
Aldehyd mrówkowy dobrze rozpuszcza się w wodzie, jest gazem o ostrym przenikliwym zapachu. 40% roztwór nazywany jest formaliną. Posiada ona właściwości bakteriobójcze.
Aldehyd
octowy
równieŜ
dobrze
rozpuszcza
się
w
wodzie
a
takŜe
w rozpuszczalnikach organicznych. Jest cieczą o niskiej temperaturze wrzenia.
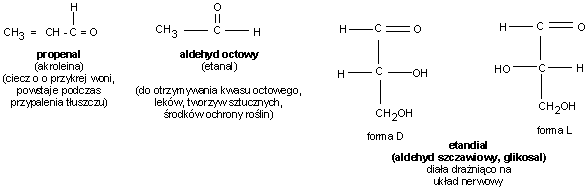
Pozostałe aldehydy są ciałami stałymi. Rozpuszczalność w wodzie wzrasta ze wzrostem masy cząsteczkowej. Posiadają charakterystyczne przyjemne zapachy.
4.1.3 Właściwości chemiczne
1. Reakcja utleniania aldehydów do kwasów karboksylowych
O
O
R
C
[O]
R
C
H
OH
2. Przyłączanie wodoru (redukcja) do alkoholi I−rzędowych.
O
[H]
R
C
R
CH2
OH
H
np.
3. Reakcje przyłączania (addycji): RMgI, HCN, NaHSO3, NH3, ROH
R1
O
OMgI
R
C
+ R1
MgI
R
C
H
H
jodek alkilomagnezu
R1
R
C
OMgI + H2O H+ R
C
OH+ Mg(OH)I
H
H
jodek hydroksymagnezu
OH
O
R
C
+ HCN
R
C
CN
H
H
cjanohydryna
OH
O
R
C + NaHSO
R
C
3
SO3Na
H
H
bisulfit
OH
O
R
C
+ H
NH
R
C
2
NH2
H
H
aldehydoamoniak
OH
O
R
C + R
R
C
OR
1
OH
1
H
H
półacetal
4. Reakcje kondensacji: 2 ROH, NH2OH, H2N−NH2
OR
O
1
R
C + 2R
R
C
OR
1
OH
1 + H2O
H
H
acetal
O
R
C + NH
OH
R
C
2
N
OH + H O
2
H
H
aldoksym
O
R
C + NH
NH
R
C
2
N
2
NH2 + H O
2
H
H
hydrazon
5. Reakcje polimeryzacji − dimeryzacja aldolowa
OH
O
O
O
rozc. NaOH
R
C
+ R
C
CH3
C
CH2
C
H
H
H
H
aldehyd -hydroksymasłowy (aldol)
4.2 Ketony
W tych związkach grupa karbonylowa połączona jest z dwoma podstawnikami węglowodorowymi.
R
C
R
Wzór ogólny
O
Grupa funkcyjna −grupa karbonylowa
Nazewnictwo tworzymy do nazwy węglowodoru dodając końcówkę −on.
4.2.1 Metody otrzymywania ketonów
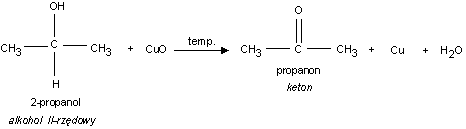
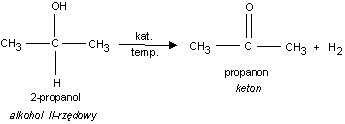
1. Utlenianie alkoholi II−rzędowych
Cu
R
C
R
R
C
R + H
T
2
OH
O
np.
2. Odwodornienie alkoholi II-rzędowych
[O]
R
C
R
R
C
R + H2O
OH
O
np.
3. Dekarboksylacja soli kwasów
CH3
COO
CH3
T
C
O + CaCO
Ca
3
CH3
COO
CH3
4.2.2 Właściwości fizyczne
NiŜsze ketony są cieczami, które dobrze rozpuszczają się w wodzie. Ze wzrostem masy cząsteczki ketonu rozpuszczalność maleje. Wszystkie ketony bardzo dobrze rozpuszczają się w wielu rozpuszczalnikach organicznych.
4.2.3 Właściwości chemiczne
1. Reakcja utleniania ketonów − zachodzi ono w bardzo trudnych warunkach. Aceton nie posiada właściwości redukujących czyli nie redukuje odczynnika Tollensa i Trommera.
O
OH
[O]
CH3
CH2
C
CH
CH
2
3
CH3
CH2
C
CH
CH3
CH3
CH2
COOH + HOOC
CH3
2. Reakcja redukcji do alkoholi II−rzędowych
[H]
R
C
R
R
C
R
O
OH
3. Reakcje addycji i kondensacji
O
H3C
CH3
st. H2SO4
3 CH
+ 3 H
3
C
CH3
2O
CH3
Przyłączają wodę tworząc nietrwałe wodziany.
Zagadnienia do przygotowania:
1. Słownictwo, właściwości chemiczne, fizyczne, metody otrzymywania aldehydów i ketonów.
2. RóŜnice w budowie i właściwościach aldehydów i ketonów.
3. Napisać reakcje etanalu i propanonu z: NH
−
−
3, NaHCO3, HCN, NH2 OH, NH2 NH2,
NH −
2 NHC6H5
4. Pewien związek organiczny reaguje z wodnym roztworem NaOH dając, substancję, która po utlenieniu przekształca się w aceton. Jaki to związek?
5. 2,4 g pewnego aldehydu poddano działaniu amoniakalnym roztworem srebra (I).
Powstałe srebro waŜyło 7,2 g. Jaki był to związek
6. Uzupełnić reakcje w podanych schematach:
eten → etanol → chlorek etylu → cyjanek etylu
etanol → eten → etanodiol → etanodiolan disodu
5. WYKONANIE ĆWICZEŃ
5.1 Redukujące właściwości aldehydów
Celem ćwiczenia jest zbadanie właściwości redukujących aldehydów.
Aldehydy łatwo utleniają się do kwasów karboksylowych, co dowodzi ich właściwości redukujacych. Aldehydy redukują amoniakalny roztwór tlenku srebra (Ag+→ Ag0) i miedź w płynie Fehlinga (Cu2+ → Cu+).
Przebieg ćwiczenia:
a) Próba Tollensa:
1. Przygotować dwie probówki, które naleŜy przemyć roztworem NaOH.
2. Do kaŜdej z nich wlać 3 cm3 4% roztworu AgNO3, a nastęnie dodać kroplami 10%
roztwór NH4OH, aŜ do rozpuszczenia wytrącającego się początkowo osadu.
3. Do pierwszej probówki wlać kroplami po ściance nieznanej substancji I.
4. Do drugiej probówki wlać kroplami po ściance nieznanej substancji II.
5. Probówki umieścić w łaźni wodnej z gorącą wodą.
6. Na ściance probówki z aldehydem moŜna zaobserwować tworzenie się lustra (metaliczne Ag).
Reakcje:
AgNO3 + NH4OH → ↓AgOH + NH4NO3
AgOH + 2 NH4OH→ [Ag(NH3)2]OH + 2H2O
2 [Ag(NH3)2]OH + HCHO → ↓2Ag + HCOOH + 4NH3 + H2O
b) Próba Trommera
1. Do dwóch probówek wlać po 1 cm3 roztworu Fehlinga I i II.
2. Następnie do pierwszej dodać kilka kropli roztworu I.
3. Do drugiej probówki dodać kilka kropli roztworu II.
4. Zawartość probówek ogrzać.
5. W probówce z aldehydem powstaje ceglasty osad.
Płyn Fehlinga składa się z dwóch roztworów:
1. Fehling I − wodny roztwór siarczanu miedzi CuSO4.
2. Fehling II − wodny roztwór winianu potasu i sodu zalkalizowany NaOH.
COONa
COONa
H
C
OH
HO
H
C
O
+
Cu
Cu + 2 H2O
H
C
OH
HO
H
C
O
COOK
COOK
COONa
COONa
H
C
O
H
C
OH
2
Cu + HCHO + 2 H2O
+ HCOOH + Cu2O
H
C
O
H
C
OH
COOK
COOK
Zadania i pytania:
1. Opisać obserwacje i spostrzeŜenia z przeprowadzonego ćwiczenia.
2. Napisać reakcje przebiegu ćwiczenia.
3. Określić, w której próbie znajduje się aldehyd?
4. Dlaczego ketony dają ujemny wynik próby Tollensa i Trommera?
5.2 Reakcja kondensacji aldolowej
Celem ćwiczenia jest obserwacja działania aldehydów z rozcieńczonymi zasadami.
Zachodzi wówczas połączenie dwóch czasteczek aldehydu i powstaje aldol. Niektóre aldole mają skłonność do odłączania wody i przechodzenia w aldehydy nienasycone.
Przebieg ćwiczenia:
1. Do probówki wlać 4 cm3 wody destylowanej.
2. Następnie dodać dwie krople 10% roztworu NaOH oraz około 0,5 cm3 aldehydu octowego.
3. Zawartość probówki wymieszać, a następnie ostroŜnie zagotować (palnik gazowy) 4. Aldehyd, który powstaje ma Ŝółtą barwę oraz charakterystyczny zapach.
Reakcje:
O
O
T
CH3
C
O + H
CH2
C
CH3
CH
CH2
C
- H2O
H
H
H
OH
O
T
CH
CH
CH
C
- H
3
2 O
H
Zadania i pytania:
1. Opisać obserwacje i spostrzeŜenia z przeprowadzonego ćwiczenia.
2. Napisać reakcje przebiegu ćwiczenia.
5.3 Tworzenie przez ketony połączeń siarczynowych
Celem ćwiczenia jest przeprowadzenie i obserwowanie reakcji addycji aldehydów i ketonów z NaHSO3. Tworzą się wiązania wodorosiarczynowe.
Przebieg ćwiczenia:
1. Do probówki z korkiem o pojemności 10 cm3 wlać 2 cm3 acetonu.
2. Dodać do probówki kilka kropli nasyconego wodnego roztworu NaHSO3.
3. Probówkę zamknąć korkiem i wytrząsnąć.
4. Po kilku minutach wydziela się biały, krystaliczny osad.
Reakcja:
SO3Na
CH3
C
CH3 + NaHSO3
CH
C
CH
3
3
O
OH
bisulfit
Zadania i pytania:
1. Opisać obserwacje i spostrzeŜenia z przeprowadzonego ćwiczenia.
2. Napisać reakcje przebiegu ćwiczenia.
5.4 Wykrywanie ketonów
Celem ćwiczenia jest określenie, w której z próbówek znajduje się keton. Ketony zawierające grupę metylową związaną z grupą karbonylową (metyloketony) ulegają charakterystycznym barwnym reakcjom w środowisku zasadowym.
Próba Gunninga
Przebieg ćwiczenia:
1.OdwaŜyć na wadze analitycznej (naczyńko wagowe) 0,25 g jodu (dwukrotnie).
2.Do dwóch próbówek wlać po 5 cm3 10% roztworu NaOH.
3.Do pierwszej i drugiej probówki dodać po 0,25g jodu (wcześniej nawaŜonego).
4.Gdy jod w probówkach się rozpuści, do pierwszej probówki dodać 1 cm3 roztworu II natomiast do drugiej 1 cm3 roztworu III.
5.Probówki ogrzewać ostroŜnie w płomieniu palnika.
6.Po kilku minutach zawartość probówki ochłodzić.
7.W przypadku ketonu powstaje pomarańczowa obwódka, aldehydy nie dają tej reakcji.
Reakcje:
O
CH3
CO
CH3 + 3 I2 + 4 NaOH
CHI3 + CH3
C
+ 3 H2O + 3 NaI
ONa
Zadania i pytania:
1. Określić gdzie znajduje się keton, w której próbce?
2. Opisać obserwacje i spostrzeŜenia z przeprowadzonego ćwiczenia.
3. Napisać reakcje przebiegu ćwiczenia.
Literatura uzupełniająca:
1. Kupryszewski G., 1994. Wstęp do chemii organicznej. Wydawnictwo Gdańskie, Gdańsk
2. Dobkowska Z., K. M. Puzdro, 1980. Szkolny poradnik chemiczny. WSiP Warszawa 3. McMurry J., 2000. Chemia organiczna. PWN; Warszawa
4. Marzec H., 2001. Chemia organiczna. WU ATR; Bydgoszcz
5. Roberts J. D., M. C. Caserio, 1969. Chemia organiczna. PWN Warszawa 6. Mastalerz P., 1984. Chemia organiczna. PWN Warszawa
7. Tomasik P., 1998. Mechanizmy reakcji organicznych; WN PWN Warszawa-Łódź