emitowanie elektronów z powierzchni metalu
(np. potasu),
na którą pada promieniowanie ultrafioletowe.
Efekt Comptona:
zderzenie fotonu ze swobodnym elektronem
Zasada Heisenberga
Konsekwencją dualistycznego (korpuskularno-falowego) charakteru materii jest zasada
nieoznaczoności Heisenberga, która stwierdza, że nie jest możliwe równoczesne określenie położenia i pędu cząstki z dowolną dokładnością:
h
x
∆ p
∆ ≥ π4
F a lo w y m o d el b u d o w y a to m u
R ó w n a n ie S ch rö d in g era
h 2 ∂ ψ
2
∂ ψ
2
∂ ψ
2
Ze 2
−
+
+
2
2
2
−
ψ = ψ
π
E
8 m ∂ x
∂ y
∂ z
r
czy li
en erg ia = en erg ia k in ety czn a elek tro n u + en erg ia
p o ten cja ln a elek tro n u
h - sta ła P la n ck a (6 ,6 2 · 1 0 -34 J s)
m - m a sa czą stk i
E – en erg ia czą stk i
ψ - funkcja falow a opisująca stan danego elektronu w
p rzestrzen i i cza sie
Funkcja falowa Y jest amplitudą prawdopodobieństwa w punkcie przestrzeni określonym współrzędnymi x, y, z. W przypadku elektronu funkcja falowa Y określa zatem prawdopodobieństwo znalezienia tej cząstki w określonym miejscu przestrzeni wokół atomu, a także określa najbardziej prawdopodobne wartości jego energii.
Rozwiązaniem równania Schrödingera są pewne funkcje własne, które można
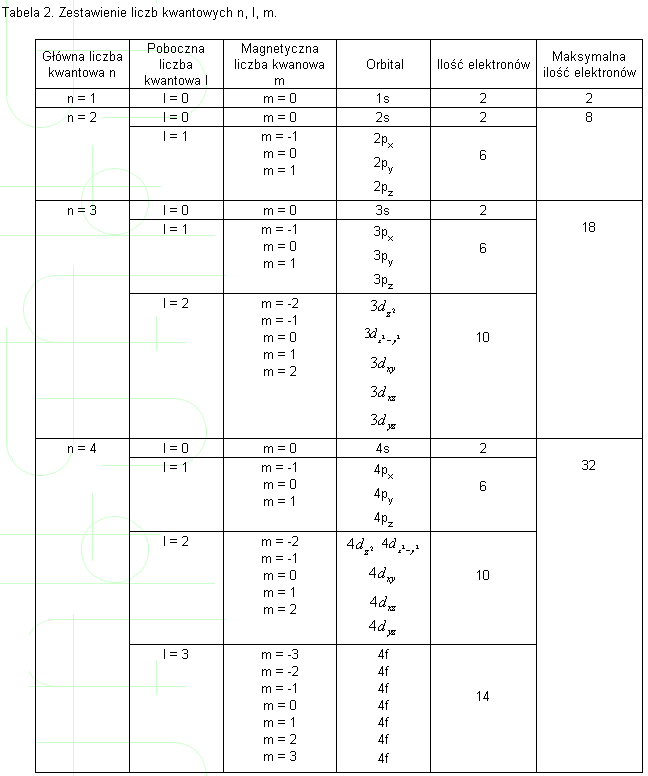
scharakteryzować przy pomocy zestawu trzech liczb kwantowych n, l, m. Liczby kwantowe nie mogą być dowolne, muszą przyjmować jedynie pewne wartości.
Liczba n jest nazywana główną liczbą kwantową może przyjmować wartości .
kolejnych liczb naturalnych (całkowitych, dodatnich): 1, 2, 3......
Liczba n jest nazywana główną liczbą kwantową może przyjmować wartości kolejnych liczb naturalnych (całkowitych, dodatnich): 1, 2, 3......
Poboczna liczba kwantowa l może przybierać wartości 0, 1, 2... (n - 1). Liczba m nazywana jest magnetyczną liczba kwantową. Liczba m osiąga wartości z przedziału <-l,+l>.
Poszczególne orbitale określa się skrótami, które zawierają główną liczbę kwantową oraz poboczną liczbę kwantową, przy czym ta ostatnia podana jest w postaci litery. Przyjęto nazywać wartość l = 0 literą s, l =1 literą p, l = 2
literą d l = 3 literą f. Litery te pochodzą od angielskich słów sharp, principle,
diffuse, fundamental i zostały wzięte z określeń stosowanych dla określenia widm w analizie spektralnej.
Graficzny zapis orbitalu
Obrazem graficznym orbitalu jest fragment przestrzeni,
w której prawdopodobieństwo znalezienia elektronu jest duże.
Każdy orbital ma inny kształt i orientację przestrzenną,
a zajmujący go elektron charakteryzuje się inną energia.
Orbitale typu s mają kształt kuli.
Wyszukiwarka
Podobne podstrony:
Dok3
Dok3
Dok3 dobór przewodów
Dok3
Dok3
Dok3
Dok3
Dok3
Dok3
Dok3
dok3 YO2M5YR4GRVP6YCSXZFAFLE474OWVFHBSNCR3BI
Dok3 (20)
Dawki leków dok3
Dok3
Dok3
SZABLONY DO WORDA, DOK3
dok3
dok3 2
Dok3 (3)
Dok3
więcej podobnych podstron