LABORATORIUM TERMODYNAMIKI
BILANS UKŁADU OTWARTEGO – POMIAR WARTOŚCI OPAŁOWEJ
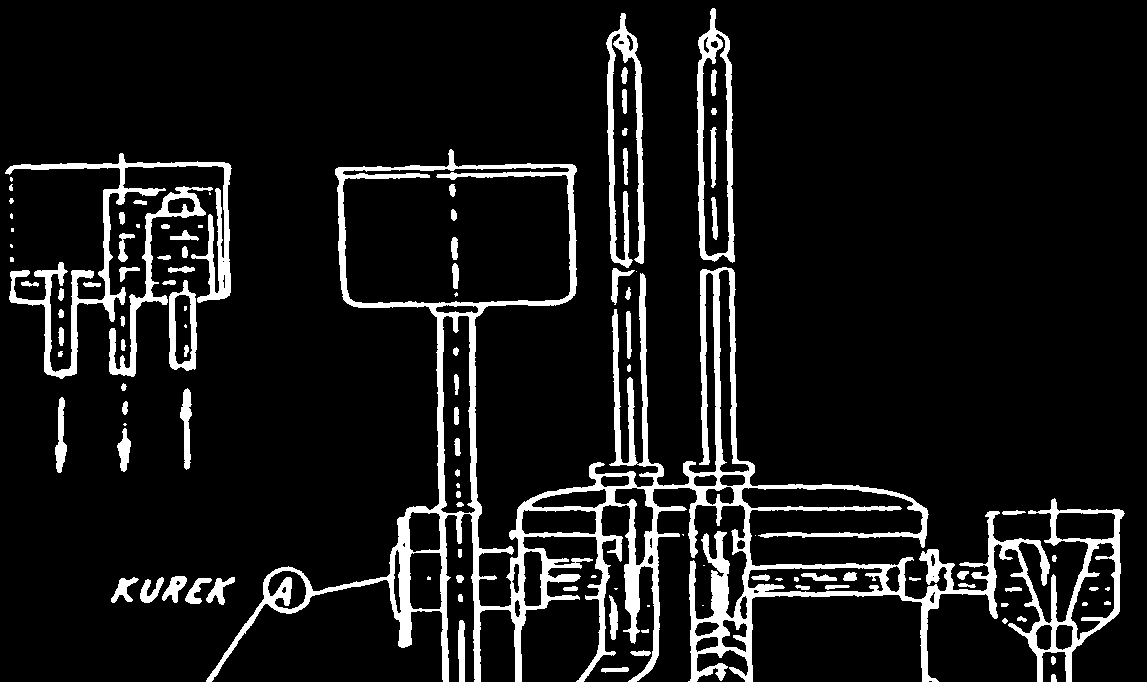
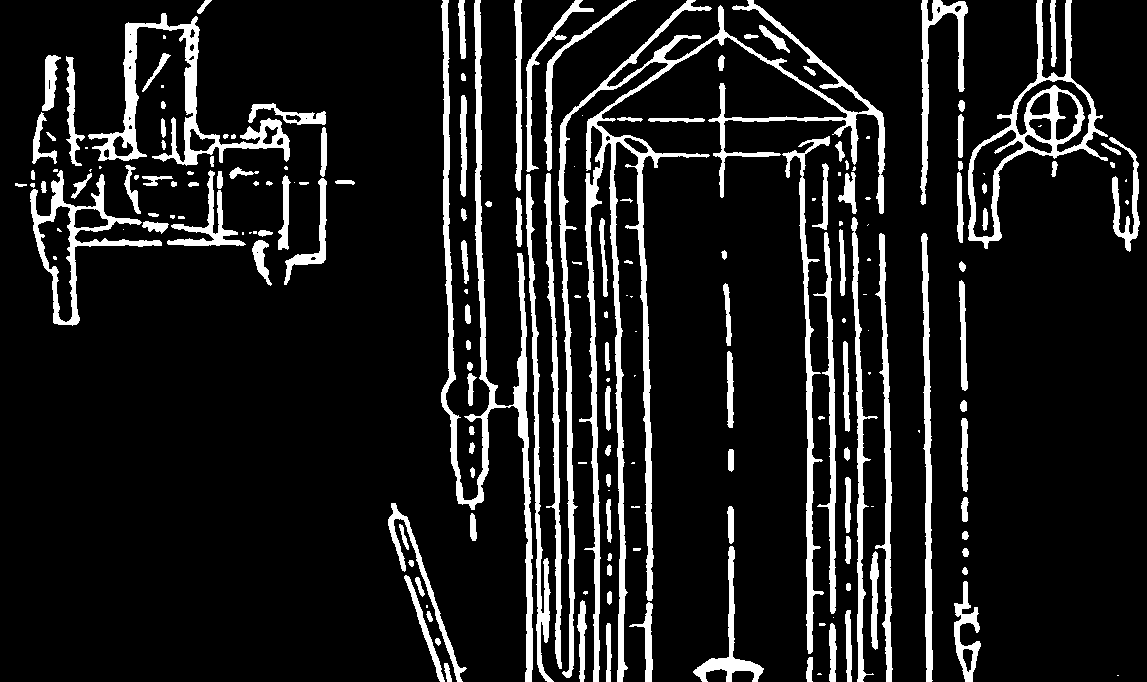
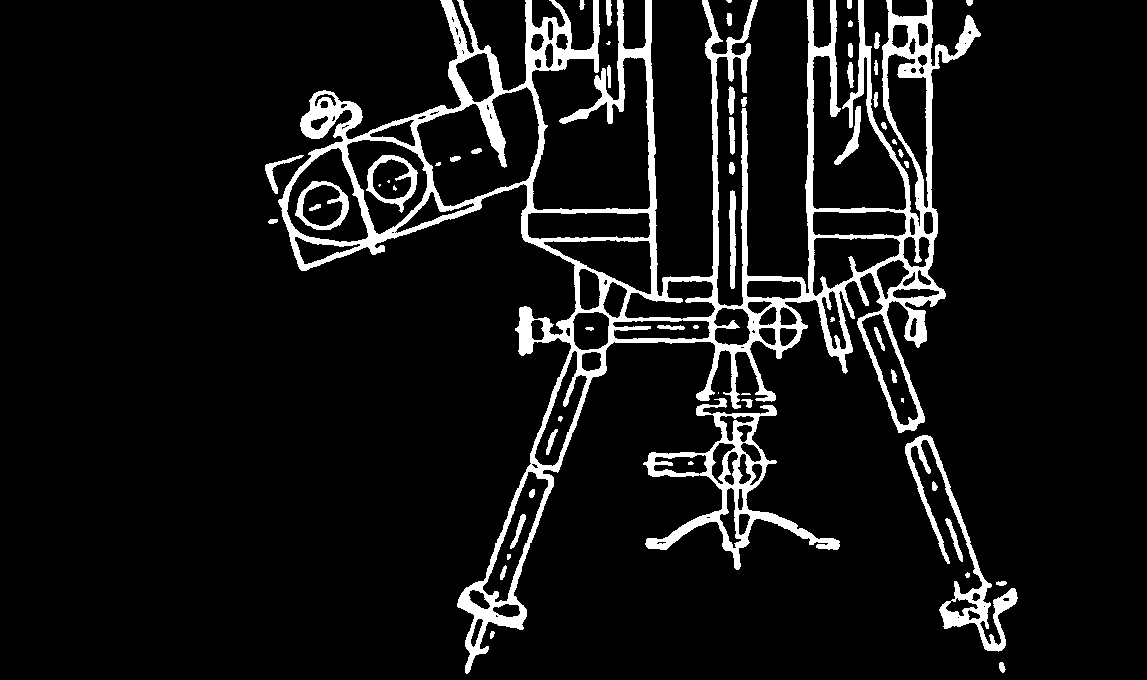
PALIW GAZOWYCH (KALORYMETR JUNKERSA) 1. Schemat kalorymetru z zaznaczonymi punktami pomiarowymi.
temperatura wody
wchodzącej
temperatura wody
wychodzącej
Ć
A
W
Y
wylot wody
chłodzącej
IS
I
temperatura
P
spalin
S
IE
I
wylot skroplin
N
Przedmiotem badania był gaz palny, którego właściwości naleŜało określić korzystając z kalorymetru Junkersa. Jego działanie opiera on się na I zasadzie termodynamiki i bilansu energii. Podpalony palnik z badanym gazem naleŜało umieścić w środku kalorymetru, a następnie ustawić temperaturę wody chłodzącej. Aby zminimalizować straty średnia wartość temperatury wody na wejściu i wyjściu musi być w przybliŜeniu równa wartości temperatury otoczenia. Po kaŜdym spaleniu 1 litra gazu sprawdzane były termometry wody chłodzącej. Po spaleniu 5 litrów gazu następowało wyznaczenie masy wody chłodzącej oraz objętość skroplin. Po zapisaniu wyników badanie zostało powtórzone.
3. Dane początkowe.
- temperatura otoczenia: To = 22 oC = 295,15 K
- ciśnienie atmosferyczne: pa = 757 mmHg = 102258 Pa
- temperatura gazu: Tg = 20 oC = 293,15 K
- nadciśnienie gazu: pn = 45 mmHg = 5999,5 Pa
4. Badanie I.
Ć
Wyniki pomiarów:
A
temperatura temperatura
wskazanie
wody na
wody na
gazomierza
wejściu
W
we [oC] Ywyjściu
Vg [m3]
T
T
02
IS
I
wy [oC]
0
12,5
31,2
0,001
12,5
31,2
0,0
0,0 P
12,4
31,4
0,003
12,5
31,4
0,004
12,5
31,4
= 7 kg
S
05 12,5 31,4
średnia:
12,483
31,333
- masa wody: mw
- objętość skroplin
ra spal I:
in: E
IVskr = 14 cm3 => masa skroplin: mskr = 14 g
- temperatu N Tspal = 14,5 oC
Obliczenia:
VN – objętość gazu spalonego odniesiona do warunków normalnych p – ciśnienie gazu
p = p + p
p = 102258 + 5999 5
, = 108257 [
5
, Pa]
a
n
dla Vg = 0,01 m3
p
T
108257 [
5
, Pa] 273 1
, [
5 K ]
N
V =
⋅
⋅ V
3
3
V =
⋅
⋅ ,
0 001 m
= 0
,
0 00995771 m
N
g
p
T
N
10130 [
0 Pa] 293 1
, [
5 K ]
[ ]
[ ]
N
g
− t )
ciepło spalania:
w
w
wy
we
W =
t
VN
Przyjmując:
cw = 4,187 kJ/kgK
twy – średnia temperatura na wyjściu twe – średnia temperatura na wejściu
[
kJ
7 kg]
⋅ 1
,
4 87
⋅ 3
( 1 3
, 33 −1 ,
2 483 [
) K ]
kgK
kJ
MJ
W
t =
110964 0
, 862
111
5 ⋅ 0
,
0 0099577 [ 3
2 m ]
=
3 ≈
3
m
m
r ⋅ m
wartość opałowa:
skr
W = W −
u
t
VN
Przyjmując
r = 2500 kJ/kg
Ć
kJ
2500
⋅ 0
,
0 1 [
4 kg]
kJ
kg
kJ
MJ
W
u = 110964 0
, 862
103934 3
, 645
104
3 −
m
5 ⋅ 0
,
0 0099577 [ 3
2 m ] =
A
5. Badanie II.
W 3≈ 3
m
m
Wyniki pomiarów:
Y
temperatura temperatura
wskazanie
wody na
wody na
gazomierza
IS
I
V
3
g [m P wejściu
wyjściu
S
] Twe [oC] Twy [oC]
0
12,45
31,4
0,001
12,45
31,45
IE
I 0,002 12,5 31,3
0,003
12,5
31,35
0,004
12,55
31,4
N 0,005 12,6 31,4
średnia:
12,508
31,383
- masa wody: mw = 6,72 kg
- objętość skroplin: Vskr = 15 cm3 => masa skroplin: mskr = 15 g
- temperatura spalin: Tspal = 14,5 oC
Obliczenia:
ciepło spalania:
kJ
7
,
6
[2 kg]
⋅ 1,
4 9
⋅ 3
( 1 3
, 83 −12 5
, 08 [
) K ]
kgK
kJ
MJ
W
t =
10674 ,
3 2304
107
5 ⋅ 0
,
0 0099577 [ 3
2 m ]
=
3 ≈
3
m
m
wartość opałowa:
kJ
250
0
⋅ 0
,
0 1 [
5 k ]
g
kJ
kg
kJ
MJ
Wu =1067 3
,
4 230
4
992 1
,
1 38576
99 2
,
3 −
m
5⋅ 0
,
0 0099577[ 3
2 m ] =
3 ≈
3
m
m
6. Wnioski
Podczas obu prób uzyskano róŜne wyniki spowodowane jest to niedokładnością aparatury pomiarowej, np. zakończenie obu pomiarów miało być dokonane po spaleniu 0,05
m3 gazu, co jest bardzo trudno dokładnie wyznaczyć. Dlatego ciepło spalania i wartość opałowa najlepiej jest obliczać wykonując kilka prób, a wynik ostateczne będzie ich średnią.
MJ
MJ
W tym przypadku W ≈ 109
, W ≈ 101 6
,
. W obu pomiarach wartość opałowa jest o t
3
u
m
3
m
ok. 10% mniejsza od ciepła spalania, co jest zgodne z danymi z tablic. Nie z y podcĆ
nając dokładnej
charakterystyki badanego gazu trudno jest określić błąd popełnian o otocze Azas pomiarów.
Niedokładność moŜe być spowodowana niecałkowitym i niezupełnym spalaniem gazu, izolacja kalorymetru mogła nie zapewniać w dostatecznym stopniu małych strat ciepła do otoczenia, część pary wodnej mogła nie być skroplona i ujść dWnia wraz ze spalinami, ponadto temperatura spalin nie była równa temperaturze otoczenia.
Y
IS
I
P
S
IE
I
N