Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
Wykład 5.
TEORIA PASMOWA CIAŁA STAŁEGO
METALE, PÓŁPRZEWODNIKI i DIELEKTRYKI
1) Rozpatrzmy strukturę elektronową typowego metalu, to
jest sodu.
Jest to metal którego atomy posiadają tylko 1 elektron
walencyjny → znajduje się on na orbitalu 3s.
2) Teraz rozpatrzmy sieć przestrzenną zbudowaną z dwóch
atomów. Następuje nakładanie się zewnętrznych orbitali 3s, a w wyniku powstają dwa orbitale cząsteczkowe:
- orbital wiąŜący o energii niŜszej,
- orbital antywiąŜący o energii wyŜszej.
Wykład 5. Teoria Pasmowa Ciała Stałego
1/9



Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
3) Dla 3 atomów pojawiają się 3 orbitale cząsteczkowe, tj.
wiąŜący, niewiąŜący i antywiąŜący.
4) Teraz rozpatrzmy sieć przestrzenną złoŜoną z N - atomów
→ opisuje je N orbitali cząsteczkowych.
KaŜdemu z tych orbitali odpowiada inny poziom energetyczny.
W rzeczywistości poziomy te są tak blisko, Ŝe tworzą ciągłe pasmo stanów energetycznych
odległości tych poziomów są rzędu 10-22 eV tj. 10-41 J
Wykład 5. Teoria Pasmowa Ciała Stałego
2/9
Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
Takie pasmo energetyczne jest tylko w połowie zapełnione
elektronami.
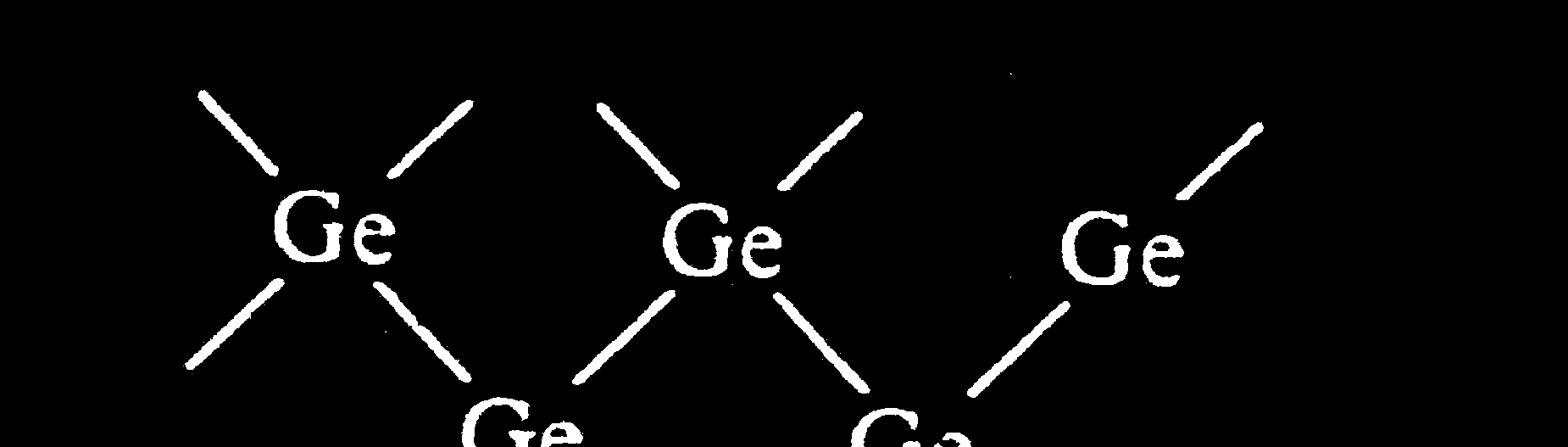
5) Co się dzieje z orbitalami 3p?
W miarę zbliŜania się atomów sodu do odległości ro
(odległość 2 węzłów) rozszczepieniu ulega
teŜ zdegenerowany poziom energetyczny 3p.
Wykład 5. Teoria Pasmowa Ciała Stałego
3/9




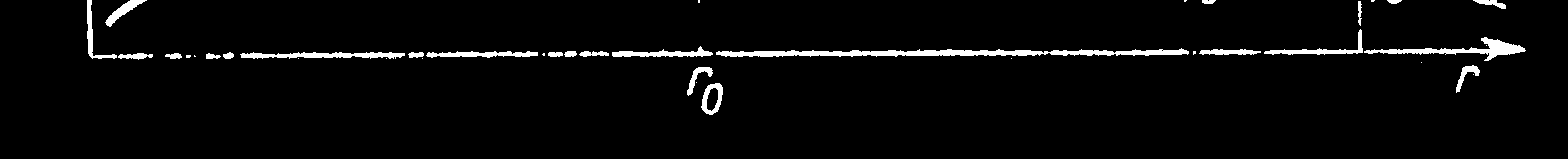
Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
6) Pasma 3s i 3p tworzą jedno wspólne pasmo. Tak więc łączna liczba zdelokalizowanych orbitali wynosi 4 N dla
N - atomów. Mogą one pomieścić 8 N - elektronów.
Wykład 5. Teoria Pasmowa Ciała Stałego
4/9
Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
7) Tak więc powstało szerokie pasmo tylko częściowo
wypełnione elektronami → jest to charakterystyczne dla
metali.
8) W temp. 0 K zajęte są tylko poziomy najniŜej połoŜone
- poziomy Fermiego.
9) W miarę podwyŜszania temperatury elektrony przechodzą
na coraz wyŜsze poziomy.
10) Takie rozszczepienie poziomów energetycznych zachodzi
nie tylko w metalach. Ale w kryształach nie wykazujących właściwości metalicznych, pasma energetyczne nie zachodzą
na siebie.
Wykład 5. Teoria Pasmowa Ciała Stałego
5/9

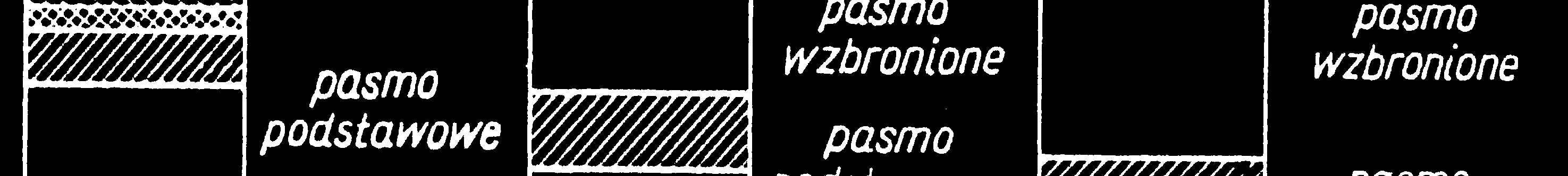

Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
WyróŜniamy tutaj :
podstawowe
pasma przewodnictwa
wzbronione
Izolatory
- diament, kwarc (SiO2), tlenek magnezu (MgO) Pasmo
wzbronione 5 - 10 eV → przewodnictwo elektryczne w bardzo
wysokiej temperaturze lub pod wpływem bardzo wysokiego
napięcia elektrycznego.
Wykład 5. Teoria Pasmowa Ciała Stałego
6/9




Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
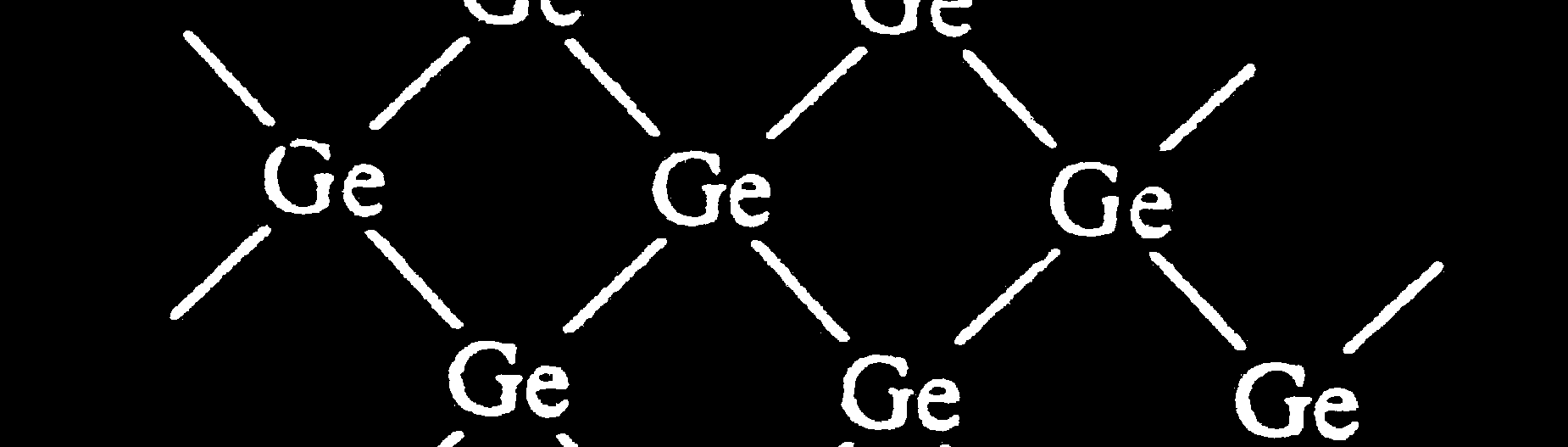
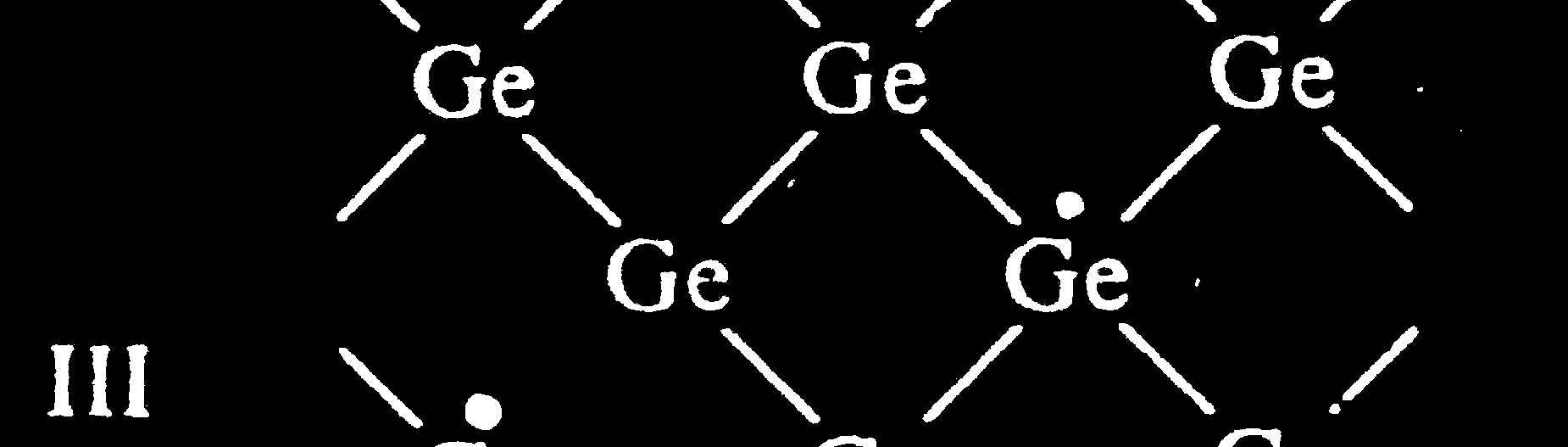
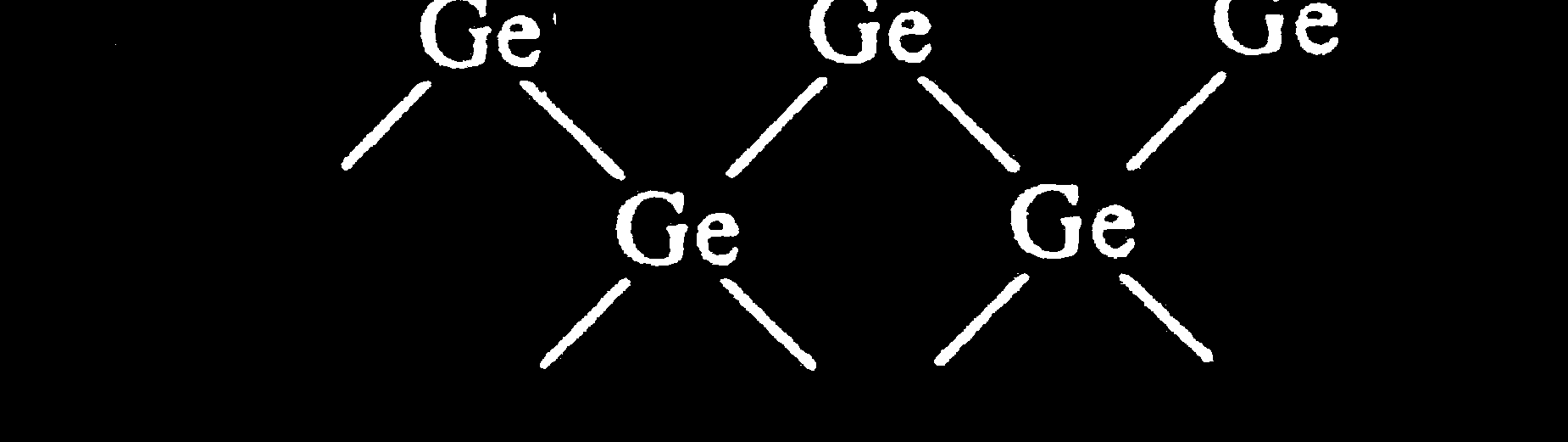
Półprzewodniki
- np. german (sieć typu diamentu)
- Pasmo wzbronione 1 - 2 eV
I
- Przemieszczanie się dziury
elektronowej i swobodnego
elektronu – przewodnictwo samoistne.
Wykład 5. Teoria Pasmowa Ciała Stałego
7/9






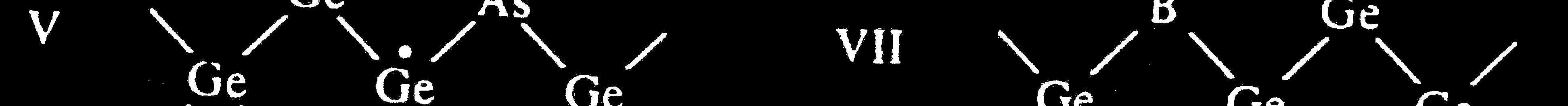


Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
Przewodnictwo typu n
Przewodnictwo typu p
Domieszka arsenu → nadmiar jednego elektronu → centrum donorowe → przewodnictwo typu n
Domieszka boru → niedobór jednego elektronu dziura elektronowa
→ centrum akceptorowe → przewodnictwo typu p
Wykład 5. Teoria Pasmowa Ciała Stałego
8/9





Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
pasmo
przewodnictwa
Centrum
donorowe
Centrum
akceptorowe
pasmo
podstawowe
Półprzewodnik Półprzewodnik
typu n typu p
Koniec rozdziału V
Wykład 5. Teoria Pasmowa Ciała Stałego
9/9