Nowoczesne metody w biologii molekularnej
Prowadzący – dr hab. Jerzy Kruk, dr Beata Myśliwa-Kurdziel Anizotropia fluorescencji DPH jako metoda badania płynności błon biologicznych
Metoda pomiaru anizotropii fluorescencji.
Jedną z powszechnie stosowanych metod badania własności strukturalnych i dynamicznych błon biologicznych, zarówno modelowych jak i naturalnych, są pomiary fluorescencyjne. Niewątpliwą zaletą tej metody jest możliwość przeprowadzania pomiarów w roztworach w warunkach zbliżonych do fizjologicznych, a także wysoka czułość, powtarzalność i łatwość analizy. W przypadku gdy badane układy nie wykazują fluorescencji własnej, wprowadza się do nich cząsteczki fluoryzujące, tzw. sondy (znaczniki) fluorescencyjne. Procesy zachodzące w otoczeniu sondy, w nanosekundowym czasie trwania zjawiska fluorescencji, wpływają na emisję światła, przy czym zmiany mogą dotyczyć położenia maksimum emisji, wydajności kwantowej, anizotropii, oraz czasu i charakteru zaniku fluorescencji.
Jedną z powszechniej stosowanych sond fluorescencyjnych w badaniach błon modelowych –liposomów jest DPH.
Difenyloheksatrien
DPH (1, 6-dwufenylo-1, 3, 5-heksatrien) jest węglowodorowym polienem o stabilnej konformacji all-trans posiadającym wydłużony kształt, który jest stabilny chemicznie i łatwo wbudowuje się w matrycę błon. DPH posiada ponadto wiele zalet dzięki, którym jest dobrym znacznikiem fluorescencyjnym powszechnie używanym do monitorowania płynności błon.
Cechuje go wysoka wydajność kwantowa, dobre odseparowanie pasma emisji fluorescencji od pasm absorpcyjnych składników błon. Dipole wzbudzenia i emisji DPH są mniej więcej kolinearne z osią symetrii cząsteczki. Z tego powodu rotacja wokół długiej osi molekularnej, zasadniczo nie wnosi wkładu do anizotropii fluorescencji, podczas gdy rotacje wokół dwóch pozostałych; ortogonalnych wzajemnie i prostopadłych do długiej osi, są w stanie depolaryzować fluorescencje. Cylindrycznie symetryczny kształt cząsteczki DPH pozwala na prosty opis molekularnej dynamiki w środowisku dwuwarstwy lipidowe. W ostatnich latach zaproponowano kilka modeli opisujących zachowanie się cząsteczki DPH w dwuwarstwie lipidowej.
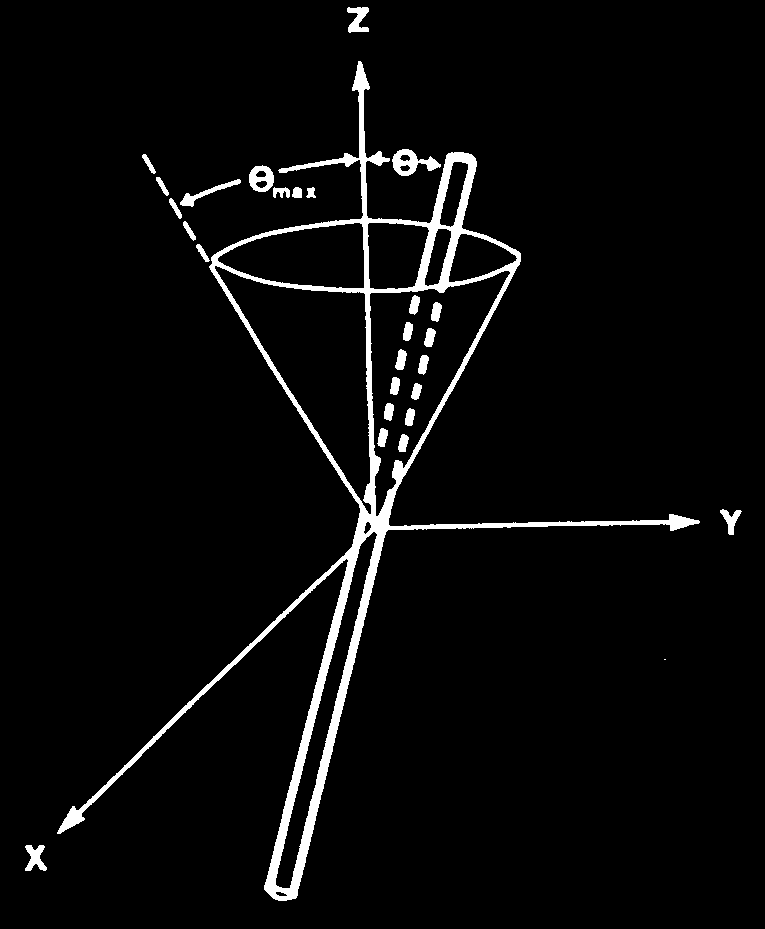
W jednym z modeli zakłada się, że cząsteczka sondy może wykonywać swobodną dyfuzję, ograniczoną jednak w ramach pewnego kąta bryłowego, w formie stożka.
Rozwartość stożka charakteryzuje pośrednio stopień uporządkowania łańcuchów lipidowych w dwuwarstwie.
1
W innym modelu, zwanym modelem silnych
zderzeń, cząsteczka sondy doznaje nagłych zmian
na skutek silnych zderzeń z łańcuchami
węglowodorowymi fosfolipidów. W wyniku tych
zderzeń dochodzi do szybkich przeskoków z jednej
pozycji kątowej w inną.
Trzeci
z
proponowanych modeli zakłada, że reorientacja
znacznika jest wynikiem kolejnych bardzo małych
obrotów zachodzących w wyniku zderzeń z
lipidowymi cząsteczkami.
W izotropowym roztworze nie ma
uprzywilejowanego kierunku uporządkowania
cząsteczek. Anizotropia fluorescencji jest związana Schemat swobodnej rotacji w stożku wyłącznie z tzw. zjawiskiem fotoselekcji, które ma znacznika fluorescencyjnego DPH.
miejsce podczas procesu wzbudzenia. Elektronowe
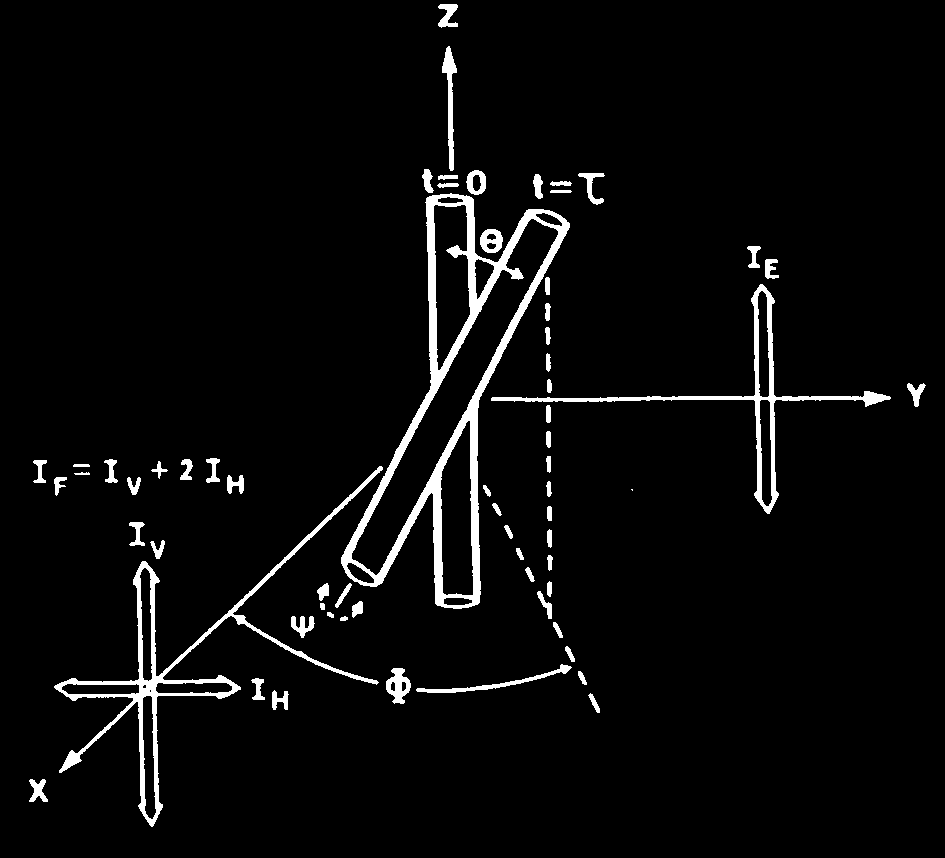
obsadzenie podstawowego i wzbudzonego stanu fluoroforu, definiuje w cząsteczce kierunki, w których możliwość absorpcji i emisji fotonu są największe (kierunki momentów dipolowych wzbudzenia i emisji) . Gdy spolaryzowane światło wzbudzające zostanie skierowane na cząsteczkę chromoforu, której dipolowy moment wzbudzenia jest równoległy do wektora elektrycznego światła wzbudzającego, to chromofor preferencyjnie zaabsorbuje to światło. Ponieważ proces absorpcji jest szybszy niż rotacja molekuły, użycie zorientowanego światła wzbudzającego wytwarza populację preferencyjnie zorientowanych wzbudzonych fluoroforów (fotoselekcja). W związku z tym, że emisja fotonu przez wzbudzony fluorofor wymaga znacznie dłuższego czasu (czas życia stanu wzbudzonego) niż absorpcja, fluorofor może wielokrotnie przeorientować się, zanim wyemituje foton.
Jeżeli taka sytuacja zaistnieje (tj rotacyjny czas korelacji wzbudzonej cząsteczki jest krótszy niż czas życia stanu wzbudzonego) , wyemitowany foton nie będzie już spolaryzowany równolegle do fotonu wzbudzającego, nawet jeżeli dipole wzbudzenia i emisji są równoległe wewnątrz fluoroforu. Ostateczna polaryzacja fluorescencji jest często definiowana jako anizotropia fluorescencji stanu stacjonarnego.
IVV − GIVH
A =
IVV + G
2 IVH
IVV, IVH -natężenia mierzone w kierunku odpowiednio równoległym i prostopadłym do wektora elektrycznego światła wzbudzającego.
Widać, że im większa wielkość reorientacji fluoroforu podczas czasu życia jego stanu wzbudzonego, tym mniejsza będzie obserwowana anizotropia fluorescencji, aż do A=0 dla całkowitej reorientacji IV=IH) fluoroforu. W tym sensie pomiar anizotropii fluorescencji dostarcza informacji o płynności błon biologicznych.
2
Schemat obrazujący istotę pomiaru
anizotropii fluorescencji.
Liposomy jako modelowe błony biologiczne.
Badania interakcji lipidów prenylowych z łańcuchami acylowymi kwasów tłuszczowych można przeprowadzać na błonach modelowych - liposomach jednowarstwowych. Liposomy są to pęcherzyki utworzone z jednej, podwójnej warstwy lipidowej, posiadające kształt elipsoidalny lub zbliżony do kulistego i zawierające w swym wnętrzu wodę. Liposomy utworzone z DPL zawierają średnio 2700 molekuł lipidu, zaś ich średnica wynosi 250Å. Sztuczne fazy liotropowe można otrzymać, stosując naświetlanie ultradźwiękami mieszanin lipidów z wodą, lub jak to było w przypadku prezentowanych badań -przez bardzo powolne wstrzykiwanie etanolowego roztworu fosfolipidu do silnie mieszanej wody. Ich tworzenie związane jest z amfifilowymi własnościami lipidów. Uważa się, że otrzymane w ten sposób jednowarstwowe liposomy są dobrą reprezentacją rzeczywistej architektury błon biologicznych.
Struktura i termiczne przejścia fazowe fosfolipidów.
² DPL - dwupalmitynofosfatydylocholina jest fosfolipidem, w którym do grup hydroksylowych dołączone są dwie reszty nasyconego kwasu palmitynowego (16: 0), oraz grupa fosforanowa tworząca wiązanie estrowe z alkoholem - choliną. Najbardziej stabilnym stanem łańcucha węglowodorowego kwasów tłuszczowych jest konformacja all-trans. Odległości między atomami węgla wynoszą wtedy około 1. 533A, podobnie jak odległość C-C w diamencie, a miara kąta tego wiązania oscyluje wokół wartości 112°. DPL dzięki własnościom amfifilowym tworzy spontanicznie w środowisku wodnym struktury dwuwarstwowe.
Grubość rdzenia hydrofobowego błony utworzonej przez ten lipid wynosi około 30A (podobnie jak błony tylakoidu. Dwuwarstwy z DPL, podobnie jak wszystkie lecytyny nasycone, posiada trzy główne przejścia temperaturowe pierwszego rzędu: sub-, przed-, i główne przejście fazowe. Stąd są cztery oddzielne stany fizyczne odpowiadające różnym zakresom temperaturowym pomiędzy tymi przejściami.
3
Schematyczna prezentacja różnych lamellarnych
i kwazilamellarnych stanów dwuwarstwy
Pierwszym stanem, odpowiadającym temperaturom poniżej 25°C jest stan, w którym występują specyficzne oddziaływania między łańcuchami węglowodorowymi, powodując ich upakowanie w prostokątny układ. W temperaturze około 25°C DPL podlega polimorficznemu przejściu fazowemu. Forma odpowiadająca niższej temperaturze jest uwodnioną, krystaliczną formą, z hybrydową subkomórką mającą specyficzne uporządkowanie łańcuchów. Średnia powierzchnia przypadająca na łańcuch wynosi około 19. 04 A2, a orientacja łańcuchów jest prawie prostopadła do płaszczyzny dwuwarstwy. Jest to najbardziej upakowana forma.
Zmiany objętości przy przejściu fazowym wynoszą około 7%. Między (25÷35) °C występuje stan parakrystaliczny {Lβ'} z łańcuchami upakowanymi w zniekształcone heksagonalne warstwy. Łańcuchy są nachylone, a kąt nachylenia zależy od temperatury i stopnia hydratacji.
Średnia powierzchnia przypadająca na łańcuch wynosi około 19. 1A2. Przedprzejściu z entalpią około 1. 3 kcal/mol towarzyszy przejście z jednowymiarowej struktury lamellarnej
{Lβ'} do dwuwymiarowej sieci jednoskośnej, utworzonej z lipidowych warstw lamellarnych odkształconych periodycznie {Pβ}. We wszystkich dyskutowanych fazach łańcuchy węglowodorowe były w stanie dobrze uporządkowanym i prezentowały swą maksymalną rozciągłość. Przy dalszym wzroście temperatury ten łańcuchowy porządek jest tracony.
Wreszcie przy 41. 4°C występuje duże, ostre, endotermiczne przejście fazowe a entalpią 7. 74
kcal/mol, które jest przejściem topnienia łańcuchów (ang. chain-melting) . Pofałdowanie znika i zostaje zastąpione przez płaską, dwuwarstwową strukturę z ciekłymi łańcuchami {Lα
}.
² EYL (ang. Egg Yolk Lecitin) jest naturalną lecytyną z żółtka jaja kurzego. Trudno precyzyjnie określić jej budowę, stanowi bowiem mieszaninę wielonienasyconych kwasów tłuszczowych. Obfitość wiązań podwójnych w łańcuchu hydrofobowym cząsteczki EYL
powoduje, że temperatura topnienia łańcuchów wynosi -19°C, co jest wartością znacznie niższą niż dla DPL. W temperaturze pokojowej błona z EYL charakteryzuje się więc dużą płynnością, podczas gdy łańcuchy węglowodorowe dwuwarstwy z DPL są w stanie dobrze uporządkowanym, co decyduje o jej sztywności.
4
Pomiar widma absorpcji, emisji i wzbudzenia DPH w etanolu.
Przygotować roztwór DPH o absorbancji ok. 0.1 w maksimum (ε=80000) i wykreślić widmo absorpcji, emisji oraz wzbudzenia fluorescencji w etanolu i określić odpowiednie maksima.
Preparatyka liposomów jednowarstwowych.
Do kiuwety wlać 2 ml wody dest. i powoli wstrzykiwać 25µl roztworu EYL lub DPPC przy mieszaniu roztworu mieszadełkiem magnetycznym uzyskując stężenie lipidu 0.5 mM. W
przypadku DPPC czynność tą przeprowadzać powyżej temperatury przejścia fazowego lipidu, tzn. 41 stopni. Następnie dodać taką ilość roztworu DPH w etanolu aby stosunek lipid/DPH
wynosił 1000/1. Na tak przygotowanych liposomach zmierzyć anizotropię DPH w temperaturze pokojowej dla liposomów z EYL oraz dla liposomów z DPPC w temperaturach 20, 40, 45 i 50 oC przy maksimach wzbudzenia i emisji wyznaczonych w etanolu.
Pomiary anizotropii.
Przystawka polaryzacyjna zawiera dwa elementy polaryzacyjne: jeden polaryzator umieszczony jest na drodze światła wzbudzającego, między monochromatorem wzbudzenia a próbką, drugi zaś znajduje się po stronie emisyjnej, między próbką, a monochromatorem emisji.
Polaryzator
Polaryzator
wzbudzenia
emisji
[za płaszczyzną]
[za płaszczyzną]
H
H
V
V
Próbka
z monochromatora
do monochromatora
wzbudzenia
emisji
Schemat ustawienia polaryzatorów.
Umieszczona w komorze pomiarowej próbka jest wzbudzana światłem prostopadle spolaryzowanym. Natężenia światła emitowanego mierzone są równolegle (IVV) i prostopadle (IVH) do prostopadłej płaszczyzny polaryzacji światła wzbudzającego.
Polaryzator
Polaryzator
Składowa
wzbudzenia
emisji
natężenia
horyzontalnie horyzontalnie
IHH
horyzontalnie wertykalnie
IHV
wertykalnie horyzontalnie
IVH
wertykalnie wertykalnie
IVV
5
Po
wzbudzeniu
światłem spolaryzowanym horyzontalnie próbki niepolaryzującej, składowe emisyjne IHV i IHH powinny być równe
1 = IHV
IHH
Wpływ polaryzacyjnej odpowiedzi instrumentu sprawia jednak, że stosunek ten różni się od jedynki o wartość G
IHV
G =
IHH
Wartość czynnika G zależy od typu spektrometru i długości fali przy której pomiary są wykonywane i jest zwykle mniejszy od jedności.
Współczynnik G oblicza się na próbce z DPH w etanolu, a następnie mierzy się anizotropię fluorescencji próbki z liposomami, zgodnie ze wzorem IVV − GIVH
A =
IVV + G
2 IVH
Po zmierzeniu anizotropii dla próbki liposomów zbudowanych z EYL w 20 oC i wybranych temperatur dla DPPC przedstawić graficznie zależność anizotropii DPH od temperatury dla liposomów DPPC oraz porównać otrzymaną wartość dla EYL i DPPC w 20 oC i omówić otrzymane wyniki.
6