Otrzymywanie biodiesla jako przykład reakcji stymulowanej
promieniowaniem mikrofalowym
prowadzący: mgr inż. Kamila Sadowska
1. Promieniowanie mikrofalowe – podstawowe informacje
Region promieniowania mikrofalowego zajmuje na widmie elektromagnetycznym
położenie pomiędzy promieniowaniem podczerwonym i częstotliwością radiową, co
odpowiada długości fali z zakresu od 1 cm do 1 m (częstotliwość odpowiednio od 30 GHz do 300 MHz). Domowe i przemysłowe urządzenia mikrofalowe pracują przy 2,45 GHz, aby nie
zakłócały działania urządzeń telekomunikacyjnych.
Promieniowanie mikrofalowe może być pochłaniane przez materię na dwa różne
sposoby. Pierwszym z nich jest polaryzacja dipolowa. Jeśli w materiale są obecne cząsteczki chemiczne będące dipolami, to w wyniku działania pola elektrycznego fali
elektromagnetycznej starają się ustawić zgodnie z kierunkiem i zwrotem tego pola. Wektor pola elektrycznego zmienia zwrot co pół okresu fali promieniowania. Dipole zmieniają więc również ustawienie, podążając za polem. Podczas obrotów uderzają w sąsiadujące z nimi cząsteczki, przekazując im nabytą od promieniowania energię. Te przekazują ją kolejnym i w ten sposób ciepło rozprzestrzenia się równomiernie w materiale. Wykorzystując
mechanizm polaryzacji dipolowej, możemy ogrzać jednak tylko substancje będące dipolami, takie jak woda, metanol, DMF, octan etylu, chloroform, chlorek metylenu, kwas octowy.
Substancje takie jak heksan, benzen, eter dietylowy czy czterochlorek węgla nie ogrzewają się pod wpływem promieniowania mikrofalowego.
Drugi mechanizm pochłaniania promieniowania mikrofalowego opiera się na
przewodnictwie jonowym. Gdy w materiale znajdują się jony, zaczynają one przemieszczać się zgodnie z kierunkiem pola elektrycznego: dodatnie w jedną, a ujemne w przeciwną stronę.
Zderzając się po drodze z innymi cząsteczkami, powodują rozprzestrzenianie się energii cieplnej w materiale.
Promieniowanie mikrofalowe z powodzeniem wykorzystywane jest zarówno w laboratorium,
w przemyśle jak i w budownictwie. Energia mikrofalowa pozwala znacznie przyspieszyć
przebieg procesów chemicznych. Przyczyna takiego zachowania nie jest do końca
wyjaśniona. Przypuszcza się, że jest to efekt termiczno/kinetyczny wynikający z miejscowego gwałtownego wzrostu temperatury. Tworzą się tzw. „gorące miejsca”, których temperatura może być nawet o kilkadziesiąt stopni wyższa od średniej temperatury ogrzewanego
materiału. Nie we wszystkich jednak przypadkach takie wyjaśnienie wystarcza. Znane są bowiem procesy, które w obecności promieniowania mikrofalowego przebiegają inaczej niż podczas zwykłego ogrzewania. Oznacza to, że całkowitej zmianie ulega mechanizm reakcji lub że zachodzą zmiany w strukturze biorących w niej udział cząsteczek. Próbuje się wiązać je z oddziaływaniami między dipolami, z tworzeniem jonów czy z przemieszczaniem
elektronów w obrębie cząsteczki.
Obecnie wiele uwagi poświęca się rozwojowi nowych energooszczędnych,
ekonomicznych i bezpiecznych dla środowiska technologii. Z tego względu, poszukiwanie nowych metod aktywacji reakcji chemicznych staje się niezmiernie istotne. W ostatnich latach procesy prowadzone z wykorzystaniem promieniowania mikrofalowego skupiają coraz większą uwagę. W
większości przypadków poddawanie działaniu promieniowania
mikrofalowego prowadzi do znacznego zwiększenia szybkości reakcji w porównaniu do
reakcji prowadzonych w sposób tradycyjny. Wynika z tego, iż reakcje wymagające
kilkugodzinnego ogrzewania przebiegają w reaktorze mikrofalowym w czasie kilku sekund
czy minut. Co więcej, z reguły uzyskuje się produkty bardziej czyste. Aktywacja mikrofalami jest również bardziej przyjazna środowisku ze względu na możliwość zmniejszenia ilości lub całkowitego wyeliminowania rozpuszczalników niezbędnych do prowadzenia reakcji
w sposób tradycyjny. Pierwsze przykłady zastosowania promieniowania mikrofalowego
w syntezie organicznej dotyczyły reakcji Diesla-Aldera, utleniania czy estryfikacji [1,2].
W chwili obecnej opisany jest cały szereg różnego rodzaju reakcji w tym syntezy związków heterocyklicznych, polimerów, katalizatorów przeniesienia fazowego czy wykorzystanie
w chemii kombinatoryjnej [3,4,5,6]. Dość szeroko opisane jest zastosowanie mikrofali do produkcji tzw. biodiesla, która polega na transestryfikacji olejów roślinnych
niskocząsteczkowym alkoholem, głównie metanolem [7]. Dla tego procesu obserwuje się
korzystny wpływ promieniowania mikrofalowego na szybkość i wydajność reakcji a także na proces izolacji i oczyszczania produktów.
Oprócz widocznego wpływu promieniowania mikrofalowego na syntezę związków
organicznych znany jest również wpływ tego promieniowania na procesy rozkładu substancji.
Sprawia to, że promieniowanie mikrofalowe może być zastosowane w procesach
oczyszczania ścieków komunalnych i przemysłowych, jak również unieszkodliwiania
odpadów stałych [8]. Z
powodzeniem wykorzystano również mikrofale w
procesach
depolimeryzacji będących jednym z etapów recyklingu chemicznego materiałów
polimerowych [9].
2. Otrzymywanie biodiesla
Biodiesel jest zastępczym paliwem do silników wysokoprężnych, produkowanym
z odnawialnych surowców, np. olejów roślinnych czy tłuszczów zwierzęcych. Oleje roślinne same w sobie mogą być paliwem silnikowym, pod pewnymi warunkami. Jednak ich wysoka
lepkość wynikająca z obecności wielkocząsteczkowych struktur estrów glicerynowych
wyższych kwasów tłuszczowych jest cechą niekorzystną. Jednym ze sposobów obniżenia
lepkości oleju jest poddanie go transestryfikacji, to jest poddanie go działaniu metanolu lub etanolu z użyciem odpowiedniego katalizatora, na skutek czego otrzymuje się estry metylowe lub etylowe kwasów tłuszczowych o znacznie mniejszych cząsteczkach oraz mniejszej
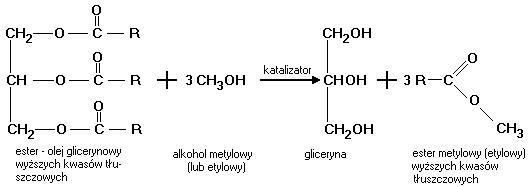
lepkości. Schemat reakcji transestryfikacji przedstawiono na Rys. 1. Jak wynika ze
stechiometrii reakcji na każdą cząsteczkę trójglicerydu przypadać powinny trzy cząsteczki alkoholu, aby reakcja była kompletna. Jednakże, reakcja transestryfikacji jest procesem równowagowym i w celu doprowadzenia jej do końca wymagane jest użycie nadmiaru
reagenta bądź usuwanie produktów w miarę przebiegu reakcji. Przeprowadzone
eksperymenty wykazały, że w celu uzyskania wydajności 95-98% wystarczający jest
dwukrotny nadmiar alkoholu tj. 6 moli alkoholu na 1 mol trojglicerydu.
Rys. 1. Schemat reakcji transestryfikacji alkoholem metylowym
Proces transestryfikacji prowadzony jest z użyciem katalizatora kwaśnego, zasadowego lub enzymatycznego. Jako katalizatora zasadowego stosuje się głównie KOH, NaOH, NaOCH3,
NaOEt; kwaśnym jest najczęściej kwas siarkowy. Surowcem mogą być oleje roślinne:
sojowy, rzepakowy, słonecznikowy, kukurydziany, bawełniany, palmowy, również produkty uboczne z przerobu olejów jadalnych a także tłuszcze zwierzęce oraz przepalony olej
z gastronomii np. po smażeniu frytek.
Niezależnie od rodzaju użytego surowca sposób postępowania jest podobny. Wstępnie
ogrzany olej dodaje się stopniowo do zawiesiny katalizatora w alkoholu i dalej ogrzewa. Gdy reakcja dobiegnie końca, mieszaninę produktów pozostawia się w celu rozdzielenia warstw. Z
warstwy estrowej odparowuje się pod zmniejszonym ciśnieniem nadmiar alkoholu. Po
przemyciu, osuszeniu i przesączeniu mieszanina estrów może być wykorzystana jako dodatek do paliwa. Warstwę glicerolu poddaje się oczyszczaniu. Usuwa się katalizator
i nieprzereagowany metanol.
Badanie wpływu promieniowania mikrofalowego na szybkość reakcji transestryfikacji
Do reakcji prowadzonych z użyciem reaktora mikrofalowego używać można tylko specjalnie do tego celu przeznaczonych naczyń!!!
25 g oleju
0,25 g NaOH
4,8 g bezwodnego metanolu, d = 0,791 g/cm3
1. W celu usunięcia wody olej ogrzewać w reaktorze mikrofalowym przez 10 minut
w temperaturze 120°C przy zastosowaniu mocy 750 W.
2. Odważyć zadaną ilość NaOH do kolbki stożkowej, dodać odpowiednią objętość
alkoholu i podgrzewać w celu rozpuszczenia.
3. Przygotowany alkoholowy roztwór katalizatora dodać do oleju i całość ogrzewać
przez 3 min w reaktorze mikrofalowym w temperaturze 60°C, wykorzystując 50%
maksymalnej mocy.
4. Po zakończeniu reakcji mieszaninę przenieść do rozdzielacza. Zlać dolną warstwę,
którą stanowi nieprzereagowany olej. Warstwę estrową zlać górą rozdzielacza do
czystego naczynia.
5. Estry przenieść do czystego rozdzielacza i na powierzchni rozpylić około 25 ml wody.
Zlać warstwę wodną i ponownie przemyć wodą..
6. Rozdzieloną warstwę estrową osuszyć bezwodnym Mg2SO4, przesączyć i zważyć.
Przeprowadzić transestryfikację według powyższego opisu zwiększając czas reakcji (punkt 3) do 6, 10 i 15 minut.
Obliczyć wydajność reakcji jako stosunek masy otrzymanego produktu do masy oleju.
Sporządzić wykres zależności wydajności reakcji od czasu jej trwania. Przedyskutować
wyniki.
Literatura
1. Gedye, R.N., Smith, F., Westaway, K., Ali, H., Baldisera, L., Laberge, L., Rousell, J. Tetrahedron Lett.
1986 (27) 279
2. Giguere, R.J., Bray, T.L., Dunkan, S.M., Majetich, G. Tetrahedron Lett. 1986 (27) 4945
3. Deshayes, S., Liagre, M., Loupy, A., Luche, J.-L., Petit, A. Tetrahedron, 1999 (55) 10851
4. Bogdal, D., Penczek, P., Pielichowski, J., Prociak, A. Adv. Polym. Sci. 2003 (163) 193
5. Lew, A., Krutzik, P.O., Hart, M.E., Chamberlin, A.R. J.Comb. Chem. 2002 (4) 95
6. Kuznetsov, D.V., Raev, V.A., Kuranov, G.L., Arapov, O.V., Kostikov, R.R. Russ. J. Org. Chem. 2005
(41) 1719
7. Saifuddin, N., Chua, K.H. Malaysian J. Chem. 2004 (6) 77
8. Appleton, T.J. , Colder, R.I., Kingman, S.W., Lowndes, I.S., Read, A.G. Appl. Energy 2005 (81) 85
9. Klun, U., Kržan, A. Polymer 2000 (41) 4361
Wyszukiwarka
Podobne podstrony:
sciągawka koło 2 biodiesel (DRANCO)
Biodiesel production a review
Biodiesel vs bioethanol
biodiesel eng
Biodiesel from microalgae
biodiesel
biodiesel materiały do wykładu, Wykorzystanie olejów roślinnych jako paliwa do silników Diesla przew
Biodiesel from oilgae, biofixat Nieznany (2)
Biologiczne oczyszczanie ścieków i perspektywy zagospodarowania produktów ubocznych w technologiach
więcej podobnych podstron