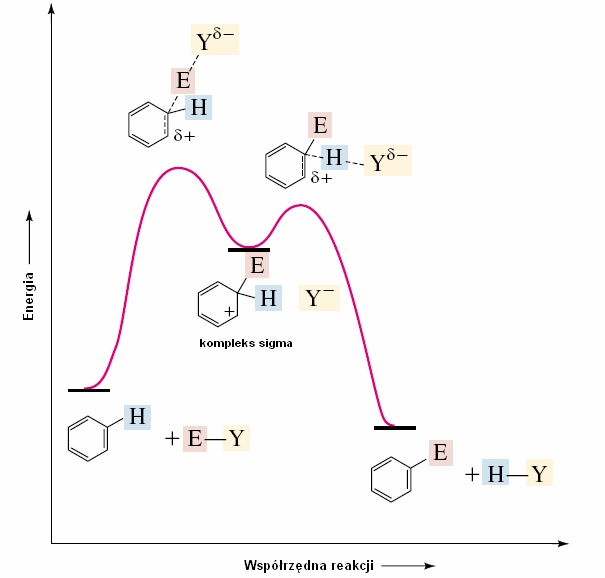
Ogólny mechanizm aromatycznej substytucji elektrofilowej H
H
H
H
H
H
H
H
E
E
E
E
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
stabilizowany rezonansowo kompleks sigma H
H
H
H
E
H
H
E
H
B
H
H
H
H
1
1. Bromowanie i chlorowanie X X
X X FeX
+ FeX
3
X FeX
3
4
X
X
H
X X FeX
+ HX + FeX3
3
H
FeX4
katalizatory: FeBr3 (dla Br2), AlCl3 i FeCl3 (dla Cl2) 2. Jodowanie
Jod jest mało reaktywny w stosunku do pierścienia aromatycznego i reakcja ta wymaga dodania utleniacza jako aktywatora (H2O2, HNO3, sole miedzi (II) ). Aktywator utlenia I2 do I I2 + 2Cu2
2 I + 2Cu
I
I2
Cu2
3. Fluorowanie
Przeprowadza się za pośrednictwem organicznych zwiazków talu Tl(OCOCF
F
3)2
KF, BF3
+ Tl(OCOCF3)3
4. Nitrowanie
O
O
O
O
H O N O
+
H O S O H
H O N O
+
O S O H
O
H
O
O
O
H O N O
N
+ H2O
H
O
kation nitroniowy
HSO4
H
O
O
NO
N
2
N
O
O
H
2
Dymiący kwas siarkowy: 7% SO3 w H2SO4
HSO4
H O
O
SO3
SO3H
S O
H2SO4
S O
O
O
H
+ HSO4
6. Alkilowanie Friedla-Craftsa
a. 10 halogenki alkilowe
+
−
δ
δ
R-CH2-X
+ AlCl3
R-CH2 X AlCl3
+
−
H
δ
δ
R-CH2 X AlCl3
CH2-R
+ HX + AlCl3
CH
H
2-R
X-AlCl3
UWAGA - możliwe przegrupowania do trwalszych karbokationów
+
−
H
H
δ
δ
R-C-CH
R-C-CH
+ AlCl
2
X
AlCl3
3
3X
H
"nowy" czynnik alkilujący b. 20 i 30 halogenki alkilowe
R1
R1
R2 C X
+ AlCl
R
+ AlCl
3
2
C
3X
R3
R3
H
R1
R1
R
C R
1
2
C
+ HX + AlCl3
R2
R
C
1
R
R
3
3
H
R3
X-AlCl3
OGRANICZENIA reakcji:
1. Może być przeprowadzona tylko z benzenem, toluenem i pochodnymi podstawionymi atomami fluorowca. Niemożliwa do przeprowadzenia dla pochnych benzenu z podstawnikami silnie wyciągającymi elektrony 2. Dla 10 oraz 20 halogenków alkilowych możliwe przegrupowania i tworzenie niepożądanych produktów ubocznych 3. Możliwe wielokrotne podstawienie (produkt jest bardziej reaktywny w reakcji substytucji elektrofilowej niż substrat) 4. Niemożliwa dla aniliny i jej N-alkilowanych pochodnych z powodu kompleksowania katalizatora (AlCl3, kwas Lewisa) 3
przez parę elektronową na atomie azotu
7. Acylowanie Friedla-Craftsa O
O
O
AlCl
C
+ AlCl4
C Cl
3
C Cl AlCl3
R
R
R
kation acyliowy
O
O
H O
R
C
C
+ AlCl3 +
R
R
HCl
H
Cl-AlCl3
O AlCl
O
3
H
R
2O
R
UWAGI:
1. Może być przeprowadzona tylko z benzenem, toluenem i pochodnymi podstawionymi atomami fluorowca.
Niemożliwa do przeprowadzenia dla pochnych benzenu z podstawnikami silnie wyciągającymi elektrony 2. Brak możliwości przegrupowania czynnika acylującego 3. Produkt jest mniej reaktywny w reakcji substytucji elektrofilowej niż substrat zatem poliacylowanie nie jest możliwe 4. Niemożliwa dla aniliny i jej N-alkilowanych pochodnych z powodu kompleksowania katalizatora (AlCl3, kwas Lewisa) przez parę elektronową na atomie azotu 4
1. Podstawniki aktywujące, kierujące w pozycje orto i para
-grupa alkilowa (R), alkoksylowa (-OR), hydroksylowa (-OH), aminowa (-NH2, -NHR, -NR2), pierścień aromatyczny (-Ph), anion karboksylanowy
- "moc aktywująca" grupy: R
H
O
-O
>
N
>
-OH
>
-OR
>
N O
>
-R
R
R
2. Podstawniki dezaktywujące, kierujące w pozycję meta
-nitrowa (-NO2), sulfonowa (-SO3H), nitrylowa (-CN), acylowa (-COR), karboksylowa (-COOH), estrowa (-COOR), amoniowa (-NR3), trifluorometylowa (-CF3)
- "moc dezaktywująca" grupy:
-NR3 > -NO
>
>
>
-COOH
2
-CF
>
3
-CN
-SO3H
-CHO > -COR >
> -CONH >
2
-NH3
3. Podstawniki dezaktywujące, kierujące w pozycje orto i para
- atomy fluorowców:F, Cl, Br, I
ADDYTYWNOŚĆ EFEKTÓW KIERUJĄCYCH - REGUŁY
1. Wpływ grup aktywujacych przeważa nad wpływem grup dezaktywujących.
2. W przypadku obecności w substracie dwóch grup aktywujących wpływ kierujący silniejszej z nich przeważa, ale zwykle tworzą się mieszaniany produktów.
3. W przypadku zwiazków meta-podstawionych, trzeci podstawnik rzadko podstawia się w do atomu węgla pomiędzy grupami już obecnymi.
4. Gdy grupa kierująca w meta jest w położeniu meta do grupy kierujacej w pozycje orto i para, trzecia grupa zwykle podstawia sie w pozycji orto do podstawnika kierującego w meta ( co odpowiada połozeniu para - w stosunku do podstawnika kierującego w orto i para): CH
CH
CH
3
CH3
3
3
Cl
Cl
Cl
2 / FeCl3
+
+
NO
NO
NO
2
NO2
2
2
Cl
produkt główny kilka % nie tworzy się O
O
-NH2
-OCH
C H
C OH
-SO
3
-CH3 (alkil)
-F
-Br
3H
-NO2
REAKTYWNOŚĆ
-OH
-HN C CH
-H
-Cl
-I
C OCH
3
3
C CH3
-CN
-NR3
O
O
O
dezaktywatory
aktywatory
kierujące w orto i para
dezaktywatory
kierujące w orto i para
kierujące w meta
5
Inne reakcje związków aromatycznych 1. Utlenianie łańcucha bocznego alkilowych pochodnych benzenu CH2R
COOH
[utl.]
czynniki utleniające:
KMnO4, Na2Cr2O7, HNO3(rozc.)
2. Podstawienie w łańcuchu bocznym alkilowych pochodnych benzenu X
CH2-CH2-R
X
CH2-CH2-R
2 / hν (lub temp.)
X - Cl, Br
(lub NBS)
TYLKO w tej pozycji
3. Redukcja produktów acylowania Friedla-Craftsa Clemmensena (amalgamat cynku w stęż. HCl) O
Zn(Hg) / HCl stęż.
C
CH2-R
R
H2N-NH2 / KOH
Wolffa-Kiżnera (hydrazyna wobec mocnej zasady) 4. Reakcja Gattermana-Kocha
O
AlCl3 / CuCl
CO + HCl
C
H-C=O
AlCl4
Cl
H
O
C H
+
H-C=O
AlCl4
5. Redukcja (uwodornienie) pierścienia aromatycznego.
H2, 1000 psi
wymaga bardzo drastycznych warunków Pt, Pd, Ni, Pu lub Rh
6
Wpływ podstawników:
R - grupa elektronoakceptorowa - atom węgla z nią związany ulega Na (lub Li)
redukcji
NH
COOH
Na
COOH
3, ROH
R
R
H
NH3, EtOH
R - grupa elektronodonorowa - atom węgla z nią związany nie ulega redukcji
OCH
Na
3
OCH3
NH3, EtOH
7. Perchlorowanie
Cl
Cl
Cl
Cl
2
ciśnienie, temp.
lub naświetlanie
Cl
Cl
Cl
7