Izomery są to związki chemiczne o tym samym wzorze sumarycznym, ale różniące się budową i właściwościami fizykochemicznymi, mające różne wzory strukturalne.
Izomeria
konstytucyjna (strukturalna)
stereoizomeria (przestrzenna)
izomery różnią się kolejnością i sposobem powiązania atomów w stereoizomery różnią się rozmieszczeniem cząsteczce
atomów w przestrzeni przy tej samej kolejności powiązania atomów
I. szkieletowa
I. konformacyjna
a) łańcuchowa
II. geometryczna
b) pierścieniowa
III. optyczna
c) położenia wiązań wielokrotnych
II. podstawienia
III. metameria (funkcyjna)
IV. tautomeria
Izomeria konstytucyjna to zjawisko występowania związków chemicznych o tym samym wzorze sumarycznym w różnych odmianach, różniących się kolejnością i sposobem połączenia atomów w cząsteczce.
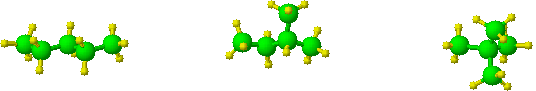
Jednym z rodzajów izomerii konstytucyjnej jest izomeria szkieletowa. Ten typ izomerii pojawia się już w alkanach i wiąże się z różną budową szkieletu węglowego izomerów.
wz�r sumaryczny - C5H12
alkany
H
H
H
H
H
H
H
CH
H
CH H
3 H
3
H
C
C
C
C
C
H
H
C
C
C
C
H
H
C
C
C
H
H
H
H
H
H
H
H
H
H
H
CH3 H
n-pentan
2-metylobutan
2, 2-dimetylopropan
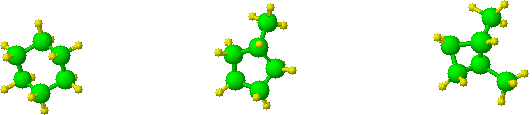
wz�r sumaryczny - C6H12
cykloalkany
H
H
H
H
H
CH3
H
CH3
C
H
H
H
H
C
C
H
C
H
C
H
C
C
C
H
C
C
H
C
H
C
C
H
CH
C
H
C
3
H
H
H
H
H
H
H
H
H
cykloheksan
metylocyklopentan
1, 2-dimetylocyklobutan
Drugi rodzaj izomerii strukturalnej nazywany jest izomerią położenia podstawnika. Cząsteczki związków chemicznych będące tego typu izomerami różnią się położeniem podstawnika, np. bromowego, chlorowego czy hydroksylowego, lub położeniem wiązania wielokrotnego. Ten rodzaj izomerii przedstawiono poniżej na przykładzie chloropochodnych węglowodorów aromatycznych i alkoholi.
wz�r sumaryczny - C
chloropochodne w�glowodor�w aromatycznych 6H4Cl2
Cl
Cl
Cl
Cl
Cl
1, 2-dichlorobenzen
1, 3-dichlorobenzen
Cl
o-dichlorobenzen
m-dichlorobenzen
1, 4-dichlorobenzen
p-dichlorobenzen

wz�r sumaryczny - C4H9OH
alkohole
H
H
H
H
H
H
OH H
H
OH H
H
C
C
C
C
OH
H
C
C
C
C
H
H
C
C
C
H
H
H
H
H
H
H
H
H
H
CH3H
butan-1-ol
butan-2-ol
2-metylopropan-2-ol
Trzeci rodzaj izomerii konstytucyjnej to izomeria funkcyjna. Wiąże się ona z występowaniem w cząsteczkach izomerów o takim samym składzie pierwiastkowym różnych grup funkcyjnych. Poniżej przedstawiono przykłady izomerii funkcyjnej aldehydów i ketonów oraz estrów i kwasów karboksylowych.
wz�r sumaryczny - C3H6O
aldehydy i ketony
O
O
H C
3
C
CH3
H C
CH
3
2 C
propanon
H
propanal
wz�r sumaryczny - C5H10O2
estry i kwasy karboksylowe
O
O
H C
CH
3
2 C
H C
CH CH CH
3
2
2
2 C
O
CH2 CH3
OH
propionian etylu
kwas pentanowy
Poza izomerią konstytucyjną istnieje jeszcze izomeria konfiguracyjna zwana stereoizomerią. Stereoizomery to związki, które mają taką samą konstytucję (strukturę), ale różnią się rozmieszczeniem atomów w przestrzeni – konfiguracją.
Pierwszy rodzaj stereoizomerii to izomeria geometryczna cis (Z) – trans (E). Cząsteczki izomerów geometrycznych różnią się od siebie położeniem podstawników względem wiązania podwójnego lub płaszczyzny pierścienia. Ten typ izomerii najłatwiej jest wyjaśnić na przykładzie alkenów i cykloalkanów.
wz�r sumaryczny - C3H4Cl2
alkeny
H C
Cl
3
H C
H
3
cis – podstawniki o
„najwyższym
C
C
C
C
pierwszeństwie” po
Cl
H
Cl
Cl
tej samej stronie
wiązania
trans-1, 2-dichloropropan
cis-1, 2-dichloropropan
podwójnego
wz�r sumaryczny - C
chloropochodne cyklalkan w
�
3H4Cl2
H
Cl
H
Cl
trans – podstawniki
o „najwyższym
C
C
pierwszeństwie” po
H
C
C
H
H
C
C
Cl
przeciwnej stronie
wiązania
H
Cl
H
H
podwójnego
trans-1, 2-dichlorocyklopropan
cis-1, 2-dichlorocyklopropan
Izomeria geometryczna nie występuje w przypadku alkenów, jeżeli przy jednym z atomów węgla przy wiązaniu podwójnym są dwa identyczne podstawniki. Ten typ izomerii nie wystąpi także dla cykloalkanów, jeśli dwa podstawniki znajdują się przy tym samym atomie węgla.
H C
Cl
3
Cl Cl
C
C
C
H C
H
H
C
C
H
3
1-chloro-2-metyloprop-1-en
H
H
1, 1-dichlorocyklopropan
dwa enancjomery
Drugi rodzaj stereoizomerii to izomeria optyczna. Zanim ten rodzaj izomerii zostanie bardziej szczegółowo omówiony, należy wyjaśnić kilka ważnych pojęć ściśle związanych ze stereoizomerią.
I
I
I
C
Asymetryczny atom węgla. Atom węgla, C
C
*
Br
*
H
który połączony jest z czterema różnymi H
Br
*
Br
H
Cl
podstawnikami; oznacza się go symbolicznie Cl
gwiazdką.
Cl
Chiralność. Termin ten pochodzi od greckiego słowa cheir oznaczającego rękę. Przedmioty chiralne to takie, które są nieidentyczne ze swoim odbiciem lustrzanym. O tym, czy przedmiot zwierciadᄈ o
jest chiralny, decydują jego elementy symetrii. Obiekt jest chiralny, wi�zanie skierowane przed p�aszczyzn� rysunku jeśli nie ma ani płaszczyzny, ani środka symetrii, może mieć natomiast oś symetrii. Te same zasady związane z chiralnością wiᄈ zanie skierowane za pᄈ aszczyzne rysunku dotyczą cząsteczek związków chemicznych. Każda cecha cząsteczki, wi z
ᄍ anie leᄍ c
ᄍ e w p a
ᄍ szczy n
゚ ie rysunku
która powoduje jej chiralność, nazywa się centrum chiralności.
Rodzaje izomerów optycznych
Enancjomery
Diastereoizomery
Różnią się konfiguracją przy wszystkich Różnią się konfiguracją, ale nie przy wszystkich asymetrycznych atomach węgla.
asymetrycznych atomach węgla.
Epimery
Forma mezo
Różnią się konfiguracją Optycznie nieczynny tylko przy jednym
rodzaj
asymetrycznym atomie diastereoizomerów, węgla.
który posiada
płaszczyznę symetrii.
Enancjomery. Cząsteczki danego związku występujące w dwóch nieidentycznych odmianach, które są swoimi odbiciami lustrzanymi, nie mają płaszczyzny i środka symetrii. Enancjomery różnią się konfiguracją przy wszystkich asymetrycznych atomach węgla. Każdy z enancjomerów skręca płaszczyznę światła spolaryzowanego w przeciwnym kierunku o taki sam kąt. Jeżeli więc mieszanina dwóch enancjomerów zawiera ich równomolowe ilości, to jest ona optycznie nieczynna i nazywa się mieszaniną racemiczną lub racematem. Racemat nie wykazuje czynności optycznej.
Czynność optyczna to zjawisko, które polega na skręcaniu płaszczyzny światła spolaryzowanego (występują substancje prawoskrętne lub lewoskrętne).
Konfiguracja jest to przestrzenne rozmieszczenie podstawników wokół tetraedrycznego(kostka k4) atomu węgla. Pojęcie to ściśle wiąże się z izomerią optyczną, ponieważ cząsteczki będące swoimi odbiciami lustrzanymi mają przeciwne (różne) konfiguracje.
Diastereoizomery. Cząsteczki diastereoizomerów różnią się konfiguracją, ale nie przy wszystkich atomach węgla.
Forma mezo to rodzaj diastereoizomeru, który posiada płaszczyznę symetrii. Forma p a
ᄈ szczyzna symetri
mezo jest optycznie nieczynna. Maksymalną liczbę możliwych dla danego związku chemicznego stereoizomerów określa się ze wzoru 2n, gdzie n oznacza liczbę centrów Cl Cl
chiralności, czyli np. liczbę asymetrycznych atomów węgla. Jeżeli jeden ze stereoizomerów jest formą mezo, to liczba możliwych stereoizomerów jest równa 2n-1.
H
C
C
H
*
*
OH OH
forma mezo