![]()
Dr inż. Andrzej Szymański pok 542 (WBMiZ) tel. 665 2806 email: andrzej.szymanski@put.poznan.pl
Związki trudno rozpuszczalne
Uwagi ogólne:
Jeżeli przy wzorze substancji nie ma indeksu to reagent jest w stanie ciekłym
Jeżeli jest po reagencie znak ↓ to reagent jest w stanie stałym
Jeżeli jest po reagencie znak ↑ to reagent jest w stanie gazowym
![]()
Reakcje wytrącania i rozpuszczania osadów przebiegają w niejednorodnych układach faza stała - faza ciekła
Współistnienie faz w układzie ułatwia rozdzielanie mieszanin
Stężenie - wielkość fizykochemiczna nie mająca atrybutów parametru stanu, bo nie liczona na podstawie zachowania się substancji, a jedynie na podstawie ,,parametrów zewnętrznych” czyli znanej ilości substancji jaka uległa rozpuszczeniu i objętości lub masy r-r lub rozpuszczalnika
Aktywność - parametr stanu, czyli wielkość fizykochemiczna obliczana na podstawie rzeczywistego zachowania się substancji w roztworze (z uwzględnieniem wszelkich oddziaływań) można zatem powiedzieć, że jest to efektywne stężenie substancji w roztworze
Aktywność (a) i stężenie (c) są połączone zależnością ![]()
jest współczynnikiem aktywności
Współczynnik aktywności (![]()
) jest swego rodzaju współczynnikiem korekcyjnym, uwzględniającym wszelkie odstępstwa w zachowaniu się substancji w r-r rzeczywistych, w stosunku do warunków idealnych, w których nie ma jakichkolwiek oddziaływań substancji rozpuszczanej z cząsteczkami rozpuszczalnika
Aktywność fazy stałej i gazów pod ciśnieniem atmosferycznym wynosi 1
Stężeniowa stała równowagi dla reakcji
![]()
Wynosi:

Pamiętać należy:
Warunki normalne 1 atm. ciśn. 0oC
Warunki standardowe 1 atm. ciśn. 25oC
Woda to rozpuszczalnik silnie polarny (stała dielektryczna ![]()
)
Polarne cząsteczki wody hydratują rozpuszczaną w niej cząsteczkę soli nieorganicznej powodując jej dysocjacje na jony
Związki organiczne zazwyczaj rozpuszczają się tylko w formie cząsteczkowej
Dla związków trudno rozpuszczalnych w wodzie energia sieciowa jest wyższa od energii hydratacji jonów w r-r. Dla związków dobrze rozp. w wodzie ma miejsce odwrotna zależność.
Np.
Rozpuszczanie jodków litowców maleje w kierunku LiI→CsI
Rozpuszczanie fluorków litowców rośnie w kierunku LiF→CsF
Rozpuszczanie się w wodzie związków nieorganicznych
Rozpuszczanie się w formie molekularnej z jednoczesną hydratacją
Dysocjacja hydratowanej cząsteczki na jony
Schemat:
![]()
Można go uprościć:
![]()
Dla tej reakcji
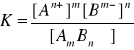
Pamiętając, że aktywność fazy stałej jest równa 1 czyli ![]()
powyższy wzór przyjmuje postać:
![]()
gdzie Ir jest iloczynem rozpuszczalności
Chemia ogólna i nieorganiczna wykład dr inż. Andrzej Szymański 01.12.2009r.