Wartość równoważnika elektrochemicznego obliczymy ze wzoru 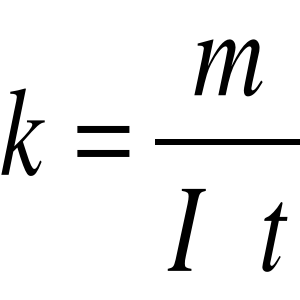
I INF |
Mariusz Nowak |
Ocena |
12.05.2008
|
Wyznaczanie współczynnika elektrochemicznego miedzi i stałej Faradaya
|
|
Opis ćwiczenia
Celem ćwiczenia jest wyznaczenie równoważnika elektrochemicznego, stałej Faraday'a oraz sprawdzenie I i II prawa Faraday'a.
W ćwiczeniu mierzymy wartość zmieniającego się w czasie natężenia prądu płynącego przez elektrolit ( w odstępach trzyminutowych), a także zmianę masy katody.
2. Tabele pomiarów:
t [s] |
0 |
180 |
360 |
540 |
720 |
900 |
I [A] |
0,662 |
0,662 |
0,661 |
0,66 |
0,658 |
0,657 |
|
|
|
|
|
|
|
t [s] |
1080 |
1260 |
1440 |
1620 |
1800 |
|
I [A] |
0,655 |
0,655 |
0,654 |
0,652 |
0,651 |
|
|
|
|
|
|
|
|
Iśr [A] |
m1 [g] |
m2 [g] |
m2 - m1 [g] |
|
|
|
0,657 |
133,7 |
134,2 |
0,47 |
|
|
|
Opracowanie wyników pomiarów
Powierzchnia katody wynosi 0,6635 dm2.
Równoważnik elektrochemiczny
Wartość równoważnika elektrochemicznego obliczymy ze wzoru 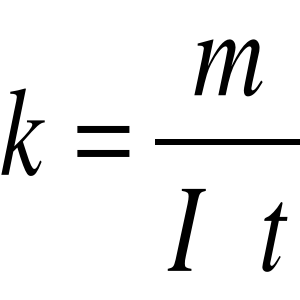
Stała Faraday'a
Stałą Faradaya obliczamy na podstawie II prawa elektrolizy:
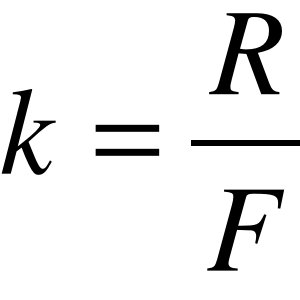
, 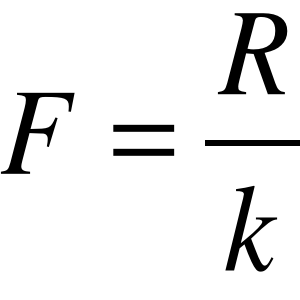
![]()
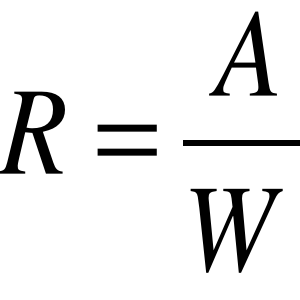
W = 2 , A = 63,55
![]()
R = 31.775
Niepewność natężenia prądu
u(I)=
[A]
Niepewność czasu
∆dt = 0,2 [s]
∆1et = 22 [s]
∆1et = 1 [s]
u(t)=
=
= 13,3[s]
Niepewność masy
Niepewność współczynnika elektrochemicznego
Niepewność współczynnika elektrochemicznego obliczamy ze wzoru:
uc(k)=
Pochodne cząstkowe wynoszą:
,
,
czyli,
uk = k * u(k)= 2 *
= 1,79*1
k = (0,0000397
0,0000179) = (39,7
1,79)*1
Niepewność stałej Faraday'a
= 1811,232861
= k * u(k)=2*1811,23 =3622,46
F = (80037
3622,46)
4. Wnioski:
Celem doświadczenia było wyznaczenie równoważnika elektrochemicznego i stałej Faraday'a. Na podstawie pomiarów prądu przepływającego przez elektrolit i zmieniającego się w czasie, czasu i zmiany masy katody (przed rozpoczęciem i po zakończeniu eksperymentu) obliczyłem, iż stała Faradaya wynosi: (wartość tablicowa to ), współczynnik elektrochemiczny wynosi: (wartość tablicowa to 0,3294![]()
]. Różnice między uzyskanymi przeze mnie wartościami, a wartościami rzeczywistymi wynikają z niedokładności urządzeń pomiarowych, błędów eksperymentatora przy odczytywaniu oraz innych czynników, które mogły wpłynąć na pomiary. Są one wyższe niż błąd pomiarowy, ale wciąż moje rezultaty pozostają bardzo zbliżone do wartości oczekiwanych i dowodzą słuszności I i II prawa Faradaya'a.
4