Zakres materiału do 1 ćwiczeń z chemii organicznej
Budowa atomu i cząsteczki: a) orbitale s i p, b) hybrydyzacja sp, sp2, sp3, c) wiązania σ i π.
Wiązania chemiczne w związkach organicznych: a) jonowe (elektrowalencyjne, heteropolarne), b) kwantowe (kowalencyjne, homeopolarne), c) koordynacyjne (akceptorodonorowe, semipolarne),
d) wodorowe.
Teorie kwasów i zasad (Arrheniusa, Br*nstedta, Lewisa).
Skład związków organicznych: a) jakościowe metody oznaczania C, H, N, O, P, S, halogenów, b) metody ilościowe - analiza elementarna.
Sposoby wyznaczania masy cząsteczkowej: a) spektroskopia masowa, b) metoda krioskopowa i ebuliosko-
powa, c) metoda Victora-Meyera.
Wzór empiryczny i rzeczywisty.
Reguły dotyczące wzorów rzeczywistych - reguła azotu.
Wzory strukturalne i izomeria.
ZADANIA:
Narysować kształt orbitali atomowych: 1s, 2s, 2px, 2py, 2pz, sp, sp2, sp3. Jaki kąt tworzą wiązania powstałe przez nakładanie się orbitali atomowych: sp - s, sp2 - s, sp3 - s?
Jak wyglądała pierwsza synteza organiczna?
Napisać wzory poniższych związków w oparciu o teorię strukturalną: a) trzech izomerów C3H8O,
b) dwóch izomerów C5H6O, z których każdy ma podwójne wiązanie C=O i dwie grupy CH3, c) dwóch izomerycznych związków C5H10, z których każdy zawiera dwie grupy CH3.
Dla skróconych wzorów podanych poniżej napisać pełny wzór strukturalny zaznaczając kreskami każde wiązanie: a) CH3CH(CH3)2, b) CH3OCH3, c) CH2ClCH2CHO, d) (CH2)4, e) CH3CONHCH3,
f) CH3CHCHCH2CH3, g) (CH)6, h) CHOCHO. Podać hybrydyzację atomów węgla w tych związkach.
Określić hybrydyzację atomu węgla w związkach:
![]()
Podać rodzaj wiązania i rodzaje orbitali wiążących każdego atomu węgla w następujących cząsteczkach:
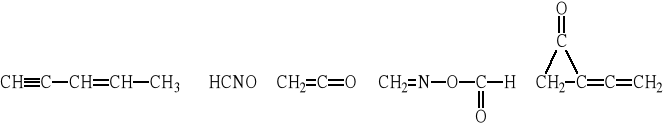
Naszkicować kształt następujących cząsteczek:
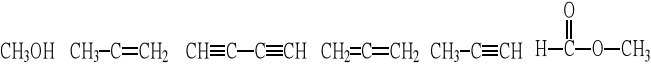
Które z podanych wzorów nie są wzorami rzeczywistymi: a) C3H5N, b) C3H6O, c) C2H4O2, d) C2H3O,
e) C3H5, f) C16H11O2N, g) C6H5BrO, h) C5H12, i) C4H10O, j) C6H4ClS, k) C4H8, l) C4H9Cl.
Obliczyć procentowy skład pierwiastków dla każdego z następujących związków: a) C2H8, b) C2H6O,
c) C3H7NO, d) C2H8N2, e) C2H5NO2, f) C3H5BrO, g) C3H9O4P, h) C4H8Cl2S, i) C2H6Hg, j) CH3HgSiCl.
Ustalić wory empiryczne na podstawie wyników analizy elementarnej:
a) C = 60,00%, H = 13,30%, b) C = 68,90%, H = 4,92%, c) C = 50,40%, H = 9,25%,
d) C = 10,00%, H = 0,84%, Cl = 89,20%, e) C = 39,20%, H = 9,74%, P = 33,70%.
0,735 g związku złożonego z węgla, wodoru i tlenu poddano analizie elementarnej i otrzymano 0,684 g H2O i 1,690 g CO2. Jaka jest procentowa zawartość wymienionych pierwiastków w tym związku?
250 mg związku organicznego dostarczyło podczas oznaczania metodą Dumasa 38,03 ml azotu o temp.
25 °C i pod ciśnieniem 748 mm Hg. Jaka jest zawartość procentowa azotu w próbce?
W wyniku spalenia 5,372 mg ciekłego związku otrzymano 12,22 mg CO2 i 4,99 mg H2O. W metodzie Victora-Meyera 33,3 mg tego związku wyparło w temperaturze 100°C pewną objętość powietrza, które po zebraniu nad wodą w temperaturze 27°C i pod ciśnieniem 755 mm Hg miało objętość 15,2 ml. Wyznaczyć wzór empiryczny i cząsteczkowy oraz zaproponować wzór strukturalny tego związku. Prężność pary wodnej w temp. 27°C wynosi 26,7 mm Hg.
Analiza pewnego kwasu organicznego wykazała, że zawiera on 26,1% C, 4,35% H, 69,55% O. Analiza jego soli srebrowej dała: 7,84% C, 0,65% H, 20,92% O i 70,59% Ag. Jaki jest wzór cząsteczkowy tego kwasu, jeżeli jest on jednozasadowy?
Dla wyznaczenia stałych krioskopowych fenolu, dioksanu i naftalenu rozpuszczono każdorazowo 0,20 g mocznika CO(NH2)2 w 10 g rozpuszczalnika. Obniżenie temp. krzepnięcia wynosiło: a) dla fenolu 2,43°C, b) dla dioksanu 1,57°C, c) dla naftalenu 2,30°C. Obliczyć stałe krioskopowe użytych rozpuszczalników.
Jaka jest masa molowa związku, jeżeli rozpuszczenie jego próbki o masie 3,5 g w 25 g benzenu powoduje, że roztwór krzepnie w temp. 2,92°C. Czysty benzen krzepnie w temp. 5,5 °C, a jego stała krioskopowa wynosi KK=5,1.
Wyprowadzić wzór cząsteczkowy substancji zawierającej 93,75% C i 6,25% H, jeżeli gęstość jej par względem powietrza wynosi 4,41.
W wyniku analizy elementarnej 0,2150 g substancji organicznej otrzymano 22,85 ml azotu w temp. 20°C
i pod ciśnieniem 740 mm Hg. Jaka jest procentowa zawartość azotu w badanej próbce?
0,256 g próbki syntetycznego disiarczku alkilowego spalano przez ogrzewanie w zatopionej rurze szklanej z czystym stężonym kwasem azotowym. Po otwarciu rury z otrzymanego bezbarwnego, klarownego roztworu strącono ilościowo siarczan baru, który po odsączeniu i wysuszeniu ważył 0,973 g. Wyznaczyć wzór sumaryczny związku.
Podać, w jaki sposób wykonuje się próby jakościowe na następujące pierwiastki w związkach organicznych: C, H, N, S, P, Br. Opisać metody Kjeldahla i Dumasa oznaczania azotu w związkach organicznych.
Wyszukiwarka